Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Koloni Oluşturan İnsan Hematopoetik Hücreler Hücre (CFC) Testi
Bu Makalede
Özet
Koloni oluşturan hücre (CFC) tayini hematopoetik atalarıdır yarı-katı ortamda koloniler oluşturur in vitro testtir. Koloni morfolojisi, hücre morfolojisi ve akış sitometri bir arada, farklı hematopoetik soy boyunca çoğalırlar ve ayırt atalarıdır yeteneklerini değerlendirmek için kullanılır.
Özet
İnsan hematopoietik kök / progenitör hücreleri genellikle kemik iliği, kordon kanı veya periferik kandan elde edilen ve hemopoeziste ve leukemogenesis incelemek için kullanılır. Bunlar lenfoid ve myeloid soyları ayırt etmek için kapasite var. Koloni oluşturan hücre (CFC) tayini, yarı katı bir ortamda koloniler oluşturmak için yeteneklerini proliferasyon ve farklılaşma desen hematopoetik atalarıdır çalışma kullanılır. Sabit bir sayıda giriş hücrelerinin oluşturduğu kolonilerin sayısı ve morfolojisi ayırt etmek atalarıdır yeteneği hakkında ön bilgi vermek ve çoğalırlar. Hücreler bireysel koloniler veya bütün plaka numaraları ve akım sitometri ve Giemsa lekeli dia morfolojik değerlendirme kullanarak farklılaşma devletler daha da değerlendirmek için hasat edilebilir. Bu testte, ama lenfoid değil miyeloid farklılaşma değerlendirmek için yararlıdır. Bu bağlamda vadeli miyeloid granülositik, monositik, eritroid ve megakaryocytic soy kapsayacak şekilde daha geniş anlamda kullanılır.
Biz periferik kandan elde edilen birincil insan CD34 + hücre farklılaşması onkogenler etkilerini değerlendirmek için bu testte kullandık. Bu amaçla hücreler için NUP98-HOXA9 Bu durumda, kontrol retroviral inşa veya ilgi onkogen ifade bir yapı ile transduced. Biz, ilgi ve GFP işaretleyici gen üreten bir bicistronic mRNA ifade yaygın olarak kullanılan bir retroviral vektör, MSCV IRES-GFP, istihdam etmektedir. Hücreler sitokinlerin varlığında retroviral transdüksiyon öncesinde iki gün boyunca büyüyerek önceden aktive edilir. Bir iki gün sonra, floresan ile aktive olan hücre sıralama (FACS) GFP + hücreler izole edilir ve sitokinler ile desteklenmiş ve koloniler genellikle yüzey, 14 gün kadar inkübe metilselüloz içeren yarı katı orta ile karışık. Kolonilerin sayısı ve morfolojisi belgelenmiştir. Hücreler daha sonra plakalar kaldırılır yıkanmış sayılır ve akım sitometri ve morfolojik inceleme tabi. Flow sitometri hematopoez sırasında ifade edilen hücre yüzey belirteçleri için özel antikorlar ile soy ve olgunlaşma aşamasında hakkında bilgi sağlar. Wright-Giemsa boyama sonrası mikroskop altında tek tek hücrelerin morfolojik çalışmalar, soy ve olgunlaşma ile ilgili daha fazla bilgi sağlar. Hücrelerin karşılaştırılması bir onkogen hematopoetik farklılaşma onkogen etkileri açığa transduced bu boş vektör kontrolü ile transduced.
Protokol
1. REAKTİFLERİN HAZIRLANMASI
- Fms ilgili tirozin kinaz 3 steril 1000x stok çözelti hazırlayın (FLT-3) ligand, makrofaj / granülosit koloni-interlökin (IL) -3 uyarıcı faktör (GM-CSF), kök hücre faktörü (SCF), trombopoetin (TPO), ve IL-6, üreticinin talimatlarına göre. Steril Retronectin stok solüsyonu (1mg/ml) da üreticinin talimatlarına göre hazırlayın. Küçük alikotları bu stok çözümleri Böl ve tekrarlanan donma-çözülme önlemek için -20 ° C'de tutmak.
- IMDM içinde% 2 FBS hazırlayın.
- % 20 FBS son konsantrasyonları, 2 mM Glutamin, 100 adet / ml Penisilin / Streptomisin (PS) ile tam IMDM orta hazırlayın. Kullanmadan önce aşağıdaki sitokinler: 100 ng / ml FLT-3 ligand, 20 ng / ml GM-CSF, 100 ng / ml SCF, 100 ng / ml TPO, 50 ng / ml, IL-3 ve 100 ng / ml IL-6.
- HBSS% 1 BSA (fenol kırmızısı olmadan Ca ve Mg-) ve D-PBS (Ca ve Mg-serbest)% 2 BSA hazırlayın. 4 0.22 mikron şırınga filtreler ve mağaza ° C geçerek çözümler sterilize
- 4 HBSS ve mağaza% 0.02 EDTA hazırlayın ° C.
- Alikotları ilgi ve mağaza DNA -80 ° C kodlama galv pseudotyped retrovirüs hazırlayın Bu prosedür, bu makalenin kapsamı dışındadır, ancak başka yerlerde açıklandığı (1-3).
Giemsa Boyama için
- Kullanmadan önce, temiz bir cam şişe 1 mikron filtre kağıdı ile iki kez Wright / Giemsa leke çözüm filtre.
- Giordano formülü - Kullanımdan hemen önce, filtrelenmiş Wright / Giemsa leke çözüm ve fosfat tampon çözeltisi, pH 6.4 200 ml, 50 ml karıştırılarak, Wright, / Giemsa buffer pH 6.4 hazırlamak.
- Fosfat tampon çözeltisi, pH 6.0, 3.5 LH 2 O. 27.3 g KH 2 PO 4 ve 4.62 g Na 2 HPO 4 eriterek hazırlayın
- H 2 O.% 50 metanol hazırlayın
2. PROSEDÜRÜ
Çözülme ve pre-harekete geçirmek CD34 + hücreler
- 37 CD34 + donmuş hücreleri hızla bir şişe çözülme ° C son küçük bir buz kristali kalana kadar hafifçe sallayarak hücre süspansiyonu (1 ml) ve 50 ml konik tüp transferi. Şişeden geri kalan hücreler yavaşça oda sıcaklığında 1 ml ile durulayın% 2 FBS / IMDM ve hafifçe dönen 50 ml tüp açılır akıllıca ekleyin. 3 dakika bekleyin. Sonra, yavaş yavaş hafifçe karıştırarak 2 ml% 2 FBS / IMDM ekleyin ve 3 dakika bekleyin. Son hacim 32 ml ulaşana kadar, FBS / IMDM seyreltilmiş hücre süspansiyonu olarak 3 dakika aralıklarla aynı hacimde% 2 ekleyerek eklemeler arasında yavaşça dönen aynı işlemi tekrarlayın.
- Oda sıcaklığında 10 dakika boyunca 250 xg'de santrifüjleyin ve yaklaşık 0.5 ml geride bırakarak süpernatant kaldırmak.
- 20 ml% 2 FBS / IMDM askıya alınması ve oda sıcaklığında 8 dakika boyunca 200 xg'de santrifüj pelet yıkayın.
- Süpernatantı ve yaklaşık 0,5 x 10 6 hücre / ml tam bir IMDM ortamda hücrelerin askıya . Mikrotüp, karışımı içine hücre süspansiyonu aynı Tripan mavisi çözeltisinin hacmi (% 0.4) ile 10 ul alın ve bir hemasitometre kullanarak saymak.
- (1.3) sitokinler ile desteklenmiş IMDM orta ekleyerek 0,1-0,15 X 10 6 hücre / ml hücreleri sulandırınız
- Kültür, 2 gün boyunca% 5 CO 2 ile nemlendirilmiş bir 37 ° C inkübatör hücreler .
Virüs ön yükleme retroviral transdüksiyon
- Iletimi gün, hazırlıklı olmak kuyuların sayısını belirlemek için ön yükleme virüs başlamadan önce hücreleri saymak.
- Retronectin stok çözeltinin 25 mcg / ml ve 24-iyi arıtılmamış doku kültürü plakası her bir kuyunun 400 ul ekleyin. Ön kat laminer akış biyogüvenlik kaput 2 saat oda sıcaklığında inkübe edin.
- Retronectin çözüm çıkarın ve her bir kuyu için D-PBS içinde% 2 BSA 400 ul ekleyin. Oda sıcaklığında 30 dakika inkübe edin.
- Virüs stok solüsyonları çözülme ve buz üzerinde tutmak. BSA çözüm çıkarın, her iyi 0.5 ml virüs hazırlık ve 4 2200 xg'de santrifüj ° C de 15 dakika boyunca.
- Kuyulardan virüs çözümü çıkarın ve 2.10 en fazla üç defa açıklanan virüs yükleme tekrarlayın.
- Soğuk 0.5 ml HBSS (+ Ca, Mg) veya IMDM her iyice durulayın.
- Oda sıcaklığında 8 dakika boyunca 200 xg'de santrifüj önceden aktive edilmiş CD34 + hücreler toplayın.
- Sitokinler ile tam IMDM orta 1.5 ml başına 0,1-0,15 x 10 6 hücre hücrelerin tekrar
- Her iyi 1.5 ml hücre süspansiyonu ekleyin ve 2 gün için% 5 CO 2 ile nemlendirilmiş bir 37 ° C inkübatör inkübe edin.
Hücre sıralama ve toplama hücreleri transduced
- Yavaşça ama iyice yukarıda virüs yüklü plaka hücreleri askıyakonik bir tüp içine 50 mikron CellTrics hücre filtre ile filtre. Tripan mavisi çözeltisinin eşit hacmi olan bir mikrotüp, karışımı içine atın ve 10 ul hücre süspansiyonu bir hemasitometre kullanarak saymak. 0.8 ml soğuk% 0.02 EDTA / HBSS (fenol kırmızısı olmadan Ca ve Mg-free) her iyice durulayın ve 50 mikron CellTrics hücre filtre ile aynı toplama tüpüne ekleyin.
- 8 dakika 4 ° C 200 xg'de hücreler santrifüj, ve 4, 8 dakika için 200 xg'de santrifüj tarafından soğuk HBSS ile pelet (fenol kırmızısı olmadan Ca ve Mg-free) yıkamak ° C
- BSA / HBSS (fenol kırmızısı olmadan Ca ve Mg-) 15 X 10 6 / ml veya hücre sıralama için 0.250 ml minimum hacim konsantrasyonu% 1 pelletini tekrar. Hücreler karanlıkta buz üzerinde tutun. Soğuk% 20 FBS / IMDM / sıralanmış hücreleri toplamak için Glutamin / PS orta içeren bir tüp hazırlayın. Washington Üniversitesi Tıp MoFlo yüksek hızda sıralayıcı (Dako, Glostrup, Danimarka) kullanarak Fakültesi Alvin J. Siteman Kanser Merkezi Yüksek Hızlı Hücre Sıralayıcısı Çekirdeği sıralama yapılır.
CFC testi
- CFC tahlil medya 3 ml alikotları gerekli sayıda çözülme. Vortex kuvvetlice karıştırın ve tüpler kabarcıkları eklemeden önce hücrelerin yüzeye çıkması için mevcut en az 5 dakika bekletin.
- Sıralanmış her bir örnek için hücre konsantrasyonu elde etmek için, hücre sayısı yaklaşık hücre süspansiyonu hacmi sıralama tesisi tarafından sağlanan bölün. 3.000 atın virüs transduced, soğuk% 2 FBS / IMDM içeren steril bir mikrotüp ayrılır hücreleri. Ön ayarlamak son süspansiyon hacmi yaklaşık 0.3 ml olacak FBS / IMDM% 2 birim.
- Hücreleri, askıya alma ve 2 mM L-glutamin% 1 metilselüloz oluşur Methocult GF + H4435,% 30 FBS,% 1 BSA, 10 -4 M 2-mercaptoethanol, 3 ml kısım için tüm 0.3 ml hücre süspansiyonu transfer 50 ng / ml SCF, 20 ng / ml, GM-CSF, 20 ng / ml, IL-3, 20 ng / ml, IL-6, 20 ng / ml G-CSF ve 3 adet / ml eritropoietin IMDM. % 1.3 metilselüloz oluşur İnsan Metilselüloz Zenginleştirilmiş Medya (Ar-Ge Sistemleri),% 25 FBS,% 1 BSA, 5 x 10 -5 M 2-mercaptoethanol, 2 mM L-glutamin, 50 ng / ml SCF, 20 ng / 20 ml GM-CSF, IL-3 ng / ml, 20 ng / ml, IL-6, 20 ng / ml G-CSF ve 3 adet / ml eritropoietin IMDM de kullanılıyor olabilir.
- Vortex şiddetle karışımı tam olarak yükselişi ve 3-4 kez düşme. Tüp 3 dakika bekletin.
- 3 ml şırınga göstergesi, 16 künt uç iğne takın ve 2.2 ml kadar çizin. Büyük kabarcıklar yukarı çekmek etmeyin; başında birkaç kez basarak onları kovmak. Her iki adet 30 mm arıtılmamış çanak içine 1.1 ml çevirerek dışarı itin ve karışımı eşit olarak yaymak.
- 3 ml steril su içeren bir su çanağı ile birlikte 100 mm plakası yinelenen bir tabak koyun. 14 - 17 gün için Kültür.
- Göre koloniler karakterize bir skor ızgara ile işaretlenmiş bir kültür çanak 40x büyütme ters bir mikroskop ile morfoloji ve skor. Saf eritroid, myelomonositik ve karışık: testin amaçları için, koloniler 3 kategoride sınıflandırılır. Daha fazla koloni subclassification için üreticinin talimatlarına bakın.
- Tüm CFC tahlil plaka büyütme olmaksızın düzenli bir 600 dpi tarayıcı ve kolonilerin fotomikrografı renkli bir kamera ile donatılmış bir inverted mikroskop kullanılarak alınabilir düşük-güç (40x) ile taranabilir.
- Tüm CFC tahlil plaka hücre farklılaşması ve proliferasyonu daha fazla analiz için, oda sıcaklığında% 2 FBS / IMDM birkaç cilt olarak askıya tarafından kurtarıldı. 10 dakika 4 ° C için 300 xg'de santrifüj sonra, hücrelerin% 2 FBS / IMDM, sayılır ve her iki akım sitometri için antikorlar ile boyanarak ya da Giemsa boyama için sitospin santrifüj kullanarak slayt transfer yeniden süspanse.
Antikor boyama ve flow sitometri
- 4 8 dk boyunca 200 xg'de Santrifüj hücreler HBSS soğuk% 50 normal fare serumu ° C ve tekrar süspansiyon (fenol kırmızısı olmadan Ca ve Mg-ücretsiz).
- Yaklaşık 5 x 10 5 hücre tüp başına 80 ul (12 x 75 mm yuvarlak alt tüpler) koyun ve buz üzerinde tutmak. Antikor karışımı (yaklaşık 20 ul-antikor kontrolleri için karışım veya negatif kontrol solüsyonu) ve tüpler hafifçe dokunarak karışımı ekleyin. Herhangi bir antikor ya da her florokrom için bir anti-CD45 antikoru ile kalibrasyon kontrolü tüpleri hazırlayın. Tüpler, 20 dakika boyunca karanlık ve inkübe buz koyun. İlk 10 dakika sonra tüpleri hafifçe dokunarak karıştırın. 20 dakika inkübasyondan sonra, soğuk HBSS tüpleri doldurmak ve 4, 8 dk boyunca 200 xg'de santrifüj ° C. Soğuk% 0.5 paraformaldehid / HBSS pelletini tekrar.
Antikor aşağıdaki karışımlar genelde analizi için kullanılır. Miyeloid farklılaşma: CD11b (fikoeritrin-konjuge klon ICRF44) / CD33 (allophycocyanin konjuge klon WM53) / CD45 (fikoeritrin-Cy7-congjugated klon HI30). Eritroid farklılaşması için: CD71 (fikoeritrin-konjuge klon M-A712) / CD235a (allophycocyanin-konjuge klon GA-R2) / CD45 (fikoeritrin-Cy7-congjugated klon HI30). - Flow sitometri, Alvin J. Washington Üniversitesi Tıp Okulu'nda Siteman Kanser Merkezi, 5 renk ve iki lazerler (BD Biosciences) yükseltilmiş bir FACScan akış sitometresinde Yüksek Hız Hücre Sıralayıcısı Çekirdek ve CellQuest (BD Biosciences) veya kullanılarak analiz FlowJO v7.2.4 (Tree Star, Inc, Ashland, OR, ABD) yazılımı.
Giemsa boyama
- CFC tahlil plakaları kurtarıldı yaklaşık 30.000 hücreleri 0.3 askıya yukarıda açıklanan ml% 2 FBS / IMDM ve oda sıcaklığında 10 dakika 1.000 rpm'de sitospin santrifüj kullanarak slayt aktarılır.
- Aşağıdaki sırayla çözümler içeren dokuz boyama damarları ayarlayın.
- Mutlak Metanol
- Wright / Giemsa stok solüsyonu
- Wright / Giemsa tamponu, pH 6.4
- % 50 H 2 O Metanol
- H 2 O
- H 2 O
- Fosfat tamponu, pH 6.0
- H 2 O
- H 2 O
- Slaytları slayt taşıyıcı içine yerleştirin ve 2 dakika için mutlak metanol daldırma (# 1) ve fazla metanol kurulayın.
- Hemen 5 dakika Wright / Giemsa stok solüsyonu slayt taşıyıcı (# 2) batırın.
- Wright / Giemsa tamponu, pH 6.4 (# 3) taşıyıcı aktarın ve 10 dakika inkübe edin.
- (# 4) iki kez% 50 metanol taşıyıcı Daldırma, H 2 O (# 5), H 2 O (# 6) başka bir 10 kat, 10 kat ve daha sonra 5 kez Fosfat tamponu, pH 6.0 (# 7) .
- H 2 O (# 8) taşıyıcı transferi ve 2 dakika boyunca inkübe edin. H 2 O (# 9) yıkama işlemi tekrarlayın.
- Slaytlar taşıyıcı tamamen kurumaya bırakın. Her bir slayt çıkarın ve lekeleri çıkarmak için, metanol-batırılmış Kimwipes slayt geri silin. Cytoseal 60 bir damla ve mühür cam bir kapakla yerleştirin.
- Olympus BX51 mikroskop kullanılarak her Giemsa lekeli slayt için 500 hücre diferansiyel sayımı yapılır. Hücreler beş kategoriye ayrılır: ilkel hücrelerden patlamalar ve promyelocytes; ara miyeloid hücrelerin myelocytes ve metamyelocytes; olgun miyeloid hücrelerin bantları, segmente nötrofiller, monositler ve makrofajlar; ara eritroid hücreler ara hemoglobinization sahip hücreler içerir; ve olgun eritroid hücreler içerir tam hemoglobinization sahip hücreler. Fotomikrografı 60x petrol hedefi ile Olympus DP71 kamera ile alınır.
3.0) TEMSİLCİSİ SONUÇLAR:
- CFC tahlil: Bazı giriş hücre popülasyonu, prolifere farklılaştırmak ve 14-17 günlük kuluçka döneminde yarı-katı orta form koloniler. Bu deneyde, NUP98 HOXA9 onkogen ekspresyonu belirgin kırmızı (eritroid koloni) (Şekil 1) (3) oluşumuna neden olduğu açıktır.
- Antikor Boyama ve Akış Sitometri: Akış sitometrik işaretleyicidir CFC tahlil plakaları toplanan hücreler, hücre nüfusun farklılaşması durumu hakkında bilgi sağlar . Belirli bir farklılaşma işaretleri karşı antikor kombine kullanımı, hücrelerin olgunlaşma soy ve derecesi tespit edilebilir. Bu durumda CD235a eritroid hücreleri tanımlamak için kullanılır oldu. Şekil 2A gösterildiği gibi, NUP98-HOXA9 CD235a + eritroid hücrelerin yüzdesi bir artışa neden olmuştur, ancak bu hücreler tarafından CD235a ifade parlaklık eritroid olgunlaşma inhibisyonu gösteren, kontrollere göre azaldığı gözlendi. Şekil 2B, miyeloid hücrelerin, CD33 pozitifliği sayesinde tespit edilir. NUP98 HOXA9 CD11b ifade parlaklık miyeloid olgunlaşma inhibisyonu (3) ile tutarlı bir azalma ile CD33 + hücrelerin sayısında bir azalmaya neden oldu. Böylece akış sitometri sonuçları NUP98-HOXA9 miyeloid ve eritroid hem olgunlaşma inhibisyonu ile eritroid hiperplazi neden olduğunu göstermektedir.
- Giemsa Boyama: CFC tahlil plakaları toplanan hücreler morfolojik incelemesinde hücre popülasyonunun olgunlaşma soy ve derecesi hakkında bilgi sağlar. Morfolojik olarak elde edilen sonuçlar, akım sitometrik çalışmaları ile elde edilen farklı olabilir ve bu nedenle bu yöntemleri (3) birbirini tamamlayıcı niteliktedir. Deney en az 3 kez tekrarlanır ve her seferinde 500 hücre diferansiyel sayısı, yukarıda açıklandığı gibi hücre 5 kategoriye ayırmak için yapılır. Şekil 3'te bu hücrelerin örnekleri dikkat çekti. Sonuçları arasında istatistiksel olarak anlamlı farklılıklar onkogen transduced örnek ve kontrolü olup olmadığını belirlemek amacıyla tablo ve analiz edilir. Bu durumda, sonuçlar NUP98-HOXA9 sayısında genel bir artışa neden olduğunu gösterdieritroid hiperplazi ve eritroid ve myeloid olgunlaşma (3) (gösterilmemiştir) inhibisyonu ile hücre.
Şekil açıklamaları

Şekil 1: insan CFC morfolojisi NUP98-HOXA9 etkiler.
İlköğretim insan CD34 + hücre retrovirally kontrolü MSCV IRES-GFP vektör veya vektör NUP98-HOXA9 ifade transduced, ve hücreler, GFP pozitifliği için sıralanır. CFC tayini için iki yinelenen plakaların her birine bin hücre numaralı seribaşı ve deney 3 4 bağımsız kez tekrarlandı. Büyütme (solda) ve düşük güç temsilcisi eritroid kolonilerin (sağda) fotomikrografı olmadan Temsilcisi levhalar (3) gösterilmiştir.
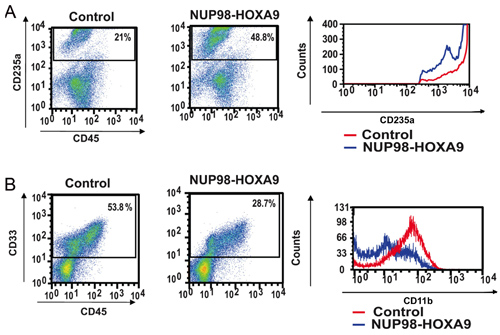
Şekil 2: Flow sitometri NUP98-HOXA9 tarafından bozulması insan birincil CD34 + hücre farklılaşması gösterir.
(A) CD45 ve CD235a eritroid farklılaşması için akış sitometri: CFC plakalardan Hücreler (bkz. Şekil 1) antikorları ile hasat ve boyandı. (B) CD235a + kapı kontrol hücrelerine göre CD235a ifade göstermek için histogram (sağ panel) çizilen oldu miyeloid farklılaşma Flow sitometri: CFC plakalardan hücreler CD45 ve CD33 ile hasat ve boyandı. CD33 + kapı kontrole göre (sağ panel) CD11b ifade göstermek için bir histogram üzerinde çizilen oldu. Her bir geçidin giren hücrelerinin yüzdeleri gösterilmiştir (3).
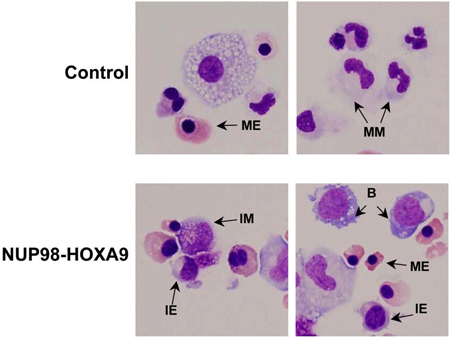
Şekil 3: Hücre morfolojisi HOXA9 NUP98-farklılaşma bozulması vektör kontrol ile karşılaştırıldığında gösterir.
Sitospin smear CFC plakalardan hazırlanan ve Giemsa ile boyandı. Fotomikrografı 60x petrol hedefi ile temsili alanlar alınmıştır. B: patlama; MM: olgun miyeloid, IM: orta miyeloid, ME: olgun eritroid, IE: Ara eritroid (3).
Tartışmalar
CFC tahlil hematopoetik atalarıdır çoğalmasını ve farklılaşmasını modellerini belirlemek ve onkogenler (4, 5) etkilerini incelemek için yaygın olarak kullanılmaktadır. Bu koloniler tek bir progenitör soyu temsil eden ve ileri analiz için ayrı ayrı kaldırılabilir klonal bir tahlil, sıvı kültürler üzerinde bir avantaja sahiptir. Bu tür hücreler kullanılarak tespit edilir, uzun vadeli bir kültür başlatan hücre (LTC-IC) assay (6, 7). CFC testinin sınırlama, daha olgunlaşmamış atalarıdı...
Açıklamalar
Teşekkürler
Malzemeler
| Name | Company | Catalog Number | Comments |
| IMDM | Life Technologies | 12440 | |
| FBS | Stem Cell Technologies | 06150 | |
| L-Glutamine | Life Technologies | 25030 | |
| Penicillin/Streptomycin (PS) | Life Technologies | 15140 | |
| FLT-3 ligand | PeproTech Inc | 300-19 | |
| GM-CSF | PeproTech Inc | 300-03 | |
| SCF | PeproTech Inc | 300-07 | |
| TPO | PeproTech Inc | 300-18 | |
| IL3 | PeproTech Inc | 200-03 | |
| IL6 | PeproTech Inc | 200-06 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7030 | |
| EDTA | Fisher Scientific | BP118 | |
| Retronectin | Takara Bio Inc | T100A | |
| HBSS | Life Technologies | 14175 | |
| PBS | Life Technologies | 14200 | |
| Trypan Blue solution (0.4%) | Sigma-Aldrich | T8154 | |
| Methocult GF+ H4435 | Stem Cell Technologies | 04445 | |
| Human Methylcellulose Enriched Media | R&D Systems | HSC005 | |
| Wright/ Giemsa stain | Harleco | 64571 | |
| Phosphate Buffer Solution, pH 6.4 - Giordano formula | Ricca Chemical Company | 1450 | |
| Methanol | Fisher Scientific | A412-4 | |
| Cytoseal 60 | Thermo Fisher Scientific, Inc. | 8310 | |
| Normal Mouse Serum | Rockland Immunochemicals | D208 | |
| Anti-Human CD11b phyc–rythrin-conjugated | BD Biosciences | 555388 | |
| Anti-Human CD33 allophycocyanin-conjugated | BD Biosciences | 551378 | |
| Anti-Human CD45 phyc–rythrin-Cy7-congjugated | BD Biosciences | 557748 | |
| Anti-Human CD71 phyc–rythrin-conjugated | BD Biosciences | 555537 | |
| Anti-Human CD235a allophycocyanin-conjugated | BD Biosciences | 551336 | |
| Anti-Human CD45 phyc–rythrin-Cy7-congjugated | BD Biosciences | 557748 | |
| 24-well non-treated tissue culture plates | BD Biosciences | 35-1147 | |
| 30 mm non-treated dish | Stem Cell Technologies | 27150 | |
| 100 mm tissue culture dish | Fisher Scientific | 08-757-12 | |
| Gridded scoring dishes | Stem Cell Technologies | 27500 | |
| 15 ml centrifuge tubes | BD Biosciences | 35-2097 | |
| 50 ml centrifuge tubes | BD Biosciences | 35-2070 | |
| Syringes 3 ml | Stem Cell Technologies | 28240 | |
| 16 gauge blunt-end, 1½ inch needle | Stem Cell Technologies | 28110 | |
| 50 μm CellTrics cell filter | Partec | 04-004-2327 | |
| Hemocytometer | Fisher Scientific | 0267110 | |
| TPX sample chambers | Thermo Fisher Scientific, Inc. | A78710018 | |
| Fisherbrand Superfrost/Plus Microscope Slides, Precleaned | Fisher Scientific | 12-550-15 | |
| Shandon filter cards | Thermo Fisher Scientific, Inc. | 5991022 | |
| Shandon cytospin slide holder | Thermo Fisher Scientific, Inc. | 59920063 | |
| Shandon Complete Staining Assembly 100 | Thermo Fisher Scientific, Inc. | 100 | |
| Kimwipes | Kimberly-Clark Corporation | 34155 | |
| 1 μm filter paper | VWR international | 28307-134 | |
| Inverted microscope | Nikon Instruments | Diaphot | |
| Microscope camera | Nikon Instruments | DS-F11 | |
| Microscope | Olympus Corporation | BX51 | |
| Microscope camera | Olympus Corporation | DP71 | |
| Scanner | Microtek | Scanmaker 4 | |
| Vortex mixer | Fisher Scientific | 12-812 | |
| Tissue culture incubator | Sanyo | MCO-18AIC | |
| Cytospin | Shandon, Inc. | Cytospin 2 | |
| Bench-top centrifuge | Eppendorf | 5810-R | |
| Water purification system | Barnstead | Nanopure-Diamond |
Referanslar
- Takeda, A., Goolsby, C., Yaseen, N. R. NUP98-HOXA9 induces long-term proliferation and blocks differentiation of primary human CD34+ hematopoietic cells. Cancer Res. , 66-6628 (2006).
- Yassin, E. R., Abdul-Nabi, A. M., Takeda, A., Yaseen, N. R. Effects of the NUP98-DDX10 oncogene on primary human CD34+ cells: role of a conserved helicase motif. Leukemia. , (2010).
- Yassin, E. R., Sarma, N. J., Abdul-Nabi, A. M., Dombrowski, J., Han, Y., Takeda, A., Yaseen, N. R. Dissection of the transformation of primary human hematopoietic cells by the oncogene NUP98-HOXA9. PLoS One. 4, e6719-e6719 (2009).
- Nissen-Druey, C., Tichelli, A., Meyer-Monard, S. Human hematopoietic colonies in health and disease. Acta Haematol. 113, 5-96 (2005).
- Pereira, C., Clarke, E., Damen, J. Hematopoietic colony-forming cell assays. Methods Mol Biol. 407, 177-208 (2007).
- Coulombel, L. Identification of hematopoietic stem/progenitor cells: strength and drawbacks of functional assays. Oncogene. 23, 7210-7222 (2004).
- Hogge, D. E., Lansdorp, P. M., Reid, D., Gerhard, B., Eaves, C. J. Enhanced detection, maintenance, and differentiation of primitive human hematopoietic cells in cultures containing murine fibroblasts engineered to produce human steel factor, interleukin-3, and granulocyte colony-stimulating factor. Blood. 88, 3765-3773 (1996).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır