Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Колония Формирование Cell (CFC) Пробирной по правам гемопоэтических клеток
В этой статье
Резюме
Колониеобразующих клетки (CFC) анализа является в пробирке тест, в котором кроветворные предшественники образовывать колонии в полутвердой среде. Сочетание колонии морфологии, морфологии клеток, и проточной цитометрии используются для оценки способности к пролиферации предшественников и дифференцировать по различным гемопоэтических линий.
Аннотация
Человек гемопоэтических стволовых / прогениторных клеток, как правило, полученные из костного мозга, пуповинной крови, или периферической крови и используются для изучения кроветворения и возникновение и развитие лейкоза. Они обладают способностью дифференцироваться в лимфоидной и миелоидной линий. Колониеобразующих клетки (CFC) анализ используется для изучения пролиферации и дифференцировки гемопоэтических шаблон прародителей по их способности образовывать колонии в полутвердой среде. Количество и морфология колоний образована фиксированное число входных клетки обеспечивают предварительную информацию о способности прародителей дифференцировать и размножаться. Клетки могут быть собраны из отдельных колоний или целую тарелку для дальнейшей оценки их численности и дифференциация состояний с помощью проточной цитометрии и морфологической оценки Гимза окрашенных слайдов. Этот анализ используется для оценки миелоидной но не лимфоидной дифференцировки. Термин миелоидной в данном контексте используется в более широком смысле, чтобы охватить гранулоцитарного, моноцитов, эритроидных и megakaryocytic линий.
Мы использовали этот анализ для оценки влияния онкогенов на дифференциацию первичных человеческих CD34 + клетки, полученные из периферической крови. Для этого клетки трансдуцированных либо контроль ретровирусных построить или построить выражения онкоген интерес, в данном случае NUP98-HOXA9. У нас работают обычно используется ретровирусных вектор, MSCV-IRES-GFP, который выражает bicistronic мРНК, которая производит ген интереса и маркера GFP. Клетки предварительно активируется росту в присутствии цитокинов в течение двух дней до ретровирусной трансдукции. Еще через два дня, GFP + клеток изолированы флуоресценции активированной сортировки клеток (FACS) и в смеси с метил-содержащих полутвердых среде, дополненной цитокинов и инкубировали до колонии появляются на поверхности, как правило, 14 дней. Количество и морфология колоний документируются. Затем клетки удаляются из пластин, промывают, подсчитываются и подвергали проточной цитометрии и морфологические исследования. Проточная цитометрия с антителами, специфичными к поверхности клеток маркеры, высказанных в ходе кроветворения предоставляет информацию о линии и созревания. Морфологические исследования отдельных клеток под микроскопом после Райта-Гимза окрашивания предоставить дополнительную информацию в отношении происхождения и созревания. Сравнение клеток трансдуцированных с управлением пустой вектор тем трансдуцированных с онкоген показывает последствия онкоген на гемопоэтических дифференциации.
протокол
1. Подготовка реагентов
- Подготовка стерильные растворы 1000x ФМС связанных тирозинкиназы 3 (FLT-3) лиганда, гранулоцитов / макрофагов колониестимулирующий фактор (GM-CSF), фактор стволовых клеток (SCF), тромбопоэтин (ТПО), интерлейкин (IL) -3 и ИЛ-6 в соответствии с инструкциями производителя. Подготовка стерильного раствора фондовом Retronectin (1mg/ml), также в соответствии с инструкциями производителя. Разделите эти растворы на небольшие порции и храните при температуре -20 ° С, чтобы избежать повторного замораживания-оттаивания.
- Подготовка 2% ЭТС в IMDM.
- Подготовить всю среду IMDM с конечной концентрации 20% FBS, 2 мМ глютамина, 100 ед / мл пенициллина / стрептомицина (PS). Добавьте следующие цитокины непосредственно перед употреблением: 100 нг / мл FLT-3 лиганд, 20 нг / мл GM-CSF, 100 нг / мл SCF, 100 нг / мл ТПО, 50 нг / мл IL-3, и 100 нг / мл IL-6.
- Подготовка 1% BSA в HBSS (Са и Mg-бесплатно, без фенола красного) и 2% БСА в D-PBS (Са и Mg-бесплатно). Стерилизовать решения, проходя через фильтры 0,22 мкм шприц и хранить при 4 ° C.
- Подготовка 0,02% ЭДТА в HBSS и хранить при температуре 4 ° C.
- Подготовка Galv-pseudotyped ретровируса кодирования ДНК интерес и хранить в аликвоты при -80 ° C. Эта процедура выходит за рамки данной статьи, но это описано в другом месте (1-3).
Для окрашивания Гимза
- Просто перед употреблением, фильтр Райт / Гимза решение в два раза до 1 мкм фильтровальную бумагу в чистую стеклянную бутылку.
- Непосредственно перед использованием, подготовить Райт / Гимза буфера рН 6,4, путем смешивания 50 мл фильтруется Райт / Гимза раствора и 200 мл фосфатного буферного раствора, рН 6,4 - Джордано формуле.
- Подготовка фосфатного буферного раствора, рН 6,0, растворяя 27,3 г KH 2 PO 4 и 4,62 г Na 2 HPO 4 в 3,5 LH 2 O.
- Подготовка 50% метанола в H 2 O.
2. ПОРЯДОК
Размораживание и предварительно активацию клеток CD34 +
- Оттепель флакон замороженных CD34 + клетки быстро при 37 ° С, осторожно встряхивая, пока последний небольшой кристалл льда остается и передачи клеточной суспензии (1 мл) в 50 мл коническую трубку. Аккуратно смойте оставшиеся клетки из флакона с 1 мл комнатной температуре 2% ЭТС / IMDM и добавить его по каплям к 50 мл трубки в то время как закрученной мягко. Подождите 3 минуты. Затем медленно добавьте 2 мл 2% ЭТС / IMDM, при перемешивании осторожно, и ждать в течение 3 минут. Повторите эту процедуру путем добавления 2% ЭТС / IMDM то есть тот же объем, разбавленный суспензии клеток в 3 минутные интервалы, циркулируя мягко между дополнениями, пока конечный объем достигает 32 мл.
- Центрифуга при 250 мкг в течение 10 минут при комнатной температуре и удалить супернатант оставив около 0,5 мл.
- Вымойте гранул, приостановив в 20 мл 2% ЭТС / IMDM и центрифугирования при 200 мкг в течение 8 минут при комнатной температуре.
- Удалить супернатант и приостановить клетки в полной среде IMDM примерно 0,5 х 10 6 клеток / мл. Возьмите 10 мкл суспензии клеток в микропробирки, смешать с таким же объем раствора Трипановый синий (0,4%) и подсчета использованием гемоцитометра.
- Развести клетки 0,1-0,15 х 10 6 клеток / мл, добавляя полной среде IMDM дополнен цитокинов (см. п. 1.3)
- Культуры клеток в увлажненных 37 ° C инкубаторе с 5% CO 2 в течение 2 дней.
Ретровирусные трансдукции вирусом предварительной загрузки
- В день трансдукции, граф клетки перед началом вирус предварительной загрузки, чтобы определить количество скважин должен быть подготовлен.
- Развести Retronectin маточного раствора до 25 мкг / мл и добавляют 400 мкл в каждую лунку 24-луночных необработанной пластины для культуры ткани. Инкубируйте в течение 2 часов при комнатной температуре в ламинарный поток биобезопасности капотом предварительного пальто.
- Удалить Retronectin решение и добавить 400 мкл 2% БСА в D-PBS в каждую лунку. Инкубировать 30 минут при комнатной температуре.
- Оттепель решения вирус акции и держать на льду. Удалить решение BSA, добавить 0,5 мл вируса подготовки в каждую лунку, и центрифуге при 2200 мкг при 4 ° С в течение 15 минут.
- Удалить вирус решение из колодцев и повторить вирусной нагрузки описаны в 2.10 еще три раза.
- Промыть каждую лунку с холодным 0,5 мл HBSS (+ Са и Mg) или IMDM.
- Сбор предварительно активированной CD34 + клеток путем центрифугирования при 200 мкг в течение 8 минут при комнатной температуре.
- Ресуспендируют клеток на 0,1-0,15 х 10 6 клеток на 1,5 мл в полной среде IMDM с цитокинами.
- Добавить 1,5 мл клеточной суспензии в каждую лунку и инкубировать в увлажненной 37 ° C инкубаторе с 5% CO 2 в течение 2 дней.
Сортировка клеток и коллекция трансдуцированных клетки
- Аккуратно, но тщательно приостановить клетки над вирусом нагруженных пластинов и фильтруют через 50 мкм CellTrics ячейки фильтра в конической трубе. Возьмите 10 мкл суспензии клеток в микропробирки, смешать с равным объемом раствора Трипановый синий и считать использование гемоцитометра. Промыть каждую лунку с 0,8 мл холодной 0,02% ЭДТА / HBSS (Са и Mg-бесплатно без фенола красного) и добавить к той же трубкой коллекции через 50 мкм фильтр ячейки CellTrics.
- Центрифуга клетки при 200 мкг в течение 8 минут при температуре 4 ° С, и мыть гранул с холодным HBSS (Са и Mg-бесплатно без фенола красного) путем центрифугирования при 200 мкг в течение 8 минут при 4 ° C.
- Ресуспендируют гранул в 1% BSA / HBSS (Са и Mg-бесплатно без фенола красного) до концентрации 15 х 10 6 / мл и минимальным объемом 0,250 мл для сортировки клеток. Держите клеток на лед в темное время суток. Подготовка трубку с холодным 20% FBS / IMDM / глютамин / PS среда для сбора отсортированных клеток. Сортировка производится на высокоскоростной сотовый Сортировщик Ядро Элвин Дж. Siteman Cancer Center в Вашингтоне школы медицины университета использованием MoFlo высокоскоростной сортировщик (Dako, Glostrup, Дания).
ХФУ анализа
- Оттепель необходимом количестве 3 мл аликвот СМИ ХФУ анализа. Vortex энергично перемешать и пусть трубы стоят не менее 5 минут, чтобы любые пузыри настоящее подняться на поверхность перед добавлением клеток.
- Для получения концентрации клеток для каждого образца сортируются, разделите число клеток осуществляется сортировка объекта по приблизительный объем клеточной суспензии. Возьмите 3000 вирусов трансдуцированных, отсортированных клеток в стерильных микропробирку содержащие холодной 2% ЭТС / IMDM. Предварительно регулировки громкости на 2% ЭТС / IMDM таким образом, чтобы конечный объем подвески составит около 0,3 мл.
- Приостановить клетки и передачу всей 0,3 мл клеточной суспензии с 3 мл аликвоту Methocult GF + H4435, которая состоит из 1% метилцеллюлозы, 30% ЭТС, 1% BSA, 10 -4 М 2-меркаптоэтанол, 2 мМ L-глутамина, 50 нг / мл SCF, 20 нг / мл GM-CSF, 20 нг / мл IL-3, 20 нг / мл IL-6, 20 нг / мл G-CSF, и 3 ед / мл эритропоэтина в IMDM. Человек Метилцеллюлоза Обогащенный Media (R & D Systems), которая состоит из 1,3% метилцеллюлозы, 25% ЭТС, 1% BSA, 5 х 10 -5 М 2-меркаптоэтанол, 2 мМ L-глутамина, 50 нг / мл SCF, 20 нг / мл GM-CSF, 20 нг / мл IL-3, 20 нг / мл IL-6, 20 нг / мл G-CSF, и 3 ед / мл эритропоэтина в IMDM также может быть использован.
- Vortex энергично, чтобы сделать смесь рост полностью и осенью 3-4 раза. Пусть труба стоит на месте в течение 3 мин.
- Прикрепить 16 калибра тупой конец иглы для шприц 3 мл и составляет 2,2 мл. Не составляет большого пузырьков; изгнать их в начале путем выталкивания пару раз. Выталкивайте 1,1 мл каждая на две 30-мм необработанных блюдо и разложите смесь равномерно вращается.
- Место дублировать плиты в 100 мм пластины вместе с водой блюдо, содержащий 3 мл стерильной воды. Культура для 14 - 17 дней.
- Охарактеризовать и счет колоний в соответствии с их морфологии с инвертированным микроскопом при 40-кратном увеличении в культуре блюдо, отмеченные забив сетки. Для целей нашего анализа, колонии делятся на 3 категории: чисто эритроидных, миеломоноцитарный и смешанные. См. инструкции производителя для дальнейшего деление на подклассы колонии.
- Всей пластинки анализа ХФУ могут быть отсканированы без увеличения с помощью обычного сканера на 600 точек на дюйм, и низкое энергопотребление (40x) микрофотографии колонии могут приниматься с использованием инвертированного микроскопа оснащен цветной камерой.
- Для дальнейшего анализа дифференциации и пролиферации клеток из всей пластинки анализа ХФУ восстанавливаются путем приостановления в нескольких томах комнатной температуре 2% ЭТС / IMDM. После центрифугирования при 300 мкг в течение 10 мин при 4 ° С, клетки ресуспендировали в 2% ЭТС / IMDM, пересчитал, и либо окрашенные антитела для проточной цитометрии или переведены на слайдах использованием цитоспина центрифуга для окрашивания Гимза.
Окрашивание антител и проточной цитометрии
- Центрифуга клетки при 200 мкг в течение 8 минут при температуре 4 ° С и ресуспендируют в холодной 50% нормальной сывороткой мыши в HBSS (Са и Mg-бесплатно без фенола красного).
- Поместите приблизительно 5 х 10 5 клеток в 80 мкл на трубке (12 х 75 мм с круглым дном трубы) и держать на льду. Добавить смесь антител (примерно 20 мкл смеси или отрицательное решение для управления не-антитело контроля) и перемешать, слегка нажав труб. Подготовка труб контроль калибровки без каких-либо антител или с анти-CD45 антител для каждого флуорохромом. Место труб на льду в темноте и инкубировать в течение 20 минут. Смешать, слегка нажав труб после первых 10 мин. После 20 мин инкубации, заполнить трубы с холодной HBSS и центрифуги при 200 мкг в течение 8 мин при 4 ° C. Ресуспендируют гранул в холодной 0,5% параформальдегид / HBSS.
Следующие смеси антител обычно используются для нашего анализа. Для миелоидной дифференциации: CD11b (фикоэритрин-сопряженных клон ICRF44) / CD33 (allophycocyanin-сопряженных клон WM53) / CD45 (фикоэритрин-Cy7-congjugated клон HI30). Для дифференциации эритроидных: CD71 (фикоэритрин-сопряженных клон M-A712) / CD235a (allophycocyanin-сопряженных клон GA-R2) / CD45 (фикоэритрин-Cy7-congjugated клон HI30). - Проточная цитометрия осуществляется на высокоскоростной сотовый Сортировщик Ядро Элвин Дж. Siteman Cancer Center в Вашингтоне школы медицины университета на FACScan цитометр потока повышен до 5 цветов и два лазера (BD Biosciences) и анализировали с помощью CellQuest (BD Biosciences) или FlowJO v7.2.4 (Tree Star, Inc, Ashland, Орегон, США), программное обеспечение.
Гимза окрашивания
- Около 30 тысяч клетки оправился от пластин ХФУ анализа, описанного выше, взвешенные в 0,3 мл 2% ЭТС / IMDM и переданы в слайд с помощью центрифуги цитоспина при 1000 оборотов в минуту в течение 10 мин при комнатной температуре.
- Настройка девять окрашивание сосудов с решениями в следующем порядке.
- Абсолютная Метанол
- Райт / Гимза маточного раствора
- Райт / Гимза буфере, рН 6,4
- 50% метанола в H 2 O
- H 2 O
- H 2 O
- Фосфатного буфера, рН 6,0
- H 2 O
- H 2 O
- Место слайдов в слайд перевозчика и окунуться в абсолютном метаноле (# 1) в течение 2 мин и промокните лишнюю метанола.
- Сразу же, окуните слайд перевозчика в Райт / Гимза маточного раствора (# 2) в течение 5 мин.
- Передача перевозчиком в Райт / Гимза буфере, рН 6,4 (№ 3) и инкубировать в течение 10 мин.
- Dip перевозчика два раза в 50% метанола (# 4), 10 раз в H 2 O (# 5), еще 10 раз в H 2 O (# 6), а затем 5 раз в фосфатном буфере, рН 6,0 (# 7) .
- Передача перевозчиком в H 2 O (# 8) и выдержать в течение 2 мин. Повторите мыться в H 2 O (# 9).
- Разрешить слайды высохнуть полностью на перевозчика. Удалить каждого слайда и протрите заднюю слайд с метанолом пропитанной Kimwipes для удаления пятен. Место капли Cytoseal 60 и покровного стекла, чтобы запечатать.
- 500-клеточной дифференциальный подсчет выполняется для каждого Гимза окрашенных слайд с помощью микроскопа Olympus BX51. Клетки делятся на пять категорий: примитивные клетки включают взрывы и промиелоциты; промежуточных клеток миелоидного включают миелоциты и метамиелоциты; зрелых клеток миелоидного включают группы, сегментоядерных нейтрофилов, моноцитов и макрофагов, промежуточные эритроидных клеток включают клетки с промежуточным hemoglobinization, и зрелые клетки эритроидного включают клетки с полным hemoglobinization. Микрофотографии взяты с камерой Olympus DP71 с 60x цель нефти.
3,0) репрезентативные результаты:
- ХФУ анализа: некоторые из клеточной популяции вход будет расти, дифференцируются и образуют колонии на полутвердые среды в течение 14-17-дневного инкубационного периода. В этом эксперименте, то очевидно, что выражение NUP98-HOXA9 онкоген вызывает образование видные красные (эритроидных колоний) (рис. 1) (3).
- Окрашивание антител и проточной цитометрии: проточной цитометрии иммунофенотипирования клеток собраны из пластин ХФУ анализа предоставляет информацию о дифференциации состояние клеточной популяции. К комбинированным использованием антител против определенных маркеров дифференциации, линии и степени созревания клеток могут быть оценены. В этом случае CD235a была использована для выявления эритроидных клеток. Как показано на рисунке 2А, NUP98-HOXA9 привело к увеличению доли CD235a + эритроидных клеток, но и яркость выражения CD235a этими клетками была снижена по сравнению с контрольной, что указывает на ингибирование созревания эритроидных. На Рисунке 2Б, миелоидных клеток выявляются в силу своей положительности CD33. NUP98-HOXA9 вызвано уменьшением числа CD33 + клеток, с уменьшением яркости выражения CD11b, в соответствии с торможением созревания миелоидных (3). Таким образом, результаты проточной цитометрии показывают, что NUP98-HOXA9 вызвано гиперплазией эритроидного с угнетением и миелоидного и эритроидного созревания.
- Гимза Пятно: Морфологические исследования клеток, собранных из пластин ХФУ анализа предоставляет информацию о линии и степени созревания клеточной популяции. Выводы, полученные морфологически могут отличаться от результатов, полученных с помощью проточной цитометрии исследований, и, следовательно, эти методы дополняют друг друга (3). Эксперимент повторяется по крайней мере 3 раза, и каждый раз 500-клеточной дифференциальный подсчет производится выделить 5 категорий клеток, как описано выше. Примеры эти клетки указал на рисунке 3. Результаты сведены в таблицу и проанализированы с целью определить, является ли Есть статистически значимых различий между онкоген-трансдуцированных образца и контроля. В этом случае, результаты показали, что NUP98-HOXA9 вызвало общее увеличение числаы клеток, с гиперплазией эритроидного и торможения обеих эритроидных и миелоидных созревания (3) (не показаны).
Рисункам

Рисунок 1: последствия NUP98-HOXA9 по морфологии человека CFC.
Первичные человеческие CD34 + клетки retrovirally трансдуцированных либо контроль MSCV-IRES-GFP вектор или вектор выражения NUP98-HOXA9, и клетки были отсортированы положительности GFP. Тысяча клетки высевали в каждую из двух одинаковых пластин для CFC анализа и эксперимент был повторен 3 4 независимых раза. Представитель пластины без увеличения (слева) и низкой микрофотографии власти представительной эритроидных колоний (справа) показаны (3).
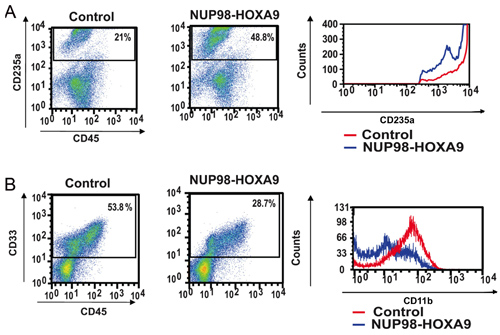
Рисунок 2: Проточная цитометрия показывает нарушение человеческих первичной CD34 + клеток дифференциации по NUP98-HOXA9.
(А) Проточная цитометрия для дифференциации эритроидных: Клетки из CFC пластины (см. рисунок 1) были собраны и окрашивали антителами к CD45 и CD235a. CD235a + ворот была построена на гистограммы (справа), чтобы показать выражение CD235a по сравнению с контрольными клетками (В) Проточная цитометрия для миелоидной дифференциации: Клетки из CFC пластины собирают и окрашивают CD45 и CD33. CD33 + ворот была построена на гистограмме, чтобы показать CD11b выражении по сравнению с контролем (правая панель). Процент клеток, входящих в каждых ворот показаны (3).
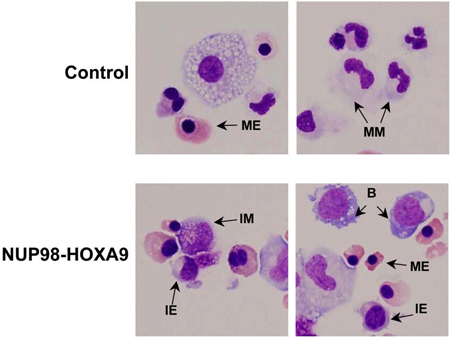
Рисунок 3: Сотовый морфологии показывает, нарушение дифференциации по NUP98-HOXA9 по сравнению с переносчиками болезней.
Цитоспина мазках были приготовлены из CFC пластины и окрашивали Гимза. Микрофотографии были взяты из представителей полей с 60x цель нефти. B: взрыв, М. М.: зрелые миелоидные, И. М.: промежуточные миелоидного, ME: зрелые эритроидных, И. Е.: промежуточные эритроидных (3).
Обсуждение
Анализ ХФУ широко используется для определения пролиферации и дифференцировки гемопоэтических моделей прародителей и изучать эффекты онкогенов (4, 5). Его преимущество над жидким культуры бытия клонального анализа, например, что колонии представляют собой потомство одной предшествен...
Раскрытие информации
Благодарности
Материалы
| Name | Company | Catalog Number | Comments |
| IMDM | Life Technologies | 12440 | |
| FBS | Stem Cell Technologies | 06150 | |
| L-Glutamine | Life Technologies | 25030 | |
| Penicillin/Streptomycin (PS) | Life Technologies | 15140 | |
| FLT-3 ligand | PeproTech Inc | 300-19 | |
| GM-CSF | PeproTech Inc | 300-03 | |
| SCF | PeproTech Inc | 300-07 | |
| TPO | PeproTech Inc | 300-18 | |
| IL3 | PeproTech Inc | 200-03 | |
| IL6 | PeproTech Inc | 200-06 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7030 | |
| EDTA | Fisher Scientific | BP118 | |
| Retronectin | Takara Bio Inc | T100A | |
| HBSS | Life Technologies | 14175 | |
| PBS | Life Technologies | 14200 | |
| Trypan Blue solution (0.4%) | Sigma-Aldrich | T8154 | |
| Methocult GF+ H4435 | Stem Cell Technologies | 04445 | |
| Human Methylcellulose Enriched Media | R&D Systems | HSC005 | |
| Wright/ Giemsa stain | Harleco | 64571 | |
| Phosphate Buffer Solution, pH 6.4 - Giordano formula | Ricca Chemical Company | 1450 | |
| Methanol | Fisher Scientific | A412-4 | |
| Cytoseal 60 | Thermo Fisher Scientific, Inc. | 8310 | |
| Normal Mouse Serum | Rockland Immunochemicals | D208 | |
| Anti-Human CD11b phyc–rythrin-conjugated | BD Biosciences | 555388 | |
| Anti-Human CD33 allophycocyanin-conjugated | BD Biosciences | 551378 | |
| Anti-Human CD45 phyc–rythrin-Cy7-congjugated | BD Biosciences | 557748 | |
| Anti-Human CD71 phyc–rythrin-conjugated | BD Biosciences | 555537 | |
| Anti-Human CD235a allophycocyanin-conjugated | BD Biosciences | 551336 | |
| Anti-Human CD45 phyc–rythrin-Cy7-congjugated | BD Biosciences | 557748 | |
| 24-well non-treated tissue culture plates | BD Biosciences | 35-1147 | |
| 30 mm non-treated dish | Stem Cell Technologies | 27150 | |
| 100 mm tissue culture dish | Fisher Scientific | 08-757-12 | |
| Gridded scoring dishes | Stem Cell Technologies | 27500 | |
| 15 ml centrifuge tubes | BD Biosciences | 35-2097 | |
| 50 ml centrifuge tubes | BD Biosciences | 35-2070 | |
| Syringes 3 ml | Stem Cell Technologies | 28240 | |
| 16 gauge blunt-end, 1½ inch needle | Stem Cell Technologies | 28110 | |
| 50 μm CellTrics cell filter | Partec | 04-004-2327 | |
| Hemocytometer | Fisher Scientific | 0267110 | |
| TPX sample chambers | Thermo Fisher Scientific, Inc. | A78710018 | |
| Fisherbrand Superfrost/Plus Microscope Slides, Precleaned | Fisher Scientific | 12-550-15 | |
| Shandon filter cards | Thermo Fisher Scientific, Inc. | 5991022 | |
| Shandon cytospin slide holder | Thermo Fisher Scientific, Inc. | 59920063 | |
| Shandon Complete Staining Assembly 100 | Thermo Fisher Scientific, Inc. | 100 | |
| Kimwipes | Kimberly-Clark Corporation | 34155 | |
| 1 μm filter paper | VWR international | 28307-134 | |
| Inverted microscope | Nikon Instruments | Diaphot | |
| Microscope camera | Nikon Instruments | DS-F11 | |
| Microscope | Olympus Corporation | BX51 | |
| Microscope camera | Olympus Corporation | DP71 | |
| Scanner | Microtek | Scanmaker 4 | |
| Vortex mixer | Fisher Scientific | 12-812 | |
| Tissue culture incubator | Sanyo | MCO-18AIC | |
| Cytospin | Shandon, Inc. | Cytospin 2 | |
| Bench-top centrifuge | Eppendorf | 5810-R | |
| Water purification system | Barnstead | Nanopure-Diamond |
Ссылки
- Takeda, A., Goolsby, C., Yaseen, N. R. NUP98-HOXA9 induces long-term proliferation and blocks differentiation of primary human CD34+ hematopoietic cells. Cancer Res. , 66-6628 (2006).
- Yassin, E. R., Abdul-Nabi, A. M., Takeda, A., Yaseen, N. R. Effects of the NUP98-DDX10 oncogene on primary human CD34+ cells: role of a conserved helicase motif. Leukemia. , (2010).
- Yassin, E. R., Sarma, N. J., Abdul-Nabi, A. M., Dombrowski, J., Han, Y., Takeda, A., Yaseen, N. R. Dissection of the transformation of primary human hematopoietic cells by the oncogene NUP98-HOXA9. PLoS One. 4, e6719-e6719 (2009).
- Nissen-Druey, C., Tichelli, A., Meyer-Monard, S. Human hematopoietic colonies in health and disease. Acta Haematol. 113, 5-96 (2005).
- Pereira, C., Clarke, E., Damen, J. Hematopoietic colony-forming cell assays. Methods Mol Biol. 407, 177-208 (2007).
- Coulombel, L. Identification of hematopoietic stem/progenitor cells: strength and drawbacks of functional assays. Oncogene. 23, 7210-7222 (2004).
- Hogge, D. E., Lansdorp, P. M., Reid, D., Gerhard, B., Eaves, C. J. Enhanced detection, maintenance, and differentiation of primitive human hematopoietic cells in cultures containing murine fibroblasts engineered to produce human steel factor, interleukin-3, and granulocyte colony-stimulating factor. Blood. 88, 3765-3773 (1996).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены