Method Article
La interferencia de ARN en las garrapatas
En este artículo
Resumen
Un método de interferencia de ARN (RNAi), mediante la inyección de dsRNA en las garrapatas alimentadas se describe. El ARNi es el más utilizado silenciamiento génico técnica en las garrapatas, donde ha sido el uso de otros métodos de manipulación genética limitada.
Resumen
Las garrapatas son ectoparásitos hematófagos obligados de los animales salvajes y domésticos y los seres humanos, y se considera que todo el mundo segundo a los mosquitos como vectores de enfermedades humanas 1 y los vectores más importantes que afectan a la industria ganadera a nivel mundial 2. Las garrapatas se clasifican en la subclase Acari, Parasitiformes orden, suborden Ixodida y se distribuyen en todo el mundo desde el Ártico a las regiones tropicales 3. A pesar de los esfuerzos para controlar la infestación por garrapatas, estos ectoparásitos siguen siendo un problema grave para la salud humana y animal 4,5.
ARN de interferencia (RNAi) 6 es un ácido nucleico enfoque basado en genética inversa que consiste en la interrupción de la expresión génica con el fin de determinar la función del gen o su efecto sobre una vía metabólica. Pequeños RNAs de interferencia (siRNA) son las moléculas efectoras de la vía de RNAi que se inicia por ARN de doble cadena (dsRNA) y los resultados en una secuencia específica de potentes degradación de los ARNm citoplasmático que contiene la misma secuencia que el gatillo dsRNA 7-9. Post-transcripcional mecanismos de silenciamiento de genes iniciada por dsRNA se han descubierto en todos los eucariotas estudiados hasta ahora, y RNAi se ha desarrollado rápidamente en una variedad de organismos como una herramienta para estudios de genómica funcional y otras aplicaciones 10.
RNAi se ha convertido en el más utilizado silenciamiento génico técnica en las garrapatas y otros organismos en distintos criterios para la manipulación genética no están disponibles o no son fiables 5,11. La caracterización genética de las garrapatas se ha limitado hasta la reciente aplicación de RNAi 12,13. En el poco tiempo que el ARNi ha estado disponible, ha demostrado ser una herramienta valiosa para estudiar la función génica garrapata, la caracterización de la interfaz de garrapata-patógeno y la detección y caracterización de antígenos de garrapatas de protección 14. En esto, un método para RNAi a través de la inyección de dsRNA en las garrapatas alimentadas se describe. Es probable que el conocimiento obtenido a partir de este enfoque experimental contribuirá notablemente a la comprensión de los sistemas básicos biológicos y el desarrollo de vacunas para controlar las infestaciones de garrapatas y prevenir la transmisión de patógenos transmitidos por garrapatas 15-19.
Protocolo
1. Generación de dsRNA.
- Sintetizar oligonucleótidos que contienen secuencias de promotor T7 para la transcripción in vitro y la síntesis del dsRNA (por ejemplo, para Dermacentor variabilis subolesin uso de oligonucleótidos D8AAT75:
5'-TAATACGACTCACTATAGGGTACTGACTGGGATCCCCTGCACAGT-3 'y D8DVT73: 5'-TAATACGACTCACTATAGGGTACTCGAGCTTGGTGGAAAGGACG-3'). - Amplificación del gen diana por RT-PCR con 10 pmol de cada oligonucleótido y 10.1 ng de ARN total de garrapatas.
- Purificar el producto de PCR.
- Sintetizar dsRNA con 8 l del producto de PCR purificado.
- Cuantificar dsRNA por espectrometría.
2. La inyección de garrapatas con dsRNA.
2.1. Preparación de las garrapatas de la inyección.
- Primero, lávese las garrapatas en una serie de soluciones por agitación en cada solución en un tubo de centrífuga de 50 ml desechables, decantando la solución a través de una malla de alambre fino en la parte superior del tubo para mantener las garrapatas. La secuencia de las soluciones para las garrapatas de lavado es agua del grifo, 3% de peróxido de hidrógeno, dos lavados de agua destilada, etanol 70% y más de dos lavados con agua destilada.
- Blot-seca las garrapatas en las toallas de papel.
- Contar con las garrapatas en grupos de 20 a 50, dependiendo del experimento, coloque las garrapatas de cada grupo en una taza de 1,25 oz de plástico con tapa bien ajustada y una etiqueta con el número del grupo experimental.
2.2. Marque el equipo de inyección.
El equipo de RNAi se compone de tres personas: (1) una persona que las posiciones de cada marca en la cinta adhesiva de doble estampará en una hoja de cera dental rojo, (2) una persona que se inyectaba las garrapatas y (3) una persona que controla las garrapatas después inyección, respira CO 2 en las garrapatas para activarlos y cuenta con las garrapatas que viven en las tazas marcado con el número del grupo experimental. Todos los miembros del equipo deben usar guantes desechables.
2.3. La colocación de las garrapatas de la inyección.
- Captura de una garrapata con unas pinzas finas Dumont y el lugar que la parte ventral en cinta adhesiva de doble colocada en un 3 "x 6" hoja de cera dental rojo. Las garrapatas están muy posicionados en grupos de 5 garrapatas.
- Coloque una pequeña tira de cinta adhesiva sobre las piezas bucales de los 5 garrapatas a fin de promover las limitan, pero dejando la mayor parte del cuerpo que están expuestas de manera que el proceso de inyección se pueden observar por la garrapata del inyector (Figura 1).
2.4. La inyección de garrapatas.
- Las garrapatas se inyecta en el cuadrante inferior derecho de la cara ventral del exoesqueleto.
- En primer lugar, perfore un agujero en el exoesqueleto con una jeringa de insulina Monoject equipado con un ½ ", 29 de aguja (Figura 2a).
- Inyectar inmediatamente las garrapatas con 0,2-0,5 l de solución de dsRNA (5 x 10 10 - 5 x 10 11 moléculas por microlitro) con una jeringa a medida Hamilton con 1 pulgada, aguja de calibre 33 con un punto de biselado 45 ° (Figura 2b) . La aguja debe estar en buena posición dentro de la cavidad de verificación para asegurar la colocación y el mantenimiento de la dsRNA. Un poco de líquido es probable que escape de la zona de inyección (figura 2c). Se debe tener cuidado de no inyectar más de las garrapatas, lo que causaría la pérdida de hemolinfa y podría causar la muerte de la garrapata.
- Limpie la jeringa Hamilton después de completar la inyección en cada grupo experimental. antes de usar para otro grupo experimental. Llene la jeringa primero de un vaso que contiene 3% de peróxido de hidrógeno y luego expulsar a un contenedor de residuos, y repita 15 veces. Llene la jeringa de un vaso que contiene agua estéril y luego expulsar a un contenedor de residuos, y repita 15 veces. Tenga cuidado de no doblar el émbolo de la jeringa Hamilton, ya que, si se doblan, el émbolo no se mueve sin problemas y responder a la suave toque necesario para la inyección de las garrapatas.
2.5. El tratamiento de garrapatas después de la inyección.
- Recoger la garrapata inyecta inmediatamente de la cinta adhesiva de doble con las pinzas finas y colocarlo en un recipiente de recuperación de plástico (de aproximadamente 6 "x 6" y rodeada con cinta adhesiva para evitar la fuga de las garrapatas). Las garrapatas se hará una breve inactivos después de la inyección, pero pronto comienzan a gatear alrededor del plato.
- Respiración de CO 2 a la garrapata inmediatamente después de colocarlos en el recipiente de recuperación para ayudar a activar las garrapatas. Una vez que las garrapatas se están arrastrando y activa, la herida de la inyección se curan rápidamente y van a sobrevivir más probable.
- Contar con las garrapatas de acuerdo con el número en cada grupo experimental y colocarlos en un vaso de plástico etiquetados con una tapa bien ajustada. Las garrapatas de reemplazo debe ser inyectada para reemplazar el que cualquier murió antes de inyectar el grupo experimental que viene.
2.6. Marque la celebración.
- Coloque la garrapata en una cámara de humedad (12 h luz: 12 h fotoperíodo oscuridad a 22-25 ° C y 95% en relación humidity) y mantener durante 1 día.
- Garrapatas lugar en las células de alimentación de garrapatas, uno por cada grupo experimental, pegado a una oveja y les permite alimentarse con el mismo número de garrapatas no inyectadas hombre o mujer (lo que el sexo no se inyecta). Las hembras de que se alimentan hasta la saciedad, los que se retiran de las ovejas después de 10 días de alimentación o cuando el control de las mujeres han desaparecido de la sede se recogen y se pesó.
- Coloque la garrapata en cajas de cartón, y mantener en la cámara de humedad hasta la finalización de la oviposición. Evaluar la oviposición de ponderación la masa de huevos producidos por todas las garrapatas en el grupo.
2.7. Análisis del fenotipo garrapata después de RNAi.
- Evaluar el fenotipo de garrapatas después de la alimentación mediante la determinación del número de pasos que sobrevivieron, el peso de garrapatas, la oviposición y la fertilidad del huevo. Sin embargo, otros análisis se puede realizar en función de los genes específicos y objetivos del estudio.
3. Análisis para confirmar el silenciamiento de genes por RT-PCR.
- Diseccionar las glándulas salivales y las vísceras de las garrapatas individuales de los grupos de control de inyección y dsRNA inyectado después de la alimentación.
- Extraer el ARN total de muestras de tejidos individuales.
- Analizar las transcripciones de genes objetivo en los distintos tejidos en tiempo real de RT-PCR y normalizar los niveles de ARN 16S contra la garrapata rRNA utilizando el método de genNorm (método DDCT implementado por Bio-Rad Edition iQ5 estándar, versión 2.0).
- Ejecutar las curvas de disociación en la final de la reacción para garantizar que sólo un amplicón se forma y que la desnaturalizan los amplificados constantemente en el mismo rango de temperatura para cada muestra.
- Comparar los niveles de ARNm (normalizaron los valores Ct) entre el control y con inyección de dsRNA inyección de garrapatas con el Student `s t-test (P = 0,05).
4. Los resultados representativos:
El protocolo se describe en este documento se ha utilizado en nuestro laboratorio de RNAi en muchas especies diferentes de garrapatas ixodid (Tabla 1). La cantidad de dsRNA se inyecta en las garrapatas varía con el tamaño de la garrapata; grandes especies de garrapatas pueden alojar a un mayor volumen. Las garrapatas de control negativo debe ser inyectado con un dsRNA relacionados. DsRNAs varios como subolesin 14-19,22-25,27-32,34 y beta-actina 20,21 podrían ser utilizados como controles positivos. Tenga en cuenta que es importante lavar la jeringa entre los tratamientos para evitar la mezcla de soluciones de dsRNA. Si el protocolo se hace correctamente, menos del 5% de mortalidad se debe obtener de el procedimiento de inyección a las 24 horas. Un fenotipo típico después de caída de genes en las garrapatas se muestra en la Figura 3 con un grupo de garrapatas inyectadas con piscinas de dsRNA con el fin de la pantalla para marcar antígenos protectores.
| Especies de garrapatas | dsRNA inyección | Referencias |
| Ixodes scapularis | biblioteca de cDNA, subolesin, la actina, nucleotidasa, NF-kB, akirin | 21, 22, 29, 30 |
| Dermacentor variabilis | subolesin, GST, la ubiquitina, vATPase, selenoproteínas M y W2A, hematopoyéticas células madre / progenitoras de proteínas como la actina del proteasoma subunidad 26S, ferritin1, varisin, akirin | 15, 19, 22, 24, 26, 30-32 |
| Dermacentor marginatus | subolesin | 22 |
| Amblyomma americanum | biblioteca de cDNA, subolesin, akirin | 17, 22, 30 |
| Amblyomma hebraeum | subolesin, voraxin | 28 |
| Rhipicephalus sanguineus | Rs86, subolesin | 22, 23 |
| Rhipicephalus microplus | GST, selenoproteína ubiquitina, Bm86, Bm91, subolesin, GI, GIII, EF1A, proteínas de seda flagelliform, von Willebrand factor | 16, 18, 25, 27 |
| Rhipicephalus annulatus | subolesin ubiquitina, EF1A, GIII | 16 |
Tabla 1. Especies de garrapatas en el que el protocolo de RNAi ha sido utilizado.
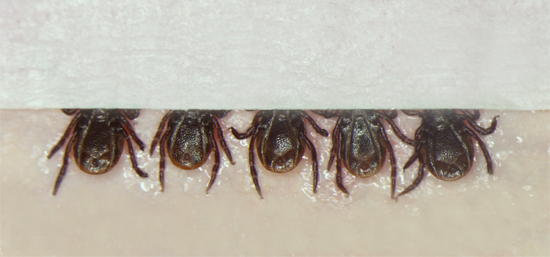
Figura 1. Colocación de las garrapatas, lado ventral hacia arriba, en la cinta doble adhesiva adherida a una lámina de cera dental rojo. Las garrapatas son colocados en grupos de 5, después de que una pequeña tira de cinta adhesiva se coloca sobre el aparato bucal con el fin de proteger aún más las garrapatas al tiempo que permite la inyección para observar el cuerpo de la garrapata durante la inyección.

Figura 2. El procedimiento de inyección incluyen (a) perforar el cuadrante inferior derecho del exoesqueleto marque con una insulina de syringe equipado con una aguja de calibre 29 con el fin de crear un sitio de la inyección, (b) la inyección inmediata de la dsRNA en este sitio con una jeringa Hamilton con una aguja de calibre 33, que (c) muy probablemente se traducirá en alguna fuga de la hemolinfa de garrapatas / líquidos.

Figura 3. Un panel de seis grupos de garrapatas en el que se utilizó RNAi para la detección de antígenos protectores garrapata Amblyomma americanum en. Los cambios fenotípicos en las garrapatas se pueden ver cuando se compara con el control positivo subolesin ARN de interferencia y el control negativo dsRNA relacionados. En este experimento, el efecto de RNAi en la mortalidad de garrapatas, pesos y la oviposición de cada grupo se analizaron estadísticamente.
Discusión
Aunque otros métodos han sido descritos por RNAi en pasos de 14, 33, la inyección de dsRNA se describe aquí es el más utilizado en los dos sin alimento (Tabla 1) y se alimentan las garrapatas 16,25,34. ARNi ha demostrado ser una herramienta valiosa para el estudio de la función de marcar los genes, la caracterización de la interfaz de garrapata-patógeno y la detección y caracterización de antígenos de garrapatas de protección 14,35. En particular, el ARNi se ha convertido en la herramienta más valiosa para el análisis funcional de las garrapatas 35.
Metodológicamente, el ARNi es probable que evolucionar hacia métodos más eficientes que permitan caída de genes en un gran número de personas. El mecanismo de dsRNA inducida por RNAi en las garrapatas debe ser refinado para contribuir a una mejor comprensión y utilización de este enfoque genético de esta especie 35,36. La extensión de los efectos fuera del objetivo de RNAi en las garrapatas es también una cuestión importante que debe abordarse la cuestión 14,27. Por último, el ARNi es muy probable que hagan contribuciones integral para el estudio de la regulación de genes y marque la biología de sistemas y de la garrapata-patógeno y la interfaz puede tener un impacto en el desarrollo de vacunas para controlar la infestación por garrapatas y la transmisión de enfermedades transmitidas por garrapatas patógenos.
Divulgaciones
Agradecimientos
Agradecemos a los miembros de nuestros laboratorios para un debate fructífero y asistencia técnica. Esta presentación en video fue apoyada por el Decano Asociado para la Investigación y el Departamento de Patología Veterinaria, Centro de Ciencias de la Salud Veterinaria, Universidad Estatal de Oklahoma. La investigación fue financiada por el Ministerio de Ciencia e Innovación, España (proyecto BFU2008-01244/BMC), el proyecto intramural del CSIC PA1002451 a JF, Walter R. Sitlington Cátedra de Investigación en Alimentación Animal de KMK, CVHS 2009 RAC subvención, las emisiones otoacústicas Fondos de Salud Animal y el USDA, la Beca Nacional de Investigación Iniciativa de la competencia, N º 2007-04613.
Materiales
| Name | Company | Catalog Number | Comments |
| Access RT-PCR system | Promega | A1250 | |
| Purelink PCR purification kit | Invitrogen | K3100-02 | |
| Megascript RNAi kit | Ambion | AM1626M | |
| Red dental wax | Electron Microscopy Sciences | 72674 | |
| Plastic cups, 1.25 oz and lids | Solo Cup Company, Urbana Ill. | ||
| Fine forceps | Electron Microscopy Sciences | Various | |
| Insulin syringe | Monoject | Fitted with a ½", 29 gauge needle | |
| Hamilton syringe | Hamilton | 701SN,33/.375”/45DGR | Custom made |
| TriReagent | Sigma | 93289 | |
| iScript One-Step RT-PCR Kit with SYBR Green | Bio-Rad | 170-8892 | |
| Real-time PCR detection system | Bio-Rad | Several | Please refer to http://www.bio-rad.com/ |
Referencias
- de la Fuente, J. Overview: Ticks as vectors of pathogens that cause disease in humans and animals. Front. Biosci. 13, 6938-6946 (2008).
- Peter, R. J. mosquito control-Lessons from the past, solutions for the future. Vet. Parasitol. 132, 205-215 (2005).
- Barker, S. C., Murrell, A. Systematics and evolution of ticks with a list of valid genus and species names. Parasitol. 129, S15-S36 (2004).
- Willadsen, P. Tick control: Thoughts on a research agenda. Vet. Parasitol. 138, 161-168 (2006).
- de la Fuente, J., Kocan, K. M. Strategies for development of vaccines for control of ixodid tick species. Parasite Immunol. 28, 275-283 (2006).
- Fire, A. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Cerutti, H. RNA interference: traveling in the cell and gaining functions. Trends Genet. 19, 39-46 (2003).
- Kavi, H. H. RNA silencing in Drosophila. FEBS Lett. 579, 5940-5949 (2005).
- Mello, C. C., Conte, D. J. r Revealing the world of RNA interference. Nature. 431, 338-342 (2004).
- Zhou, D. RNA interference and potential applications. Curr. Top. Med. Chem. 6, 901-911 (2006).
- Ramakrishnan, V. G. Application of RNA interference in tick salivary gland research. J. Biomol. Tech. 16, 297-305 (2005).
- Aljamali, M. N. RNA interference: applicability in tick research. Exp. Appl. Acarol. 28, 89-96 (2002).
- Aljamali, M. N. RNA interference in ticks: a study using histamine binding protein dsRNA in the female tick Amblyomma americanum. Insect. Mol. Biol. 12, 299-305 (2003).
- de la Fuente, J. RNA interference for the study and genetic manipulation of ticks. Trends Parasitol. 23, 427-433 (2007).
- de la Fuente, J. Functional genomic studies of tick cells in response to infection with the cattle pathogen, Anaplasma marginale. Genomics. 90, 712-722 (2007).
- AlmazäN, C. Identification and characterization of Rhipicephalus (Boophilus) microplus candidate protective antigens for the control of cattle tick infestations. Parasitol. Res. 106, 471-479 (2010).
- de la Fuente, J. Identification of protective antigens by RNA interference for control of the lone star tick, Amblyomma americanum. Vaccine. 28, 1786-1795 (2010).
- Zivkovic, Z. Differential expression of genes in salivary glands of male Rhipicephalus (Boophilus) microplus in response to infection with Anaplasma marginale. BMC Genomics. 11, 186-186 (2010).
- de la Fuente, J. Reduction of tick infections with Anaplasma marginale and A. phagocytophilum by targeting the tick protective antigen subolesin. Parasitol. Res. 100, 85-91 (2006).
- Narasimhan, S. Disruption of Ixodes scapularis anticoagulation by using RNA interference. Proc. Natl. Acad. Sci U.S.A. 101, 1141-1146 (2004).
- de la Fuente, J. RNA interference screening in ticks for identification of protective antigens. Parasitol. Res. 96, 137-141 (2005).
- de la Fuente, J. The tick protective antigen, 4D8, is a conserved protein involved in modulation of tick blood ingestion and reproduction. Vaccine. 24, 4082-4095 (2006).
- de la Fuente, J. Synergistic effect of silencing the expression of tick protective antigens 4D8 and Rs86 in Rhipicephalus sanguineus by RNA interference. Parasitol. Res. 99, 108-113 (2006).
- de la Fuente, J. Autocidal control of ticks by silencing of a single gene by RNA interference. Biochem. Biophys. Res. Commun. 344, 332-338 (2006).
- Nijhof, A. M. Bm86, Bm91 and subolesin, in the silencing of the tick protective antigens. Int. J. Parasitol. 37, 653-662 (2007).
- Kocan, K. M. Silencing of the defensin, varisin, in male Dermacentor variabilis by RNA interference results in reduced Anaplasma marginale infections. Exp. Appl. Acarol. 46, 17-28 (2008).
- de la Fuente, J. Evidence of the role of tick subolesin in gene expression. BMC Genomics. 9, 372-372 (2008).
- Smith, A. The impact of RNA interference of the subolesin and voraxin genes in male Amblyomma hebraeum (Acari: Ixodidae) on female engorgement and oviposition. Exp. Appl. Acarol. 47, 71-86 (2009).
- Galindo, R. C. Tick subolesin is an ortholog of the akirins described in insects and vertebrates. Dev. Comp. Immunol. 33, 612-617 (2009).
- Canales, M. Conservation and immunogenicity of the mosquito ortholog of the tick protective antigen, subolesin. Parasitol. Res. 105, 97-111 (2009).
- Kocan, K. M. Silencing of genes involved in Anaplasma marginale-tick interactions affects the pathogen developmental cycle in Dermacentor variabilis. BMC Dev. Biol. 9, 42-42 (2009).
- Zivkovic, Z. Subolesin expression in response to pathogen infection in ticks. BMC Immunol. 11, 7-7 (2010).
- Karim, S. Functional genomics tool: gene silencing in Ixodes scapularis eggs and nymphs by electroporated dsRNA. BMC Biotechnol. 10, 1-1 (2010).
- Kocan, K. M. Transovarial silencing of the subolesin gene in three-host ixodid tick species after injection of replete females with subolesin dsRNA. Parasitol. Res. 100, 1411-1415 (2007).
- de la Fuente, J. Targeting the tick-pathogen interface for novel control strategies. Front. Biosci. 13, 6947-6956 (2008).
- Kurscheid, S. Evidence of a tick RNAi pathway by comparative genomics and reverse genetics screen of targets with known loss-of-function phenotypes in Drosophila. BMC Mol. Biol. 10, 26-26 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados