Method Article
ダニのRNA干渉
要約
食物を与えられていないダニへのdsRNAの注射により、RNA干渉(RNAi)のための方法が記載されている。 RNAiは、遺伝子操作の他のメソッドの使用が制限されているダニの中で最も広く使用されている遺伝子サイレンシング技術です。
要約
ダニは、野生と家畜と人間の真正の吸血性外部寄生虫であり、ヒトの疾患1、畜牛業界世界中で2を影響を与える最も重要なベクトルのベクトルとしての蚊への2番目の世界的であると考えられている。チックはサブクラスダニ目、注文Parasitiformes、亜Ixodidaに分類され、北極から熱帯地域3に世界的に分布している。ダニの蔓延を制御するための努力にもかかわらず、これらの外部寄生虫は、人間と動物の健康に深刻な問題が4,5のまま。
RNA干渉(RNAi)6遺伝子機能や代謝経路への影響を判断するために、遺伝子発現の混乱を含む核酸系逆遺伝学的ア プローチです。低分子干渉RNA(siRNA)は二本鎖RNA(dsRNA)とdsRNAのトリガ7月9日と同じ配列を含む細胞質mRNAの強力な配列特異的分解の結果によって開始されるRNAi経路のエフェクター分子である。 dsRNAをによって開始された転写後遺伝子サイレンシングのメカニズムがすべての真核生物で発見されたことはこれまで研究し、RNAiは、急速に機能ゲノミクス研究やその他のアプリケーション10のツールとしてさまざまな生物で開発されています。
RNAiは、遺伝子操作のための代替アプローチが利用できなかったり、信頼できない5,11であるダニや他の生物の中で最も広く使用されている遺伝子サイレンシング技術となっている。ダニの遺伝的特性は、RNAiの12,13の最近の応用まで限定されている。 RNAiは利用可能であることを短い時間で、それはダニの遺伝子機能を研究するための貴重なツール、ダニ媒介病原体のインタフェースの特性評価とスクリーニングとダニ防御抗原14の特性であることが証明されました。ここで、食物を与えられていないダニへのdsRNAの注入によるRNAiの方法が記載されている。それはこの実験的なアプローチから得られた知識は、基本的な生物学的システムの理解とダニの蔓延を制御し、ダニ媒介性病原体15-19伝送を予防するワクチンの開発に著しく寄与する可能性があります。
プロトコル
1。 dsRNAの世代。
- dsRNAのin vitroでの転写および合成のためのT7プロモーター配列を含むオリゴヌクレオチドプライマーを合成する(例えば、 カクマダニ属のためにsubolesinオリゴヌクレオチドプライマーD8AAT75を使用アベマキ :
5' - TAATACGACTCACTATAGGGTACTGACTGGGATCCCCTGCACAGT - 3'とD8DVT73:5' - TAATACGACTCACTATAGGGTACTCGAGCTTGGTGGAAAGGACG - 3')。 - RT - PCRは、それぞれのオリゴヌクレオチドプライマーとダニのトータルRNA 1-10 ngの10 pmolのを使用して標的遺伝子を増幅する。
- PCR産物を精製する。
- 精製したPCR産物の8μLを用いてdsRNAを合成する。
- スペクトロメトリーによりdsRNAを定量化する。
2。 dsRNAを持つマダニの注射。
2.1。注射のためのティックの準備。
- 最初に、ダニを保持するためにチューブトップを細かくメッシュワイヤースクリーンを通してソリューションをデカント、50mLの使い捨て遠心管に各ソリューションでそれらを振盪することによってソリューションの一連のティックを洗う。洗濯ダニのためのソリューションのシーケンスは、水道水、3%過酸化水素、蒸留水の2回洗浄、70%エタノールおよび蒸留水でさらに2回洗浄です。
- ペーパータオルの上でダニをブロット乾燥。
- 実験に応じて、20〜50のグループにティックをカウント、実験群の数としっかりフィットふたとラベルを1.25オンスのプラスチック製のコップで各グループからダニを置きます。
2.2。射出チームティック。
RNAiのチームは3人で構成されています:(1)赤歯科用ワックスのシートに貼り付けられた二重粘着テープ上の各目盛りを置いた一人、後にダニを監視目盛りと(3)一人を注入する(2)一人注射は、それらを有効にダニにCO 2を吹き込みと実験群の番号のラベルが付いてカップに住んでいるダニをカウントします。すべてのチームメンバーは、使い捨ての手袋を着用しなければならない。
2.3。注射のためのダニの配置。
- デュモン細かい鉗子を使用してダニをキャプチャし、赤歯科ワックスの3"× 6"シートに貼付ダブル粘着テープの上に腹側を上に置きます。チックは密接に5ティックのグループで一緒に配置されている。
- さらに、それらを抑制するために、全5ダニの口器にわたってマスキングテープの小片を置きますが、注射のプロセスがダニインジェクタ(図1)によって観察できるように公開されたボディのほとんどを残すこと。
2.4。ダニの注射。
- ダニは、外骨格の腹側表面の右下腹部に注入されます。
- 最初に、ピアス½"、29ゲージの針(図2a)を装備Monojectのインスリン注射器を使用して外骨格に穴。
- 45 °傾斜したポイントで1インチ、33ゲージの針を使用してカスタムメイドのハミルトンシリンジを用いて- (μLあたり5 × 10 11分子が5 × 10 10)(図2b)のdsRNAのソリューションの0.2から0.5μLで、すぐにチックを注入する。針は、dsRNAの配置と保持を保証するためにもダニの空洞内に配置する必要があります。いくつかの流体は、注射部位(図2c)から脱出する可能性があります。ケアは、以上の血リンパの損失を引き起こすとダニの死を引き起こす可能性ダニを、注入しないように注意してください。
- 各実験群で注射を完了した後にハミルトンシリンジを清掃してください。別の実験群のために使用する前に。 3%の過酸化水素を含むビーカーから最初の注射器をいっぱいにし、廃棄物の容器に追放し、15回繰り返す。滅菌水の入ったビーカーからシリンジを記入し、廃棄物の容器に追放し、15回繰り返す。曲がった場合、プランジャーがスムーズに移動し、ダニの注入に必要な優しいタッチに反応しない、ので、ハミルトンシリンジのプランジャーを曲げないように注意してください。
2.5。注入後のダニの治療。
- 細かい鉗子ですぐにダブル粘着テープから注入された目盛りをピックアップし、プラスチックの回収容器(約6"× 6"とダニの脱出を防ぐためにマスキングテープで囲ま)に置きます。ティックは、注射後しばらく非アクティブになりますが、すぐに皿の周りにクロールを開始する必要があります。
- 息がすぐにダニを有効にするための回収容器にそれらを配置した後にダニにCO 2を 。ダニは、クロールとアクティブされると、注射の傷は急速に治癒するが、これはほとんど生き残っていくだろう。
- 各実験群の数に応じて目盛りを数えて、しっかりと取り付けられた蓋のラベルが付いたプラスチック製のコップの中に置いてください。交換用の目盛りは、いずれかが次の実験群を注入する前に死亡したことを置き換えるために注入されるべきである。
2.6。持株ティック。
- ° Cと95%の相対時間22〜25で12時間暗光周期:湿度チャンバ内でダニを置きます(12時間光umidity)と1日間保持する。
- ダニ送り細胞、実験群に1つずつ配置ダニは、羊に接着し、それらをuninjected雄または雌ダニの数と同じ数(注入されていない方の性別)を供給することができます。たらふく女性チックそのフィードは、給餌の10日後に羊から削除されるか、コントロールの女性がホストを降ろしているときにそれらを収集し、秤量する。
- カートンでダニを置き、そして産卵の完了まで、湿度チャンバ内に保持する。重み付けして、グループ内のすべてのダニによって生成された卵塊を産卵を評価する。
2.7。 RNAiの後のダニの表現型の解析。
- 生き残ったダニの数を決定することによって、餌の後に表現型をチェック評価し、体重、産卵と卵の肥沃度をチェックします。しかし、他の分析は、標的遺伝子と研究の目的に応じて実施することができる。
3。 RT - PCRによる遺伝子サイレンシングを確認する分析。
- 授乳後のコントロールを注入し、dsRNAを注入されたグループから個々のダニから唾液腺や内臓を細かく分析。
- 個々の組織サンプルからトータルRNAを抽出する。
- リアルタイムRT - PCRによって個々の組織における標的遺伝子の転写産物を分析し、ダニの16Sに対してRNAレベルを正常化するには、genNorm法(Bio - Rad社iQ5のStandard Edition、バージョン2.0で実装されたddCT方式)を使用してrRNAの。
- 唯一のアンプリコンが形成されていることを確認するために反応の終了時に、その解離曲線を実行するすべてのサンプルに対して同じ温度範囲で一貫してアンプリコンの変性。
- 制御注入し、学生の`sのt -検定(P = 0.05)を用いて二本鎖RNAを注入されたティック間のmRNAレベル(正規化されたCt値)を比較する。
4。代表的な結果:
ここに記述されているプロトコルは、多くの異なるマダニの種でRNAi実験のための我々の研究室(表1)で使用されています。ティックに注入されたdsRNAの量は、ダニの大きさによって変化します。大きくダニの種は、より大きなボリュームを収容することができます。ネガティブコントロールの目盛りは、無関係のdsRNAを注入する必要があります。このようなsubolesin 14-19,22-25,27-32,34とβ-アクチン20,21のようないくつかのdsRNAはポジティブコントロールとして使用することができる。それは混合のdsRNAソリューションを避けるために、治療の間に注射器を洗浄することが重要であることに注意してください。プロトコルが適切に行われた場合、5%未満の死亡率は、24時間後に注射の手順から入手してください。ダニの遺伝子のノックダウン後の典型的な表現型は防御抗原をチェックするための画面にするためにdsRNAのプールを注入ダニのパネルと図3に示します。
| 種ティック | dsRNAは、注入 | 参考文献 |
| scapularisマダニ属 | cDNAライブラリー、subolesin、アクチン、ヌクレオチダーゼ、NF - KB、akirin | 21、22、29、30 |
| カクマダニ属アベマキ | subolesin、GST、ユビキチン、vATPase、セレンMとW2A、造血幹細胞/前駆細胞アクチン、タンパク質のような26Sプロテアソームサブユニット、ferritin1、varisin、akirin | 15、19、22、24、26、30から32 |
| カクマダニ属marginatus | subolesin | 22 |
| キララamericanum | cDNAライブラリー、subolesin、akirin | 17、22、30 |
| キララhebraeum | subolesin、voraxin | 28 |
| Rhipicephalusのsanguineus | Rs86、subolesin | 22、23 |
| Rhipicephalus microplus | GST、ユビキチン、セレン、Bm86、Bm91、subolesin、GI、GIII、EF1a、鞭毛状の糸タンパク質、フォンウィルブランド ファクタ | 16、18、25、27 |
| Rhipicephalusのannulatus | ユビキチン、subolesin、EF1a、GIII | 16 |
表1:RNAiのプロトコルが使用されている種にチェックを入れます。
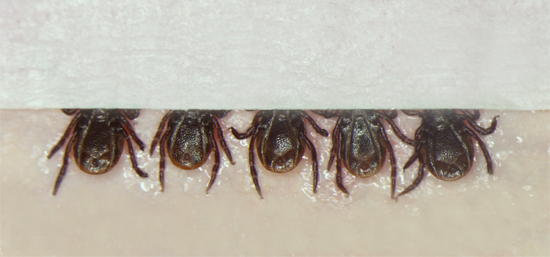
図1赤歯科用ワックスのシートに付着ダブル粘着テープの目盛りの配置、上腹側、。ダニは、マスキングテープの小片がインジェクタが注入中にダニの体を観察しながら、さらにダニを確保するために口器上に配置され、その後、5グループに配置されます。

図2。注入手順はインスリンSYとダニの外骨格の右下の象限にピアス()が含まれています注射部位を作成するために29ゲージの針を備えたringe、(c)のほとんどがダニの血リンパ/いくつかの漏洩につながる33ゲージの針でハミルトンシリンジを使用して、このサイトでのdsRNAの(b)の即時注入流体。

図3。RNAiのはキララamericanumのダニ防御抗原をスクリーニングするために使用されたダニ6つのグループのパネル。ポジティブsubolesin RNAiを制御し、負の無関係なdsRNAをコントロールと比較した場合、ティック単位での表現型の変化を見ることができます。この実験では各グループのダニの死亡率、重量、および産卵に対するRNAiの効果が統計的に解析した。
ディスカッション
他の方法がダニ14 33にRNAiに記載されているが、dsRNAの注射は、ここで説明する最も広く食物を与えられていない(表1)と供給チック16,25,34の両方で使用されています。 RNAiは、ダニの遺伝子機能の研究、ダニ媒介病原体のインタフェースの特性評価とスクリーニングとダニ防御抗原14,35の特性評価のための有用なツールであることが示されている。特に、RNAiは、チック35の機能解析のための最も有効なツールとなっています。
方法論的に、RNAiは、おそらく多数の個人の遺伝子のノックダウンを可能にすることがより効率的な方法に進化していきます。ダニでdsRNA誘発性RNAiのメカニズムは、この種の35,36でこの遺伝学的ア プローチの理解と活用に貢献する洗練されるべきである。マダニにおけるRNAiのオフターゲット効果の程度は、完全に14,27を対処する必要がある重要な問題です。最後に、RNAiはほとんどの可能性ダニの遺伝子制御とシステム生物学の研究に総合的な貢献を提供し、ダニ - 病原体のインタフェースとダニの蔓延とダニ媒介性病原体の伝播を制御するためのワクチン開発に影響を及ぼす可能性があります。
開示事項
謝辞
我々は、有意義な議論と技術支援のために我々の研究室のメンバーに感謝。このビデオプレゼンテーションは、研究と獣医病理学科のための副学部長、獣医健康科学センター、オクラホマ州立大学によってサポートされていました。研究がMinisterioデCiencia電子Innovación、スペイン(プロジェクトBFU2008-01244/BMC)、JFにCSIC学内プロジェクトPA1002451によって資金を供給された、ウォルターR. SitlingtonはKMK、CVHS 2009 RAC助成金、OAESに食用動物の研究のための椅子を寄附アニマルヘルスファンドと米国農務省、国立研究イニシアチブ競争グラント、第2007〜04613。
資料
| Name | Company | Catalog Number | Comments |
| Access RT-PCR system | Promega | A1250 | |
| Purelink PCR purification kit | Invitrogen | K3100-02 | |
| Megascript RNAi kit | Ambion | AM1626M | |
| Red dental wax | Electron Microscopy Sciences | 72674 | |
| Plastic cups, 1.25 oz and lids | Solo Cup Company, Urbana Ill. | ||
| Fine forceps | Electron Microscopy Sciences | Various | |
| Insulin syringe | Monoject | Fitted with a ½", 29 gauge needle | |
| Hamilton syringe | Hamilton | 701SN,33/.375”/45DGR | Custom made |
| TriReagent | Sigma | 93289 | |
| iScript One-Step RT-PCR Kit with SYBR Green | Bio-Rad | 170-8892 | |
| Real-time PCR detection system | Bio-Rad | Several | Please refer to http://www.bio-rad.com/ |
参考文献
- de la Fuente, J. Overview: Ticks as vectors of pathogens that cause disease in humans and animals. Front. Biosci. 13, 6938-6946 (2008).
- Peter, R. J. mosquito control-Lessons from the past, solutions for the future. Vet. Parasitol. 132, 205-215 (2005).
- Barker, S. C., Murrell, A. Systematics and evolution of ticks with a list of valid genus and species names. Parasitol. 129, S15-S36 (2004).
- Willadsen, P. Tick control: Thoughts on a research agenda. Vet. Parasitol. 138, 161-168 (2006).
- de la Fuente, J., Kocan, K. M. Strategies for development of vaccines for control of ixodid tick species. Parasite Immunol. 28, 275-283 (2006).
- Fire, A. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Cerutti, H. RNA interference: traveling in the cell and gaining functions. Trends Genet. 19, 39-46 (2003).
- Kavi, H. H. RNA silencing in Drosophila. FEBS Lett. 579, 5940-5949 (2005).
- Mello, C. C., Conte, D. J. r. Revealing the world of RNA interference. Nature. 431, 338-342 (2004).
- Zhou, D. RNA interference and potential applications. Curr. Top. Med. Chem. 6, 901-911 (2006).
- Ramakrishnan, V. G. Application of RNA interference in tick salivary gland research. J. Biomol. Tech. 16, 297-305 (2005).
- Aljamali, M. N. RNA interference: applicability in tick research. Exp. Appl. Acarol. 28, 89-96 (2002).
- Aljamali, M. N. RNA interference in ticks: a study using histamine binding protein dsRNA in the female tick Amblyomma americanum. Insect. Mol. Biol. 12, 299-305 (2003).
- de la Fuente, J. RNA interference for the study and genetic manipulation of ticks. Trends Parasitol. 23, 427-433 (2007).
- de la Fuente, J. Functional genomic studies of tick cells in response to infection with the cattle pathogen, Anaplasma marginale. Genomics. 90, 712-722 (2007).
- AlmazäN, C. Identification and characterization of Rhipicephalus (Boophilus) microplus candidate protective antigens for the control of cattle tick infestations. Parasitol. Res. 106, 471-479 (2010).
- de la Fuente, J. Identification of protective antigens by RNA interference for control of the lone star tick, Amblyomma americanum. Vaccine. 28, 1786-1795 (2010).
- Zivkovic, Z. Differential expression of genes in salivary glands of male Rhipicephalus (Boophilus) microplus in response to infection with Anaplasma marginale. BMC Genomics. 11, 186-186 (2010).
- de la Fuente, J. Reduction of tick infections with Anaplasma marginale and A. phagocytophilum by targeting the tick protective antigen subolesin. Parasitol. Res. 100, 85-91 (2006).
- Narasimhan, S. Disruption of Ixodes scapularis anticoagulation by using RNA interference. Proc. Natl. Acad. Sci U.S.A. 101, 1141-1146 (2004).
- de la Fuente, J. RNA interference screening in ticks for identification of protective antigens. Parasitol. Res. 96, 137-141 (2005).
- de la Fuente, J. The tick protective antigen, 4D8, is a conserved protein involved in modulation of tick blood ingestion and reproduction. Vaccine. 24, 4082-4095 (2006).
- de la Fuente, J. Synergistic effect of silencing the expression of tick protective antigens 4D8 and Rs86 in Rhipicephalus sanguineus by RNA interference. Parasitol. Res. 99, 108-113 (2006).
- de la Fuente, J. Autocidal control of ticks by silencing of a single gene by RNA interference. Biochem. Biophys. Res. Commun. 344, 332-338 (2006).
- Nijhof, A. M. Bm86, Bm91 and subolesin, in the silencing of the tick protective antigens. Int. J. Parasitol. 37, 653-662 (2007).
- Kocan, K. M. Silencing of the defensin, varisin, in male Dermacentor variabilis by RNA interference results in reduced Anaplasma marginale infections. Exp. Appl. Acarol. 46, 17-28 (2008).
- de la Fuente, J. Evidence of the role of tick subolesin in gene expression. BMC Genomics. 9, 372-372 (2008).
- Smith, A. The impact of RNA interference of the subolesin and voraxin genes in male Amblyomma hebraeum (Acari: Ixodidae) on female engorgement and oviposition. Exp. Appl. Acarol. 47, 71-86 (2009).
- Galindo, R. C. Tick subolesin is an ortholog of the akirins described in insects and vertebrates. Dev. Comp. Immunol. 33, 612-617 (2009).
- Canales, M. Conservation and immunogenicity of the mosquito ortholog of the tick protective antigen, subolesin. Parasitol. Res. 105, 97-111 (2009).
- Kocan, K. M. Silencing of genes involved in Anaplasma marginale-tick interactions affects the pathogen developmental cycle in Dermacentor variabilis. BMC Dev. Biol. 9, 42-42 (2009).
- Zivkovic, Z. Subolesin expression in response to pathogen infection in ticks. BMC Immunol. 11, 7-7 (2010).
- Karim, S. Functional genomics tool: gene silencing in Ixodes scapularis eggs and nymphs by electroporated dsRNA. BMC Biotechnol. 10, 1-1 (2010).
- Kocan, K. M. Transovarial silencing of the subolesin gene in three-host ixodid tick species after injection of replete females with subolesin dsRNA. Parasitol. Res. 100, 1411-1415 (2007).
- de la Fuente, J. Targeting the tick-pathogen interface for novel control strategies. Front. Biosci. 13, 6947-6956 (2008).
- Kurscheid, S. Evidence of a tick RNAi pathway by comparative genomics and reverse genetics screen of targets with known loss-of-function phenotypes in Drosophila. BMC Mol. Biol. 10, 26-26 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved