Method Article
ARN interférence dans les tiques
Dans cet article
Résumé
Une méthode pour l'interférence ARN (ARNi) par injection d'ARNdb dans les tiques à jeun est décrite. L'ARNi est le plus largement utilisé gène-taire technique dans les tiques où l'utilisation d'autres méthodes de manipulation génétique a été limitée.
Résumé
Les tiques sont des ectoparasites hématophages n'oblige d'animaux sauvages et domestiques et des humains, et sont considérés comme deux mondial pour les moustiques vecteurs de maladies humaines 1 et les vecteurs les plus importants qui affectent l'industrie du bétail dans le monde 2. Les tiques sont classés dans la sous-classe, Acari Parasitiformes ordre, sous-ordre Ixodida et sont distribués dans le monde de l'Arctique aux régions tropicales 3. Malgré les efforts pour contrôler les infestations de tiques, ces ectoparasites demeurent un problème grave pour la santé humaine et animale 4,5.
L'interférence ARN (ARNi) 6 est une approche inverse base d'acides nucléiques génétique qui implique la perturbation de l'expression des gènes afin de déterminer la fonction du gène ou de son effet sur une voie métabolique. Petits ARN interférents (siRNA) sont les molécules effectrices de la voie de l'ARNi qui est initiée par l'ARN double brin (ARNdb) et aboutit à une séquence-spécifique de dégradation des ARNm cytoplasmiques puissants contenant la même séquence que la gâchette ARNdb 7-9. Mécanismes post-transcriptionnels silençage génique initiée par ARNdb ont été découverts dans tous les eucaryotes étudiés jusqu'à présent, et l'ARNi a été rapidement développée dans une variété d'organismes comme un outil de génomique fonctionnelle et d'autres applications 10.
L'ARNi est devenu le plus largement utilisé gène-taire technique dans les tiques et les autres organismes où les approches alternatives pour la manipulation génétique ne sont pas disponibles ou ne sont pas fiables 5,11. La caractérisation génétique des tiques a été limité jusqu'à ce que l'application récente de l'ARNi 12,13. Dans le court laps de temps que l'ARNi a été disponible, il s'est avéré être un outil précieux pour étudier la fonction des gènes de tiques, la caractérisation de l'interface de tic-pathogène et le criblage et la caractérisation des antigènes protecteurs tic 14. Ici, une méthode pour l'ARNi par injection d'ARNdb dans les tiques à jeun est décrite. Il est probable que les connaissances acquises de cette approche expérimentale contribuera sensiblement à la compréhension de base des systèmes biologiques et le développement de vaccins pour contrôler les infestations de tiques et de prévenir la transmission du tic-pathogènes 15-19.
Protocole
1. Génération d'ARNdb.
- Synthétiser des amorces oligonucléotidiques contenant des séquences promoteur T7 pour la transcription in vitro et la synthèse d'ARN bicaténaire (par exemple, pour Dermacentor variabilis subolesin utiliser des amorces oligonucléotidiques D8AAT75:
5'-TAATACGACTCACTATAGGGTACTGACTGGGATCCCCTGCACAGT-3 'et D8DVT73: 5'-TAATACGACTCACTATAGGGTACTCGAGCTTGGTGGAAAGGACG-3'). - Amplifier gène cible par RT-PCR en utilisant 10 pmol de chaque amorce oligonucléotidique et ng 1-10 de l'ARN total de tiques.
- Purifier le produit de PCR.
- Synthétiser ARNdb en utilisant 8 ul du produit de PCR purifié.
- Quantifier ARNdb par spectrométrie.
2. L'injection de tiques avec les ARNdb.
2.1. Préparation de tiques pour l'injection.
- Tout d'abord, lavez les tiques dans une série de solutions en les secouant dans chaque solution dans un tube à centrifuger jetables de 50 ml, la décantation de la solution à travers un grillage à mailles fines sur le dessus du tube de conserver les tiques. La séquence des solutions pour les tiques de lavage est l'eau du robinet, le peroxyde d'hydrogène à 3%, deux lavages d'eau distillée, éthanol à 70% et plus de deux lavages avec de l'eau distillée.
- Blot-sécher les tiques sur des serviettes en papier.
- Comptez le nombre de tiques en groupes de 20 à 50, selon l'expérience, placer les tiques de chaque groupe dans une tasse de 1.25 oz en plastique avec un couvercle bien ajusté et l'étiquette avec le numéro du groupe expérimental.
2.2. Cochez l'équipe d'injection.
L'équipe de l'ARNi est composé de trois personnes: (1) une personne qui positionne chaque graduation sur ruban adhésif à double apposée sur une feuille de cire dentaire rouge, (2) une personne qui injecte les tiques et (3) une personne qui surveille les tiques après injection, respire de CO 2 sur les tiques pour les activer et compte les tiques qui vivent dans des tasses étiquetés avec le numéro du groupe expérimental. Tous les membres de l'équipe doivent porter des gants jetables.
2.3. Placement de tiques pour l'injection.
- Capturez une tique avec une pince fine et Dumont place, il la face ventrale sur un ruban adhésif à double apposée sur un 3 "x 6" feuille de cire dentaire rouge. Les tiques sont étroitement positionnés en groupes de 5 ticks.
- Placer une petite bande de ruban-cache sur les pièces buccales de l'ensemble des 5 tiques afin de continuer à les retenir, mais tout en laissant la plupart des corps exposés, afin que le processus d'injection peut être observée par la tique (figure 1) injecteur.
2.4. Injection de tiques.
- Les tiques seront injectés dans le quadrant inférieur droit de la surface ventrale de l'exosquelette.
- Tout d'abord, percer un trou dans l'exosquelette aide d'une seringue d'insuline Monoject équipé d'un ½ ", une aiguille de calibre 29 (figure 2a).
- Injecter les tiques immédiatement avec 0,2 à 0,5 uL de solution ARNdb (5 x 10 10 - 5 x 10 11 molécules par uL) en utilisant une seringue Hamilton sur-mesure avec un pouce 1, une aiguille de calibre 33 avec un point de 45 ° en biseau (figure 2b) . L'aiguille doit être placée dans la cavité ainsi à cocher pour assurer le placement et le maintien de l'ARNdb. Certains fluides sont susceptibles d'échapper à l'injection (figure 2c). Il faut prendre soin de ne pas injecter le plus les tiques, ce qui entraînerait la perte d'hémolymphe et pourrait causer la mort de la tique.
- Nettoyer la seringue Hamilton après avoir terminé les injections dans chaque groupe expérimental. avant d'utiliser pour un autre groupe expérimental. Remplir la seringue d'abord d'un bécher contenant du peroxyde d'hydrogène à 3%, puis d'expulser dans un conteneur à déchets, et répétez 15 fois. Remplir la seringue d'un bécher contenant de l'eau stérile, puis d'expulser dans un conteneur à déchets, et répétez 15 fois. Prenez soin de ne pas plier le piston de la seringue Hamilton parce que, si courbé, le piston se déplace pas sans heurts et répondre à la douceur des gestes requis pour l'injection de tiques.
2.5. Traitement des tiques après l'injection.
- Ramassez la tique injecté immédiatement de l'adhésif double collant avec les pinces fines et placez-le dans un récipient de récupération de plastique (environ 6 "x 6" et entouré de ruban adhésif pour éviter l'échappement des tiques). Les tiques seront brièvement inactifs après l'injection, mais devrait bientôt commencer à ramper autour du plat.
- Souffle de CO 2 sur les tiques immédiatement après les placer dans le conteneur de récupération pour aider à activer les tiques. Une fois que les tiques sont rampants et active, la blessure va guérir d'injection rapidement et ils seront plus susceptibles de survivre.
- Comptez le nombre de tiques en fonction du nombre dans chaque groupe expérimental et les placer dans une tasse en plastique étiquetés avec un couvercle bien ajusté. Tiques de remplacement doit être injecté pour remplacer ceux qui sont morts avant toute injection du prochain groupe expérimental.
2.6. Cochez la tenue.
- Placez les tiques dans une chambre humide (12 h de lumière: photopériode 12 h obscurité à 22-25 ° C et 95% par rapport humidity) et maintenez pendant 1 jour.
- Tiques lieu en tic-alimentation des cellules, une par groupe expérimental, collé à un mouton et de leur permettre de nourrir avec un nombre égal de non-injecté tiques mâle ou femelle (selon le sexe n'a pas été injecté). Tiques femelles qui se nourrissent à la réplétion, ceux qui sont retirés de la brebis après 10 jours d'alimentation ou lorsque les femelles de contrôle ont déposé l'hôte sont collectés et pesés.
- Placez les tiques dans des cartons, et de tenir dans la chambre de l'humidité jusqu'à la fin de la ponte. Évaluer la ponte en pondérant la masse d'œufs produits par toutes les tiques dans le groupe.
2.7. Analyse du phénotype coche, après l'ARNi.
- Évaluer tic phénotype après la tétée, en déterminant le nombre de tiques qui ont survécu, le poids de tiques, la ponte d'œufs et de la fertilité. Toutefois, d'autres analyses peuvent être effectuées en fonction du gène ciblé et les objectifs de l'étude.
3. Analyse pour confirmer Gene Silencing par RT-PCR.
- Disséquer les glandes salivaires et les tripes des tiques individuelles des groupes de contrôle injecté et ARNdb injecté après la tétée.
- Extrait d'ARN total à partir d'échantillons tissulaires individuels.
- Analyser transcrits du gène cible dans les tissus individuels en temps réel RT-PCR et normaliser les niveaux d'ARN 16S contre les tiques ARNr en utilisant la méthode genNorm (méthode DDCT mis en œuvre par Bio-Rad édition iQ5 Standard, Version 2.0).
- Exécuter les courbes de dissociation à la fin de la réaction pour s'assurer que seul un amplicon est formé et que le dénaturent amplicons constamment dans la même plage de température pour chaque échantillon.
- Comparez les taux d'ARNm (normalisé les valeurs de Ct) entre le contrôle-injectés et ARNdb injecté tiques en utilisant les étudiants s `test-t (P = 0,05).
4. Les résultats représentatifs:
Le protocole décrit ici a été utilisée dans notre laboratoire pour l'ARNi dans de nombreuses espèces différentes de tique (tableau 1). Le montant de l'ARNdb injecté dans les tiques varie avec la taille de la tique; grandes espèces de tiques peuvent accueillir un plus grand volume. Tiques de contrôle négatif doit être injecté par un ARNdb indépendants. Plusieurs dsRNA tels que subolesin 14-19,22-25,27-32,34 et bêta-actine 20,21 pourraient être utilisés comme contrôles positifs. Notez qu'il est important de se laver la seringue entre les traitements pour éviter de mélanger des solutions ARNdb. Si le protocole est fait correctement, à moins de 5% de mortalité devrait être obtenu à partir de la procédure d'injection après 24 heures. Un phénotype typique après inactivation génique chez des tiques est montré dans la figure 3 avec un panel de tiques injectées avec des piscines d'ARNdb dans le but de dépister les tiques antigènes protecteurs.
| Cochez les espèces | ARNdb injecté | Références |
| Ixodes scapularis | banque d'ADNc, subolesin, l'actine, nucléotidase, la NF-kB, akirin | 21, 22, 29, 30 |
| Dermacentor variabilis | subolesin, la TPS, l'ubiquitine, vATPase, sélénoprotéines M et W2A, hématopoïétiques cellules souches / progénitrices de type protéine, l'actine sous-unité 26S du protéasome, ferritin1, varisin, akirin | 15, 19, 22, 24, 26, 30-32 |
| Dermacentor marginatus | subolesin | 22 |
| Amblyomma americanum | banque d'ADNc, subolesin, akirin | 17, 22, 30 |
| Amblyomma hebraeum | subolesin, voraxin | 28 |
| Rhipicephalus sanguineus | Rs86, subolesin | 22, 23 |
| Rhipicephalus microplus | TPS, l'ubiquitine, sélénoprotéine, Bm86, Bm91, subolesin, GI, GIII, EF1a, protéines de soie flagelliformes, de von Willebrand Facteur | 16, 18, 25, 27 |
| Annulatus Rhipicephalus | ubiquitine, subolesin, EF1a, GIII | 16 |
Tableau 1. Cochez espèce dans laquelle le protocole de l'ARNi a été utilisé.
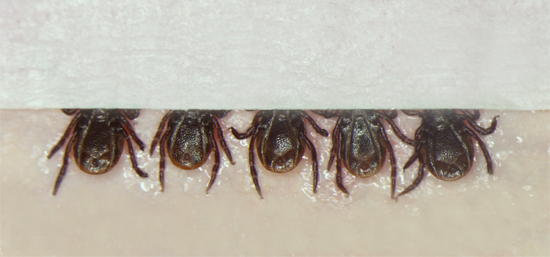
Figure 1. Placement des tiques, face ventrale en place, sur le ruban adhésif à double adhéré à une feuille de cire dentaire rouge. Les tiques sont placés dans des groupes de 5, après quoi une petite bande de ruban adhésif est placé sur les pièces buccales, afin de sécuriser davantage les tiques, tout en permettant l'injecteur d'observer le corps de la tique pendant l'injection.

Figure 2. La procédure d'injection comprend (a) perçant le quadrant inférieur droit de l'exosquelette tique avec une sy l'insulineRinge munie d'une aiguille 29 gauge, afin de créer un site d'injection, (b) injection immédiate de l'ARNdb à ce site en utilisant une seringue Hamilton avec une aiguille de calibre 33 qui (c) sera très probablement donner lieu à des fuites d'hémolymphe cocher / fluides.

Figure 3. Un panel de six groupes de cocher dans lequel l'ARNi a été utilisé pour dépister les antigènes protecteurs de cocher Amblyomma americanum. Les changements phénotypiques dans les tiques peuvent être vus par rapport à l'ARNi contrôle positif subolesin et le contrôle ARNdb négatifs indépendants. Dans cette expérience, l'effet de l'ARNi sur la mortalité tique, poids, et la ponte de chaque groupe a été analysées statistiquement.
Discussion
Bien d'autres méthodes ont été décrites pour l'ARNi dans les tiques 14, 33, l'injection d'ARNdb décrite ici est la plus largement utilisée dans les deux jeun (tableau 1) et nourris tiques 16,25,34. ARNi a été montré pour être un outil précieux pour l'étude de la fonction des gènes de tiques, la caractérisation de l'interface de tic-pathogène et le dépistage et la caractérisation des antigènes protecteurs tic 14,35. En particulier, l'ARNi est devenu l'outil le plus précieux pour l'analyse fonctionnelle dans les tiques 35.
Méthodologiquement, l'ARNi évoluera probablement dans les méthodes plus efficaces qui peuvent permettre inactivation génique dans un grand nombre d'individus. Le mécanisme de l'ARN double brin induite par ARNi dans les tiques doivent être affinés pour contribuer à une meilleure compréhension et l'utilisation de cette approche génétique chez cette espèce 35,36. L'ampleur des effets hors-cible de l'ARNi dans des tiques est également une question importante qui doit être pleinement pris en compte 14,27. Enfin, l'ARNi sera très probablement apporter une contribution globale de l'étude de la régulation des gènes tiques et la biologie des systèmes et le tic-pathogène interface et peut avoir un impact sur le développement de vaccins pour contrôler les tiques et la transmission des agents pathogènes transmis par les tiques.
Déclarations de divulgation
Remerciements
Nous remercions les membres de nos laboratoires pour des discussions fructueuses et une assistance technique. Cette présentation vidéo a été soutenue par le doyen associé de la recherche et le Département de biopathologie vétérinaires, Centre de sciences vétérinaires de la santé, de l'Oklahoma State University. La recherche a été financée par le Ministerio de Ciencia e Innovación, l'Espagne (projet BFU2008-01244/BMC), la SCCI projet intra-muros PA1002451 à JF, le Walter R. Sitlington de la chaire de recherche d'aliments pour animaux de KMK, 2009 CVHS CAR subvention, EOA Fonds de la santé animale et de l'USDA, National Research Grant initiative concurrentielle, n ° 2007-04613.
matériels
| Name | Company | Catalog Number | Comments |
| Access RT-PCR system | Promega | A1250 | |
| Purelink PCR purification kit | Invitrogen | K3100-02 | |
| Megascript RNAi kit | Ambion | AM1626M | |
| Red dental wax | Electron Microscopy Sciences | 72674 | |
| Plastic cups, 1.25 oz and lids | Solo Cup Company, Urbana Ill. | ||
| Fine forceps | Electron Microscopy Sciences | Various | |
| Insulin syringe | Monoject | Fitted with a ½", 29 gauge needle | |
| Hamilton syringe | Hamilton | 701SN,33/.375”/45DGR | Custom made |
| TriReagent | Sigma | 93289 | |
| iScript One-Step RT-PCR Kit with SYBR Green | Bio-Rad | 170-8892 | |
| Real-time PCR detection system | Bio-Rad | Several | Please refer to http://www.bio-rad.com/ |
Références
- de la Fuente, J. Overview: Ticks as vectors of pathogens that cause disease in humans and animals. Front. Biosci. 13, 6938-6946 (2008).
- Peter, R. J. mosquito control-Lessons from the past, solutions for the future. Vet. Parasitol. 132, 205-215 (2005).
- Barker, S. C., Murrell, A. Systematics and evolution of ticks with a list of valid genus and species names. Parasitol. 129, S15-S36 (2004).
- Willadsen, P. Tick control: Thoughts on a research agenda. Vet. Parasitol. 138, 161-168 (2006).
- de la Fuente, J., Kocan, K. M. Strategies for development of vaccines for control of ixodid tick species. Parasite Immunol. 28, 275-283 (2006).
- Fire, A. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Cerutti, H. RNA interference: traveling in the cell and gaining functions. Trends Genet. 19, 39-46 (2003).
- Kavi, H. H. RNA silencing in Drosophila. FEBS Lett. 579, 5940-5949 (2005).
- Mello, C. C., Conte, D. J. r Revealing the world of RNA interference. Nature. 431, 338-342 (2004).
- Zhou, D. RNA interference and potential applications. Curr. Top. Med. Chem. 6, 901-911 (2006).
- Ramakrishnan, V. G. Application of RNA interference in tick salivary gland research. J. Biomol. Tech. 16, 297-305 (2005).
- Aljamali, M. N. RNA interference: applicability in tick research. Exp. Appl. Acarol. 28, 89-96 (2002).
- Aljamali, M. N. RNA interference in ticks: a study using histamine binding protein dsRNA in the female tick Amblyomma americanum. Insect. Mol. Biol. 12, 299-305 (2003).
- de la Fuente, J. RNA interference for the study and genetic manipulation of ticks. Trends Parasitol. 23, 427-433 (2007).
- de la Fuente, J. Functional genomic studies of tick cells in response to infection with the cattle pathogen, Anaplasma marginale. Genomics. 90, 712-722 (2007).
- AlmazäN, C. Identification and characterization of Rhipicephalus (Boophilus) microplus candidate protective antigens for the control of cattle tick infestations. Parasitol. Res. 106, 471-479 (2010).
- de la Fuente, J. Identification of protective antigens by RNA interference for control of the lone star tick, Amblyomma americanum. Vaccine. 28, 1786-1795 (2010).
- Zivkovic, Z. Differential expression of genes in salivary glands of male Rhipicephalus (Boophilus) microplus in response to infection with Anaplasma marginale. BMC Genomics. 11, 186-186 (2010).
- de la Fuente, J. Reduction of tick infections with Anaplasma marginale and A. phagocytophilum by targeting the tick protective antigen subolesin. Parasitol. Res. 100, 85-91 (2006).
- Narasimhan, S. Disruption of Ixodes scapularis anticoagulation by using RNA interference. Proc. Natl. Acad. Sci U.S.A. 101, 1141-1146 (2004).
- de la Fuente, J. RNA interference screening in ticks for identification of protective antigens. Parasitol. Res. 96, 137-141 (2005).
- de la Fuente, J. The tick protective antigen, 4D8, is a conserved protein involved in modulation of tick blood ingestion and reproduction. Vaccine. 24, 4082-4095 (2006).
- de la Fuente, J. Synergistic effect of silencing the expression of tick protective antigens 4D8 and Rs86 in Rhipicephalus sanguineus by RNA interference. Parasitol. Res. 99, 108-113 (2006).
- de la Fuente, J. Autocidal control of ticks by silencing of a single gene by RNA interference. Biochem. Biophys. Res. Commun. 344, 332-338 (2006).
- Nijhof, A. M. Bm86, Bm91 and subolesin, in the silencing of the tick protective antigens. Int. J. Parasitol. 37, 653-662 (2007).
- Kocan, K. M. Silencing of the defensin, varisin, in male Dermacentor variabilis by RNA interference results in reduced Anaplasma marginale infections. Exp. Appl. Acarol. 46, 17-28 (2008).
- de la Fuente, J. Evidence of the role of tick subolesin in gene expression. BMC Genomics. 9, 372-372 (2008).
- Smith, A. The impact of RNA interference of the subolesin and voraxin genes in male Amblyomma hebraeum (Acari: Ixodidae) on female engorgement and oviposition. Exp. Appl. Acarol. 47, 71-86 (2009).
- Galindo, R. C. Tick subolesin is an ortholog of the akirins described in insects and vertebrates. Dev. Comp. Immunol. 33, 612-617 (2009).
- Canales, M. Conservation and immunogenicity of the mosquito ortholog of the tick protective antigen, subolesin. Parasitol. Res. 105, 97-111 (2009).
- Kocan, K. M. Silencing of genes involved in Anaplasma marginale-tick interactions affects the pathogen developmental cycle in Dermacentor variabilis. BMC Dev. Biol. 9, 42-42 (2009).
- Zivkovic, Z. Subolesin expression in response to pathogen infection in ticks. BMC Immunol. 11, 7-7 (2010).
- Karim, S. Functional genomics tool: gene silencing in Ixodes scapularis eggs and nymphs by electroporated dsRNA. BMC Biotechnol. 10, 1-1 (2010).
- Kocan, K. M. Transovarial silencing of the subolesin gene in three-host ixodid tick species after injection of replete females with subolesin dsRNA. Parasitol. Res. 100, 1411-1415 (2007).
- de la Fuente, J. Targeting the tick-pathogen interface for novel control strategies. Front. Biosci. 13, 6947-6956 (2008).
- Kurscheid, S. Evidence of a tick RNAi pathway by comparative genomics and reverse genetics screen of targets with known loss-of-function phenotypes in Drosophila. BMC Mol. Biol. 10, 26-26 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon