Method Article
RNA-Interferenz in Ticks
In diesem Artikel
Zusammenfassung
Ein Verfahren zur RNA-Interferenz (RNAi) durch Injektion von dsRNA in ungefüttert Zecken beschrieben. RNAi ist die am weitesten verbreitete Gen-Silencing-Technik in Zecken, wo die Verwendung von anderen Methoden der genetischen Manipulation eingeschränkt wurde.
Zusammenfassung
Zecken sind obligat hematophagous Ektoparasiten von Wild-und Haustieren und Menschen, und gelten als weltweit an zweiter Stelle, um Stechmücken als Überträger von Krankheiten des Menschen 1 und der wichtigsten Vektoren bei Rindern Industrie weltweit 2 sein. Zecken sind in der Unterklasse Acari, um Parasitiformes, Unterordnung Ixodida klassifiziert und werden weltweit vertrieben von der Arktis bis tropischen Regionen 3. Trotz der Bemühungen um Zeckenbefall kontrollieren, bleiben diese Ektoparasiten ein ernstes Problem für Mensch und Tier 4,5.
RNA-Interferenz (RNAi) 6 ist eine Nukleinsäure-basierte reverse genetische Ansatz, dass eine Störung der Genexpression beinhaltet, um Genfunktionen oder ihrer Wirkung auf einen Stoffwechselweg zu bestimmen. Small interfering RNAs (siRNAs) sind die Effektormoleküle der RNAi-Weg, die durch doppelsträngige RNA (dsRNA) und führt zu einer potenten sequenzspezifischen Abbau von cytoplasmatischen mRNAs, die die gleiche Sequenz wie die dsRNA auslösen 7-9 ist eingeleitet. Post-transkriptionelle Gen-Silencing-Mechanismen durch dsRNA initiiert haben in allen Eukaryoten entdeckt bisher untersuchten und RNAi wurde rasch in einer Vielzahl von Organismen als Werkzeug für die funktionale Genomik Studien und andere Anwendungen 10 entwickelt.
RNAi hat sich die am weitesten verbreitete Gen-Silencing-Technik in Zecken und anderen Organismen, in denen alternative Ansätze zur genetischen Manipulation sind nicht verfügbar oder unzuverlässig sind 5,11. Die genetische Charakterisierung von Zecken hat bis in die jüngste Anwendung der RNAi 12,13 begrenzt. In der kurzen Zeit, RNAi wurde zur Verfügung, hat es sich als ein wertvolles Werkzeug zur Untersuchung der Zecke Genfunktion, die Charakterisierung der tick-Erreger-Schnittstelle und das Screening und Charakterisierung von Zecken schützende Antigene 14 sein. Hierin wird ein Verfahren für RNAi durch Injektion von dsRNA in ungefüttert Zecken beschrieben. Es ist wahrscheinlich, dass das Wissen aus diesem experimentellen Ansatz gewonnen wird deutlich dazu beitragen, das Verständnis von grundlegenden biologischen Systemen und die Entwicklung von Impfstoffen zu Zeckenbefall kontrollieren und zu verhindern Übertragung von Zecken übertragene Krankheitserreger 15-19.
Protokoll
1. Generierung von dsRNA.
- Synthesize Oligonukleotidprimer mit T7-Promotor-Sequenzen für in vitro-Transkription und Synthese von dsRNA (z. B. für Dermacentor variabilis subolesin verwenden Oligonukleotidprimer D8AAT75:
5'-TAATACGACTCACTATAGGGTACTGACTGGGATCCCCTGCACAGT-3 'und D8DVT73: 5'-TAATACGACTCACTATAGGGTACTCGAGCTTGGTGGAAAGGACG-3'). - Amplify Zielgens durch RT-PCR mit 10 pmol von jedem Oligonukleotid-Primer und 1-10 ng von Zecken Gesamt-RNA.
- Purify das PCR-Produkt.
- Synthesize dsRNA mit 8 ul des gereinigten PCR-Produkt.
- Quantify dsRNA durch Spektrometrie.
2. Die Injektion von Zecken mit dsRNA.
2.1. Vorbereitung von Zecken zur Injektion.
- Zuerst waschen Sie die Zecken in eine Reihe von Lösungen durch Schütteln in jeder Lösung in einer 50 ml-Einweg-Zentrifugenröhrchen, Dekantieren der Lösung durch ein feinmaschiges Drahtgitter über den Schlauch oben nach Zecken zu behalten. Die Reihenfolge der Lösungen für das Waschen Zecken ist Leitungswasser, 3% Wasserstoffperoxid, zwei Wäschen destilliertes Wasser, 70% Ethanol und zwei weitere Waschungen mit destilliertem Wasser.
- Blot-dry die Zecken auf Küchenpapier.
- Zählen Sie die Zecken in Gruppen von 20 bis 50, je nach Experiment, legen Sie die Zecken aus jeder Gruppe in einem 1,25 Unzen Plastikbecher mit einem festsitzenden Deckel und Etikett mit den experimentellen Gruppen-Nummer.
2.2. Tick Injektion Team.
Die RNAi-Team besteht aus drei Personen: (1) eine Person, die jeder Tick-Positionen auf doppelte Klebeband angebracht, um ein Blatt rot Dentalwachs, (2) eine Person, die die Zecken und (3) einer Person, die die Zecken-Monitore nach injiziert Injektion, atmet CO 2 auf die Zecken, um sie zu aktivieren und zählt die lebende Zecken in die Tassen mit den experimentellen Gruppen-Nummer gekennzeichnet. Alle Teammitglieder müssen Einmalhandschuhe tragen.
2.3. Platzierung von Zecken zur Injektion.
- Nehmen Sie ein Häkchen mit Dumont feinen Pinzette und legen Sie sie Bauchseite auf Doppel-Klebeband befestigt, um ein 3 "x 6" Blatt rot Dentalwachs. Die Zecken sind eng in Gruppen von 5 ticks positioniert.
- Setzen Sie einen kleinen Streifen Klebeband über die Mundwerkzeuge der alle 5 Ticks, um weitere zurückhalten, aber während verlassen die meisten der Körper so, dass die Injektion Prozess durch die Zecke Injektor (Abbildung 1) beobachtet werden ausgesetzt.
2.4. Die Injektion von Zecken.
- Die Zecken werden in der rechten unteren Quadranten der ventralen Oberfläche des Exoskelett injiziert werden.
- Erstens stechen ein Loch in das Exoskelett mit einem Monoject Insulinspritze mit einem ½ ", 29-Gauge-Nadel (Abbildung 2a) ausgestattet.
- Inject Zecken sofort mit 0,2-0,5 ul der dsRNA-Lösung (5 x 10 bis 5 Oktober x 10 11 Moleküle pro Mikroliter) mit einem maßgeschneiderten Hamilton-Spritze mit einer 1 Zoll, 33-Gauge-Nadel mit einer 45 ° abgeschrägt Punkt (Abb. 2b) . Die Nadel sollte gut in der Zecke Hohlraum platziert werden, um die Platzierung und die Beibehaltung der dsRNA zu gewährleisten. Einige Flüssigkeit wird wahrscheinlich von der Injektionsstelle (Abbildung 2c) zu entkommen. Es sollte darauf geachtet werden, dass über injizieren die Zecken, die den Verlust der Hämolymphe verursachen würde und konnte den Tod der Zecke verursacht werden.
- Reinigen Sie die Hamilton-Spritze nach Abschluss der Injektionen in jeder experimentellen Gruppe. vor der Verwendung für einen anderen experimentellen Gruppe. Füllen Sie die Spritze zunächst aus einem Becherglas mit 3% Wasserstoffperoxid und dann vertreiben in einen Abfallbehälter, und wiederholen Sie 15-mal. Füllen Sie die Spritze aus einem Becherglas mit sterilem Wasser und dann vertreiben in einen Abfallbehälter, und wiederholen Sie 15-mal. Achten Sie darauf, den Kolben der Spritze Hamilton beugen, denn wenn gebogen, der Kolben wird nicht reibungslos bewegen und reagieren auf die sanfte Berührung für die Injektion von Zecken erforderlich.
2.5. Die Behandlung von Zecken nach der Injektion.
- Nehmen Sie den injizierten Tick sofort aus dem Doppel-Klebeband mit der feinen Pinzette und legen Sie sie in einem Kunststoff-Verwertung-Container (ca. 6 "x 6" und beringt mit Klebeband zu entkommen der Zecken zu verhindern). Die Zecken werden kurz nach der Injektion nicht aktiv, sollte aber bald beginnen, um die Schale zu kriechen.
- Atem CO 2 auf die Zecken sofort nach dem Einlegen in das Recovery-Container zu helfen, aktivieren Sie die Zecken. Sobald die Zecken krabbeln und aktiv sind, wird die Injektion Wunde schnell heilen, und sie werden wahrscheinlich überleben.
- Zählen Sie die Zecken nach der Zahl in jeder experimentellen Gruppe und legen Sie sie in ein markiertes Plastikbecher mit einem festsitzenden Deckel. Ersatz Zecken sollten injiziert, um jedem, dass jeder vor der Injektion der nächsten experimentellen Gruppe starb ersetzen.
2.6. Tick halten.
- Legen Sie die Zecken in eine feuchte Kammer (12-Stunden Licht: 12 Stunden Dunkelheit Photoperiode bei 22-25 ° C und 95% relative heuchte) und halten Sie für 1 Tag.
- Legen Zecken in tick-Fütterung Zellen, eine pro Versuchsgruppe, um ein Schaf geklebt und es ihnen ermöglichen, mit einer gleichen Anzahl von injizierten männlichen oder weiblichen Zecken (je nachdem, Sex war nicht gespritzt) zu ernähren. Weibliche Zecken, die Sättigung füttern, haben diejenigen, die von den Schafen nach 10 Tagen der Fütterung oder wenn die Kontroll-Weibchen entfernt werden aus dem Host werden gesammelt und gewogen gesunken.
- Legen Sie die Zecken in Kartons, und halten Sie in der feuchten Kammer bis zum Abschluss der Eiablage. Bewerten Eiablage durch die Gewichtung der Eimasse von allen Zecken in der Gruppe hergestellt.
2.7. Die Analyse der tick-Phänotyp nach RNAi.
- Bewerten Tick Phänotyp nach der Fütterung durch die Bestimmung der Anzahl der Ticks, überlebte Tick Gewicht, Eiablage und die Fertilität der Eier. Jedoch können auch andere Analysen durchgeführt je nach Zielgen und Ziele der Studie.
3. Analyse zur Gen-Stummschaltung durch RT-PCR bestätigen.
- Dissect Speicheldrüsen und Mut einzelner Zecken von Kontroll-injiziert und dsRNA-injizierten Gruppen nach der Fütterung.
- Auszug Gesamt-RNA aus einzelnen Gewebeproben.
- Analysieren Zielgen Transkripte in einzelnen Geweben durch real-time RT-PCR und normalisieren RNA-Spiegel gegen Zecken 16S rRNA mit der genNorm Methode (ddCT Methode, wie von Bio-Rad iQ5 Standard Edition, Version 2.0 implementiert).
- Run Dissoziationskurven am Ende der Reaktion, um sicherzustellen, dass nur ein Amplikon gebildet wird und dass die Amplifikate denaturiert konsequent in der gleichen Temperaturbereich für jede Probe.
- Vergleichen mRNA-Spiegel (normalisiert Ct-Werte) zwischen Kontroll-injiziert und dsRNA-Injektion Zecken mit dem Student `s t-Test (P = 0,05).
4. Repräsentative Ergebnisse:
Das Protokoll beschriebenen in unserem Labor wurde für RNAi verwendet in vielen verschiedenen Schildzecken Zeckenarten (Tabelle 1). Die Höhe der dsRNA in die Zecken injiziert variiert mit der Größe der Zecke, größere Zeckenart kann ein größeres Volumen unterzubringen. Negative Kontrolle Zecken sollten mit einem unabhängigen, dsRNA injiziert werden. Mehrere dsRNAs wie subolesin 14-19,22-25,27-32,34 und beta-Aktin 20,21 könnte als positive Kontrollen verwendet werden. Beachten Sie, dass es wichtig ist, die Spritze zwischen den Behandlungen zu mischen dsRNA Lösungen zu vermeiden waschen. Wenn das Protokoll korrekt erfolgt ist, sollte weniger als 5% Mortalität von der Injektion nach 24 Stunden erreicht werden. Eine typische Phänotyp nach Gen Knockdown in Zecken ist in Abbildung 3 mit einem Panel von Zecken mit Pools von dsRNA in Ordnung injiziert, um Bildschirm für Zecken schützende Antigene gezeigt.
| Zeckenarten | dsRNA injiziert | Referenzen |
| Ixodes scapularis | cDNA-Bibliothek, subolesin, Aktin, Nukleotidase, NF-kB, Akirin | 21, 22, 29, 30 |
| Dermacentor variabilis | subolesin, GST, Ubiquitin, vATPase, Selenoproteinen M und W2a, hämatopoetischen Stammzellen / Vorläuferzellen Protein-like, Aktin Proteasome 26S-Untereinheit, ferritin1, varisin, Akirin | 15, 19, 22, 24, 26, 30-32 |
| Dermacentor marginatus | subolesin | 22 |
| Amblyomma americanum | cDNA-Bibliothek, subolesin, Akirin | 17, 22, 30 |
| Amblyomma hebraeum | subolesin, voraxin | 28 |
| Rhipicephalus sanguineus | Rs86, subolesin | 22, 23 |
| Rhipicephalus microplus | GST, Ubiquitin, Selenoprotein, Bm86, Bm91, subolesin, GI, GIII, EF1A, flagelliform Seidenprotein, von-Willebrand- Faktor | 16, 18, 25, 27 |
| Rhipicephalus annulatus | Ubiquitin, subolesin, EF1A, GIII | 16 |
Tabelle 1. Tick Arten, in denen die RNAi-Protokoll verwendet wurde.
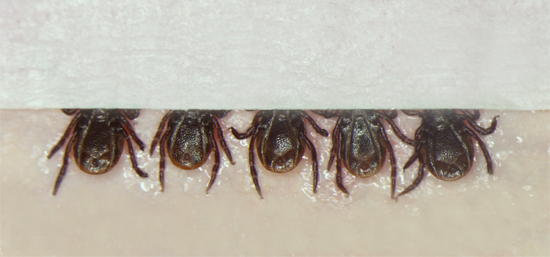
Abbildung 1. Platzierung von Zecken, Bauchseite nach oben, auf Doppel-Klebeband verklebt auf ein Blatt rot Dentalwachs. Die Zecken sind in Gruppen von 5 gelegt, nach denen ein kleiner Streifen Klebeband über die Mundwerkzeuge platziert wird, um weiteren Sicherung der Zecken und gleichzeitig den Injektor, um den Körper der Zecke während der Injektion zu beobachten.

Abbildung 2. Das Injektionsverfahren umfasst (a) Durchstechen der unteren rechten Quadranten der Zecke Exoskelett mit einer Insulin-syringe mit einer 29 Gauge Nadel ausgestattet um eine Injektionsstelle erstellen, (b) die sofortige Injektion von dsRNA an dieser Stelle mit einer Hamilton-Spritze mit einer 33-Gauge-Kanüle, die (c) am wahrscheinlichsten in eine Leckage von Zecken Hämolymphe / Ergebnis Flüssigkeiten.

Abbildung 3. Ein Gremium von Zecken sechs Gruppen, in denen RNAi auf dem Bildschirm für Zecken schützende Antigene in Amblyomma americanum verwendet wurde. Die phänotypische Veränderungen in Zecken zu sehen, wenn sie mit der positiven subolesin RNAi-Steuerung und die negativen unabhängig dsRNA Kontrolle verglichen werden. In diesem Experiment die Wirkung von RNAi auf Pump Sterblichkeit, Gewichte und Eiablage der einzelnen Gruppen war statistisch analysiert.
Diskussion
Obwohl auch andere Methoden zur RNAi haben in Zecken 14, 33 beschrieben wurde, beschrieb die Injektion von dsRNA ist dabei die am häufigsten in beiden ungefüttert (Tabelle 1) und gefüttert Zecken 16,25,34 verwendet. RNAi hat sich gezeigt, dass ein wertvolles Werkzeug für die Untersuchung von Zecken Genfunktion, die Charakterisierung der tick-Erreger-Schnittstelle und das Screening und Charakterisierung von Zecken schützende Antigene 14,35 sein. Insbesondere hat RNAi wird das wertvollste Werkzeug für funktionelle Analysen in Zecken 35.
Methodisch wird RNAi wahrscheinlich in effizientere Methoden, die Gen-Knockdown in einer großen Anzahl von Personen können damit zu entwickeln. Der Mechanismus der dsRNA-induzierte RNAi in Zecken sollten verfeinert werden, um zu einem besseren Verständnis und der Nutzung dieser genetischen Ansatz in dieser Art 35,36 beizutragen. Das Ausmaß der Off-Target-Effekte von RNAi in Zecken ist auch eine wichtige Frage, die umfassend angegangen werden 14,27 Bedürfnisse. Schließlich wird RNAi höchstwahrscheinlich bieten umfassende Beiträge zur Erforschung von Zecken Genregulation und Systembiologie und der tick-Erreger-Schnittstelle und kann einen Einfluss auf die Entwicklung von Impfstoffen zu Zeckenbefall und die Übertragung von Zecken übertragene Erreger zu kontrollieren.
Offenlegungen
Danksagungen
Wir danken Mitglieder unseres Labors für fruchtbare Diskussionen und technische Unterstützung. Dieses Video-Präsentation wurde von der Prodekan für Forschung und das Department of Veterinary Pathobiologie, Center for Veterinary Health Sciences, Oklahoma State University unterstützt. Die Forschungen des Ministerio de Ciencia e Innovación, Spanien (Projekt BFU2008-01244/BMC), die CSIC intramural Projekt PA1002451 zu JF finanziert wurde, Stiftungslehrstuhl der Walter R. Sitlington Chair for Food Animal Research zu KMK, CVHS 2009 RAC gewähren, OAE Animal Health Funds und USDA, National Research Initiative Competitive Grant, Nr. 2007-04613.
Materialien
| Name | Company | Catalog Number | Comments |
| Access RT-PCR system | Promega | A1250 | |
| Purelink PCR purification kit | Invitrogen | K3100-02 | |
| Megascript RNAi kit | Ambion | AM1626M | |
| Red dental wax | Electron Microscopy Sciences | 72674 | |
| Plastic cups, 1.25 oz and lids | Solo Cup Company, Urbana Ill. | ||
| Fine forceps | Electron Microscopy Sciences | Various | |
| Insulin syringe | Monoject | Fitted with a ½", 29 gauge needle | |
| Hamilton syringe | Hamilton | 701SN,33/.375”/45DGR | Custom made |
| TriReagent | Sigma | 93289 | |
| iScript One-Step RT-PCR Kit with SYBR Green | Bio-Rad | 170-8892 | |
| Real-time PCR detection system | Bio-Rad | Several | Please refer to http://www.bio-rad.com/ |
Referenzen
- de la Fuente, J. Overview: Ticks as vectors of pathogens that cause disease in humans and animals. Front. Biosci. 13, 6938-6946 (2008).
- Peter, R. J. mosquito control-Lessons from the past, solutions for the future. Vet. Parasitol. 132, 205-215 (2005).
- Barker, S. C., Murrell, A. Systematics and evolution of ticks with a list of valid genus and species names. Parasitol. 129, S15-S36 (2004).
- Willadsen, P. Tick control: Thoughts on a research agenda. Vet. Parasitol. 138, 161-168 (2006).
- de la Fuente, J., Kocan, K. M. Strategies for development of vaccines for control of ixodid tick species. Parasite Immunol. 28, 275-283 (2006).
- Fire, A. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Cerutti, H. RNA interference: traveling in the cell and gaining functions. Trends Genet. 19, 39-46 (2003).
- Kavi, H. H. RNA silencing in Drosophila. FEBS Lett. 579, 5940-5949 (2005).
- Mello, C. C., Conte, D. J. r. Revealing the world of RNA interference. Nature. 431, 338-342 (2004).
- Zhou, D. RNA interference and potential applications. Curr. Top. Med. Chem. 6, 901-911 (2006).
- Ramakrishnan, V. G. Application of RNA interference in tick salivary gland research. J. Biomol. Tech. 16, 297-305 (2005).
- Aljamali, M. N. RNA interference: applicability in tick research. Exp. Appl. Acarol. 28, 89-96 (2002).
- Aljamali, M. N. RNA interference in ticks: a study using histamine binding protein dsRNA in the female tick Amblyomma americanum. Insect. Mol. Biol. 12, 299-305 (2003).
- de la Fuente, J. RNA interference for the study and genetic manipulation of ticks. Trends Parasitol. 23, 427-433 (2007).
- de la Fuente, J. Functional genomic studies of tick cells in response to infection with the cattle pathogen, Anaplasma marginale. Genomics. 90, 712-722 (2007).
- AlmazäN, C. Identification and characterization of Rhipicephalus (Boophilus) microplus candidate protective antigens for the control of cattle tick infestations. Parasitol. Res. 106, 471-479 (2010).
- de la Fuente, J. Identification of protective antigens by RNA interference for control of the lone star tick, Amblyomma americanum. Vaccine. 28, 1786-1795 (2010).
- Zivkovic, Z. Differential expression of genes in salivary glands of male Rhipicephalus (Boophilus) microplus in response to infection with Anaplasma marginale. BMC Genomics. 11, 186-186 (2010).
- de la Fuente, J. Reduction of tick infections with Anaplasma marginale and A. phagocytophilum by targeting the tick protective antigen subolesin. Parasitol. Res. 100, 85-91 (2006).
- Narasimhan, S. Disruption of Ixodes scapularis anticoagulation by using RNA interference. Proc. Natl. Acad. Sci U.S.A. 101, 1141-1146 (2004).
- de la Fuente, J. RNA interference screening in ticks for identification of protective antigens. Parasitol. Res. 96, 137-141 (2005).
- de la Fuente, J. The tick protective antigen, 4D8, is a conserved protein involved in modulation of tick blood ingestion and reproduction. Vaccine. 24, 4082-4095 (2006).
- de la Fuente, J. Synergistic effect of silencing the expression of tick protective antigens 4D8 and Rs86 in Rhipicephalus sanguineus by RNA interference. Parasitol. Res. 99, 108-113 (2006).
- de la Fuente, J. Autocidal control of ticks by silencing of a single gene by RNA interference. Biochem. Biophys. Res. Commun. 344, 332-338 (2006).
- Nijhof, A. M. Bm86, Bm91 and subolesin, in the silencing of the tick protective antigens. Int. J. Parasitol. 37, 653-662 (2007).
- Kocan, K. M. Silencing of the defensin, varisin, in male Dermacentor variabilis by RNA interference results in reduced Anaplasma marginale infections. Exp. Appl. Acarol. 46, 17-28 (2008).
- de la Fuente, J. Evidence of the role of tick subolesin in gene expression. BMC Genomics. 9, 372-372 (2008).
- Smith, A. The impact of RNA interference of the subolesin and voraxin genes in male Amblyomma hebraeum (Acari: Ixodidae) on female engorgement and oviposition. Exp. Appl. Acarol. 47, 71-86 (2009).
- Galindo, R. C. Tick subolesin is an ortholog of the akirins described in insects and vertebrates. Dev. Comp. Immunol. 33, 612-617 (2009).
- Canales, M. Conservation and immunogenicity of the mosquito ortholog of the tick protective antigen, subolesin. Parasitol. Res. 105, 97-111 (2009).
- Kocan, K. M. Silencing of genes involved in Anaplasma marginale-tick interactions affects the pathogen developmental cycle in Dermacentor variabilis. BMC Dev. Biol. 9, 42-42 (2009).
- Zivkovic, Z. Subolesin expression in response to pathogen infection in ticks. BMC Immunol. 11, 7-7 (2010).
- Karim, S. Functional genomics tool: gene silencing in Ixodes scapularis eggs and nymphs by electroporated dsRNA. BMC Biotechnol. 10, 1-1 (2010).
- Kocan, K. M. Transovarial silencing of the subolesin gene in three-host ixodid tick species after injection of replete females with subolesin dsRNA. Parasitol. Res. 100, 1411-1415 (2007).
- de la Fuente, J. Targeting the tick-pathogen interface for novel control strategies. Front. Biosci. 13, 6947-6956 (2008).
- Kurscheid, S. Evidence of a tick RNAi pathway by comparative genomics and reverse genetics screen of targets with known loss-of-function phenotypes in Drosophila. BMC Mol. Biol. 10, 26-26 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten