Method Article
RNA interferenza nelle zecche
In questo articolo
Riepilogo
Un metodo per l'interferenza dell'RNA (RNAi) mediante iniezione di dsRNA in zecche digiuno è descritta. RNAi è il più utilizzato silenziamento genico tecnica zecche dove l'utilizzo di altri metodi di manipolazione genetica è stato limitato.
Abstract
Le zecche sono ectoparassiti ematofagi obbligati degli animali selvatici e domestici e gli esseri umani, e sono considerati il secondo al mondo per le zanzare come vettori di malattie umane 1 e i vettori più importanti che riguardano l'industria del bestiame in tutto il mondo 2. Le zecche sono classificate nella sottoclasse Acari, Parasitiformes ordine, sottordine Ixodida e sono distribuiti in tutto il mondo da Arctic alle regioni tropicali 3. Nonostante gli sforzi per controllare le infestazioni di zecche, ectoparassiti questi rimangono un serio problema per la salute umana e animale 4,5.
Interferenza dell'RNA (RNAi) 6 è un acido nucleico approccio inverso genetico che comporta interruzione di espressione genica per determinare la funzione del gene o il suo effetto su una via metabolica. Piccoli RNA interferenti (siRNA) sono le molecole effettrici della via RNAi che è iniziata da RNA a doppio filamento (dsRNA) e si traduce in un potente degradazione sequenza-specifica degli mRNA citoplasmatici contenenti la stessa sequenza come trigger dsRNA 7-9. Post-trascrizionale meccanismi di silenziamento genico iniziata da dsRNA sono stati scoperti in tutti gli eucarioti studiato finora, e RNAi è stata rapidamente sviluppata in una varietà di organismi come strumento per studi di genomica funzionale e altre applicazioni 10.
RNAi è diventato il più utilizzato silenziamento genico tecnica zecche e altri organismi in cui approcci alternativi per la manipolazione genetica non sono disponibili o non sono affidabili 5,11. La caratterizzazione genetica delle zecche è stata limitata fino alla recente applicazione di RNAi 12,13. Nel poco tempo che RNAi è stato disponibile, ha dimostrato di essere uno strumento prezioso per studiare la funzione del gene tick, la caratterizzazione del tic-patogeno interfaccia e lo screening e la caratterizzazione di antigeni tick di protezione 14. Qui, un metodo per RNAi mediante iniezione di dsRNA in zecche digiuno è descritta. E 'probabile che la conoscenza acquisita da questo approccio sperimentale contribuirà notevolmente alla comprensione dei sistemi biologici di base e lo sviluppo di vaccini per controllare le infestazioni zecche e prevenire la trasmissione di zecche patogeni 15-19.
Protocollo
1. Generazione di dsRNA.
- Sintetizzare primer oligonucleotidi contenenti sequenze promotore T7 per la trascrizione in vitro e la sintesi di dsRNA (ad esempio, per Dermacentor variabilis subolesin utilizzare primer oligonucleotidi D8AAT75:
5'-TAATACGACTCACTATAGGGTACTGACTGGGATCCCCTGCACAGT-3 'e D8DVT73: 5'-TAATACGACTCACTATAGGGTACTCGAGCTTGGTGGAAAGGACG-3'). - Amplificare gene bersaglio mediante RT-PCR utilizzando 10 pmol di ciascun primer oligonucleotidi e 1-10 ng di RNA totale tick.
- Purificare il prodotto della PCR.
- Sintetizzare dsRNA utilizzando 8 ml di prodotto purificato PCR.
- Quantificare dsRNA mediante spettrometria.
2. Iniezione di zecche con dsRNA.
2.1. Preparazione di zecche per l'iniezione.
- In primo luogo, lavare le zecche in una serie di soluzioni agitando in ogni soluzione in una provetta da 50 ml per centrifuga monouso, decantazione la soluzione attraverso uno schermo sottile rete metallica sopra la parte superiore del tubo per mantenere le zecche. La sequenza delle soluzioni per le zecche lavaggio è l'acqua del rubinetto, il perossido di idrogeno al 3%, due lavaggi di acqua distillata, 70% di etanolo e altri due lavaggi con acqua distillata.
- Blot-asciugare le zecche su carta assorbente.
- Contare le zecche in gruppi da 20 a 50, a seconda della sperimentazione, posto le zecche di ogni gruppo in una tazza di 1,25 once di plastica con un coperchio a tenuta, arredata e un'etichetta con il numero del gruppo sperimentale.
2.2. Tick squadra iniezione.
Il team di RNAi è composto da tre persone: (1) una persona che ha posizioni di ogni segno di spunta sul doppio nastro adesivo apposto su un foglio di rosso per impronte dentarie, (2) una persona che inietta le zecche e (3) una persona che controlla le zecche dopo iniezione, respira di CO 2 sul zecche per attivarli e conta le zecche che vivono nelle tazze etichettata con il numero del gruppo sperimentale. Tutti i membri della squadra devono indossare guanti monouso.
2.3. Il posizionamento di zecche per l'iniezione.
- Cattura un segno di spunta utilizzando pinze Dumont bene e posizionarlo sul lato ventrale doppio nastro adesivo apposto su un foglio 3 "x 6" di rosso per impronte dentarie. Le zecche sono strettamente posizionati insieme in gruppi di 5 tick.
- Mettere una piccola striscia di nastro adesivo sopra l'apparato boccale di tutte e 5 le zecche al fine di contenere ulteriormente, ma lasciando la maggior parte del corpo esposto in modo che il processo di iniezione può essere osservata dalla zecca iniettore (Figura 1).
2.4. Iniezione di zecche.
- Le zecche sarà iniettato nel quadrante in basso a destra della superficie ventrale della esoscheletro.
- In primo luogo, forare un buco nella esoscheletro usando una siringa per insulina Monoject dotato di un ½ ", 29 gauge (Figura 2a).
- Iniettare zecche immediatamente con 0,2-0,5 ml di soluzione dsRNA (5 x 10 10 - 5 x 10 11 molecole per mL) con una misura siringa Hamilton con un pollice 1, 33 gauge con un 45 ° smussato punto (Figura 2b) . L'ago deve essere inserito anche nella cavità tick per assicurare il posizionamento e la ritenzione del dsRNA. Alcuni fluido è probabile fuga dal sito di iniezione (figura 2c). Si deve prestare attenzione a non iniettare il zecche, che causerebbe la perdita di emolinfa e potrebbe causare la morte della zecca.
- Pulire la siringa Hamilton dopo aver completato le iniezioni in ciascun gruppo sperimentale. prima di utilizzare per un altro gruppo sperimentale. Riempire la siringa prima da un bicchiere contenente acqua ossigenata al 3% e poi espellere in un contenitore dei rifiuti, e ripetere 15 volte. Riempire la siringa da un bicchiere contenente acqua sterile e poi espellere in un contenitore dei rifiuti, e ripetere 15 volte. Fare attenzione a non piegare lo stantuffo della siringa Hamilton perché, se piegato, il pistone non si muove senza problemi e rispondere al tocco gentile richiesta per l'iniezione di zecche.
2.5. Trattamento di zecche dopo l'iniezione.
- Sollevare il segno di spunta iniettato immediatamente dal doppio nastro adesivo con la pinza sottile e metterla in un contenitore di plastica di recupero (circa 6 "x 6" e circondata da nastro adesivo per evitare la fuga delle zecche). Le zecche saranno brevemente inattivo dopo l'iniezione, ma dovrebbe presto cominciare a strisciare intorno al piatto.
- Respiro di CO 2 sul zecche subito dopo metterli nel contenitore di recupero per aiutare ad attivare le zecche. Una volta che le zecche sono striscianti e attivo, la ferita iniezione guarirà rapidamente e saranno molto probabilmente sopravvivere.
- Contare le zecche in base al numero di ogni gruppo sperimentale e metterli in un bicchiere di plastica marcato con un coperchio a tenuta montato. Zecche sostituzione deve essere iniettato per sostituire qualsiasi che ogni morto prima di iniettare il prossimo gruppo sperimentale.
2.6. Tick azienda.
- Posizionare il zecche in una camera umida (12 ore di luce: 12 ore fotoperiodo buio a 22-25 ° C e 95% rispetto humidità) e tenere premuto per 1 giorno.
- Zecche posto in tick-alimentare celle, una per ogni gruppo sperimentale, incollato a una pecora e permettere loro di alimentare con un numero uguale di uninjected zecche maschio o femmina (a seconda del sesso non è stato iniettato). Zecche femminile che si nutrono a sazietà, quelli che vengono rimossi dalle pecore dopo 10 giorni di alimentazione o quando le femmine di controllo sono caduto fuori l'host sono raccolti e pesati.
- Posizionare il zecche in cartoni, e tenere nella camera di umidità fino al completamento della deposizione delle uova. Valutare deposizione delle uova ponderando la massa di uova prodotte da tutte le zecche del gruppo.
2.7. Analisi del fenotipo tick dopo RNAi.
- Valutare tick fenotipo dopo l'alimentazione, determinando il numero di zecche che sono sopravvissuti, il peso zecca, deposizione delle uova e la fertilità delle uova. Tuttavia, altre analisi può essere eseguita a seconda del gene bersaglio e gli obiettivi dello studio.
3. Analisi per confermare silenziamento genico mediante RT-PCR.
- Sezionare ghiandole salivari e coraggio da zecche singoli gruppi di controllo iniezione e iniezione di dsRNA dopo la poppata.
- Estrarre l'RNA totale da campioni di tessuto individuali.
- Analizzare le trascrizioni gene bersaglio nei tessuti singole real-time RT-PCR e normalizzare i livelli di RNA contro le zecche rRNA 16S con il metodo genNorm (metodo DDCT come attuato da Bio-Rad iQ5 Standard Edition, versione 2.0).
- Eseguire curve di dissociazione, alla fine della reazione per garantire che solo un amplicone è formato e che la denaturare ampliconi costantemente nella gamma stessa temperatura per ogni campione.
- Confrontare i livelli di mRNA (normalizzato valori Ct) tra controllo iniezione e iniezione di dsRNA zecche utilizzando la Student `s t-test (p = 0,05).
4. Rappresentante dei risultati:
Il protocollo qui descritto è stato utilizzato nel nostro laboratorio per RNAi in molte specie differenti zecche ixodid (Tabella 1). La quantità di dsRNA iniettato nel zecche varia con le dimensioni della zecca; specie di zecche più grande può ospitare un volume maggiore. Zecche controllo negativo deve essere iniettato con un dsRNA indipendenti. DsRNAs diversi come subolesin 14-19,22-25,27-32,34 e beta-actina 20,21 potrebbero essere utilizzati come controlli positivi. Si noti che è importante lavare la siringa tra i trattamenti per evitare la miscelazione di soluzioni dsRNA. Se il protocollo viene fatto correttamente, meno del 5% di mortalità dovrebbe essere ottenute con la procedura di iniezione dopo 24 ore. Un fenotipo tipico dopo knockdown gene nelle zecche è mostrato in figura 3 con un pannello di zecche iniettato con piscine di dsRNA in modo da schermo per tick antigeni protettivi.
| Tick specie | dsRNA iniettato | Referenze |
| Ixodes scapularis | libreria di cDNA, subolesin, actina, nucleotidasi, NF-kB, akirin | 21, 22, 29, 30 |
| Dermacentor variabilis | subolesin, GST, ubiquitina, vATPase, selenoproteine M e W2A, ematopoietiche staminali / progenitrici di proteine come, subunità actina proteasoma 26S, ferritin1, varisin, akirin | 15, 19, 22, 24, 26, 30-32 |
| Dermacentor marginatus | subolesin | 22 |
| Amblyomma americanum | libreria di cDNA, subolesin, akirin | 17, 22, 30 |
| Amblyomma hebraeum | subolesin, voraxin | 28 |
| Rhipicephalus sanguineus | Rs86, subolesin | 22, 23 |
| Rhipicephalus Microplus | GST, ubiquitina, selenoproteina, Bm86, Bm91, subolesin, GI, GIII, EF1a, proteine della seta flagelliform, von Willebrand fattore | 16, 18, 25, 27 |
| Rhipicephalus annulatus | ubiquitina, subolesin, EF1a, GIII | 16 |
Tabella 1. Tick specie in cui il protocollo RNAi è stato usato.
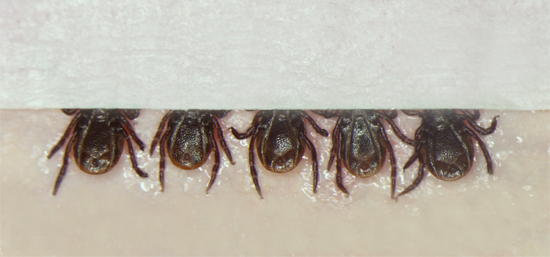
Figura 1. Posizionamento delle zecche, lato ventrale, sulla doppio nastro adesivo aderito a un foglio di colore rosso per impronte dentarie. Le zecche sono inseriti in gruppi di 5, dopo il quale una piccola striscia di nastro adesivo è posta sopra l'apparato boccale al fine di garantire ulteriormente le zecche, consentendo l'iniettore di osservare il corpo della zecca durante l'iniezione.

Figura 2. La procedura di iniezione comprende (a) penetrante quadrante in basso a destra della zecca con un esoscheletro insulina syRinge con ago 29 gauge in modo da creare un sito di iniezione, (b) l'iniezione immediata del dsRNA in questo sito utilizzando una siringa Hamilton con un ago 33 gauge, che (c) molto probabilmente si tradurrà in una perdita di emolinfa tick / fluidi.

Figura 3. Un gruppo di zecca sei gruppi in cui è stato utilizzato per lo screening RNAi per gli antigeni tick di protezione Amblyomma americanum. I cambiamenti fenotipici in zecche possono essere visti se confrontato con il lato positivo subolesin RNAi di controllo e il controllo negativo dsRNA indipendenti. In questo esperimento l'effetto di RNAi sulla mortalità zecca, pesi, e la deposizione di ogni gruppo sono stati analizzati statisticamente.
Discussione
Anche se altri metodi sono stati descritti per RNAi nelle zecche 14, 33, l'iniezione di dsRNA qui descritto è il più utilizzato in entrambe le digiuno (Tabella 1) e nutriti zecche 16,25,34. RNAi ha dimostrato di essere un valido strumento per lo studio della funzione tick genica, la caratterizzazione del tic-patogeno interfaccia e lo screening e la caratterizzazione di antigeni tick di protezione 14,35. In particolare, la RNAi è diventato lo strumento più prezioso per l'analisi funzionale nelle zecche 35.
Metodologicamente, RNAi probabilmente evolverà in metodi più efficienti che possono permettere knockdown gene in un gran numero di individui. Il meccanismo di dsRNA indotta RNAi nelle zecche dovrebbe essere raffinato per contribuire ad una migliore comprensione e l'utilizzo di questo approccio genetico in questa specie di 35,36. Il grado di off-target effetti della RNAi nelle zecche è anche una questione importante che deve essere pienamente affrontati 14,27. Infine, RNAi sarà molto probabilmente fornire contributi completa allo studio della regolazione genica e zecche biologia dei sistemi e il tic-patogeno interfaccia e possono avere un impatto sullo sviluppo di vaccini per controllare le infestazioni di zecche e la trasmissione di zecche patogeni.
Divulgazioni
Riconoscimenti
Ringraziamo i membri del nostro laboratorio per le discussioni fruttuose e assistenza tecnica. Questa presentazione video è stato sostenuto dal Preside Associato per la Ricerca e il Dipartimento di Veterinaria Patobiologia, Centro per la Veterinaria Scienze della Salute, Oklahoma State University. La ricerca è stata finanziata dal Ministerio de Ciencia e Innovación, Spagna (progetto BFU2008-01244/BMC), il progetto CSIC intramurale PA1002451 di JF, Walter R. Sitlington Dotato Cattedra per la ricerca alimentare animale a KMK, CVHS 2009 RAC concessione, OAE Fondi sanità animale e USDA, Nazionale di Grant Research Initiative competitivi, n. 2007-04613.
Materiali
| Name | Company | Catalog Number | Comments |
| Access RT-PCR system | Promega | A1250 | |
| Purelink PCR purification kit | Invitrogen | K3100-02 | |
| Megascript RNAi kit | Ambion | AM1626M | |
| Red dental wax | Electron Microscopy Sciences | 72674 | |
| Plastic cups, 1.25 oz and lids | Solo Cup Company, Urbana Ill. | ||
| Fine forceps | Electron Microscopy Sciences | Various | |
| Insulin syringe | Monoject | Fitted with a ½", 29 gauge needle | |
| Hamilton syringe | Hamilton | 701SN,33/.375”/45DGR | Custom made |
| TriReagent | Sigma | 93289 | |
| iScript One-Step RT-PCR Kit with SYBR Green | Bio-Rad | 170-8892 | |
| Real-time PCR detection system | Bio-Rad | Several | Please refer to http://www.bio-rad.com/ |
Riferimenti
- de la Fuente, J. Overview: Ticks as vectors of pathogens that cause disease in humans and animals. Front. Biosci. 13, 6938-6946 (2008).
- Peter, R. J. mosquito control-Lessons from the past, solutions for the future. Vet. Parasitol. 132, 205-215 (2005).
- Barker, S. C., Murrell, A. Systematics and evolution of ticks with a list of valid genus and species names. Parasitol. 129, S15-S36 (2004).
- Willadsen, P. Tick control: Thoughts on a research agenda. Vet. Parasitol. 138, 161-168 (2006).
- de la Fuente, J., Kocan, K. M. Strategies for development of vaccines for control of ixodid tick species. Parasite Immunol. 28, 275-283 (2006).
- Fire, A. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Cerutti, H. RNA interference: traveling in the cell and gaining functions. Trends Genet. 19, 39-46 (2003).
- Kavi, H. H. RNA silencing in Drosophila. FEBS Lett. 579, 5940-5949 (2005).
- Mello, C. C., Conte, D. J. r Revealing the world of RNA interference. Nature. 431, 338-342 (2004).
- Zhou, D. RNA interference and potential applications. Curr. Top. Med. Chem. 6, 901-911 (2006).
- Ramakrishnan, V. G. Application of RNA interference in tick salivary gland research. J. Biomol. Tech. 16, 297-305 (2005).
- Aljamali, M. N. RNA interference: applicability in tick research. Exp. Appl. Acarol. 28, 89-96 (2002).
- Aljamali, M. N. RNA interference in ticks: a study using histamine binding protein dsRNA in the female tick Amblyomma americanum. Insect. Mol. Biol. 12, 299-305 (2003).
- de la Fuente, J. RNA interference for the study and genetic manipulation of ticks. Trends Parasitol. 23, 427-433 (2007).
- de la Fuente, J. Functional genomic studies of tick cells in response to infection with the cattle pathogen, Anaplasma marginale. Genomics. 90, 712-722 (2007).
- AlmazäN, C. Identification and characterization of Rhipicephalus (Boophilus) microplus candidate protective antigens for the control of cattle tick infestations. Parasitol. Res. 106, 471-479 (2010).
- de la Fuente, J. Identification of protective antigens by RNA interference for control of the lone star tick, Amblyomma americanum. Vaccine. 28, 1786-1795 (2010).
- Zivkovic, Z. Differential expression of genes in salivary glands of male Rhipicephalus (Boophilus) microplus in response to infection with Anaplasma marginale. BMC Genomics. 11, 186-186 (2010).
- de la Fuente, J. Reduction of tick infections with Anaplasma marginale and A. phagocytophilum by targeting the tick protective antigen subolesin. Parasitol. Res. 100, 85-91 (2006).
- Narasimhan, S. Disruption of Ixodes scapularis anticoagulation by using RNA interference. Proc. Natl. Acad. Sci U.S.A. 101, 1141-1146 (2004).
- de la Fuente, J. RNA interference screening in ticks for identification of protective antigens. Parasitol. Res. 96, 137-141 (2005).
- de la Fuente, J. The tick protective antigen, 4D8, is a conserved protein involved in modulation of tick blood ingestion and reproduction. Vaccine. 24, 4082-4095 (2006).
- de la Fuente, J. Synergistic effect of silencing the expression of tick protective antigens 4D8 and Rs86 in Rhipicephalus sanguineus by RNA interference. Parasitol. Res. 99, 108-113 (2006).
- de la Fuente, J. Autocidal control of ticks by silencing of a single gene by RNA interference. Biochem. Biophys. Res. Commun. 344, 332-338 (2006).
- Nijhof, A. M. Bm86, Bm91 and subolesin, in the silencing of the tick protective antigens. Int. J. Parasitol. 37, 653-662 (2007).
- Kocan, K. M. Silencing of the defensin, varisin, in male Dermacentor variabilis by RNA interference results in reduced Anaplasma marginale infections. Exp. Appl. Acarol. 46, 17-28 (2008).
- de la Fuente, J. Evidence of the role of tick subolesin in gene expression. BMC Genomics. 9, 372-372 (2008).
- Smith, A. The impact of RNA interference of the subolesin and voraxin genes in male Amblyomma hebraeum (Acari: Ixodidae) on female engorgement and oviposition. Exp. Appl. Acarol. 47, 71-86 (2009).
- Galindo, R. C. Tick subolesin is an ortholog of the akirins described in insects and vertebrates. Dev. Comp. Immunol. 33, 612-617 (2009).
- Canales, M. Conservation and immunogenicity of the mosquito ortholog of the tick protective antigen, subolesin. Parasitol. Res. 105, 97-111 (2009).
- Kocan, K. M. Silencing of genes involved in Anaplasma marginale-tick interactions affects the pathogen developmental cycle in Dermacentor variabilis. BMC Dev. Biol. 9, 42-42 (2009).
- Zivkovic, Z. Subolesin expression in response to pathogen infection in ticks. BMC Immunol. 11, 7-7 (2010).
- Karim, S. Functional genomics tool: gene silencing in Ixodes scapularis eggs and nymphs by electroporated dsRNA. BMC Biotechnol. 10, 1-1 (2010).
- Kocan, K. M. Transovarial silencing of the subolesin gene in three-host ixodid tick species after injection of replete females with subolesin dsRNA. Parasitol. Res. 100, 1411-1415 (2007).
- de la Fuente, J. Targeting the tick-pathogen interface for novel control strategies. Front. Biosci. 13, 6947-6956 (2008).
- Kurscheid, S. Evidence of a tick RNAi pathway by comparative genomics and reverse genetics screen of targets with known loss-of-function phenotypes in Drosophila. BMC Mol. Biol. 10, 26-26 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon