Method Article
RNA de interferência em Carrapatos
Neste Artigo
Resumo
Um método para a interferência de RNA (RNAi) pela injeção de dsRNA em carrapatos em jejum é descrito. RNAi é a mais utilizada técnica de silenciamento de genes em carrapatos onde o uso de outros métodos de manipulação genética tem sido limitado.
Resumo
Carrapatos são ectoparasitas hematófagos obrigatórios de animais selvagens e domésticos e seres humanos, e são considerados em todo o mundo segundo a mosquitos como vetores de doenças humanas 1 e os vetores mais importantes que afetam pecuária em todo o mundo 2. Carrapatos são classificados na subclasse Acari, Parasitiformes ordem, subordem Ixodida e são distribuídas em todo o mundo a partir do Ártico para as regiões tropical 3. Apesar dos esforços para controlar a infestação de carrapatos, estes ectoparasitas continuar a ser um problema sério para a saúde humana e animal 4,5.
Interferência de RNA (RNAi) 6 é uma abordagem inversa à base de ácido nucléico genética que envolve a interrupção da expressão do gene, a fim de determinar a função do gene ou o seu efeito em uma via metabólica. Pequenos RNAs de interferência (siRNAs) são as moléculas efetoras da via RNAi que é iniciado pelo double-stranded RNA (dsRNA) e resulta em um potente seqüência específica de degradação de mRNAs citoplasmáticos contendo a mesma seqüência como o gatilho dsRNA 7-9. Pós-transcricional mecanismos de silenciamento de genes iniciado por dsRNA foram descobertas em todos os eucariotos estudados até agora, e RNAi foi rapidamente desenvolvido em uma variedade de organismos como uma ferramenta para estudos de genômica funcional e outras aplicações 10.
RNAi tem se tornado a mais utilizada técnica de silenciamento de genes em carrapatos e outros organismos em que as abordagens alternativas para a manipulação genética não estão disponíveis ou são pouco confiáveis 5,11. A caracterização genética de carrapatos tem sido limitado até que a recente aplicação de RNAi 12,13. No pouco tempo que RNAi tem sido disponível, ele provou ser um instrumento valioso para estudar a função do gene carrapato, a caracterização da interface carrapato-patógeno e ao rastreio e caracterização de antígenos de carrapatos de proteção 14. Aqui, um método para RNAi através da injeção de dsRNA em carrapatos em jejum é descrito. É provável que o conhecimento adquirido a partir desta abordagem experimental contribuirá significativamente para a compreensão dos sistemas biológicos básicos e ao desenvolvimento de vacinas para controlar a infestação de carrapato e prevenir a transmissão de patógenos por carrapatos 15-19.
Protocolo
1. Geração de dsRNA.
- Sintetizar primers contendo seqüências de promotor T7 para transcrição in vitro ea síntese de dsRNA (por exemplo, para Dermacentor variabilis subolesin usar primers D8AAT75:
5'-TAATACGACTCACTATAGGGTACTGACTGGGATCCCCTGCACAGT-3 'e D8DVT73: 5'-TAATACGACTCACTATAGGGTACTCGAGCTTGGTGGAAAGGACG-3'). - Amplificar gene-alvo por RT-PCR utilizando 10 pmol de cada primer oligonucleotídeo e ng 1-10 de RNA total de carrapatos.
- Purificar o produto da PCR.
- Sintetizar dsRNA com 8 mL do produto da PCR purificada.
- Quantificar dsRNA por espectrometria.
2. Injeção de Carrapatos com dsRNA.
2.1. Preparação de carrapatos injectável.
- Primeiro, lave a carrapatos em uma série de soluções, agitando-os em cada solução em um tubo de centrífuga de 50 mL descartáveis, decantação a solução através de uma tela fina malha de arame sobre a parte superior do tubo para manter os carrapatos. A seqüência das soluções para os carrapatos de lavagem é a água da torneira, peróxido de hidrogênio 3%, duas lavagens de água destilada, o etanol 70% e duas lavagens mais com água destilada.
- Blot-seque a carrapatos em toalhas de papel.
- Contar os carrapatos em grupos de 20 a 50, dependendo do experimento, coloque os carrapatos de cada grupo em um copo de plástico 1,25 onças com uma tampa bem ajustada e etiqueta com o número do grupo experimental.
2.2. Tick equipe de injeção.
A equipe de RNAi consiste em três pessoas: (1) uma pessoa que posições cada instante em fita adesiva dupla afixada a uma folha de cera dental vermelho, (2) uma pessoa que injeta os carrapatos e (3) uma pessoa que monitora os carrapatos após injeção, respira de CO 2 na carrapatos para ativá-las e conta os carrapatos que vivem em copos marcados com o número do grupo experimental. Todos os membros da equipe devem usar luvas descartáveis.
2.3. Colocação de carrapatos injectável.
- Captura de um carrapato com pinças Dumont fina e colocá-lo lado ventral em fita adesiva dupla aposta num 3 "x 6" folha de cera dental vermelho. Os carrapatos estão intimamente posicionados juntos em grupos de 5 carrapatos.
- Coloque uma pequena tira de fita adesiva sobre o aparelho bucal de todos os cinco carrapatos, a fim de diminuir as deles, mas deixando a maior parte do corpo exposto para que o processo de injeção pode ser observado pelo carrapato injetor (Figura 1).
2.4. Injeção de carrapatos.
- Os carrapatos serão injetados no quadrante inferior direito da superfície ventral do exoesqueleto.
- Primeiro, faça um furo no exoesqueleto usando uma seringa de insulina Monoject equipado com um ½ ", agulha de calibre 29 (Figura 2a).
- Injetar carrapatos imediatamente com 0,2-0,5 mL de solução de dsRNA (5 x 10 10 - 5 x 10 11 moléculas por mL), utilizando uma custom-made seringa Hamilton com uma polegada de 1, 33 agulha com um ponto de 45 ° chanfrado (Figura 2b) . A agulha deve ser colocada bem na cavidade carrapato para assegurar a colocação e retenção do dsRNA. Algum fluido é provável que escapar do local da injeção (Figura 2c). Cuidados devem ser tomados para não mais de injetar os carrapatos, o que causaria perda de hemolinfa e pode causar a morte do carrapato.
- Limpe a seringa Hamilton depois de completar as injeções em cada grupo experimental. antes de usar para outro grupo experimental. Encha a seringa primeira de um copo contendo peróxido de hidrogênio 3% e, em seguida, expelir em um recipiente de resíduos, e repita 15 vezes. Encha a seringa de um copo contendo água estéril e, em seguida, expelir em um recipiente de resíduos, e repita 15 vezes. Tome cuidado para não dobrar o êmbolo da seringa de Hamilton, porque, se dobrado, o êmbolo não irá mover-se suavemente e responder ao toque suave necessária para injeção de carrapatos.
2.5. Tratamento de carrapatos após a injeção.
- Pegar o carrapato injetado imediatamente a partir da fita adesiva dupla com a pinça fina e colocá-lo em um recipiente de recuperação de plástico (cerca de 6 "x 6" e cercado com fita adesiva para evitar o escape dos carrapatos). Os carrapatos serão brevemente inativos após a injeção, mas deverá em breve começar a engatinhar ao redor do prato.
- Respiração CO 2 para os carrapatos imediatamente após colocá-los no recipiente de recuperação para ajudar a ativar os carrapatos. Uma vez que os carrapatos estão rastejando e ativa, a ferida vai curar injeção rapidamente e eles provavelmente irão sobreviver.
- Contar os ticks de acordo com o número em cada grupo experimental e os coloque em um copo de plástico rotulados com uma tampa bem equipado. Carrapatos substituição deve ser injetado para substituir qualquer que qualquer morreu antes de injetar o próximo grupo experimental.
2.6. Tick exploração.
- Coloque os carrapatos em uma câmara de umidade (12h de luz: 12 hr fotoperíodo escuro, a 22-25 ° C e 95% em relação humidity) e segure por um dia.
- Carrapatos lugar no carrapato-alimentação células, uma por grupo experimental, colada a uma ovelha e permitir-lhes para se alimentar com um número igual de uninjected carrapatos masculina ou feminina (o que o sexo não foi injetado). Carrapatos fêmeas que se alimentam de reposição, aqueles que são retirados da ovelha após 10 dias de alimentação, ou quando as fêmeas controle têm deixado o anfitrião são coletados e pesados.
- Coloque os carrapatos em caixas de cartão, e segure a câmara de umidade até a conclusão de oviposição. Avaliar oviposição pela ponderação das massa de ovos produzidos por todos os carrapatos no grupo.
2.7. Análise do fenótipo tick após RNAi.
- Avaliar carrapato fenótipo após a alimentação, determinando o número de carrapatos que sobreviveram, peso carrapato, oviposição e fertilidade dos ovos. No entanto, outras análises podem ser realizadas, dependendo do gene-alvo e objetivos do estudo.
3. Análise para confirmar o silenciamento do gene por RT-PCR.
- Dissecar as glândulas salivares e tripas de carrapatos individuais de grupos de controle de injeção e dsRNA injetado após a alimentação.
- Extrato de RNA total de amostras de tecido individual.
- Analisar as transcrições gene alvo nos tecidos individuais por real-time RT-PCR e normalizar os níveis de RNA contra o 16S rRNA tick usando o método genNorm (método ddCT implementada pelo Bio-Rad iQ5 Standard Edition, versão 2.0).
- Executar curvas de dissociação no final da reação para garantir que apenas um amplicon é formada e que a desnaturar amplicons consistentemente na faixa de temperatura mesmo para cada amostra.
- Comparar os níveis de mRNA (valores normalizados Ct) entre o controle com injeção e dsRNA injetado carrapatos usando o Student `s t-test (P = 0,05).
4. Resultados representativos:
O protocolo aqui descrito tem sido utilizado em nosso laboratório para RNAi em muitas diferentes espécies de carrapatos ixodídeos (Tabela 1). A quantidade de dsRNA injetado no carrapatos varia com o tamanho do carrapato; espécies maiores carrapato pode acomodar um grande volume. Carrapatos controle negativo deve ser injectado com um dsRNA não relacionados. DsRNAs diversas, tais como subolesin 14-19,22-25,27-32,34 e beta-actina 20,21 pode ser usado como controle positivo. Note que é importante lavar a seringa entre os tratamentos para evitar soluções de mistura dsRNA. Se o protocolo for feito corretamente, menos de 5% de mortalidade deve ser obtido a partir do procedimento de injeção após 24 horas. Um fenótipo típico após knockdown do gene em carrapatos é mostrado na Figura 3, com um painel de carrapatos injetados com piscinas de dsRNA, a fim de tela para assinalar antígenos protetores.
| Tick espécies | dsRNA injetado | Referências |
| Scapularis Ixodes | biblioteca de cDNA, subolesin, actina, nucleotidase, NF-kB, akirin | 21, 22, 29, 30 |
| Dermacentor variabilis | subolesin, GST, ubiquitina, vATPase, selenoproteínas M e W2a, tronco hematopoiéticas / progenitoras proteína-like, actina subunidade 26S Proteassoma, ferritin1, varisin, akirin | 15, 19, 22, 24, 26, 30-32 |
| Dermacentor marginatus | subolesin | 22 |
| Amblyomma americanum | biblioteca de cDNA, subolesin, akirin | 17, 22, 30 |
| Amblyomma hebraeum | subolesin, voraxin | 28 |
| Rhipicephalus sanguineus | Rs86, subolesin | 22, 23 |
| Rhipicephalus microplus | GST, ubiquitina, selenoproteína, Bm86, Bm91, subolesin, GI, GIII, EF1a, flagelliform proteína de seda, von Willebrand fator | 16, 18, 25, 27 |
| Annulatus Rhipicephalus | ubiquitina, subolesin, EF1a, GIII | 16 |
Tabela 1. Tick espécies em que o protocolo de RNAi tem sido utilizado.
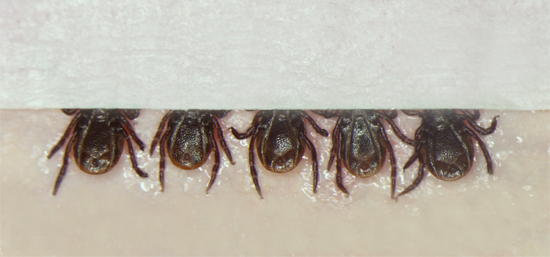
Figura 1. Colocação de carrapatos, o lado ventral para cima, sobre fita adesiva dupla adere a uma folha de cera dental vermelho. Os carrapatos são colocados em grupos de 5, após o qual uma pequena tira de fita adesiva é colocada sobre o aparelho bucal, a fim de proteger ainda mais os carrapatos, permitindo que o injector para observar o corpo do carrapato durante a injeção.

Figura 2. O procedimento de injeção inclui (a) perfuração no quadrante inferior direito do exoesqueleto do carrapato com uma insulina de syringe com uma agulha calibre 29, a fim de criar um local da injeção, (b) a injeção imediata do dsRNA neste site, utilizando uma seringa Hamilton com uma agulha de calibre 33, que (c) muito provavelmente vai resultar em algum vazamento de hemolinfa carrapato / fluidos.

Figura 3. Um painel de carrapato seis grupos em que RNAi foi utilizado para triagem de antígenos carrapato Amblyomma americanum protetora em. As mudanças fenotípicas em carrapatos pode ser visto quando comparado com o positivo subolesin RNAi controle eo controle dsRNA negativas não relacionadas. Neste experimento o efeito do RNAi na mortalidade carrapato, pesos e oviposição de cada grupo foram analisados estatisticamente.
Discussão
Embora outros métodos têm sido descritos para RNAi em carrapatos 14, 33, a injeção de dsRNA aqui descrito é o mais utilizado em ambos os jejum (Tabela 1) e carrapatos alimentados 16,25,34. RNAi tem se mostrado uma ferramenta valiosa para o estudo da função dos genes carrapato, a caracterização da interface carrapato-patógeno e ao rastreio e caracterização de antígenos de carrapatos de proteção 14,35. Em particular, RNAi se tornou a ferramenta mais valiosa para análises funcionais em carrapatos 35.
Metodologicamente, RNAi provavelmente evoluir para métodos mais eficientes que podem permitir knockdown do gene em um grande número de indivíduos. O mecanismo de dsRNA induzida por RNAi em carrapatos deve ser refinado para contribuir para uma melhor compreensão e utilização desta abordagem genética nesta espécie 35,36. A extensão de fora do alvo os efeitos da RNAi em carrapatos também é uma questão importante que precisa ser totalmente dirigida 14,27. Finalmente, RNAi provavelmente irá fornecer contribuições ao estudo abrangente da regulação de genes e carrapato biologia de sistemas e do carrapato-patógeno interface e pode ter um impacto sobre o desenvolvimento de vacinas para controlar a infestação de carrapatos e de transmissão de patógenos por carrapatos.
Divulgações
Agradecimentos
Agradecemos a membros de nossos laboratórios para discussões frutíferas e assistência técnica. Esta apresentação de vídeo foi apoiado pelo Reitor de Pesquisa e do Departamento de Patobiologia Veterinária, Centro de Ciências da Saúde Veterinária, Oklahoma State University. A pesquisa foi financiada pelo Ministério de Ciencia e Innovación, Espanha (projeto BFU2008-01244/BMC), o projeto CSIC intramural PA1002451 de JF, o Walter R. Sitlington cadeira dotada de Pesquisa Animal Food para KMK, 2009 CVHS RAC concessão, EOAs animais Fundos de Saúde e USDA, National Research Grant Initiative Competitiva, n º 2007-04613.
Materiais
| Name | Company | Catalog Number | Comments |
| Access RT-PCR system | Promega | A1250 | |
| Purelink PCR purification kit | Invitrogen | K3100-02 | |
| Megascript RNAi kit | Ambion | AM1626M | |
| Red dental wax | Electron Microscopy Sciences | 72674 | |
| Plastic cups, 1.25 oz and lids | Solo Cup Company, Urbana Ill. | ||
| Fine forceps | Electron Microscopy Sciences | Various | |
| Insulin syringe | Monoject | Fitted with a ½", 29 gauge needle | |
| Hamilton syringe | Hamilton | 701SN,33/.375”/45DGR | Custom made |
| TriReagent | Sigma | 93289 | |
| iScript One-Step RT-PCR Kit with SYBR Green | Bio-Rad | 170-8892 | |
| Real-time PCR detection system | Bio-Rad | Several | Please refer to http://www.bio-rad.com/ |
Referências
- de la Fuente, J. Overview: Ticks as vectors of pathogens that cause disease in humans and animals. Front. Biosci. 13, 6938-6946 (2008).
- Peter, R. J. mosquito control-Lessons from the past, solutions for the future. Vet. Parasitol. 132, 205-215 (2005).
- Barker, S. C., Murrell, A. Systematics and evolution of ticks with a list of valid genus and species names. Parasitol. 129, S15-S36 (2004).
- Willadsen, P. Tick control: Thoughts on a research agenda. Vet. Parasitol. 138, 161-168 (2006).
- de la Fuente, J., Kocan, K. M. Strategies for development of vaccines for control of ixodid tick species. Parasite Immunol. 28, 275-283 (2006).
- Fire, A. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Cerutti, H. RNA interference: traveling in the cell and gaining functions. Trends Genet. 19, 39-46 (2003).
- Kavi, H. H. RNA silencing in Drosophila. FEBS Lett. 579, 5940-5949 (2005).
- Mello, C. C., Conte, D. J. r Revealing the world of RNA interference. Nature. 431, 338-342 (2004).
- Zhou, D. RNA interference and potential applications. Curr. Top. Med. Chem. 6, 901-911 (2006).
- Ramakrishnan, V. G. Application of RNA interference in tick salivary gland research. J. Biomol. Tech. 16, 297-305 (2005).
- Aljamali, M. N. RNA interference: applicability in tick research. Exp. Appl. Acarol. 28, 89-96 (2002).
- Aljamali, M. N. RNA interference in ticks: a study using histamine binding protein dsRNA in the female tick Amblyomma americanum. Insect. Mol. Biol. 12, 299-305 (2003).
- de la Fuente, J. RNA interference for the study and genetic manipulation of ticks. Trends Parasitol. 23, 427-433 (2007).
- de la Fuente, J. Functional genomic studies of tick cells in response to infection with the cattle pathogen, Anaplasma marginale. Genomics. 90, 712-722 (2007).
- AlmazäN, C. Identification and characterization of Rhipicephalus (Boophilus) microplus candidate protective antigens for the control of cattle tick infestations. Parasitol. Res. 106, 471-479 (2010).
- de la Fuente, J. Identification of protective antigens by RNA interference for control of the lone star tick, Amblyomma americanum. Vaccine. 28, 1786-1795 (2010).
- Zivkovic, Z. Differential expression of genes in salivary glands of male Rhipicephalus (Boophilus) microplus in response to infection with Anaplasma marginale. BMC Genomics. 11, 186-186 (2010).
- de la Fuente, J. Reduction of tick infections with Anaplasma marginale and A. phagocytophilum by targeting the tick protective antigen subolesin. Parasitol. Res. 100, 85-91 (2006).
- Narasimhan, S. Disruption of Ixodes scapularis anticoagulation by using RNA interference. Proc. Natl. Acad. Sci U.S.A. 101, 1141-1146 (2004).
- de la Fuente, J. RNA interference screening in ticks for identification of protective antigens. Parasitol. Res. 96, 137-141 (2005).
- de la Fuente, J. The tick protective antigen, 4D8, is a conserved protein involved in modulation of tick blood ingestion and reproduction. Vaccine. 24, 4082-4095 (2006).
- de la Fuente, J. Synergistic effect of silencing the expression of tick protective antigens 4D8 and Rs86 in Rhipicephalus sanguineus by RNA interference. Parasitol. Res. 99, 108-113 (2006).
- de la Fuente, J. Autocidal control of ticks by silencing of a single gene by RNA interference. Biochem. Biophys. Res. Commun. 344, 332-338 (2006).
- Nijhof, A. M. Bm86, Bm91 and subolesin, in the silencing of the tick protective antigens. Int. J. Parasitol. 37, 653-662 (2007).
- Kocan, K. M. Silencing of the defensin, varisin, in male Dermacentor variabilis by RNA interference results in reduced Anaplasma marginale infections. Exp. Appl. Acarol. 46, 17-28 (2008).
- de la Fuente, J. Evidence of the role of tick subolesin in gene expression. BMC Genomics. 9, 372-372 (2008).
- Smith, A. The impact of RNA interference of the subolesin and voraxin genes in male Amblyomma hebraeum (Acari: Ixodidae) on female engorgement and oviposition. Exp. Appl. Acarol. 47, 71-86 (2009).
- Galindo, R. C. Tick subolesin is an ortholog of the akirins described in insects and vertebrates. Dev. Comp. Immunol. 33, 612-617 (2009).
- Canales, M. Conservation and immunogenicity of the mosquito ortholog of the tick protective antigen, subolesin. Parasitol. Res. 105, 97-111 (2009).
- Kocan, K. M. Silencing of genes involved in Anaplasma marginale-tick interactions affects the pathogen developmental cycle in Dermacentor variabilis. BMC Dev. Biol. 9, 42-42 (2009).
- Zivkovic, Z. Subolesin expression in response to pathogen infection in ticks. BMC Immunol. 11, 7-7 (2010).
- Karim, S. Functional genomics tool: gene silencing in Ixodes scapularis eggs and nymphs by electroporated dsRNA. BMC Biotechnol. 10, 1-1 (2010).
- Kocan, K. M. Transovarial silencing of the subolesin gene in three-host ixodid tick species after injection of replete females with subolesin dsRNA. Parasitol. Res. 100, 1411-1415 (2007).
- de la Fuente, J. Targeting the tick-pathogen interface for novel control strategies. Front. Biosci. 13, 6947-6956 (2008).
- Kurscheid, S. Evidence of a tick RNAi pathway by comparative genomics and reverse genetics screen of targets with known loss-of-function phenotypes in Drosophila. BMC Mol. Biol. 10, 26-26 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados