Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Los análisis competitivos de Homing para el Estudio de la tripa-trópico migración de células T
En este artículo
Resumen
Competitiva experimentos homing permiten la evaluación directa de las propiedades migratorias de dos poblaciones diferentes de células en un ratón. Aquí se ilustra este procedimiento mediante la comparación de la migración de los ex vivo generado intestino tropicales versus no-gut células T trópico.
Resumen
Con el fin de ejercer su función de linfocitos necesidad de salir de la sangre y migran hacia los diferentes tejidos del cuerpo. La adhesión de linfocitos a las células endoteliales y la extravasación de tejido es un proceso de múltiples pasos controlados por diferentes moléculas de adhesión (receptores homing) expresa en los linfocitos y sus respectivos ligandos (addressins) que aparecen en las células endoteliales 1 2. A pesar de que la función de estos receptores de adhesión puede ser parcialmente estudiado ex vivo, la prueba definitiva de su relevancia fisiológica es para evaluar su función en vivo en la adhesión de linfocitos y la migración. Dos estrategias complementarias se han utilizado para este propósito: la microscopía intravital (IVM) y los experimentos mensajeras. A pesar de IVM ha sido esencial para definir la contribución exacta de los receptores de adhesión específicas en la cascada de adherencia en tiempo real y en diferentes tejidos, IVM es mucho tiempo y mano de obra intensiva, que a menudo requiere el desarrollo de sofisticadas técnicas quirúrgicas, es necesario el aislamiento previo de homogeneidad las poblaciones de células y permite el análisis de un solo tejido / órgano en un momento dado. Por el contrario, la competencia experimentos homing permitir la comparación directa y simultánea en la migración de los dos (o más) subconjuntos de células en el mismo ratón y también permiten el análisis de muchos tejidos y de un elevado número de células en el mismo experimento.
A continuación se describe el protocolo de la competencia clásica mensajeras para determinar la ventaja / desventaja de un tipo de célula a la casa a tejidos específicos, en comparación con una población de células control. Hemos elegido para ilustrar las propiedades migratorias de la tripa-tropical frente a las células T no destripar-trópico, debido a que la mucosa intestinal es la mayor superficie del cuerpo en contacto con el medio externo y es también el tejido extra-linfoides con los requisitos de mejor definidos migratorias . Por otra parte, trabajos recientes han determinado que la vitamina A metabolito ácido trans-retinoico (RA) es el principal mecanismo molecular responsable de la inducción al intestino receptores específicos de la adhesión (integrinas receptor de quimiocinas a4b7and CCR9) en los linfocitos. Por lo tanto, fácilmente puede generar un gran número de intestino tropicales y no tropicales los linfocitos al intestino ex vivo mediante la activación de células T en la presencia o ausencia de RA, respectivamente, que pueden ser finalmente utilizado en los experimentos competitivos homing se describe aquí.
Protocolo
1. Ex generación in vivo de células T del intestino-homing y control (ver Figura 1)
- Aislar esplenocitos por maceración un bazo de ratones de tipo salvaje. Resuspender la suspensión de las células en PBS y centrifugar durante 5 minutos a 400 x g. Eliminar el sobrenadante y lisar los glóbulos rojos por la resuspensión del sedimento de células en 4 ml de solución amortiguadora de lisis ACK durante 2-3 minutos. Después de eso, añadir 5 ml de PBS. Centrifugar durante 5 'a 400 xg y eliminar el sobrenadante.
- Resuspender esplenocitos totales de 1 x 10 6 / ml en IMDM + 10% de SFB + 50 mM 2-mercaptoetanol + penicilina / estreptomicina (IMDM completo). Separar las células en dos grupos, uno de los cuales se complementa con AR (RAR o sintético-agonistas, como Am80 o Am580) a una concentración final de 100-200 Nm 3. Las células T activadas en la presencia de RA o RAR-agonistas se upregulate a4b7and CCR9 y se convertirá en trópico intestinal de células T, mientras que las células T activadas sin la AR se convierten en células T de control.
- Agregar 1,5-2,0 ml de la suspensión celular a cada pocillo de una placa de 24 pocillos previamente recubiertas con anti-CD3 (10 mg / ml) y anti-CD28 (10 mg / ml) y se incuba a 37 ° C en 5% CO 2 (para el recubrimiento de la placa de 500 ml / pocillo de anti-CD3 más anti-CD28 en PBS y se incuba durante 2 horas a 37 ˚ C y lavar dos veces con 2 ml de PBS).
- Con el fin de evitar la sobreestimulación de las células T, después de 2-3 días la transferencia de las suspensiones de células en una nueva sin recubrimiento de 24 pocillos. Incubar durante otros 2-3 días. Dependiendo de la densidad celular y la proliferación de los medios de comunicación puede convertirse en ácido (amarillo), en cuyo caso podría ser necesario para reemplazar la mitad de los medios de comunicación con IMDM completo fresco. Recoger las células después de 4-5 días (a contar desde el día 0).
- Típico de los rendimientos finales son 1.2 x 10 6 células T efectoras / bien. Por lo tanto, un mínimo de 12.9 de cada uno de los pozos de las células intestinales trópico-T y las células T de control debe ser recubierto con el fin de terminar con 10-20 x 10 6 células T en cada condición.
2. Análisis de la tripa-homing los receptores de las células T activadas
Después de 4-5 días de cultivo se debe observar una alta expresión de la tripa-homing a4b7and CCR9 receptores en las células T activadas en la presencia de los agonistas de RA o RAR, mientras que el control de las células T que expresan niveles muy bajos de estos cuatro receptores.
La citometría de flujo (FACS) el análisis.
- Recoger entre 0,2-0,5 x 10 6 células y centrifugar durante 5 minutos a 300 g a 4 ° C.
- Se incuba con anti-CD4-FITC, anti-a4b7-PE (BD Biosciences), anti-CCR9-APC (eBiosciences) y anti-CD8 PerCP por 15 min a 4 ° C en la oscuridad.
- Después de la incubación, centrifugar durante 5 min a 300 g 4 ° C. Lavar y volver a suspender las células en buffer de tinción y análisis por FACS.
3. T marcado de células con seguidores de células CFSE y CMTMR
- Mantenga todas las soluciones a 37 ° C antes de comenzar. Lavado de estómago-trópico células T (a4b7 alta CCR9 alta) y el control de las células T (a4b7 Baja / Neg CCR9 Baja / Neg) dos veces con PBS para eliminar el suero. Ajustar la concentración de células T de 10.15 x 10 6 / ml en PBS.
- Añadir CFSE (carboxifluoresceína succinimidil éster) o CMTMR (clorometil-benzoil-amino-tetrametilrodamina) fluoróforos a cualquiera de intestino-trópico de células T y T el control a una concentración final de 5 mm y 10 mm, respectivamente, suavemente vortex e incubar durante 20 minutos a 37 ° C. Se recomienda cambiar los etiquetados en el mismo o en otro experimento con el fin de excluir posibles efectos intrínsecos de fluoróforos en la migración de células T.
- Después de la incubación, apagar con un volumen de FBS y se incuba durante 1-5 minutos a temperatura ambiente. Diluir 10 veces con PBS caliente y centrifugar durante 5 minutos a 300 g. Lavar dos veces con PBS y resuspender en IMDM completo.
- Idealmente, 10-20 x 10 6 células T de cada población debe ser mezclado en una proporción de 1:1 y luego se centrifuga a 300 xg durante 5 min. Por último, volver a suspender las células en 200-250 ml de PBS caliente y se inyecta a través de la vena de la cola.
- Para calcular la proporción exacta de entrada (lo ideal es cercano a 1) salvar a 5-10 ml de la suspensión de células inyectadas y se diluye con 300 ml de PBS y analizar por FACS.
4. El análisis de células T homing
Aunque los ratones pueden ser analizados en diversos puntos de tiempo (entre 1 hora y después de varios días de la inyección de células T), mensajeras de las células intestinales trópico-T es la mejor documentada entre 12-24 h después de la inyección. Ya los puntos de tiempo aumentar los posibles efectos de otras variables que afectan el número final de células / relaciones, como la apoptosis de las células T y la salida de las células T de los tejidos. Después de los ratones son suspensiones eutanasia, células de diversos tejidos deben ser aislados de inmediato a fin de reducir la muerte celular, lo que podría afectar los rendimientos y resultados finales. Los tejidos de interés son el intestino delgado, colon, bazo, ganglios linfáticos, las placas de Peyer, hígado, pulmones y sangre. Si elinyectaron células T son de buena fe trópico intestinal de células T, que debe su casa, en promedio de 5-10 veces más (o superior) a la mucosa del intestino delgado, en comparación con el control de las células T. Sin embargo, otros tejidos, como la sangre y el bazo, no debe presentar una migración de las células T preferencial. Aislamiento de linfocitos de la lámina propia intestinal y el compartimiento intraepitelial se ha descrito anteriormente 5.
- Tinción FACS: Las muestras se resuspendieron en función del número de células recogidas, con una densidad no superior a 3,0 x 10 6 células / ml. Si congenic CD45.1 + o + Thy1.1 ratones fueron utilizados como receptores, las células se tiñen con el marcador correspondiente congenic (por ejemplo, o CD45.2 Thy1.2) en combinación con algún marcador linaje (por ejemplo, TCRbchain, CD4 y CD8 , CD45.1 + / CD45.2 +).
- Durante el análisis de FACS, las células están separadas en el marcador congenic (por ejemplo, CD45.1) y luego en los marcadores de linaje específico (por ejemplo, CD4/CD8) y se analizó la relación entre las células CFSE CMTMR y positivo.
- Los datos generalmente se expresa como el Índice de Homing (HI), que se calcula como el cociente CFSE / CMTMR (o CMTMR / CFSE) en cada tejido, dividido por el ratio de la entrada correspondiente (ver abajo). Si la relación de entrada es muy cercano a 1, las razones de tejido será equivalente a la HI.
HI = CFSE tejido / tejido CMTMR: CFSE entrada / CMTMR entrada
La sangre también deben ser analizados con el fin de determinar si las dos poblaciones de células T están igualmente representados en la circulación, o si una población de células T es menor respecto a los otros (por ejemplo, por la captura preferencial en los pulmones / el hígado o por disminución de la viabilidad). Esto puede ocurrir cuando se comparan las células de memoria ingenua o T en reposo en comparación con hace poco activa las células T efectoras, ya que estos últimos podrían quedar atrapados en mayor medida en los pulmones. Si el HI en la sangre es significativamente diferente de 1, se puede normalizar la HI en los tejidos por la HI en la sangre. La sangre se puede obtener a través de punción cardíaca de los ratones anestesiados (con la eutanasia avertina o isofluorano antes) y deben ser lisadas dos veces con tampón ACK antes de usarlo para la tinción FACS.
Normalización de la sangre = HI tejido / HI sangre
5. Resultados representante
Ratones receptores (Thy1.1 +) fueron post euthanized18h la inyección de células. Las suspensiones celulares fueron generados a partir del bazo, los ganglios linfáticos periféricos (PLN), los ganglios linfáticos mesentéricos (MLN) y Propia pequeña lámina de intestino (LP). Después de que las células se tiñeron de Thy1.2 y CD8 y luego analizada por FACS de gating en viable Thy1.2 + células CD8 +, que fueron analizados por fin de la relación entre las células CMTMR + (trópico intestinal de células T) y la CFSE + las células (control de las células T) dividida por la relación de entrada. Los resultados se pueden visualizar como se muestra en la Figura 2, en el que se puede apreciar que el trópico intestino y el control de las células T alojados también en el bazo (HI cercano a 1, se indica con una línea roja). Por el contrario, trópico intestinal de células T emigraron alrededor de 10 veces más eficiente que el LP, en comparación con el control de las células T.
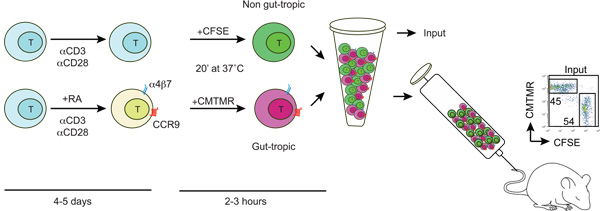
Figura 1:. Esquema de la generación y el etiquetado de los intestinos-trópico y no-gut células T trópico células T son aislados de los ratones de tipo salvaje y se activa con anti-CD3/anti-CD28 y en la presencia o ausencia de 100-200 nm todos - trans del ácido retinoico (RA). Después de 4-5 días la AR tratados con células T adquieren la expresión de receptores de intestino homing CCR9 y a4b7. Entonces, trópico intestino y el control de las células T son diferencialmente etiquetados con CFSE o CMTMR, lavado, mezclado en una proporción de 1:1 y se inyecta en un ratón receptor a través de la vena de la cola. Algunas células marcadas se utilizan para determinar la relación de entradas CFSE / CMTMR (debe ser cercano a 1).
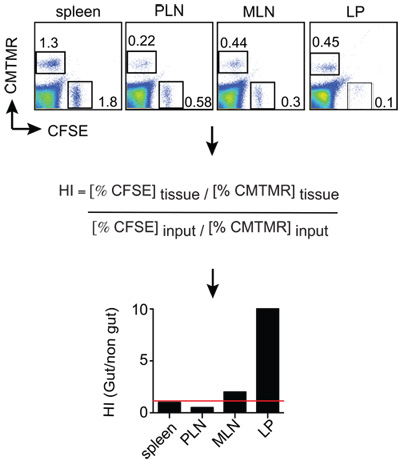
Figura 2:. Ratones Ejemplo de análisis de recalada analizado 12-18 h después de la inyección de células T y suspensiones de células individuales se obtienen de los órganos de interés. Las células se tiñeron con anti-Thy1.2 (marcador congenic), además de anti-CD8 y Thy1.2 + células T CD8 + se analizan para la relación de CMTMR + + y CFSE células en cada tejido por FACS. El tejido CMTMR / CFSE relaciones se normalizan por la entrada CMTMR / CFSE relación para obtener los índices de homing (HI). En este ejemplo CMTMR + y + CFSE células son intestino tropicales y control de las células efectoras T, respectivamente.
Discusión
A pesar de que los experimentos homing proporcionar información muy valiosa acerca de la migración de la población total de células en un tejido determinado, se debe tener en cuenta que estos ensayos no analizan directamente de adhesión endoteliales y por lo tanto no discriminar en qué etapa (s) de la adhesión de varios pasos cascada (tethering / móvil, activación o pegue) un determinado receptor homing está actuando. El estándar de oro para definir el papel específico de los receptores de homing en la casca...
Divulgaciones
Agradecimientos
EJV es apoyado por una beca de la enfermedad de Crohn s & Colitis Foundation of America (CCFA). JRM es apoyado por becas de CCFA, Cancer Research Institute (CRI), Howard H. Goodman (MGH), Massachusetts Life Science Center (MLSC) y Premio a la Innovación Nuevo director del NIH, s.
Materiales
Animales: ratones C57BL / 6 se utilizan para el aislamiento de células T. Además, CD45.1 y Thy1.1 cepas congenic están disponibles a través Jackson Laboratories (Bar Harbor, ME).
Los medios de cultivo: IMDM (medio modificado de Iscove Dulbecco + L-Glutamina + Hepes) más el 10% SFB inactivado por calor (bovino fetal endotoxina en suero, baja, Gibco ®, Invitrogen, Carlsbad, CA), complementado con 100 U / ml de penicilina, 100 mg / ml de estreptomicina (antibióticos HyClone, Waltham, MA), 0,5 mg / ml fungizone / anfotericina B (Gibco) y 50 mM b-mercaptoetanol.
ACK Glóbulos Rojos tampón de lisis (RBC, 10 mM KHCO3, 150 mM NH 4 Cl, 0,1 mM EDTA, pH 8,0), ajustar el pH a 7,2-7,4 y almacenar a temperatura ambiente).
PBS (tampón fosfato salino, Hyclone, Waltham, MA).
La citometría de flujo (FACS) los medios de comunicación (PBS o IMDM + 2% de SFB + 5 mM EDTA). Cuando la tinción con Selectina-Fc quimeras, los medios de comunicación con 2 mM de Ca + + se debe utilizar en todos los pasos (incluyendo la adquisición de FACS). IMDM se recomienda en este caso.
T etiquetado celular y la transferencia adoptiva: CFSE (diacetato carboxifluoresceína, succinimidil éster), CMTMR ((5 - (y-6 )-((( 4-clorometil) benzoilo) amino) tetrametilrodamina) de Molecular Probes ®, Invitrogen, Carlsbad, CA ). 1.000 acciones x debe hacerse en DMSO (5 CFSE mm, 20 mm CMTMR) y almacenados a -20 ° C.
La activación policlonal de células T: 24 y 96 o bien placas (cultivo de tejidos tratados, de poliestireno, de fondo plano con tapa, BD Falcon, Franklin Lakes, NJ) se incuban durante 2 horas a 37 ° C con 50 ml de PBS, respectivamente , que contiene anti-CD3 además de los anticuerpos anti-CD28 (10 mg / ml cada uno). A continuación, las placas de cultivo se lavan dos veces con PBS y se utiliza inmediatamente para el cultivo de células T. Por otra parte, Dynabeads recubiertas con anti-CD3/anti-CD28 (Dynal, Invitrogen, Carlsbad, CA) se puede utilizar para la activación de células T en lugar de obligado placa de anticuerpos.
Citometría de flujo (FACS) de tinción: la activación policlonal: CD3 (1452C11), CD28 (37.51). Lineage MAB: CD4 (L3T4), CD8a (Ly-2), Thy1.2 (CD90.2/53-1.2), CD45.2 (104). Gut-homing receptores: purificada CCR9 (CD199/eBioCW-1.2, eBioscience, San Diego, CA), a4b7 (LPAM-1/DATK3), control de isotipo (IgG2a, k). Homing la piel de los receptores: P-selectina-Fc (purificada ratón P-selectina - IgG proteína de fusión, BD Pharmingen, San Jose, CA), E-selectina Fc (E-Selectin/Fc ratón recombinante quimera, R & D Systems, Minneapolis, MN) más el correspondiente F secundario de cabra reactivo (ab ') 2 anti-IgG humana R-PE (Invitrogen, Carlsbad, CA).
El ácido trans-retinoico (Sigma, St. Louis, MO) se vuelve a suspender en etanol absoluto o DMSO con una bombilla de color amarillo o una fuente indirecta de la luz durante la preparación. Alícuotas de almacenar en frascos de vidrio a -80 ° C y protegido de la luz en todo momento. RAR-agonistas sintéticos: Am80 (Wako Chemicals, Richmond, VA).
Referencias
- Butcher, E. C. Leukocyte-endothelial cell recognition: Three (or more) steps to specificity and diversity. Cell. 67, 1033-1036 (1991).
- Springer, T. A. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell. 76, 301-314 (1994).
- Iwata, M. Retinoic acid imprints gut-homing specificity on T cells. Immunity. 21, 527-538 (2004).
- Mora, J. R. Reciprocal and dynamic control of CD8 T cell homing by dendritic cells from skin- and gut-associated lymphoid tissues. J Exp Med. 201, 303-316 (2005).
- Mora, J. R. Selective imprinting of gut-homing T cells by Peyer's patch dendritic cells. Nature. 424, 88-93 (2003).
- Mempel, T. R., Scimone, M. L., Mora, J. R., von Andrian, U. H. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr Opin Immunol. 16, 406-417 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados