È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Competitivo saggi Homing allo Studio Gut-tropico Migrazione cellulare T
In questo articolo
Riepilogo
Esperimenti di homing competitivo permettono di valutare direttamente le proprietà migratorie di due diverse popolazioni cellulari in un mouse. Qui illustrare questa procedura confrontando la migrazione di ex vivo generata gut-tropico rispetto a non-intestinali cellule T tropico.
Abstract
Al fine di esercitare la loro funzione di linfociti bisogno di lasciare il sangue e migrare in vari tessuti del corpo. Adesione dei linfociti alle cellule endoteliali e lo stravaso del tessuto è un processo a più fasi controllate da molecole di adesione diversi (recettori di homing) ha espresso sui linfociti e le loro rispettive ligandi (addressins) visualizzati sulle cellule endoteliali 1 2. Anche se la funzione di questi recettori di adesione può essere parzialmente studiati ex vivo, l'esame finale per la loro rilevanza fisiologica è quello di valutare il loro ruolo in vivo durante l'adesione e la migrazione dei linfociti. Due strategie complementari sono state utilizzate per questo scopo: microscopia intravitale (IVM) e gli esperimenti di homing. Anche se IVM è stato essenziale per definire il contributo preciso di recettori di adesione specifici durante la cascata adesione in tempo reale e in diversi tessuti, IVM richiede tempo e lavoro intensivo, spesso richiede lo sviluppo di sofisticate tecniche chirurgiche, ha bisogno di isolamento prima di omogenea popolazioni di cellule e permette l'analisi di un solo tessuto / organo in un dato momento. Al contrario, competitivo esperimenti di homing consentono il confronto diretto e simultaneo nella migrazione di due (o più) sottoinsiemi cellula lo stesso mouse e permettono anche l'analisi di molti tessuti e di un elevato numero di cellule nel medesimo esperimento.
Qui si descrive il classico protocollo di homing competitivo utilizzato per determinare il vantaggio / svantaggio di un tipo di cellula dato casa ai tessuti specifici rispetto ad una popolazione di cellule di controllo. Abbiamo scelto di illustrare le proprietà migratorie di gut-tropico rispetto a non gut-tropico cellule T, perché la mucosa intestinale è la superficie più grande corpo a contatto con l'ambiente esterno ed è anche l'olio extra-tessuto linfoide con il meglio definiti i requisiti migratori . Inoltre, un recente lavoro ha stabilito che la vitamina A metabolita acido all-trans retinoico (RA) è il principale meccanismo molecolare responsabile per indurre gut-specifici recettori di adesione (integrine recettori delle chemochine a4b7and CCR9) sui linfociti. Quindi, possiamo facilmente generare un gran numero di gut-tropico e non gut-tropico linfociti ex vivo, attivando le cellule T, in presenza o assenza di RA, rispettivamente, che possono essere finalmente utilizzati negli esperimenti di homing competitivo qui descritto.
Protocollo
1. Generazione ex vivo di cellule T gut-homing e di controllo (vedi Figura 1)
- Isolare splenociti da schiacciare uno milza di topi wild-type. Risospendere la sospensione le cellule in PBS e centrifugare per 5 'a 400 x g. Rimuovere il supernatante e lisare i globuli rossi da risospendere il pellet in 4 ml di tampone di lisi ACK per 2-3 minuti. Dopo di che, aggiungere 5 ml di PBS. Centrifugare per 5 'a 400 xg ed eliminare il surnatante.
- Risospendere splenociti totale a 1 x 10 6 / ml in IMDM + 10% FBS + 50 mM di 2-mercaptoetanolo + penicillina / streptomicina (IMDM completo). Separare le cellule in due gruppi, uno dei quali è integrato con AR (o sintetiche RAR-agonisti, come Am80 o Am580) ad una concentrazione finale di 100-200 nM 3. Cellule T attivate in presenza di RA o RAR-agonisti sarà upregulate a4b7and CCR9 e diventerà gut-tropico cellule T, mentre le cellule T attivate senza RA diventeranno cellule T di controllo.
- Aggiungere 1,5-2,0 mL di sospensione cellulare a ciascun pozzetto di una 24-pozzetti precedentemente rivestita con anti-CD3 (10 mg / ml) e anti-CD28 (10 mg / ml) e incubare a 37 ° C in 5% di CO 2 (per il rivestimento della piastra aggiungere 500 ml / pozzetto di anti-CD3, più anti-CD28 in PBS e incubare per 2 ore a 37 ˚ C e poi lavare due volte con 2 ml di PBS).
- Al fine di evitare eccesso di stimolazione delle cellule T, dopo 2-3 giorni il trasferimento delle sospensioni di cellule in una nuova patinata 24-pozzetti. Incubare per altri 2-3 giorni. A seconda della densità delle cellule e la proliferazione dei media potrebbe diventare acido (giallo), nel qual caso potrebbe essere necessario sostituire la metà della media con fresca IMDM completa. Raccogliere le cellule dopo 4-5 giorni (contando da giorno 0).
- Tipici rendimenti finali sono 1-2 x 10 6 cellule T effettrici / bene. Quindi, un minimo di 9-12 pozzi di ogni gut-tropico cellule T ed il controllo delle cellule T dovrebbe essere placcato per finire con 10-20 x 10 6 cellule T per condizione.
2. Analisi di gut-homing recettori su cellule T attivate
Dopo 4-5 giorni di coltura si dovrebbero osservare un'alta espressione di gut-homing a4b7and CCR9 recettori sulle cellule T attivate in presenza di agonisti RA o RAR, mentre il controllo delle cellule T dovrebbe esprimere livelli molto bassi di questi recettori 4.
Citometria a flusso (FACS) analisi.
- Raccogliere tra 0,2-0,5 x10 6 celle e centrifugare per 5 min a 300 g a 4 ° C.
- Incubare con anti-CD4-FITC, anti-a4b7-PE (BD Biosciences), anti-CCR9-APC (eBiosciences) e anti-CD8-PerCP per 15 minuti a 4 ° C al buio.
- Dopo l'incubazione, centrifugare per 5 min a 300 g 4 ° C. Lavare e risospendere le cellule in colorazione buffer e analizzare con il FACS.
3. T etichettatura cella con inseguitori cellula CFSE e CMTMR
- Tenere tutte le soluzioni a 37 ° C prima di iniziare. Lavare gut-tropico cellule T (a4b7 alta CCR9 alta) e il controllo delle cellule T (a4b7 Basso / Neg CCR9 Basso / Neg) due volte con PBS per rimuovere il siero. Regolare la concentrazione delle cellule T a 10-15 x 10 6 / ml in PBS.
- Aggiungi CFSE (Carboxyfluorescein succinimidile estere) o CMTMR (clorometil-benzoil-amino-tetrametilrodamina) fluorofori a uno gut-tropico T e il controllo delle cellule T ad una concentrazione finale di 5 mm e 10 mm, rispettivamente, dolcemente vortex e incubare per 20 minuti a 37 ° C. Si raccomanda di scambiare le labelings nello stesso o in un esperimento separato per escludere potenziali effetti intrinseci di fluorofori sulla migrazione delle cellule T.
- Dopo l'incubazione, spegnere con 1 volume di FBS e incubare per 1-5 minuti a temperatura ambiente. Diluire 10 volte con caldo PBS e centrifugare per 5 min a 300 g. Lavare due volte con PBS e risospendere in IMDM completo.
- Idealmente, 10-20 x 10 6 cellule di ogni popolazione T deve essere miscelato in rapporto 1:1 e poi centrifugato a 300 xg per 5 min. Infine, risospendere le cellule in 200-250 ml di PBS caldo e iniettare attraverso la vena della coda.
- Per calcolare il rapporto esatto di ingresso (idealmente prossimo a 1) salvare 5-10 ml di sospensione cellulare iniettato e diluire con 300 ml di PBS e analizzare con il FACS.
4. Analisi di homing delle cellule T
Anche se i topi possono essere analizzati in vari momenti (tra 1 ora e diversi giorni dopo l'iniezione di cellule T), homing di gut-tropico cellule T è meglio documentato tra 12-24 ore dopo l'iniezione. Punti di tempo più lungo aumentare i potenziali effetti di altre variabili che incidono sulla cella finale numeri / rapporti, come ad esempio l'apoptosi delle cellule T e cellule T uscita dal tessuto. Dopo i topi sono eutanasia, sospensioni cellulari da tessuti diversi devono essere isolati senza indugio al fine di diminuire la morte delle cellule, che potrebbero influire sul rendimento finale e risultati. I tessuti di interesse sono il piccolo intestino, colon, milza, linfonodi, placche di Peyer, fegato, polmoni e sangue. Se l'iniettate cellule T sono in buona fede gut-tropico cellule T, che dovrebbero a casa in media 5-10 volte migliore (o superiore) alla mucosa dell'intestino tenue rispetto al controllo delle cellule T. Tuttavia, altri tessuti, come il sangue e la milza, non dovrebbe mostrare una preferenziale la migrazione delle cellule T. Isolamento dei linfociti da lamina propria intestinale e il vano intraepiteliale è stato descritto in precedenza 5.
- Colorazione FACS: I campioni sono risospesi a seconda del numero di cellule raccolte, con una densità non superiore a 3,0 x 10 6 cellule / ml. Se congenic CD45.1 + o + Thy1.1 topi sono stati usati come destinatari, le cellule sono colorate con il marcatore corrispondente congenic (ad esempio, CD45.2 o Thy1.2) in combinazione con alcuni marker lignaggio (ad esempio, TCRbchain, CD4, CD8 , CD45.1 + / CD45.2 +).
- Durante l'analisi FACS, le cellule sono gated sul marcatore congenic (ad esempio CD45.1) e poi sui globi lineage specifici (ad esempio CD4/CD8) e analizzati per i rapporti tra CMTMR e cellule CFSE positivo.
- I dati sono di solito espressa come l'Indice di Homing (HI), che è calcolato come rapporto CFSE / CMTMR (o CMTMR / CFSE) in ogni tessuto divisa per il rapporto di ingresso corrispondente (vedi sotto). Se il rapporto di ingresso è molto vicino a 1, poi i rapporti tessuto sarà equivalente al HI.
HI = CFSE tessuto / tessuto CMTMR: CFSE ingresso / CMTMR ingresso
Il sangue dovrebbe essere analizzati al fine di determinare se le due popolazioni di cellule T sono ugualmente rappresentati in circolazione o se una popolazione di cellule T è diminuito rispetto agli altri (ad esempio, intrappolando preferenziale nei polmoni / fegato o con vitalità ridotta). Ciò può accadere quando si confrontano ingenuo o di riposo delle cellule T memoria rispetto recentemente attivato le cellule T effettrici, in quanto quest'ultimo potrebbe essere intrappolato in misura maggiore nei polmoni. Se il HI nel sangue è significativamente diverso da 1, si può normalizzare HI nei tessuti dalla HI nel sangue. Sangue può essere ottenuto tramite puntura cardiaca di topi anestetizzati (con l'eutanasia o Avertin isofluorane precedente) e devono essere lisate due volte con tampone ACK prima di utilizzarlo per la colorazione FACS.
Normalizzazione sangue = HI tessuto / HI Sangue
5. Rappresentante Risultati
Topi riceventi (Thy1.1 +) sono stati dopo l'iniezione euthanized18h cellulare. Sospensioni cellulari sono stati generati dalla milza, linfonodi periferici (PLN), linfonodi mesenterici (MLN) e piccola lamina propia intestino (LP). Dopo che le cellule sono state colorate per Thy1.2 e CD8 e poi analizzati da FACS di gating su valida Thy1.2 + cellule CD8 +, che sono stati infine analizzati per il rapporto tra le cellule CMTMR + (gut-tropico cellule T) e CFSE + cellule (controllo di cellule T) divisa per il rapporto di ingresso. I risultati possono essere visualizzati come mostrato nella Figura 2, in cui può essere apprezzato che gut-tropico e il controllo delle cellule T homed anche per la milza (HI vicino a 1, indicato con una linea rossa). Al contrario, gut-tropico cellule T migrate circa 10 volte più efficiente al LP rispetto al controllo delle cellule T.
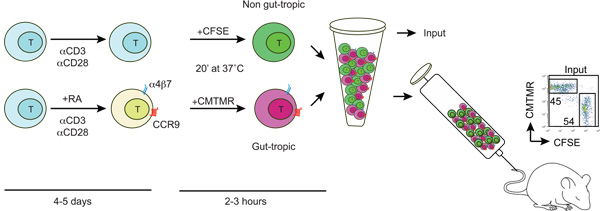
Figura 1:. Schema della generazione e l'etichettatura di gut-tropico e non-gut cellule T tropico cellule T sono isolate da topi wild-type e attivato con anti-CD3/anti-CD28 e in presenza o assenza di 100-200 nM tutti - trans retinoico (RA). Dopo 4-5 giorni AR trattati con cellule T acquisire l'espressione dei recettori di homing intestino CCR9 e a4b7. Poi, gut-tropico e il controllo delle cellule T sono etichettati in modo differenziale con CFSE o CMTMR, lavati, mescolati in rapporto 1:1 e iniettato in un topo destinatario attraverso la vena della coda. Alcune cellule marcate sono utilizzati per determinare il CFSE / CMTMR rapporto input (dovrebbe essere vicino a 1).
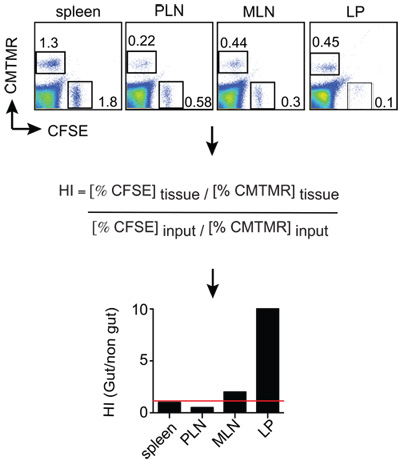
Figura 2:. Esempio di analisi homing topi analizzati 12-18 ore dopo l'iniezione di cellule T e le sospensioni singola cella sono ottenute dagli organi di interesse. Le cellule sono colorate con anti-Thy1.2 (marcatore congenic) più anti-CD8 + e poi Thy1.2 cellule T CD8 + vengono analizzati per il rapporto tra CMTMR CFSE + + e le cellule di ogni tessuto da FACS. Il CMTMR / CFSE rapporti tessuti vengono poi normalizzate dal rapporto input CMTMR / CFSE di ottenere gli indici di homing (HI). In questo esempio e + CMTMR CFSE cellule + sono gut-tropico e le cellule T effettrici controllo, rispettivamente.
Discussione
Anche se gli esperimenti di homing fornire informazioni molto importanti sulla migrazione di popolazioni di cellule totali in qualsiasi tessuto dato, va tenuto presente che questi test non direttamente analizzare l'adesione endoteliale e, pertanto, che non discriminino in cui passo (s) del adesione multistep cascata (tethering / a rotazione, l'attivazione o attaccare), un recettore dato homing agisce. Il gold standard per definire il ruolo specifico dei recettori di homing in cascata l'adesione è microscopi...
Divulgazioni
Riconoscimenti
EJV è sostenuto da una borsa di studio L's & colite di Crohn Foundation of America (CCFA). JRM è supportato anche da finanziamenti CCFA, Cancer Research Institute (CRI), Howard H. Goodman (MGH), Massachusetts Life Science Center (MLSC) e Innovator Award nuovo direttore del NIH s.
Materiali
Animali: topi C57BL / 6 sono comunemente usati per l'isolamento delle cellule T. Inoltre, CD45.1 e Thy1.1 ceppi congenic sono disponibili attraverso Jackson Laboratories (Bar Harbor, ME).
Cultura dei media: IMDM (Medium Iscove di modifica Dulbecco + L-Glutamina + Hepes) più 10% di siero FBS (Fetal Bovine Serum, endotossine basse, Gibco ®, Invitrogen, Carlsbad, CA) integrata con 100 U / ml di penicillina, 100 mg / ml di streptomicina (antibiotici Hyclone, Waltham, MA), 0,5 mg / ml Fungizone / amfotericina B (Gibco), e 50 mm b-mercaptoetanolo.
ACK Red Cell Lysis buffer di sangue (globuli rossi, 10 mM KHCO 3, 150 mM NH 4 Cl, 0,1 mM EDTA, pH 8,0), portato a pH 7,2-7,4 e conservare a temperatura ambiente).
PBS (Phosphate Buffered Saline, Hyclone, Waltham, MA).
Citometria a flusso (FACS), media (PBS o IMDM + 2% FBS + 5 mM EDTA). Quando colorazione utilizzando selectina-Fc chimere, mezzi di comunicazione con 2 mM Ca + + deve essere usato in tutte le misure (compresa l'acquisizione FACS). IMDM è raccomandato in questo caso.
Etichettatura delle cellule T e adottiva di trasferimento: CFSE (diacetato carboxyfluorescein, succinimidile estere), CMTMR ((5 - (e-6 )-((( 4-clorometil) benzoile) ammino) tetrametilrodamina) da Molecular Probes ®, Invitrogen, Carlsbad, CA ). 1000 x scorte dovrebbe essere effettuata in DMSO (5 CFSE mm, 20 mm CMTMR) e conservati a -20 ° C.
Policlonale attivazione delle cellule T: 24-bene o piastre a 96 pozzetti (tessuto-coltura trattata, polistirolo, a fondo piatto con coperchio, BD Falcon, Franklin Lakes, NJ) vengono incubate per 2 ore a 37 ° C con 50 ml di PBS, rispettivamente , contenente anti-CD3 più anticorpi anti-CD28 (10 mg / mL). Poi, piastre di coltura vengono lavate due volte con PBS e utilizzato immediatamente per la coltura delle cellule T. In alternativa, Dynabeads rivestito con anti-CD3/anti-CD28 (Dynal, Invitrogen, Carlsbad, CA) possono essere utilizzati per l'attivazione delle cellule T, invece di piatto legato anticorpi.
Citometria a flusso (FACS) colorazione: attivazione policlonali: CD3 (1452C11), CD28 (37,51). Lineage mAb: CD4 (L3T4), CD8a (Ly-2), Thy1.2 (CD90.2/53-1.2), CD45.2 (104). Gut-homing recettori: purificato CCR9 (CD199/eBioCW-1.2, eBioscience, San Diego, CA), a4b7 (LPAM-1/DATK3), isotipo di controllo (IgG2a, k). Skin-homing recettori: P-selectina-Fc (depurata del mouse P-selectina - proteina di fusione IgG, BD Pharmingen, San Jose, CA), E-selectina-Fc (E-Selectin/Fc mouse ricombinante Chimera, R & D Systems, Minneapolis, MN), più corrispondente secondaria F capra reagente (ab ') 2 anti-IgG umane R-PE (Invitrogen, Carlsbad, CA).
Acido all-trans retinoico (Sigma, St. Louis, MO) è risospeso in etanolo assoluto o DMSO utilizzando una lampadina gialla o una fonte indiretta di luce durante la preparazione. Aliquote Conservare in flaconi di vetro a -80 ° C e al riparo dalla luce in ogni momento. Sintetico RAR-agonisti: Am80 (Wako Chemicals, Richmond, VA).
Riferimenti
- Butcher, E. C. Leukocyte-endothelial cell recognition: Three (or more) steps to specificity and diversity. Cell. 67, 1033-1036 (1991).
- Springer, T. A. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell. 76, 301-314 (1994).
- Iwata, M. Retinoic acid imprints gut-homing specificity on T cells. Immunity. 21, 527-538 (2004).
- Mora, J. R. Reciprocal and dynamic control of CD8 T cell homing by dendritic cells from skin- and gut-associated lymphoid tissues. J Exp Med. 201, 303-316 (2005).
- Mora, J. R. Selective imprinting of gut-homing T cells by Peyer's patch dendritic cells. Nature. 424, 88-93 (2003).
- Mempel, T. R., Scimone, M. L., Mora, J. R., von Andrian, U. H. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr Opin Immunol. 16, 406-417 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon