このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
腸管指向性T細胞の移動を研究するために競争力のあるホーミングアッセイ
要約
競争力のあるホーミングの実験は、直接、単一のマウスの2つの異なる細胞集団の遊走特性を評価することができます。ここでは、生体外で生成された腸管指向性と非腸熱帯T細胞の遊走を比較することによって、この手順を示しています。
要約
それらの機能リンパ球を発揮するために血液を離れて、体内の異なる組織に移行する必要があります。内皮細胞と組織の溢出にリンパ球の接着は、リンパ球と内皮細胞1 2上に表示されるそれぞれのリガンド(アドレシン)に発現する別の接着分子によって制御される多段階プロセス(ホーミング受容体)である。これらの接着受容体の機能が部分的にex vivoで検討することができるにもかかわらず、それらの生理的関連性の究極のテストは、 生体内リンパ球の接着および遊走の中に自分の役割を評価することである。生体顕微鏡(IVM)とホーミングの実験:二つの補完的な戦略は、この目的のために使用されています。 IVMは、リアルタイムで、異なる組織の接着カスケード時に特定の接着受容体の正確な寄与を定義するために必要不可欠なってきていますが、IVMは時間がかかり、労働集約的であり、それはしばしば、高度な手術手技の開発を必要とする、それは均質の前の分離が必要細胞集団と、それは任意の時点で唯一の組織/臓器の分析を可能にします。これとは対照的に、競争力のあるホーミングの実験では、同じマウスの2つ(あるいはそれ以上)細胞サブセットの移行における直接的と同時比較が可能となり、彼らはまた、多くの組織のと同じ実験中の細胞の数が多いの分析を可能にする。
ここでは、コントロール細胞集団と比較して、特定の組織へホームへ所定の細胞型の利点/欠点を決定するために使用される古典的な競争力のあるホーミングプロトコルについて説明します。腸の粘膜が外部環境と接触する最大の身体の表面であり、それはまた最高の定義の渡り鳥要件を持つ追加のリンパ組織であるので、我々は、腸管指向性に対する腸管指向性以外のT細胞の遊走特性を説明するために選んだ。また、最近の研究では、ビタミンが代謝オールトランスレチノイン酸(RA)がリンパ球上に腸に特異的な接着受容体(インテグリンa4b7andのケモカイン受容体CCR9)を誘導に関与する主要分子機構であると判断しました。従って、我々は容易にようやくここで説明する競争力のあるホーミングの実験で使用することができる、それぞれ、RAの存在下または非存在下でT細胞を活性化することによって腸指向性とリンパ球腸管指向性非ex vivoでの多数を生成することができます。
プロトコル
腸管ホーミングと制御性T細胞(図1参照)1。 生体外での発生
- 野生型マウスから一脾臓を糖化により、脾細胞を分離します。 5'400 × gでのためにPBSと遠心で細胞懸濁液を懸濁します上清を除去し、2〜3分のためのACK溶解緩衝液を4 mlに細胞ペレットを再懸濁することにより赤血球を溶解する。その後、PBS 5 mlを加える。 400 xgで5'間遠心し上清を取り除く。
- 1 × 10 IMDM 6 / mLの+ 10%FBS + 50 mM 2 -メルカプトエタノール+ペニシリン/ストレプトマイシン(完全IMDM)で合計脾細胞を再懸濁します。 100から200 nMの3の最終濃度にRA(またはそのようなAm80やAm580などの合成RAR -アゴニスト、)を補足されそのうちの1つのグループ、セルを区切る。 RAまたはRAR -アゴニストの存在下で活性化T細胞はa4b7and CCR9を上方調節し、RAせずに活性化T細胞が制御性T細胞になるのに対し、腸管指向性T細胞になります。
- 以前に抗CD3(10 mg / ml)を、抗CD28(に10 mg / ml)でコートした24ウェルプレートの各ウェルに細胞懸濁液の1.5〜2.0 mlを加え37℃、5%COで2は、(コーティング用プレートは、500ミリリットル/ウェルの抗CD3プラス37℃で2時間PBSとインキュベートにおける抗CD28を追加˚Cと後、2 mlのPBSで2回洗浄)。
- T細胞の過剰な刺激を避けるために、2〜3日後に新しいコーティングされていない24ウェルプレートに細胞懸濁液を移す。さらに2〜3日間インキュベートする。細胞密度と増殖に応じてメディアは、それが新鮮な完全IMDMとメディアの半分を交換する必要があるかもしれない、その場合には酸(黄色)、になる可能性があります。 4-5日(0日目から数えて)の後に細胞を収集する。
- 典型的な最終的な収量は1〜2 × /ウェル10 6エフェクターT細胞である。したがって、各腸指向性T細胞と制御性T細胞の9月12日のウェルの最小値は、条件ごとに10から20 × 10 6 T細胞で終わるためにメッキをしてください。
2。活性化T細胞上腸ホーミング受容体の解析
制御性T細胞はこれらの受容体4の非常に低いレベルで発現してください一方、文化の4-5日後に我々は、RAまたはRARアゴニストの存在下で活性化T細胞上の腸管ホーミング受容体a4b7and CCR9の高発現を観察する必要があります。
フローサイトメトリー(FACS)分析。
- 4℃で300gで5分間、0.2〜0.5 × 10 6個の細胞および遠心の間に収集℃の
- 抗CD4 - FITC、抗a4b7 - PE(BD Biosciences社)、4℃で15分間暗所でのための抗CCR9 - APC(eBiosciences)および抗- CD8 - PerCPでインキュベートする。
- インキュベーション後、300 G 4℃で5分間のために遠心分離洗って再懸濁細胞を染色バッファーでとFACSにより解析する。
3。 CFSEとCMTMR細胞トラッカーを持つT細胞のラベリング
- 37すべてのソリューションを保持° Cを開始する前に。血清を除去するためにPBSで2回腸指向性T細胞(a4b7 ハイ CCR9 高 )と制御性T細胞(a4b7 ロー/負 CCR9 ロー/ NEG)洗う。 10月15日× 10 6 / PBS中にT細胞の濃度を調整します。
- で穏やかにボルテックスし、20分間インキュベート、それぞれ5 mMおよび10mMの最終濃度に腸内指向性Tと制御性T細胞のいずれかにCFSE(カルボキシフルオレセインスクシンイミジルエステル)またはCMTMR(クロロメチル - ベンゾイル - アミノ - テトラメチルローダミン)フルオロフォアを追加37℃それは、T細胞遊走に対する蛍光物質の潜在的な本質的な影響を除外するために、同じまたは別の実験でラベリングを交換することをお勧めします。
- インキュベーション後、室温で1〜5分間、FBSとインキュベートの1ボリュームで急冷。温かいPBSで10倍に希釈し、300 gで5分間遠心操作完全IMDMにPBSに懸濁するで2回洗浄。
- 理想的には、各Tの人口の10-20 × 10 6細胞を1:1の割合で混合し、5分間、300 × gで遠心してください。最後に、温かいPBSの200から250 mLで細胞を再懸濁し、尾静脈を介して注入する。
- 正確な入力の比を(理想的に1に近い)注入さ細胞懸濁液5〜10 mLを保存し、希釈PBS 300mLでとFACSによって分析する計算に。
4。ホーミング性T細胞の解析
マウスは様々な時点で(1時間と数日の後のT細胞の注入の間)で分析することができますが、腸管指向性T細胞のホーミングは、最高の12から24時間後の注射の間で文書化されています。長い時間点は、このようなT細胞のアポトーシスと組織からT細胞の出口としての最終的な細胞数/比率を、影響を与える他の変数の影響の可能性を増加させる。マウスは安楽死された後、いくつかの組織からの細胞懸濁液は、最終的な収量と結果に影響を与える可能性が細胞死を、減少させるために遅滞なく分離されている必要があります。興味のある組織は、小腸、大腸、脾臓、リンパ節、パイエル板、肝臓、肺と血液です。場合注入されたT細胞は正真正銘の腸管指向性T細胞であり、これらはT細胞を制御するために比較して、小腸の粘膜に平均5〜10倍向上(またはそれ以降)上のホームすべき。しかし、そのような血液や脾臓などの他の組織は、優先的T細胞の遊走を示さないではありません。腸管粘膜固有層および上皮内コンパートメントからリンパ球の単離は、以前は次の5を記載されている。
- FACSは、染色:試料は3.0 × 10 6細胞/ ml以上ない高い密度で、採取した細胞の数に応じて再懸濁する。もしコンジェニックCD45.1 +またはThy1.1 +マウスをレシピエントとして使用された、細胞はいくつかの系統のマーカー(例えば、TCRbchain、CD4、CD8との組み合わせに対応するコンジェニックマーカー(例えば、CD45.2またはThy1.2)に染色されています、CD45.1 + / CD45.2 +)。
- FACS分析の間、細胞はコンジェニックマーカー(例えばCD45.1)上にしてから、特定の系統マーカー(例えば、CD4/CD8)にゲートとCMTMRとCFSE陽性細胞の比率が分析されます。
- データは通常、対応する入力の比率(下記参照)で割った、各組織の比のCFSE / CMTMR(またはCMTMR / CFSE)として計算されるホーミング指数(HI)、として表される。入力の比が1に非常に近い場合には、組織率は、HIと同じになります。
HI = CFSEの組織 / CMTMR 組織 :CFSEの入力 / CMTMR 入力
血はまた、両方のT細胞集団が均等に循環で表現されている、または1つのT細胞集団が互いに対して(例えば、肺/肝臓や生存率低下による優先トラップによって)減少している場合かどうかを決定するために分析する必要があります。後者は肺に大きい程度にトラップされる可能性がありますので、ナイーブまたは安静時のメモリーT細胞と、最近活性化エフェクターT細胞を比較するときに発生する可能性があります。血液中のHIが1よりも大幅に異なる場合、人は血液中のHIによって組織の中にHI正規化することができます。血液は、麻酔したマウスから心臓穿刺によって得られることができる(AVERTINまたはイソフルラン前に安楽死を含む)及びFACS染色に使用する前に、ACK緩衝液で2回溶解されるべきである。
血液の正常化= HIの組織 / HI ブラッド
5。代表的な結果
レシピエントマウス(Thy1.1 +)は euthanized18hポスト細胞注入した。細胞懸濁液は、脾臓、末梢リンパ節(PLN)、腸間膜リンパ節(MLN)と小腸の粘膜のpropia(LP)から生成されました。細胞は、Thy1.2とCD8を染色し、最終的にCMTMR +細胞(腸指向性T細胞)とCFSEの比率を分析した現実的なThy1.2 + CD8 +細胞、上にゲートでFACSにより解析したそのあと+入力の比で割った細胞(制御性T細胞)。結果は、それが腸指向性と制御性T細胞が均等に脾臓(HI赤線で示されている、TO1を閉じる)をホームとすることが理解できるような、 図2に示すように、表示することができます。 T細胞の制御に比べて対照的に、腸内指向性T細胞はLPに、より効率的に10倍の周りに移行。
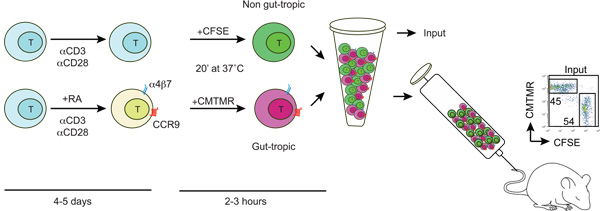
図1:。腸指向性と非腸熱帯のT細胞の生成とラベルを示す T細胞は野生型マウスから単離されたとanti-CD3/anti-CD28とし、100〜200 nMのすべての存在下または非存在下で活性化されている図 - トランスレチノイン酸(RA)。 4-5日後にRAで処理したT細胞は腸管ホーミング受容体CCR9とa4b7の表現を取得する。その後、腸指向性と制御性T細胞は、差動1:1の割合で混合し、尾静脈を介してレシピエントマウスに注入、洗浄し、CFSEまたはCMTMRで標識されています。いくつかの標識された細胞をCFSE / CMTMR入力の比を(1に近いはず)を決定するために使用されています。
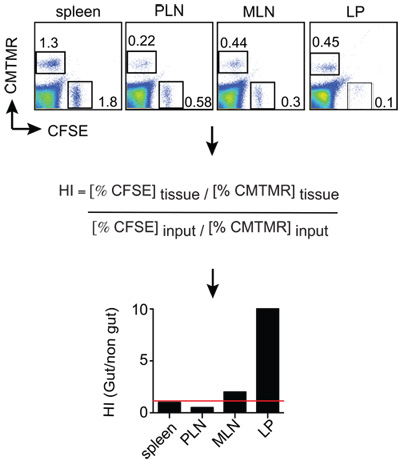
図2:。ホーミング分析の例マウスは、12から18時間後にT細胞の注入と、単一の細胞懸濁液が関心の器官から得られる分析した。細胞は抗Thy1.2(コンジェニックマーカー)+抗CD8し、Thy1.2で染色されています+ CD8 + T細胞はCMTMRの+とCFSE + FACSによって各組織中の細胞の割合について分析する。組織CMTMR / CFSE比は、ホーミングインデックスを(HI)を取得するために入力CMTMR / CFSE比で正規化されます。この例ではCMTMRの+とCFSE +細胞はそれぞれ、腸指向性と制御エフェクターT細胞である。
ディスカッション
ホーミングの実験は、任意の組織の全細胞集団の移行についての非常に貴重な情報を提供していても、それはこれらのアッセイは、直接血管内皮の接着性を分析していないため、多段階の接着性の中のステップ(複数可)を区別しないことを心に留めておく必要がありますカスケード(ローリング/テザリング、活性化または付着)所定のホーミング受容体が機能しています。接着カスケード...
開示事項
謝辞
EJVは、アメリカのクローン病S&大腸炎財団(CCFA)のフェローシップでサポートされています。 JRMはCCFA、がん研究所(CRI)、ハワードH.グッドマン(MGH)、マサチューセッツ州ライフサイエンスセンター(MLSC)とNIHのディレクターの新イノベーター賞からの補助金によってサポートされています。
資料
動物:C57BL / 6マウスは、一般的にT細胞の単離に使用されています。さらに、CD45.1とThy1.1コンジェニック系統は、ジャクソン研究所(バーハーバー、ME)を介して使用できます。
文化メディア:IMDM(イスコフ改変ダルベッコ培地+ L -グルタミン+ HEPES)を加えた10% 熱不活性 100 U / mlペニシリンを添加したFBS(ウシ胎児血清、低エンドトキシン、GIBCO ®、Invitrogen社、カールスバッド、カリフォルニア州)、100 mgの/ mlのストレプトマイシン(HyCloneの抗生物質、ウォルサム、MA)、0.5 mg / mlのfungizone /アンホテリシンB(Gibco社)、および50mMのβ-メルカプトエタノール。
ACK赤血球溶解バッファー (RBC、10mMのKHCO 3、150mMのNH 4 Clを、0.1mMのEDTA、pHは8.0)、室温でpHを7.2から7.4とストアに調整します)。
PBS(リン酸生理食塩水、Hyclone、ウォルサム、マサチューセッツバッファ)。
フローサイトメトリー(FACS)メディア (PBSまたはIMDM + 2%FBS + 5mMのEDTA)。セレクチン- Fcをキメラを用いて染色する場合、2 mMのカルシウムを持つメディアは+ +のすべてのステップ(FACSの買収を含む)で使用する必要があります。 IMDMはこのケースで推奨されます。
T細胞標識と養子移入:CFSE(カルボキシフルオレセインジアセテート、スクシンイミジルエステル)、CMTMR -分子プローブ®、Invitrogen社、カールスバッド、カリフォルニア州から((5(および6 )-((( 4 -クロロメチル)ベンゾイル)アミノ)テトラメチルローダミン) )。 1000 ×株をDMSOに作ら(5mMのCFSE、20mMのCMTMR)と-20℃で保存してください。
ポリクローナルT細胞の活性化 :24ウェルまたは96ウェルプレート(組織培養処理された、蓋付き平底ポリスチレン、、BDファルコン、フランクリンレイクス、ニュージャージー州)は、℃で50 mlのPBS、それぞれ37℃で2時間インキュベートする、抗CD3 +抗CD28抗体(10 mg / mLの各)を含む。その後、培養プレートをPBSで2回洗浄し、T細胞培養のためにすぐに使用。また、anti-CD3/anti-CD28(DYNAL、Invitrogen社、カールスバッド、カリフォルニア州)で被覆されたダイナビーズは、代わりにプレート結合抗体のT細胞活性化のために使用することができます。
フローサイトメトリー(FACS)染色:ポリクローナル活性化:CD3(1452C11)、CD28(37.51)。リネージュモノクローナル抗体:CD4(L3T4)、CD8a(LY - 2)、Thy1.2(CD90.2/53-1.2)、CD45.2(104)。腸管ホーミング受容体:精製CCR9(CD199/eBioCW-1.2、eBioscience社、サンディエゴ、CA)、a4b7(LPAM-1/DATK3)、アイソタイプコントロール (IgG2aの、K)。皮膚ホーミングレセプター:P -セレクチン- Fcの (精製マウスP -セレクチン- IgGの融合蛋白質、BD Pharmingen社、サンノゼ、カリフォルニア州)、E -セレクチン- Fcの (組換えマウスのE-Selectin/Fcキメラ、R&Dシステムズ、ミネアポリス、ミネソタ州)に加えて、対応する二次試薬ヤギF(ab')2の抗ヒトIgG R - PE(Invitrogen社、カールスバッド、カリフォルニア州)。
全トランスレチノイン酸(シグマ社、セントルイス、MO)準備中に黄色の電球や光の間接的なソースを使用して無水エタノールやDMSOに再懸濁する。 -80℃のガラスバイアルに保管してアリコート° Cとすべての回で光から保護。合成RAR -アゴニスト:Am80(和光ケミカル、リッチモンド、バージニア州)。
参考文献
- Butcher, E. C. Leukocyte-endothelial cell recognition: Three (or more) steps to specificity and diversity. Cell. 67, 1033-1036 (1991).
- Springer, T. A. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell. 76, 301-314 (1994).
- Iwata, M. Retinoic acid imprints gut-homing specificity on T cells. Immunity. 21, 527-538 (2004).
- Mora, J. R. Reciprocal and dynamic control of CD8 T cell homing by dendritic cells from skin- and gut-associated lymphoid tissues. J Exp Med. 201, 303-316 (2005).
- Mora, J. R. Selective imprinting of gut-homing T cells by Peyer's patch dendritic cells. Nature. 424, 88-93 (2003).
- Mempel, T. R., Scimone, M. L., Mora, J. R., von Andrian, U. H. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr Opin Immunol. 16, 406-417 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved