Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Конкурентные Homing Анализы по изучению тропических Гут-Т-клеток миграции
В этой статье
Резюме
Конкурентные самонаведения эксперименты позволяют непосредственно оценки миграционных свойства двух различных клеточных популяций в одной мыши. Здесь мы проиллюстрируем эту процедуру путем сравнения миграции бывших естественных генерируемых кишки тропических против не-клетках кишечника тропических T.
Аннотация
Для того, чтобы осуществлять свои функции лимфоцитов нужно выходить из крови и мигрировать в различные ткани в организме. Лимфоцитов адгезией к эндотелиальных клеток и тканей экстравазации это многоэтапный процесс контролируется различных молекул адгезии (самонаведения рецепторы), выраженные на лимфоциты и их лигандами (addressins), представленные на эндотелиальные клетки 1 2. Хотя функция этих рецепторов адгезии может быть частично изучен бывших естественных условиях, конечным критерием для их физиологическое значение заключается в оценке их роли в процессе в естественных лимфоцитов адгезии и миграции. Два дополнительных стратегии были использованы для этой цели: прижизненной микроскопии (IVM) и самонаводящиеся экспериментов. Хотя IVM было важно определить точный вклад специфические рецепторы адгезии во время адгезии каскада в режиме реального времени и в различных тканях, IVM это много времени и трудоемкий, он часто требует разработки сложных хирургических методов, необходимо предварительное выделение однородных клеточных популяций и позволяет анализ только одной ткани / органа в любой момент времени. В отличие от конкурентных самонаведения экспериментов позволяют прямой и одновременного сравнения в миграции из двух (или даже больше) ячейки подмножеств в той же мыши, и они также позволяют анализа многих тканей и большое количество клеток в одном эксперименте.
Здесь мы опишем классической конкурентной самонаведения протокол, используемый для определения преимуществ / недостатков данного типа клеток на главную конкретных тканей по сравнению с популяцией клеток контроля. Мы выбрали для иллюстрации миграционных свойств кишки по сравнению с тропическими без кишки тропических Т-клеток, так как слизистая оболочка кишечника является крупнейшим поверхности тела в контакте с внешней средой, и это также экстра-лимфоидной ткани с лучшими определенные миграционные требования . Кроме того, недавние работы установили, что витамин метаболит полностью транс-ретиноевой кислоты (РА) является основной молекулярный механизм, ответственный за склонение кишки специфическую адгезию рецепторов (интегрин a4b7and хемокинов рецептор CCR9) на лимфоцитах. Таким образом, можно легко генерировать большое количество кишки тропических и не тропических кишки лимфоциты исключая виво путем активации Т-клеток в присутствии или отсутствии РА, соответственно, может быть, наконец, используемые в конкурентной самонаведения экспериментах, описанных здесь.
протокол
1. Ex естественных поколения кишки самонаведения и управления Т-клеток (см. рисунок 1)
- Изолировать от спленоцитов затирания один из селезенки мышей дикого типа. Ресуспендируют клетки суспензии в PBS и центрифуги для 5 'при 400 х г. Удалить супернатант и лизировать эритроциты крови ресуспендированием осадок клеток в 4 мл ACK буфера для лизиса в течение 2-3 минут. После этого, добавьте 5 мл PBS. Центрифуга для 5 'при 400 мкг и удалите супернатант.
- Ресуспендируют общего спленоцитов на 1 х 10 6 / мл в IMDM + 10% FBS + 50 мМ 2-меркаптоэтанол + пенициллина / стрептомицина (полное IMDM). Отдельные клетки на две группы, одна из которых дополняется РА (или синтетические RAR-агонисты, такие как Am80 или Am580) до конечной концентрации 100-200 нм 3. Т-клетки активируются в присутствии РА или RAR-агонистов будет upregulate a4b7and CCR9 и станет кишки тропических Т-клетки, в то время как Т-клетки активируются без РА станут контрольными клетками T.
- Добавить 1.5-2.0 мл клеточной суспензии в каждую лунку 24-луночного планшета ранее покрытых анти-CD3 (10 мг / мл) и анти-CD28 (10 мг / мл) и инкубируют при 37 ° С в 5% CO 2 (для покрытия пластин добавить 500 мл / лунку анти-CD3 плюс анти-CD28 в ФБР и инкубировать в течение 2 часов при температуре 37 ˚ С и затем промыть в два раза с 2 мл PBS).
- Для того чтобы избежать перевозбуждения T клетки, через 2-3 дня передачи клеточных суспензий в новую без покрытия 24-луночного планшета. Инкубировать дополнительные 2-3 дня. В зависимости от плотности и пролиферации клеток СМИ может стать кислоты (желтый), и в этом случае может быть необходимо заменить половину средств массовой информации со свежими полный IMDM. Урожай клеток после 4-5 дней (считая с первого дня 0).
- Типичные окончательный урожай 1-2 х 10 6 эффекторных Т-клеток / лунку. Таким образом, минимум 9-12 скважин каждого кишки тропических Т-клеток и контроль Т-клетки должны быть покрыты для того, чтобы в конечном итоге с 10-20 х 10 6 Т-клеток в состоянии.
2. Анализ кишки самонаведения рецепторы на активированных Т-клеток
После 4-5 дней культуры мы должны соблюдать высокий уровень экспрессии кишки самонаведения рецепторов a4b7and CCR9 на Т-клетки активируются в присутствии РА или RAR агонисты, в то время как контроль Т-клетки должны выразить очень низкий уровень этих рецепторов 4.
Проточная цитометрия (FACS) анализа.
- Сбор между 0,2-0,5 x10 6 клеток и центрифуги в течение 5 мин при 300 г при 4 ° C.
- Инкубируйте с анти-CD4-FITC, анти-a4b7-PE (BD Biosciences), анти-CCR9 АПК (eBiosciences) и анти-CD8-PercP в течение 15 мин при 4 ° С в темноте.
- После инкубации, центрифуги в течение 5 мин при 300 г 4 ° C. Вымойте и ресуспендирования клеток в окрашивании буфера и анализировать по СУИМ.
3. Т-клеток маркировки с трекеров CFSE и CMTMR ячейки
- Держите все решения при температуре 37 ° C, прежде чем начать. Вымойте кишки тропических Т-клеток (a4b7 Высокая CCR9 Высокий) и контроль Т-клеток (a4b7 Низкий / Neg CCR9 Низкий / Neg) два раза PBS для удаления сыворотки. Отрегулируйте Т концентрация клеток до 10-15 х 10 6 / мл в PBS.
- Добавить CFSE (карбоксифлуоресцеина сукцинимидил эфир) или CMTMR (хлорметил-бензоил-амино-tetramethylrhodamine) флуорофоров либо кишки тропических Т и контроль Т-клеток в конечной концентрации 5 мм и 10 мм соответственно, мягко вихря и инкубировать 20 мин при 37 ° C. Рекомендуется, чтобы поменять маркировок в том же или в отдельном эксперименте, чтобы исключить потенциальные внутренние эффекты флуорофоров по миграции Т-клеток.
- После инкубации, утолить с 1 объемом FBS и выдержать в течение 1-5 мин при комнатной температуре. Развести в 10 раз теплой PBS и центрифуги в течение 5 мин при 300 g. Промыть два раза PBS и ресуспендируют в полной IMDM.
- В идеале, 10-20 х 10 6 клеток каждой популяции Т следует смешать в соотношении 1:1, а затем центрифугировали при 300 мкг в течение 5 мин. Наконец, ресуспендирования клеток в 200-250 мл теплой PBS и вводят через хвостовую вену.
- Чтобы вычислить точное соотношение вход (в идеале близок к 1) сохранить 5-10 мл клеточной суспензии вводили и разводят 300 мл ФСБ и анализировать по СУИМ.
4. Анализ Т-клеток самонаведения
Хотя мыши могут быть проанализированы в различных точках времени (от 1 часа до нескольких дней после инъекции клеток T), самонаводящихся кишечника-тропных Т-клетки лучше документально между 12-24 ч после инъекции. Более моменты времени рост потенциального влияния других факторов, влияющих на окончательный числа клеток / коэффициенты, такие как Т апоптоз клеток и T выхода клеток из ткани. После мышей эвтаназии, клеточные суспензии из нескольких тканей должны быть изолированы без промедления, чтобы уменьшить гибель клеток, которые могут повлиять на конечный урожай и результаты. Ткани, представляющих интерес, тонкой кишки, толстой кишки, селезенки, лимфатических узлов, патчи Пейера, печени, легких и крови. Есливводили Т-клетки являются добросовестными кишки тропических Т-клетки, то они должны дома в среднем в 5-10 раз лучше (или выше) слизистой оболочки тонкой кишки по сравнению с контролем Т-клеток. Однако в других тканях, таких как кровь и селезенки, не должны показывать льготных миграции Т-клеток. Выделение лимфоцитов из кишечной собственная пластинка и интраэпителиальной отсеке было описано ранее 5.
- FACS окрашивания: Образцы ресуспендируют в зависимости от количества клеток собирается, при плотности не превышает 3,0 х 10 6 клеток / мл. Если congenic CD45.1 + или + Thy1.1 мышей были использованы в качестве получателей, клетки окрашивали соответствующие congenic маркер (например, CD45.2 или Thy1.2) в сочетании с некоторой линии маркера (например, TCRbchain, CD4, CD8 , CD45.1 + / CD45.2 +).
- В ходе анализа FACS, клетки закрытого на congenic маркер (например CD45.1), а затем на специфические маркеры линии (например, CD4/CD8) и проанализированы для отношений между CMTMR и CFSE положительных клеток.
- Данных, как правило, выражается в виде индекса самонаведения (HI), который рассчитывается как соотношение CFSE / CMTMR (или CMTMR / CFSE) в каждой ткани, деленное на соответствующее отношение вход (см. ниже). Если входной коэффициент очень близок к 1, то ткань отношений будет эквивалентна HI.
HI = CFSE ткани / CMTMR ткани: CFSE ввода / CMTMR вход
Кровь также должны быть проанализированы, чтобы определить, является ли как Т клеточных популяций в равной степени представлены в обращении, или если один Т-клеточной популяции снижается по отношению к другим (например, путем льготного захвата в легких / печени или снижением жизнеспособности). Это может произойти при сравнении наивным или отдыха Т-клеток памяти в сравнении с недавно активированных эффекторных Т-клеток, так как последняя может оказаться в ловушке в большей степени, в легких. Если HI в крови значительно отличается от 1, можно нормализовать HI в тканях HI в крови. Кровь может быть получена с помощью пункции сердца у мышей под наркозом (с авэртин или isofluorane до эвтаназии) и должна быть в два раза лизировали с ACK буфера перед его использованием для окрашивания СУИМ.
Кровь нормализации = HI ткани / HI крови
5. Представитель Результаты
Мыши-реципиенты (Thy1.1 +) были euthanized18h сообщение инъекции клеток. Суспензии клеток были получены из селезенки, периферических лимфатических узлов (PLN), брыжеечных лимфатических узлов (МЛН) и малых propia пластинки кишечника (LP). После этого клетки были окрашены для Thy1.2 и CD8, а затем анализируют FACS по литниковой на жизнеспособные Thy1.2 + CD8 + клеток, которые в итоге были проанализированы на соотношение между CMTMR + клетки (кишечник-тропных Т-клетки) и CFSE + клеток (контроль Т-клетки), разделенное на входной коэффициент. Результаты могут быть представлены как показано на рисунке 2, в которой он может быть понятно, что кишка-тропных и управления сетевыми Т-клеток в равной степени селезенки (HI близко ТО1, обозначается красной линией). В отличие от этого, кишечник-тропных Т-клетки мигрировали в 10 раз более эффективно, чтобы LP по сравнению с контролем Т-клеток.
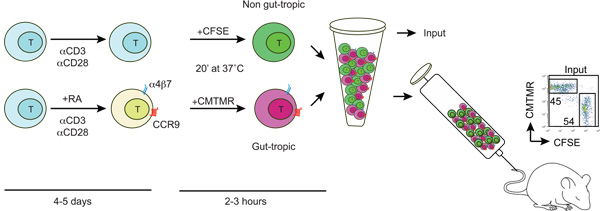
Рисунок 1. Схема поколения и маркировки кишки тропических и не-клетках кишечника тропических Т Т-клетки, изолированные от мышей дикого типа и активированный с anti-CD3/anti-CD28 и в присутствии или отсутствии 100-200 нМ все - транс-ретиноевой кислоты (РА). После 4-5 дней лечения РА-Т-клетки приобретают выражение кишки самонаведения рецепторов CCR9 и a4b7. Затем кишки тропических и контроль Т-клетки являются дифференциально помечены CFSE или CMTMR, промывают, смешанных в соотношении 1:1 и вводят получателя мышь через хвостовую вену. Некоторые меченых клеток используются для определения CFSE / CMTMR вход отношение (должна быть близка к 1).
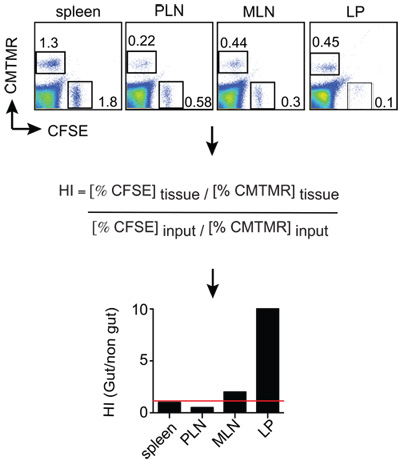
Figure2. Пример самонаведения анализ Мыши проанализированы 12-18 часов после инъекции Т клетки и клеточные суспензии одного получены от органов, представляющих интерес. Клетки окрашивали анти-Thy1.2 (congenic маркер), а также анти-CD8, а затем Thy1.2 + CD8 + Т-клеток, анализируются для отношения CMTMR + и CFSE + клеток в каждой ткани СУИМ. Ткани CMTMR / CFSE соотношения затем нормированы Входной CMTMR / CFSE соотношение получить самонаведения индексов (HI). В этом примере + CMTMR и CFSE + клетки кишечника-тропных и контроля эффекторных Т-клеток, соответственно.
Обсуждение
Хотя самонаведения эксперименты дают очень ценную информацию о миграции от общего числа клеточных популяций в той или иной ткани, следует иметь в виду, что эти тесты не непосредственно анализировать эндотелиальной адгезии и, следовательно, не являлись дискриминационными по какой эта?...
Раскрытие информации
Благодарности
EJV поддерживается стипендий, начиная с Крона и колит фонда Америки (CCFA). JRM поддерживается грантами CCFA, Рак-исследовательский институт (CRI), Говард Х. Гудман (MGH), штат Массачусетс Life Science Center (MLSC) и Нью-премии Новатор NIH директора с.
Материалы
Животные: C57BL / 6 мышей обычно используются для изоляции Т-клеток. Кроме того, CD45.1 и Thy1.1 congenic штаммов доступны через Джексон Laboratories (Bar Harbor, ME).
Культура СМИ: IMDM (Medium Искова изменения Дульбеко + L-глютамин + Hepes) плюс 10% тепла инактивированной FBS (эмбриональной телячьей сыворотки, низким эндотоксин, Gibco ®, Invitrogen, Карлсбад, Калифорния) с добавлением 100 ЕД / мл пенициллина, 100 мг / мл стрептомицина (Hyclone Антибиотики, Waltham, MA), 0,5 мг / мл Fungizone / амфотерицина В (Gibco) и 50 мм б-меркаптоэтанола.
ACK эритроцитов Лизис буфер (РБК, 10 мМ KHCO 3, 150 мМ NH 4 Cl, 0,1 мМ ЭДТА, рН 8,0), настроить до рН 7,2-7,4 и хранят при комнатной температуре).
PBS (фосфатно-солевым буфером, Hyclone, Waltham, MA).
Проточная цитометрия (FACS) СМИ (PBS или IMDM + 2% ЭТС + 5 мМ ЭДТА). При окрашивании использованием селектина-Fc химеры, средств массовой информации с 2 мМ Ca + + должен быть использован на всех этапах (в том числе приобретение FACS). IMDM рекомендуется в данном случае.
Т маркировки клеток и приемных перевода: CFSE (карбоксифлуоресцеина диацетат сукцинимидил эфир), CMTMR ((5 - (а-6 )-((( 4-хлорметил) бензоил) амино) tetramethylrhodamine) из молекулярных проб ®, Invitrogen, Карлсбад, Калифорния ). 1000 х запасы должны быть сделаны в ДМСО (5 мМ CFSE, 20 мМ CMTMR) и хранили при температуре -20 ° C.
Поликлональные Т-клеточной активации: 24-и или 96-луночных планшетах (ткань-культура рассматривается, полистирол, с плоским дном с крышкой, BD Falcon, Франклин озер, NJ) инкубируют в течение 2 часов при 37 ° С с 50 мл PBS, соответственно , содержащие анти-CD3 плюс анти-CD28 антител (10 мг / мл каждая). Затем, культуры пластины дважды промывают PBS и использовать сразу по культуре Т-клеток. Кроме того, Dynabeads покрытые anti-CD3/anti-CD28 (Dynal, Invitrogen, Карлсбад, Калифорния) может быть использован для активации Т-клеток, а не пластины-связанных антител.
Проточная цитометрия (FACS) окрашивания: Поликлональные активации: CD3 (1452C11), CD28 (37,51). Lineage мАт: CD4 (L3T4), CD8a (Ли-2), Thy1.2 (CD90.2/53-1.2), CD45.2 (104). Gut-самонаведения рецепторов: очищенная CCR9 (CD199/eBioCW-1.2, eBioscience, Сан-Диего, Калифорния), a4b7 (LPAM-1/DATK3), изотипа контроля (IgG2a, к). Кожа самонаведения рецепторов: P-селектина-Fc (очищенная Мышь P-селектина - IgG гибридный белок, BD Pharmingen, Сан-Хосе, Калифорния), Е-селектина-Fc (рекомбинантный E-Selectin/Fc Мышь Химера, R & D Systems, Minneapolis, М. Н.), а также соответствующего вторичного F козу реагента (аЬ ') 2 анти-человеческий IgG R-PE (Invitrogen, Карлсбад, Калифорния).
All-транс-ретиноевой кислоты (Sigma, Сент-Луис, Миссури) ресуспендируют в абсолютном этаноле или ДМСО использованием желтой лампы или косвенным источником света во время подготовки. Магазин аликвоты в стеклянных флаконах при температуре -80 ° С в защищенном от света во все времена. Синтетические RAR-агонисты: Am80 (Вако химических веществ, Richmond, VA).
Ссылки
- Butcher, E. C. Leukocyte-endothelial cell recognition: Three (or more) steps to specificity and diversity. Cell. 67, 1033-1036 (1991).
- Springer, T. A. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell. 76, 301-314 (1994).
- Iwata, M. Retinoic acid imprints gut-homing specificity on T cells. Immunity. 21, 527-538 (2004).
- Mora, J. R. Reciprocal and dynamic control of CD8 T cell homing by dendritic cells from skin- and gut-associated lymphoid tissues. J Exp Med. 201, 303-316 (2005).
- Mora, J. R. Selective imprinting of gut-homing T cells by Peyer's patch dendritic cells. Nature. 424, 88-93 (2003).
- Mempel, T. R., Scimone, M. L., Mora, J. R., von Andrian, U. H. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr Opin Immunol. 16, 406-417 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены