Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Les analyses concurrentielles Homing d'étude Gut tropisme migration des lymphocytes T
Dans cet article
Résumé
Concurrentiels expériences homing permettent d'évaluer directement les propriétés migratoires des deux populations cellulaires différentes dans une seule souris. Ici, nous illustrons cette procédure en comparant la migration des ex vivo généré gut-tropic versus non-intestinale des cellules T tropiques.
Résumé
Afin d'exercer leur fonction de lymphocytes besoin de quitter le sang et migrent dans les différents tissus de l'organisme. L'adhérence des lymphocytes aux cellules endothéliales et l'extravasation des tissus est un processus en plusieurs étapes contrôlées par des molécules d'adhérence différentes (récepteurs homing) exprimée sur les lymphocytes et leurs ligands respectifs (adressines) affiché sur les cellules endothéliales 1 2. Même si la fonction de ces récepteurs d'adhésion peut être partiellement étudiée ex vivo, le test ultime pour leur pertinence physiologique est d'évaluer leur rôle au cours de l'adhérence des lymphocytes in vivo et la migration. Deux stratégies complémentaires ont été utilisés à cette fin: la microscopie intravitale (IVM) et des expériences homing. Bien IVM a été essentielle pour définir la contribution précise de récepteurs d'adhésion spécifiques lors de la cascade d'adhérence en temps réel et dans différents tissus, l'IVM prend du temps et de main-d'oeuvre, il faut souvent le développement de techniques sophistiquées de chirurgie, il a besoin d'isolement avant d'homogénéité populations de cellules et il permet l'analyse d'un seul tissu / organe à un moment donné. En revanche, la compétitivité des expériences homing permettre la comparaison directe et simultanée dans la migration de deux (ou même plus) sous-ensembles de cellules dans la même souris et ils permettent également l'analyse de nombreux tissus et d'un nombre élevé de cellules dans la même expérience.
Nous décrivons ici les classiques du protocole concurrentiel homing utilisé pour déterminer l'avantage / désavantage d'un type cellulaire donné à la maison à des tissus spécifiques par rapport à une population de cellules de contrôle. Nous avons choisi d'illustrer les propriétés migratoires des intestins à tropisme intestinal par rapport aux non-tropique des cellules T, parce que la muqueuse intestinale est la plus grande surface du corps en contact avec l'environnement extérieur et il est aussi le tissu extra-lymphoïdes avec les exigences mieux définies migrateurs . Par ailleurs, des travaux récents ont établi que le métabolite de la vitamine A acide tout-trans rétinoïque (RA) est le principal mécanisme moléculaire responsable de l'induction récepteurs d'adhésion intestinale spécifique (récepteur de chimiokine intégrine a4b7and CCR9) sur les lymphocytes. Ainsi, nous pouvons facilement générer un grand nombre d'ex vivo tropisme intestinal et non gut-tropic lymphocytes T en activant les cellules en présence ou en absence de RA, respectivement, ce qui peut être finalement utilisés dans les expériences décrites ici concurrentiel homing.
Protocole
1. Génération ex vivo de cellules T gut-homing et de contrôle (voir Figure 1)
- Isoler splénocytes en écrasant une rate de souris de type sauvage. Resuspendre la suspension des cellules dans du PBS et centrifuger pendant 5 'à 400 x g. Enlever le surnageant et lyser les globules rouges par la remise en suspension du culot cellulaire dans 4 ml de tampon de lyse ACK pendant 2-3 minutes. Après cela, ajoutez 5 ml de PBS. Centrifuger pendant 5 'à 400 xg et retirer le surnageant.
- Resuspendre splénocytes total à 1 x 10 6 / ml en IMDM + 10% de FBS + 50 mM de 2-mercaptoéthanol + pénicilline / streptomycine (IMDM complet). Séparer les cellules en deux groupes, dont l'un est complété par RA (ou synthétiques RAR-agonistes, tels que AM80 ou Am580) à une concentration finale de 100-200 Nm 3. Les cellules T activées en présence de la PR ou RAR-agonistes réguler positivement a4b7and CCR9 et deviendra l'intestin tropisme des cellules T, tandis que les cellules T activées, sans AR devenir des cellules T de contrôle.
- Ajouter de 1,5 à 2,0 ml de la suspension cellulaire dans chaque puits d'une plaque de 24 puits préalablement revêtu d'anti-CD3 (10 mg / ml) et anti-CD28 (10 mg / ml) et incuber à 37 ° C dans 5% de CO 2 (pour le revêtement de la plaque ajouter 500 ml / puits d'anticorps anti-CD3 et anti-CD28 dans le PBS et incuber pendant 2 heures à 37 ˚ C et puis laver deux fois avec 2 ml de PBS).
- Afin d'éviter une stimulation excessive des cellules T, après 2-3 jours de transférer les suspensions de cellules dans un nouveau non couché de 24 puits à plaques. Incuber pendant 2-3 jours supplémentaires. Selon la densité cellulaire et la prolifération des médias pourrait devenir acide (jaune), auquel cas il pourrait être nécessaire de remplacer la moitié des médias avec IMDM complet frais. Récolter les cellules après 4-5 jours (à compter du jour 0).
- Typiques rendements finaux sont 1-2 x 10 6 cellules T effectrices / puits. Par conséquent, un minimum de 9-12 puits de chaque cellules T gut-tropic et le contrôle des cellules T devrait être plaquées afin de se retrouver avec 10-20 x 10 6 cellules T par condition.
2. Analyse de l'intestin-homing récepteurs sur les cellules T activées
Après 4-5 jours de culture, nous devrions observer une forte expression de récepteurs gut-homing a4b7and CCR9 sur les cellules T activées en présence d'agonistes de la PR ou RAR, tandis que le contrôle des cellules T devrait exprimer des niveaux très bas de ces quatre récepteurs.
La cytométrie en flux (FACS) analyse.
- Recueillir entre 0,2 à 0,5 x10 6 cellules et centrifuger pendant 5 min à 300 g à 4 ° C.
- Incuber avec l'anti-CD4-FITC, anti-a4b7-PE (BD Biosciences), anti-CCR9-APC (eBiosciences) et anti-CD8-PerCP pendant 15 min à 4 ° C dans l'obscurité.
- Après l'incubation, centrifuger pendant 5 min à 300 g à 4 ° C. Lavez et remettre en suspension les cellules dans du tampon coloration et d'analyser par FACS.
3. Marquage des cellules T avec des cellules CFSE trackers et CMTMR
- Gardez toutes les solutions à 37 ° C avant de commencer. Laver l'intestin tropisme des cellules T (a4b7 Haute CCR9 élevé) et le contrôle des cellules T (a4b7 Basse / Nég CCR9 Basse / Nég) à deux reprises avec du PBS pour éliminer le sérum. Ajuster la concentration de cellules T à 10-15 x 10 6 / ml dans le PBS.
- Ajouter CFSE (carboxyfluorescéine succinimidyl ester) ou CMTMR (chlorométhyl-benzoyl-amino-tétraméthylrhodamine) fluorophores soit gut-tropic T et le contrôle des cellules T à une concentration finale de 5 mM et 10 mM, respectivement, doucement vortex et incuber pendant 20 min à 37 ° C. Il est recommandé d'échanger les marquages dans le même ou dans une expérience séparée afin d'exclure les éventuels effets intrinsèques de fluorophores sur la migration des lymphocytes T.
- Après l'incubation, éteindre avec 1 volume de FBS et incuber pendant 1-5 min à température ambiante. Diluer 10 fois avec PBS et centrifuger chaude pendant 5 min à 300 g. Laver deux fois avec du PBS et remettre en suspension dans IMDM complet.
- Idéalement, 10-20 x 10 6 cellules T de chaque population doit être mélangé dans un rapport 1:1 et ensuite centrifugé à 300 xg pendant 5 min. Enfin, remettre en suspension les cellules dans 200 à 250 ml d'eau tiède PBS et injecter dans la veine de la queue.
- Pour calculer le ratio d'entrée exacte (idéalement proche de 1) sauver 5-10 mL de la suspension cellulaire injecté et diluer avec 300 ml de PBS et d'analyser par FACS.
4. L'analyse des cellules T homing
Bien que les souris peuvent être analysés à différents temps (entre 1 h et plusieurs jours après l'injection de cellules T), domiciliation des cellules T à tropisme intestinal sont les mieux documentées entre 12-24 h post-injection. Points de temps plus augmenter les effets potentiels des autres variables affectant la dernière cellule numéros / ratios, tels que l'apoptose des cellules T et la sortie des cellules T à partir des tissus. Après les souris sont euthanasiées, les suspensions de cellules de différents tissus doivent être isolés, sans délai, afin de diminuer la mort cellulaire, ce qui pourrait affecter les rendements finaux et les résultats. Les tissus d'intérêt sont l'intestin grêle, côlon, rate, ganglions lymphatiques, les plaques de Peyer, le foie, les poumons et le sang. Si lesont injecté des cellules T sont de bonne foi l'intestin tropisme des cellules T, ils devraient à domicile, en moyenne de 5-10 fois mieux (ou supérieur) à la muqueuse intestin grêle par rapport au contrôle des cellules T. Toutefois, d'autres tissus, tels que le sang et la rate, ne doit pas présenter une migration préférentielle des cellules T. Isolement des lymphocytes de la lamina propria intestinale et le compartiment intra-épithéliale a été décrit précédemment 5.
- Coloration FACS: Les échantillons sont remis en suspension en fonction du nombre de cellules recueillies, à une densité ne dépassant pas 3,0 x 10 6 cellules / ml. Si congéniques CD45.1 + ou + Thy1.1 souris ont été utilisés en tant que bénéficiaires, les cellules sont colorées avec le marqueur correspondant congéniques (par exemple, ou de CD45.2 Thy1.2) combiné avec quelques marqueurs lignée (par exemple, TCRbchain, CD4, CD8 , CD45.1 + / CD45.2 +).
- Lors de l'analyse FACS, les cellules sont déclenchées sur le marqueur congéniques (par exemple CD45.1) et ensuite sur les marqueurs de la lignée spécifique (par exemple CD4/CD8) et analysés pour les rapports entre les cellules CFSE CMTMR positif.
- Les données sont généralement exprimés comme l'indice Homing (HI), qui est calculé comme le ratio de CFSE / CMTMR (ou CMTMR / CFSE) dans chaque tissu, divisé par le ratio d'entrée correspondant (voir ci-dessous). Si le ratio d'entrée est très proche de 1, alors les ratios de tissus sera équivalente à l'HI.
HI CFSE = tissu / CMTMR tissus: CFSE entrée / CMTMR entrée
Le sang doit également être analysée afin de déterminer si les deux populations de cellules T sont également représentés dans la circulation ou si une population de cellules T est diminué rapport à l'autre (par exemple, par le piégeage préférentiel dans les poumons / foie ou par la viabilité diminué). Cela peut arriver lorsque l'on compare naïfs ou lymphocytes T mémoire par rapport récemment activé les lymphocytes T effecteurs, puisque ces derniers pourraient être piégés dans une plus grande mesure dans les poumons. Si le HI dans le sang est significativement différente de 1, on peut normaliser HI dans les tissus par le HI dans le sang. Le sang peut être obtenu par ponction cardiaque chez la souris anesthésiée (avec l'euthanasie ou Avertin isofluorane préalable) et devrait être lysées à deux reprises avec le tampon ACK avant de l'utiliser pour la coloration FACS.
La normalisation de sang = HI tissu / HI sang
5. Les résultats représentatifs
Souris receveuses (Thy1.1 +) ont été par injection euthanized18h cellule post. Les suspensions cellulaires ont été générées à partir de la rate, ganglions lymphatiques périphériques (PLN), les ganglions mésentériques (MLN) et les petits propia lamina intestin (LP). Après que les cellules ont été colorées pour Thy1.2 et CD8 et ensuite analysées par FACS par gating sur les cellules viables Thy1.2 + + CD8, qui ont finalement été analysés pour le ratio entre les cellules + CMTMR (gut-tropic cellules T) et CFSE + cellules (contrôle des cellules T) divisé par le ratio d'entrée. Les résultats peuvent être affichés comme le montre la figure 2, dans lequel il peut être apprécié que gut-tropic et le contrôle des cellules T hébergés également à la rate (HI proches à1, indiqué par une ligne rouge). En revanche, l'intestin tropisme des cellules T migré environ 10 fois plus efficacement à la SEC par rapport au contrôle des cellules T.
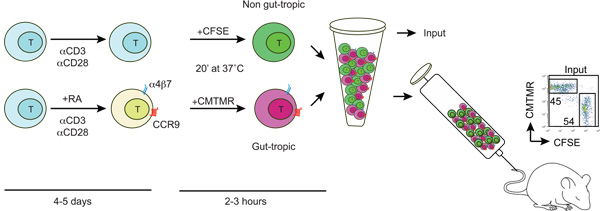
Figure1:. Schéma montrant la production et l'étiquetage des boyaux à tropisme intestinal et non des cellules T Tropic cellules T sont isolés de souris de type sauvage et activé avec anti-CD3/anti-CD28 et dans la présence ou l'absence de tous les 100-200 nm - trans rétinoïque (RA). Après 4-5 jours de PR traités lymphocytes T acquièrent l'expression de l'intestin récepteurs homing CCR9 et a4b7. Ensuite, l'intestin et le contrôle à tropisme des cellules T sont différentiellement étiquetés avec CFSE ou CMTMR, lavés, mélangés dans un rapport 1:1 et injecté dans une souris receveuse via la veine de la queue. Certaines cellules marquées sont utilisées pour déterminer le ratio d'entrée CFSE / CMTMR (qui devrait être proche de 1).
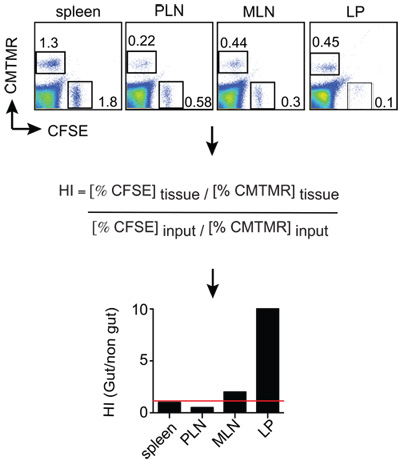
Figure 2:. Souris Exemple d'analyse de homing analysé 12-18 h après l'injection de lymphocytes T et des suspensions cellulaires simples sont obtenus à partir des organes de l'intérêt. Les cellules sont colorées avec des anti-Thy1.2 (marqueur congéniques) et anti-CD8 + et ensuite Thy1.2 cellules T CD8 + sont analysés pour le ratio de CMTMR + et + cellules CFSE dans chaque tissu par FACS. Le tissu CMTMR / CFSE ratios sont ensuite normalisés par l'entrée CMTMR / CFSE rapport pour obtenir les indices de homing (HI). Dans ce + CMTMR exemple et CFSE + sont des cellules intestinales et les cellules-tropique de contrôle T effecteurs, respectivement.
Discussion
Même si des expériences homing fournir des informations très précieuses sur la migration des populations de cellules au total dans tout tissu donné, il faut garder à l'esprit que ces essais ne concernent pas directement l'analyse d'adhérence endothéliales et donc ne soient pas discriminatoires dans lequel l'étape (s) de l'adhésion à plusieurs étapes cascade (tethering / roulement, l'activation ou de coller) un récepteur donné homing agit. L'étalon-or pour définir le rôle spé...
Déclarations de divulgation
Remerciements
CPA est soutenu par une bourse de la maladie de Crohn S & Colitis Foundation of America (CCFA). JRM est soutenu par des subventions de CCFA, le Cancer Research Institute (CRI), Howard H. Goodman (HGM), dans le Massachusetts Life Science Center (MLSC) et le Prix du directeur des NIH s Innovateur Nouvelle.
matériels
Animaux: souris C57BL / 6 sont couramment utilisés pour l'isolement de lymphocytes T. En outre, CD45.1 et Thy1.1 souches congéniques sont disponibles par le biais de Jackson Laboratories (Bar Harbor, ME).
Milieux de culture: IMDM (milieu Iscove Dulbecco modifié par + L-glutamine + HEPES) majoré de 10% de la chaleur de FBS inactivé (sérum de veau fœtal, l'endotoxine bas, Gibco ®, Invitrogen, Carlsbad, CA), supplémenté avec 100 U / ml de pénicilline, 100 mg / ml de streptomycine (antibiotiques HyClone, Waltham, MA), 0,5 mg / ml fungizone / amphotéricine B (Gibco), et 50 mM b-mercaptoéthanol.
ACK tampon lyse des globules rouges (RBC, 10 mM de KHCO3, 150 mM de NH 4 Cl, EDTA 0,1 mM, pH 8,0), ajuster le pH à 7.2 à 7.4 et stocker à température ambiante).
PBS (Phosphate Buffered Saline, Hyclone, Waltham, MA).
La cytométrie en flux (FACS) médias (PBS ou IMDM + 2% de FBS + EDTA 5 mM). Lorsque coloration utilisant la sélectine-Fc chimères, des médias avec 2 mM de Ca + + doit être utilisé dans toutes les étapes (y compris l'acquisition FACS). IMDM est recommandé dans ce cas.
Marquage des cellules T et le transfert adoptif: CFSE (diacétate de carboxyfluorescéine, succinimidyl ester), CMTMR ((5 - (et-6 )-((( 4-chlorométhyl) benzoyl) amino) tétraméthylrhodamine) de Molecular Probes ®, Invitrogen, Carlsbad, CA ). 1000 x stocks doit être faite dans le DMSO (5 CFSE mm, 20 mm CMTMR) et conservés à -20 ° C.
Polyclonaux activation des cellules T: 24-puits ou plaques de 96 puits (de culture de tissus traités, polystyrène, fond plat avec couvercle, BD Falcon, Franklin Lakes, NJ) sont incubées pendant 2 heures à 37 ° C avec 50 ml de PBS, respectivement , contenant des anti-CD3 et anti-CD28 (10 mg / ml chacun). Ensuite, des plaques de culture sont lavées deux fois avec du PBS et utilisées immédiatement pour la culture cellulaire T. Alternativement, Dynabeads recouvert d'anti-CD3/anti-CD28 (Dynal, Invitrogen, Carlsbad, CA) peut être utilisé pour l'activation des cellules T au lieu de la plaque liée anticorps.
La cytométrie en flux (FACS) coloration: activation polyclonale: CD3 (1452C11), CD28 (37.51). Lineage MAB: CD4 (L3T4), CD8a (Ly-2), Thy1.2 (CD90.2/53-1.2), CD45.2 (104). Gut-homing récepteurs: CCR9 purifiée (CD199/eBioCW-1.2, eBioscience, San Diego, Californie), a4b7 (LPAM-1/DATK3), isotype contrôle (IgG2a, k). Peau-homing récepteurs: la P-sélectine-Fc (purifiée souris P-sélectine - protéine de fusion IgG, BD Pharmingen, San Jose, CA), E-sélectine-Fc (E-Selectin/Fc recombinant de souris chimère, R & D Systems, Minneapolis, MN) et correspondante F secondaires de chèvre réactif (ab ') 2 anti-IgG humaine R-PE (Invitrogen, Carlsbad, CA).
Acide tout-trans rétinoïque (Sigma, St. Louis, MO) est remis en suspension dans l'éthanol absolu ou le DMSO en utilisant une ampoule jaune ou une source indirecte de la lumière lors de la préparation. Aliquotes Conserver dans des flacons en verre à -80 ° C et protégé de la lumière à tout moment. RAR-agonistes synthétiques: AM80 (Wako Chemicals, Richmond, VA).
Références
- Butcher, E. C. Leukocyte-endothelial cell recognition: Three (or more) steps to specificity and diversity. Cell. 67, 1033-1036 (1991).
- Springer, T. A. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell. 76, 301-314 (1994).
- Iwata, M. Retinoic acid imprints gut-homing specificity on T cells. Immunity. 21, 527-538 (2004).
- Mora, J. R. Reciprocal and dynamic control of CD8 T cell homing by dendritic cells from skin- and gut-associated lymphoid tissues. J Exp Med. 201, 303-316 (2005).
- Mora, J. R. Selective imprinting of gut-homing T cells by Peyer's patch dendritic cells. Nature. 424, 88-93 (2003).
- Mempel, T. R., Scimone, M. L., Mora, J. R., von Andrian, U. H. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr Opin Immunol. 16, 406-417 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon