Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Competitive Homing-Assays auf Gut-trope T-Zell-Migration Study
In diesem Artikel
Zusammenfassung
Competitive Homing Experimente erlauben die direkte Beurteilung der wandernde Eigenschaften von zwei verschiedenen Zellpopulationen in einem einzigen Mausklick. Hier veranschaulichen wir dieses Verfahren durch einen Vergleich der Migration von ex vivo generierten gut-tropic versus nicht-gut tropic T-Zellen.
Zusammenfassung
Um ihre Funktion ausüben Lymphozyten benötigen, um das Blut zu verlassen und wandern in verschiedenen Geweben im Körper. Lymphozyten-Adhäsion an Endothelzellen und Gewebe Extravasation ist ein mehrstufiger Prozess durch verschiedene Adhäsionsmoleküle gesteuert (Homing-Rezeptoren) auf Lymphozyten und ihre jeweiligen Liganden (Addressine) auf Endothelzellen 1 2 angezeigt ausgedrückt. Obwohl die Funktion dieser Adhäsionsrezeptoren teilweise untersucht werden können ex vivo, der ultimative Test für ihre physiologische Relevanz ist, ihre Rolle bei der In-vivo-Lymphozyten Adhäsion und Migration zu bewerten. Intravitalmikroskopie (IVM) und Homing-Experimente: Zwei sich ergänzende Strategien sind für diesen Zweck verwendet worden. Obwohl IVM war wesentlich an den genauen Anteil der spezifischen Adhäsionsrezeptoren während die Haftung Kaskade in Echtzeit und in verschiedenen Geweben zu definieren, IVM zeitaufwendig und arbeitsintensiv ist, ist es oft erfordert die Entwicklung von anspruchsvollen chirurgischen Techniken, braucht es vor Isolierung von homogenen Zellpopulationen und es erlaubt die Analyse von nur einem Gewebe / Organ zu einem bestimmten Zeitpunkt. Im Gegensatz dazu ermöglichen wettbewerbsfähige Homing Experimente die direkte und gleichzeitige Vergleich bei der Migration von zwei (oder sogar mehr) Zellpopulationen in der gleichen Maus und sie erlauben auch die Analyse von vielen Geweben und einer hohen Anzahl von Zellen in das gleiche Experiment.
Hier beschreiben wir die klassischen kompetitiven Homing-Protokoll verwendet, um den Vorteil / Nachteil eines bestimmten Zelltyp zu Hause, um spezifische Gewebe zu bestimmen, wie ein Steuerelement Zellpopulation verglichen. Wir entschieden uns für die Migration von gut-tropic gegenüber nicht gut-tropic T-Zellen zeigen, da die Darmschleimhaut ist die größte Körperoberfläche in Kontakt mit der äußeren Umgebung und es ist auch die extra-lymphatischen Gewebes mit den besten definierten wandernde Anforderungen . Darüber hinaus haben neuere Arbeiten festgestellt, dass die Vitamin-A-Metaboliten all-trans-Retinsäure (RA) die wichtigsten molekularen Mechanismus für die Induktion gut-spezifische Adhäsion Rezeptoren (Integrine a4b7and Chemokinrezeptor CCR9) auf Lymphozyten ist. So können wir ohne weiteres erzeugen eine große Anzahl von gut-tropischen und nicht gut-tropic Lymphozyten ex vivo durch Aktivierung von T-Zellen in Anwesenheit oder Abwesenheit von RA, bzw., was schließlich in der Wettbewerbssituation Homing hier beschriebenen Experimente verwendet werden.
Protokoll
1. Ex-vivo-Generation von gut-Homing und Kontrolle T-Zellen (siehe Abbildung 1)
- Isolieren Splenozyten von Maischen ein Milz von Wildtyp-Mäusen. Resuspendieren der Zellen Suspension in PBS und zentrifugieren Sie für 5 'bei 400 x g. Entfernen Sie den Überstand und lysieren die roten Blutkörperchen durch Resuspendieren des Zellpellets in 4 ml ACK-Lysepuffer für 2-3 Minuten. Danach werden 5 ml PBS. Zentrifugieren Sie für 5 'bei 400 xg und entfernen Sie den Überstand.
- Resuspendieren insgesamt Splenozyten bei 1 x 10 6 / ml in IMDM + 10% FBS + 50 mM 2-Mercaptoethanol + Penicillin / Streptomycin (komplett IMDM). Trennen Sie die Zellen in zwei Gruppen, von denen einer mit RA (oder synthetischen RAR-Agonisten, wie zB AM80 oder Am580) bis zu einer Endkonzentration von 100-200 nM 3 ergänzt. T-Zellen in Anwesenheit von RA-oder RAR-Agonisten aktiviert wird hochregulieren a4b7and CCR9 und wird gut-tropic T-Zellen werden, während T-Zellen ohne RA aktiviert Kontrolle T-Zellen werden wird.
- Fügen Sie 1,5-2,0 ml der Zellsuspension in jede Vertiefung einer 24-Well-Platte zuvor mit anti-CD3 (10 mg / ml) und anti-CD28 (10 mg / ml) beschichtet und bei 37 ° C in 5% CO 2 (für die Beschichtung der Platte 500 ml / well anti-CD3 und anti-CD28 in PBS und Inkubation für 2 Stunden bei 37 ˚ C und dann zweimal waschen mit 2 ml PBS).
- Um T-Zell-Überstimulation zu vermeiden, nach 2-3 Tagen übertragen die Zellsuspensionen in ein neues unbeschichteten 24-Well-Platte. Inkubieren für weitere 2-3 Tage. Je nach Zelldichte und Proliferation der Medien könnte Säure (gelb), in welchem Fall es nötig sein, die Hälfte der Medien mit frischen komplette IMDM ersetzen werden könnte. Ernte der Zellen nach 4-5 Tagen (gerechnet ab Tag 0).
- Typische Endausbeuten sind 1-2 x 10 6 Effektor-T-Zellen / well. Deshalb sollte ein Minimum von 9-12 Vertiefungen jeder gut-tropic T-Zellen und T-Zellen steuern ausplattiert, um am Ende mit 10-20 x 10 6 T-Zellen pro Zustand sein.
2. Analyse der Darm-Homing-Rezeptoren auf aktivierten T-Zellen
Nach 4-5 Tagen der Kultur sollten wir beobachten eine hohe Expression von gut-Homing-Rezeptoren a4b7and CCR9 auf T-Zellen in Anwesenheit von RA-oder RAR-Agonisten aktiviert, während die Control T-Zellen ein sehr niedriges Niveau dieser Rezeptoren 4 Express sollte.
Durchflusszytometrie (FACS)-Analyse.
- Sammeln Sie zwischen 0,2-0,5 x10 6 Zellen und zentrifugieren Sie für 5 min bei 300 g bei 4 ° C.
- Inkubieren mit anti-CD4-FITC, anti-a4b7-PE (BD Biosciences), anti-CCR9-APC (eBiosciences) und anti-CD8-PerCP für 15 min bei 4 ° C im Dunkeln.
- Nach der Inkubation für 5 min zentrifugieren bei 300 g 4 ° C. Waschen und die Zellen in Färbepuffer und analysieren durch FACS.
3. T-Zell-Markierung mit CFSE und CMTMR Zelle Tracker
- Bewahren Sie alle Lösungen bei 37 ° C vor dem Start. Wash gut-tropic T-Zellen (a4b7 Hohe CCR9 High) und Kontrolle T-Zellen (a4b7 Low / Neg CCR9 Low / Neg) zweimal mit PBS zur Entfernung des Serums. Passen Sie T-Zell-Konzentration von 10-15 x 10 6 / ml in PBS.
- Add CFSE (Carboxyfluorescein Succinimidylester) oder CMTMR (chlormethyl-benzoyl-amino-Tetramethylrhodamin) Fluorophore entweder gut-tropic T und Kontrolle T-Zellen zu einer Endkonzentration von 5 mM und 10 mM bzw. vorsichtig vortexen, Inkubation für 20 min bei 37 ° C. Es wird empfohlen, die Markierungen in der gleichen oder in einem separaten Experiment Swap, um mögliche intrinsische Effekte von Fluorophoren auf T-Zell-Migration ausschließen.
- Nach der Inkubation löschen mit 1 Volumen FBS und Inkubation für 1-5 min bei Raumtemperatur. Verdünnen Sie 10-mal mit warmem PBS und zentrifugieren Sie für 5 min bei 300 g. Zweimal waschen mit PBS resuspendieren und in völliger IMDM.
- Idealerweise sollte 10-20 x 10 6 Zellen jeder T Bevölkerung im Verhältnis 1:1 gemischt und anschließend zentrifugiert bei 300 xg für 5 min. Schließlich die Zellen in 200-250 ml warmem PBS und injizieren über die Schwanzvene.
- Zur Berechnung der exakten Eingabe-Verhältnis (idealerweise nahe 1) zu retten 5-10 mL des injizierten Zellsuspension und mit 300 ml PBS verdünnt und analysiert mittels FACS.
4. Die Analyse der T-Zell-Homing
Obwohl Mäuse zu verschiedenen Zeitpunkten (zwischen 1 h und mehreren Tagen post T-Zell-Injektion) analysiert werden kann, ist Homing von gut-tropic T-Zellen am besten zwischen 12-24 h nach der Injektion dokumentiert. Längere Zeit Punkte erhöhen die möglichen Auswirkungen der anderen Variablen, die die endgültige Anzahl der Zellen / Kennzahlen, wie z. B. T-Zell-Apoptose und T-Zell-Ausstieg aus dem Gewebe. Nach den Mäusen eingeschläfert, Zellsuspensionen aus verschiedenen Geweben, unverzüglich isoliert werden, um Zelltod zu verringern, könnten die Auswirkungen auf den endgültigen Erträge und Ergebnisse. Gewebe von Interesse sind, Dünndarm, Dickdarm, Milz, Lymphknoten, Peyer-Plaques, Leber, Lunge und Blut. Wenn dieinjizierten T-Zellen sind bona fide gut-tropic T-Zellen, sollten sie zu Hause im Durchschnitt 5-10 mal besser (oder höher) auf die Dünndarmschleimhaut im Vergleich zu T-Zellen zu steuern. Allerdings sollten auch andere Gewebe wie Blut und der Milz, nicht zeigen eine bevorzugte T-Zell-Migration. Isolierung von Lymphozyten aus der intestinalen Lamina propria und der intraepithelialen Fach wurde bereits 5 beschrieben.
- FACS-Färbung: Die Proben werden erneut suspendiert in Abhängigkeit von der Anzahl der Zellen gesammelt, bei einer Dichte nicht höher als 3,0 x 10 6 Zellen / ml. Wenn kongene CD45.1 + oder Thy1.1 + Mäusen als Empfänger verwendet wurden, werden die Zellen mit den entsprechenden kongene Marker (zB CD45.2 oder Thy1.2) mit einigen Linie Marker (zB TCRbchain, CD4, CD8 kombiniert gebeizt , CD45.1 + / CD45.2 +).
- Während FACS-Analyse werden die Zellen gated auf der kongene Marker (zB CD45.1) und dann auf die spezifischen Linie Marker (z. B. CD4/CD8) und analysiert das Verhältnis zwischen CMTMR und CFSE-positiven Zellen.
- Die Daten werden in der Regel als Homing Index (HALLO), die als das Verhältnis CFSE / CMTMR (oder CMTMR / CFSE) in jedem Gewebe durch die entsprechende Eingabe-Verhältnis (siehe unten) dividiert wird zum Ausdruck gebracht. Wenn die Eingabe-Verhältnis ist sehr nahe bei 1, dann das Gewebe Verhältnisse werden entsprechend der HALLO.
HALLO = CFSE Gewebe / CMTMR Gewebe: CFSE Input / CMTMR Eingang
Blut sollte auch analysiert, um festzustellen, ob beide T-Zell-Populationen gleichermaßen in den Kreislauf vertreten oder, wenn man T-Zell-Population ist in Bezug auf die anderen (z. B. durch bevorzugte Trapping in der Lunge / Leber oder durch eine verminderte Lebensfähigkeit) verringert werden. Dies könnte geschehen, wenn Vergleich naiv oder Ruhestätten Memory T-Zellen im Vergleich zu den zuletzt aktivierten Effektor-T-Zellen, da diese möglicherweise in einem größeren Ausmaß in die Lunge abgefangen werden. Wenn die HALLO im Blut ist deutlich anders als 1, kann man HALLO normalisieren im Gewebe durch die HALLO im Blut. Das Blut kann via Herzpunktion von Mäusen betäubt (mit Avertin oder Isofluoran vor Euthanasie) bezogen werden und sollten zweimal mit ACK-Puffer lysiert werden, bevor Sie es für FACS-Färbung.
Blut Normalisierung = HALLO Gewebe / HALLO Blut
5. Repräsentative Ergebnisse
Empfänger-Mäuse (Thy1.1 +) wurden euthanized18h post-Injektion. Zellsuspensionen wurden aus der Milz, periphere Lymphknoten (PLN), mesenterialen Lymphknoten (MLN) und Dünndarm Lamina propia (LP) erzeugt. Danach wurden die Zellen für Thy1.2 und CD8 gefärbt und dann analysiert durch FACS durch Gating auf lebensfähigen Thy1.2 + CD8 +-Zellen, die schließlich für das Verhältnis zwischen CMTMR +-Zellen (gut-tropic T-Zellen) und CFSE wurden analysiert + Zellen (Kontrolle T-Zellen) durch die Eingabe dividiert. Die Ergebnisse können wie in Abbildung 2, in der es versteht sich, dass gut-tropischen und Kontrolle T-Zellen auch für die Milz (HALLO nahe zu 1, gekennzeichnet mit einer roten Linie) homed kann gezeigt werden. Im Gegensatz dazu gut-tropic T-Zellen etwa 10-mal effizienter auf die LP migriert im Vergleich zu T-Zellen zu steuern.
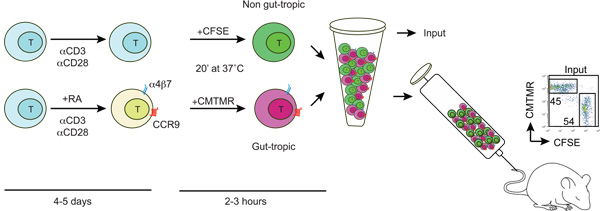
Abbildung 1:. Schematische Darstellung der Erzeugung und Kennzeichnung von gut-tropischen und nicht-gut tropic T-Zellen T-Zellen sind aus Wildtyp-Mäusen isoliert und aktiviert mit anti-CD3/anti-CD28 und in der Gegenwart oder Abwesenheit von 100-200 nm alle - trans-Retinsäure (RA). Nach 4-5 Tagen RA-behandelten T-Zellen erwerben die Expression von gut Homing-Rezeptoren CCR9 und a4b7. Dann werden gut-tropischen und Kontrolle T-Zellen differentiell mit CFSE oder CMTMR gekennzeichnet, gewaschen, gemischt im Verhältnis 1:1 und in eine Empfänger-Maus über die Schwanzvene. Einige markierten Zellen werden verwendet, um die CFSE / CMTMR Eingabe-Verhältnis (sollte nahe bei 1 liegen) zu bestimmen.
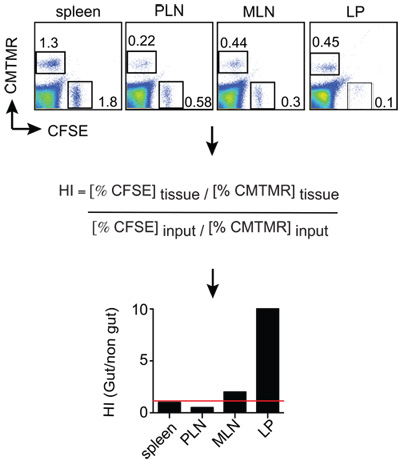
Abbildung 2:. Beispiel Homing Analyse Mäuse analysiert 12-18 h post T-Zell-Injektion und Einzelzell-Suspensionen aus den Organen von Interesse sind, erhalten. Die Zellen werden mit anti-Thy1.2 (kongene Marker) plus anti-CD8 und dann Thy1.2 gebeizt + CD8 + T-Zellen sind für das Verhältnis von CMTMR analysiert + und CFSE + Zellen in jedem Gewebe durch FACS. Das Gewebe CMTMR / CFSE Verhältnisse sind dann durch den Eingang CMTMR / CFSE Verhältnis normalisiert, um die Homing-Indizes (HALLO) zu erhalten. In diesem Beispiel CMTMR + und CFSE + Zellen sind gut-tropischen und Kontrolle Effektor-T-Zellen.
Diskussion
Obwohl Homing Experimente sehr wertvolle Informationen über die Migration des gesamten Zell-Populationen in einem bestimmten Gewebe zu schaffen, sollte es im Auge behalten werden, dass diese Tests nicht direkt analysieren endothelialen Adhäsion und daher nicht zu diskriminieren, in der Stufe (n) des mehrstufigen Haftung Kaskade (Tethering / Walz-, Aktivierungs-oder Kleben) eine gegebene Homing-Rezeptor wirkt. Der Goldstandard der spezifischen Rolle der Homing-Rezeptoren in die Haftung Kaskade zu definieren, ist Intrav...
Offenlegungen
Danksagungen
EJV wird durch ein Stipendium der Crohn s & Colitis Foundation of America (CCFA) unterstützt. JRM wird durch Zuschüsse aus CCFA, Cancer Research Institute (CRI), Howard H. Goodman (MGH), Massachusetts Life Science Center (MLSC) und NIH Director s New Innovator Award unterstützt.
Materialien
Tiere: C57BL / 6 Mäuse werden häufig für T-Zell-Isolierung verwendet. Darüber hinaus sind CD45.1 und Thy1.1 kongene Stämme durch Jackson Laboratories (Bar Harbor, ME) zur Verfügung.
Kulturmedien: IMDM (Iscove-Modified Dulbecco Medium + L-Glutamin + Hepes) plus 10% Hitze-inaktiviertes FBS (fötales Rinderserum, niedrige Endotoxin, Gibco ®, Invitrogen, Carlsbad, CA) mit 100 U / ml Penicillin, 100 mg / ml Streptomycin (HyClone Antibiotika, Waltham, MA), 0,5 mg / ml Fungizone / Amphotericin B (Gibco) und 50 mM b-Mercaptoethanol.
ACK Red Blood Cell Lysis-Puffer (RBC, 10 mM KHCO 3, 150 mM NH 4 Cl, 0,1 mM EDTA, pH 8,0), auf pH 7,2-7,4 und bei Raumtemperatur lagern anpassen).
PBS (Phosphate Buffered Saline, Hyclone, Waltham, MA).
Durchflusszytometrie (FACS) Medien (PBS oder IMDM + 2% FBS + 5 mM EDTA). Wenn Färbung mit Selectin-Fc-Chimären, Medien mit 2 mM Ca + + soll in allen Stufen (einschließlich FACS-Akquisition) verwendet werden. IMDM ist in diesem Fall empfohlen.
T-Zell-Kennzeichnung und adoptiven Transfer: CFSE (Carboxyfluoresceindiacetat, Succinimidylester), CMTMR ((5 - (und-6 )-((( 4-Chlormethyl) benzoyl) amino) Tetramethylrhodamin) von Molecular Probes ®, Invitrogen, Carlsbad, CA ). 1000 x Vorräte sollten in DMSO hergestellt werden (5 mM CFSE, 20 mM CMTMR) und bei -20 ° C.
Polyklonale T-Zell-Aktivierung: 24-well oder 96-well-Platten (Gewebe-Kultur behandelt, Polystyrol, mit flachem Boden mit Deckel, BD Falcon, Franklin Lakes, NJ) für 2 Stunden bei 37 ° C mit 50 ml PBS, jeweils inkubiert , mit anti-CD3 und anti-CD28 Antikörper (10 mg / ml). Dann werden Kulturplatten zweimal mit PBS gewaschen und sofort für die T-Zell-Kultur verwendet. Alternativ können Dynabeads mit anti-CD3/anti-CD28 (Dynal, Invitrogen, Carlsbad, CA) beschichtet für T-Zell-Aktivierung statt Platte gebundene Antikörper verwendet werden.
Durchflusszytometrie (FACS) Färbung: polyklonale Aktivierung: CD3 (1452C11), CD28 (37,51). Lineage mAb: CD4 (L3T4), CD8a (Ly-2), Thy1.2 (CD90.2/53-1.2), CD45.2 (104). Gut-Homing-Rezeptoren: gereinigtes CCR9 (CD199/eBioCW-1.2, eBioscience, San Diego, CA), a4b7 (LPAM-1/DATK3), Isotyp-Kontrolle (IgG2a, k). Skin-Homing-Rezeptoren: P-Selektin-Fc (gereinigtes Maus P-Selectin - IgG-Fusionsprotein, BD Pharmingen, San Jose, CA), E-Selektin-Fc (rekombinantes Maus E-Selectin/Fc Chimera, R & D Systems, Minneapolis, MN) plus entsprechende sekundäre Reagenz Ziege F (ab ') 2 Anti-Human-IgG R-PE (Invitrogen, Carlsbad, CA).
All-trans-Retinsäure (Sigma, St. Louis, MO) wird in absolutem Ethanol oder DMSO mit einer gelben Glühbirne oder eine indirekte Lichtquelle während der Vorbereitung resuspendiert. Shop-Aliquots in Glasflaschen bei -80 ° C und vor Licht geschützt zu allen Zeiten. Synthetische RAR-Agonisten: AM80 (Wako Chemicals, Richmond, VA).
Referenzen
- Butcher, E. C. Leukocyte-endothelial cell recognition: Three (or more) steps to specificity and diversity. Cell. 67, 1033-1036 (1991).
- Springer, T. A. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell. 76, 301-314 (1994).
- Iwata, M. Retinoic acid imprints gut-homing specificity on T cells. Immunity. 21, 527-538 (2004).
- Mora, J. R. Reciprocal and dynamic control of CD8 T cell homing by dendritic cells from skin- and gut-associated lymphoid tissues. J Exp Med. 201, 303-316 (2005).
- Mora, J. R. Selective imprinting of gut-homing T cells by Peyer's patch dendritic cells. Nature. 424, 88-93 (2003).
- Mempel, T. R., Scimone, M. L., Mora, J. R., von Andrian, U. H. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr Opin Immunol. 16, 406-417 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten