É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Competitiva Ensaios Homing para Estudar Gut trópico-Migração de Células T
Neste Artigo
Resumo
Competitiva homing experimentos permitem avaliar diretamente as propriedades migratória de duas populações celulares diferentes em um único rato. Aqui nós ilustrar este procedimento através da comparação da migração de ex-vivo gerado gut trópico-versus non-gut células T trópico.
Resumo
A fim de exercer sua função linfócitos necessidade de deixar o sangue e migram para diferentes tecidos no organismo. Adesão dos linfócitos às células endoteliais e extravasamento de tecido é um processo de várias etapas controladas por diferentes moléculas de adesão (receptores homing) expressa em linfócitos e seus ligantes respectivos (addressins) exibidos em células endoteliais 1 2. Mesmo que a função desses receptores de adesão pode ser parcialmente estudou ex vivo, o teste final para sua relevância fisiológica é avaliar o seu papel durante na adesão de linfócitos vivo e migração. Duas estratégias complementares têm sido utilizados para esse fim: microscopia intravital (IVM) e experimentos homing. Embora IVM tem sido essencial para definir a contribuição precisa de receptores de adesão específicos durante a cascata de adesão em tempo real e em diferentes tecidos, IVM é demorado e trabalhoso, que muitas vezes requer o desenvolvimento de sofisticadas técnicas cirúrgicas, que necessita de isolamento antes de homogêneo populações de células e permite a análise de apenas um órgão, tecido / a qualquer momento. Pelo contrário, competitiva experimentos homing permitir a comparação direta e simultânea na migração de duas (ou mais) em subpopulações de células com o mouse mesmo e eles também permitem a análise de muitos tecidos e de um elevado número de células no mesmo experimento.
Aqui nós descrevemos o protocolo competitivo clássica homing usado para determinar a vantagem / desvantagem de um tipo de célula dado a casa para tecidos específicos, em comparação com uma população de células controle. Escolhemos para ilustrar as propriedades migratórias do intestino trópico-versus células não gut trópico-T, porque a mucosa intestinal é a superfície maior corpo em contato com o ambiente externo e também é o tecido extra-linfóides com os requisitos definidos pelo melhor migratórias . Além disso, trabalhos recentes determinou que a vitamina A, ácido all-trans retinóico metabólito (RA) é o principal mecanismo molecular responsável pela indução de receptores específicos gut-adesão (integrinas receptor de quimiocina a4b7and CCR9) em linfócitos. Assim, podemos facilmente gerar um grande número de gut-tropical e não gut trópico de linfócitos ex vivo pela ativação de células T na presença ou ausência de RA, respectivamente, o que pode ser finalmente utilizado nos experimentos competitivos homing descrito aqui.
Protocolo
1. Geração ex vivo de células T gut-homing e controle (ver Figura 1)
- Isolar esplenócitos por mashing um baço de camundongos de tipo selvagem. Volte a suspender as células em suspensão PBS e centrifugar por 5 'a 400 x g. Remover o sobrenadante e lise das células vermelhas do sangue pela ressuspensão do pellet celular em 4 ml de tampão de lise ACK por 2-3 minutos. Depois disso, adicione 5 ml de PBS. Centrifugar por 5 'a 400 xg e remover o sobrenadante.
- Ressuspender esplenócitos total em 1 x 10 6 / mL em IMDM + 10% FBS + 50 mM 2-mercaptoetanol + penicilina / estreptomicina (IMDM completa). Separar as células em dois grupos, um dos quais são complementados com RA (ou sintético RAR-agonistas, tais como Am80 ou Am580) para uma concentração final de 100-200 nM 3. Células T ativadas na presença de RA ou RAR-agonistas vai upregulate a4b7and CCR9 e vai se tornar células do intestino trópico-T, enquanto que as células T ativadas sem RA vai se tornar as células T de controle.
- Adicionar 1,5-2,0 mL da suspensão de células em cada poço de uma placa de 24 poços previamente revestidas com anti-CD3 (10 mg / ml) e anti-CD28 (10 mg / ml) e incubar a 37 ° C em 5% de CO 2 (para o revestimento da placa de adicionar 500 ml / poço de anti-CD3-CD28, mais anti em PBS e incubar por 2 horas a 37 ˚ C e depois lave duas vezes com 2 ml PBS).
- A fim de evitar a superestimulação das células T, após 2-3 dias de transferência das suspensões de células em um novo sem revestimento placa de 24 cavidades. Incubar por mais de 2-3 dias. Dependendo da densidade e proliferação celular a mídia pode tornar-se ácido (amarelo), caso em que pode ser necessário para substituir a metade da mídia com IMDM completa fresco. Colheita das células após 4-5 dias (contando do dia 0).
- Típico rendimentos finais são 1-2 x 10 6 células T efectoras / poço. Portanto, um mínimo de 12/09 poços de cada células do intestino trópico-T e células T de controle deve ser banhado, a fim de acabar com 10-20 x 10 6 células T por condição.
2. Análise de gut-homing receptores nas células T ativadas
Após 4-5 dias de cultura, devemos observar uma alta expressão de receptores gut-homing a4b7and CCR9 em células T ativadas na presença de agonistas RA ou RAR, enquanto que as células T de controle deve expressar níveis muito baixos destas quatro receptores.
Citometria de fluxo análise (FACS).
- Coletar entre 0,2-0,5 x10 6 células e centrifugar por 5 min a 300 g a 4 ° C.
- Incube com anti-CD4-FITC, anti-a4b7-PE (BD Biosciences), anti-CCR9-APC (eBiosciences) e anti-CD8-PerCP por 15 min a 4 ° C no escuro.
- Após a incubação, centrifugar por 5 min a 300 g 4 ° C. Lavar e ressuspender as células em tampão de coloração e análise por FACS.
3. T rotulagem celular com células trackers CFSE e CMTMR
- Manter todas as soluções a 37 ° C antes de começar. Lavar as células do intestino-trópico T (a4b7 alta CCR9 Alta) e células controle T (a4b7 Baixo / Neg CCR9 Baixo / Neg) duas vezes com PBS para remover o soro. Ajuste a concentração de células T para 10-15 x 10 6 / mL em PBS.
- Adicionar CFSE (carboxifluoresceína succinimidyl éster) ou CMTMR (clorometil-benzoil-amino-tetrametilrodamina) fluoróforos para qualquer gut-trópico T e células T de controle para uma concentração final de 5 mm e 10 mm, respectivamente, gentilmente vortex e incubar por 20 min em 37 ° C. Recomenda-se trocar o bulas no mesmo ou em um experimento separado, a fim de excluir potenciais efeitos intrínsecos de fluoróforos em T migração celular.
- Após a incubação, saciar com um volume de FBS e incubar por 1-5 min à temperatura ambiente. Diluir 10 vezes com PBS quente e centrifugar por 5 min a 300 g. Lave duas vezes com PBS e ressuspender em IMDM completa.
- Idealmente, 10-20 x 10 6 células de cada população T deve ser misturado na proporção de 1:1 e, em seguida, centrifugado a 300 xg por 5 min. Finalmente, voltar a suspender as células em 200-250 mL de PBS quente e injetar através da veia da cauda.
- Para calcular a taxa de entrada exata (de preferência perto de 1) salvar 5-10 ml da suspensão de células injetadas e diluir com 300 mL de PBS e analisar por FACS.
4. Análise de células T homing
Embora os ratos podem ser analisados em vários pontos do tempo (entre 1 h e vários dias após a injeção de células T), homing das células do intestino trópico-T é o melhor documentado entre 12-24 h após a injecção. Pontos mais tempo, aumentar os potenciais efeitos de outras variáveis que afetam a célula final números / índices, como a apoptose de células T e saída de células T do tecido. Depois de os ratos são sacrificados, suspensões de células de vários tecidos devem ser isolados, sem demora, a fim de diminuir a morte celular, que pode afetar o rendimento final e resultados. Tecidos de interesse são o intestino delgado, cólon, baço, linfonodos, placas de Peyer, fígado, pulmões e sangue. Se oinjetaram células T são bona fide células do intestino trópico-T, devem casa, em média 5-10 vezes melhor (ou superior) para a mucosa do intestino delgado em relação ao controle de células T. No entanto, outros tecidos, como sangue e do baço, não deve apresentar uma migração de células T preferencial. Isolamento de linfócitos da lâmina própria intestinal eo compartimento intra-epitelial tem sido descrito anteriormente 5.
- Coloração FACS: As amostras são ressuspenso dependendo do número de células coletadas, com uma densidade não superior a 3,0 x 10 6 células / ml. Se congênitas CD45.1 + ou + Thy1.1 ratos foram usados como receptores, as células são corados com o marcador correspondente congênitas (por exemplo, ou CD45.2 Thy1.2) combinado com algum marcador de linhagem (por exemplo, TCRbchain, CD4, CD8 , CD45.1 + / CD45.2 +).
- Durante a análise do FACS, as células são fechadas no marcador congênitas (por exemplo, CD45.1) e, em seguida, os marcadores de linhagem específica (por exemplo, CD4/CD8) e analisadas para as relações entre CMTMR e células CFSE positivo.
- Os dados é geralmente expressa como o Índice de Homing (HI), que é calculado como a relação CFSE / CMTMR (ou CMTMR / CFSE) em cada tecido dividido pela relação de entrada correspondente (veja abaixo). Se a relação de entrada é muito próximo de 1, então as razões de tecido será equivalente à HI.
HI = CFSE tecido tecido / CMTMR: Entrada CFSE input / CMTMR
De sangue também devem ser analisados a fim de determinar se as duas populações de células T são igualmente representados na circulação ou se uma população de células T está diminuído relação ao outro (por exemplo, prendendo preferencial nos pulmões / fígado ou por viabilidade diminuída). Isso pode acontecer quando se comparam as células de memória T naïve ou descansando contra recentemente activado células T efetoras, já que este último pode ser preso em maior medida nos pulmões. Se o HI no sangue é significativamente diferente de 1, pode-se normalizar HI nos tecidos pelo HI no sangue. Sangue pode ser obtido através de punção cardíaca de ratos anestesiados (com Avertin ou isofluorano eutanásia antes) e devem ser lisadas por duas vezes com tampão ACK antes de o utilizar para a coloração FACS.
Normalização de sangue = HI Sangue tecido / HI
5. Resultados representante
Camundongos destinatário (Thy1.1 +) foram euthanized18h injeção de células post. Suspensões de células foram gerados a partir do baço, linfonodos periféricos (PLN), linfonodos mesentéricos (MLN) e lâmina própria do intestino delgado (LP). Depois que as células foram coradas para Thy1.2 e CD8 e depois analisados por FACS pela passagem de células viáveis Thy1.2 + CD8 +, que finalmente foram analisadas para a relação entre as células CMTMR + (células T gut-trópico) e CFSE + (células de controlo T) dividido pela relação de entrada. Os resultados podem ser exibidos como mostrado na Figura 2, em que pode ser apreciado que as células do intestino trópico e controle T homed igualmente para o baço (HI perto para 1, indicada por uma linha vermelha). Em contraste, as células do intestino trópico-T migraram cerca de 10 vezes mais eficiente para o LP em relação ao controle de células T.
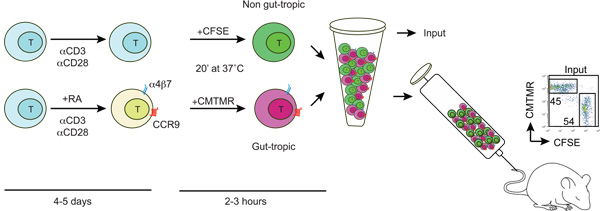
Figura 1:. Diagrama mostrando a geração e rotulagem de gut-tropical e não-gut células T trópico células T são isolados de camundongos do tipo selvagem e activado com anti-CD3/anti-CD28 e na presença ou ausência de 100-200 nM todos - trans ácido retinóico (AR). Depois de 4-5 dias RA-tratados células T adquirir a expressão de receptores do intestino homing CCR9 e a4b7. Então, as células do intestino trópico e controle T são diferencialmente marcada com CFSE ou CMTMR, lavado, misturado na proporção de 1:1 e injetado em um rato destinatário através da veia da cauda. Algumas células marcadas são usadas para determinar a relação de entrada CFSE / CMTMR (deve ser próximo a 1).
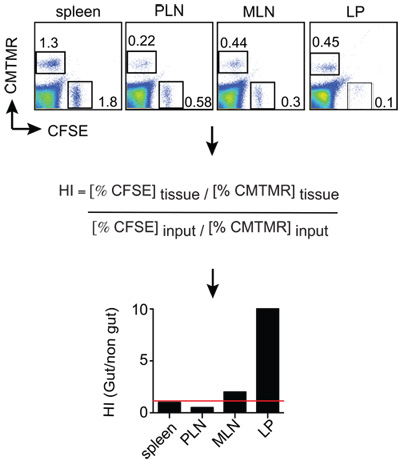
Figura 2:. Mice Exemplo de análise homing analisados 12-18 h pós-injeção de células T e suspensões única célula são obtidos a partir dos órgãos de interesse. As células são corados com anti-Thy1.2 (marcador congênitas) mais anti-CD8 + e depois Thy1.2 células T CD8 + são analisados para a relação entre CMTMR + e + CFSE células em cada tecido por FACS. O tecido CMTMR / CFSE índices são normalizados pela entrada relação CMTMR / CFSE para obter os índices de homing (HI). Neste + CMTMR exemplo e CFSE células são + gut-tropical e as células T efetoras controle, respectivamente.
Discussão
Apesar de experimentos homing fornecer informações valiosas sobre a migração de populações de células totais em qualquer dado tecido, ele deve ser mantido em mente que estes ensaios não analisam diretamente adesão endotelial e, portanto, não discriminar em qual etapa (s) da adesão de várias etapas cascata (tethering / rolamento, ativação ou furar) um determinado receptor homing está agindo. O padrão ouro para definir o papel específico dos receptores de homing na cascata de adesão é de microscopia int...
Divulgações
Agradecimentos
EJV é apoiado por uma bolsa da s & Colite de Crohn Foundation of America (CCFA). JRM é suportado por concessões do CCFA, Cancer Research Institute (CRI), H. Howard Goodman (MGH), Life Science Center Massachusetts (MLSC) e Prêmio NIH Director s New Innovator.
Materiais
Animais: camundongos C57BL / 6 são comumente usados para o isolamento de células T. Além disso, CD45.1 e Thy1.1 linhagens congênitas estão disponíveis através de Jackson Laboratories (Bar Harbor, ME).
Cultura da mídia: IMDM (Medium Modificado Iscove de Dulbecco + L-Glutamina + Hepes) acrescido de 10% inativado pelo calor FBS (fetal bovino endotoxina, Serum baixa, Gibco ®, Invitrogen, Carlsbad, CA) suplementado com 100 U / penicilina ml, 100 mg / ml de estreptomicina (antibióticos HyClone, Waltham, MA), 0,5 mg / ml Fungizone / anfotericina B (Gibco) e 50 mM b-mercaptoetanol.
ACK Red Blood tampão de lise celular (RBC, 10 mM KHCO 3, 150 mM NH 4 Cl, 0,1 mM EDTA, pH 8,0), ajustado a pH 7,2-7,4 e armazenar em temperatura ambiente).
PBS (Phosphate Buffered Saline, Hyclone, Waltham, MA).
Citometria de fluxo (FACS) media (PBS ou IMDM + 2 + 5% FBS mM EDTA). Quando coloração com Selectina-Fc quimeras, media com 2 mM Ca + + deve ser usado em todas as etapas (incluindo a aquisição FACS). IMDM é recomendado neste caso.
T rotulagem celular e transferência adotiva: CFSE (carboxifluoresceína diacetato, succinimidyl éster), CMTMR ((5 - (e-6 )-((( 4-clorometil) benzoil) amino) tetrametilrodamina) de Molecular Probes ®, Invitrogen, Carlsbad, CA ). 1.000 ações x deve ser feita em DMSO (5 CFSE mM, 20 mM CMTMR) e armazenadas a -20 ° C.
Ativação de células T policlonais: 24 bem ou placas de 96 poços (cultura de tecidos tratados, poliestireno, de fundo plano com tampa, BD Falcon, Franklin Lakes, NJ) são incubados por 2 horas a 37 ° C com 50 ml de PBS, respectivamente , contendo anti-CD3, mais anti-CD28 anticorpos (10 mg / mL cada). Então, placas de cultura são lavados duas vezes com PBS e imediatamente utilizado para cultura de células T. Alternativamente, Dynabeads revestido com anti-CD3/anti-CD28 (Dynal, Invitrogen, Carlsbad, CA) pode ser usada para ativação das células T, em vez de placa-bound anticorpos.
Citometria de fluxo coloração (FACS): ativação policlonal: CD3 (1452C11), CD28 (37,51). Lineage mAb: CD4 (L3T4), CD8a (Ly-2), Thy1.2 (CD90.2/53-1.2), CD45.2 (104). Gut-homing receptores: purificada CCR9 (CD199/eBioCW-1.2, eBioscience, San Diego, CA), a4b7 (LPAM-1/DATK3), isotipo controle (IgG2a, k). Pele-homing receptores: P-selectina-Fc (Purified rato P-Selectina - IgG proteína de fusão, BD PharMingen, San Jose, CA), E-selectina-Fc (E-Selectin/Fc rato recombinante Chimera, R & D Systems, Minneapolis, MN), mais de cabra F correspondente secundário reagente (ab ') 2 anti-humano IgG R-PE (Invitrogen, Carlsbad, CA).
All-trans ácido retinóico (Sigma, St. Louis, MO) é ressuspenso em etanol absoluto ou DMSO usando uma lâmpada amarela ou uma fonte indireta de luz durante a preparação. Alíquotas armazenar em frascos de vidro a -80 ° C e protegida da luz em todos os momentos. Sintéticos RAR-agonistas: Am80 (Wako Chemicals, Richmond, VA).
Referências
- Butcher, E. C. Leukocyte-endothelial cell recognition: Three (or more) steps to specificity and diversity. Cell. 67, 1033-1036 (1991).
- Springer, T. A. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell. 76, 301-314 (1994).
- Iwata, M. Retinoic acid imprints gut-homing specificity on T cells. Immunity. 21, 527-538 (2004).
- Mora, J. R. Reciprocal and dynamic control of CD8 T cell homing by dendritic cells from skin- and gut-associated lymphoid tissues. J Exp Med. 201, 303-316 (2005).
- Mora, J. R. Selective imprinting of gut-homing T cells by Peyer's patch dendritic cells. Nature. 424, 88-93 (2003).
- Mempel, T. R., Scimone, M. L., Mora, J. R., von Andrian, U. H. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr Opin Immunol. 16, 406-417 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados