Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La activación de la apoptosis mediante microinyección citoplasmática del citocromo C
En este artículo
Resumen
En este protocolo, se describe la microinyección directa citoplasma del citocromo C Las proteínas en los fibroblastos y las principales neuronas simpáticas. Esta técnica permite la introducción de la citocromo C Proteínas en el citoplasma de las células e imita la liberación de citocromo C De las mitocondrias, que se produce durante la apoptosis.
Resumen
La apoptosis, o muerte celular programada, es una vía conservada y muy regulado por el cual las células mueren 1. La apoptosis puede ser activado cuando las células encuentran una amplia gama de tensiones citotóxicos. Estos insultos iniciar cascadas de señalización que pueden llegar a causar la liberación de citocromo c desde el espacio intermembrana mitocondrial al citoplasma 2. La liberación de citocromo c de la mitocondria es un evento clave que desencadena la activación rápida de las caspasas, proteasas celulares claves que finalmente ejecutar la muerte celular 3-4.
La vía de la apoptosis está regulada en los puntos aguas arriba y aguas abajo de la liberación del citocromo c de la mitocondria 5. Con el fin de estudiar la regulación post-mitocondrial de activación de las caspasas, muchos investigadores han recurrido a la microinyección directa de citoplasma holocytochrome c (hemo-adjunto) de proteínas en las células 6-9. Citocromo c es normalmente localizada en la mitocondria, donde la unión de un grupo hemo es necesario para poder activar la apoptosis 10-11. Por lo tanto, para activar directamente las caspasas, es necesario inyectar la proteína c holocytochrome en lugar de su cDNA, porque si bien la expresión de citocromo c de las construcciones de cDNA se traducirá en la orientación mitocondrial y el apego del hemo, será secuestrado de caspasas citosólica. Por lo tanto, la microinyección directa citosólica de la proteína purificada hemo-adjunto del citocromo c es una herramienta útil para simular la liberación del citocromo c mitocondrial y la apoptosis, sin el uso de insultos tóxicos que causan daño celular y mitocondrial.
En este artículo se describe un método para la microinyección de citocromo c de proteínas en las células, a través del ratón fibroblastos embrionarios (MEFs) y primaria neuronas simpáticas como ejemplos. Aunque este protocolo se centra en la inyección de citocromo c de las investigaciones de la apoptosis, las técnicas mostradas aquí también se puede adaptar fácilmente para la microinyección de otras proteínas de interés.
Protocolo
1. Producción de agujas de microinyección
- Prefabricados agujas de microinyección están disponibles comercialmente (por ejemplo. Femtotips de Eppendorf) y son útiles si uno no se está realizando un gran número de micro-inyecciones. Sin embargo, para aquellos que desean establecer a largo plazo las capacidades de la microinyección, una alternativa es la producción de agujas de microinyección en el laboratorio con paredes delgadas de vidrio de borosilicato capilares y un extractor de aguja comercial. Esto también permite que la forma de agujas de ser variada, que pueden ser útiles para diferentes tipos de células.
- Con el extractor de la aguja Narishige PC-10 microinyección, conecte los cuatro pesos y el uso de un programa de un solo paso de tracción (Paso 1 de ajuste) con el ajuste de calor con respecto a 58,0 (calentador N º 2). Asegúrese de colocar el elemento de calefacción en el centro de cada capilar de modo que las dos agujas resultantes son de una longitud similar.
- Tire de varios capilares (alrededor de 2 capilares para cada proteína de interés).
- Agujas almacenar en un recipiente, mientras que estar seguro de no dañar la punta de la aguja. Materiales como la espuma o el Blu-Tack se pueden utilizar en recipientes para agujas de microinyección.
2. La preparación de mezclas de proteínas para la inyección
- Preparar un buffer de microinyección 10 veces con 1 M de cloruro de potasio y fosfato de potasio 0,1 M (KPI) buffer (mezcla equimolar de K 2 HPO 4 y KH 2 PO 4) a un pH de 7,4. Este búfer puede almacenar a largo plazo a temperatura ambiente.
- Para visualizar la inyección de un colorante fluorescente como rodamina dextrano hay que añadir. Diluir buffer de microinyección the10x en agua y disolver rodamina dextrano en polvo para preparar una solución buffer de microinyección de 5x que contiene 20-40 mg / ml de rodamina dextrano.
- Almacenar esta solución en la oscuridad a 4 ° C. Debería ser suficiente para un máximo de 100 preparaciones individuales de proteínas solución. Otros colorantes, como isotiocianato de fluoresceína-dextrano puede sustituir.
- Prepare citocromo c mediante la disolución de las poblaciones de purificar el citocromo c en el agua a una concentración de 20 mg / ml. Tienda de citocromo c a -80 ° C para almacenamiento a largo plazo y evitar los ciclos de congelación-descongelación mediante el almacenamiento de citocromo c en el pequeño (10 l) alícuotas.
- Prepare una mezcla de 10 l para la inyección de proteínas mediante la combinación de dos buffer de microinyección l 5x contienen rodamina dextrano con 3 l de agua y 5 citocromo c l para una concentración final de 10 c mg / mL en el citocromo 1x tampón (100 mM KCl, 10 mM KP i, 4-8 mg / ml de rodamina dextrano).
3. Microinyección citoplasmática del citocromo c
- Justo antes de la microinyección, centrifugar la mezcla de citocromo C y buffer de microinyección a 16.000 g durante 10 minutos a 4 ° C para separar cualquier partícula que pueda obstruir las agujas de microinyección.
- Durante la centrifugación, a su vez en el microinyector para permitir que la presión del aire para construir.
- Coloque un plato de células en el centro de la platina del microscopio y establecer el foco en las células. Para reducir al mínimo la cantidad de tiempo que las células se mantienen fuera de la incubadora, las células normalmente se devuelven a la incubadora dentro de los 30 min.
- Pipeta de 0,5 a 1 l de la superficie superior de la mezcla de la proteína en el extremo romo de los capilares. Tenga cuidado de no pipeta de las partículas que han sido centrifugada para la parte inferior del tubo. En un minuto, la mezcla de proteína va a distribuir a la punta de la aguja a través de la acción capilar.
- Coloque la aguja con firmeza al titular de la capilaridad de la micromanipulador y la posición de la aguja de modo que la punta pasa a través de la luz transmitida del microscopio aproximadamente a un ángulo de 45 °.
- Ajustar la posición de la punta de la aguja de modo que está situado en el centro del campo de visión. Al centro de la aguja, usar el micromanipulador para mover la aguja mientras mira por el ocular del microscopio. La sombra de la aguja debe ser visible. Ajustar la aguja de modo que su sombra se ve sólo en la mitad del campo de vista, lo que indica que la punta de la aguja se centra sobre las células.
- Establecer el microinyector al modo de flujo continuo y ajustar la presión de trabajo de 20 a 100 hPa. Cada aguja puede requerir una presión de trabajo diferentes, y la presión de trabajo es probable que el ajuste necesario en el procedimiento de microinyección para mantener un flujo constante.
- Baje la aguja con el mando de grueso a una posición justo por encima de las células. Para ello, elevar el plano focal del microscopio a una posición justo por encima de las células. Luego baje la aguja hacia las células con el mando hasta que la gruesa punta de la aguja está en foco.
- Volver a centrar la punta de la aguja dentro del campo de visión y aumentar la ampliación al cambiar el objetivo del microscopio.
- Baje lentamente la aguja con el unti manipulador de mando bienl que la aguja está ligeramente por encima del plano focal de las células.
- Compruebe el flujo de la mezcla de proteínas mirando a la fluorescencia de color rojo de la rodamina. La mezcla de proteínas debe ser salir de la aguja como un chorro fino y constante. Las agujas deben ser reemplazados y re-cargada si la aguja está en peligro o si el flujo es demasiado fuerte. A veces, la punta del capilar de vidrio se cierra y no se ve el flujo de la aguja. Si esto ocurre, vuelva a colocar la aguja con cuidado o inferior a la parte inferior de la placa de cultivo a la ruptura suavemente la punta de la aguja.
- La posición de la punta de la aguja de modo que apunte hacia una celda de aproximadamente un ángulo de 45 °. Luego, con un movimiento suave, bajar la aguja mientras se mueve hacia la célula. Con un movimiento suave y en segundo lugar, inmediatamente invertir la dirección de la aguja para extraer de la célula.
- Una célula con éxito a menudo se inyecta un poco oleaje y se puede confirmar mediante la visualización de la rodamina fluorescente de color rojo dentro de la célula. En ocasiones, una célula se inyecta accidentalmente en el núcleo, que será visible.
- Continuar inyectando células mediante el ajuste de la platina del microscopio hasta unos 50-100 células se inyectan. Cuando se mueve la platina del microscopio, asegúrese de levantar la aguja de microinyección de manera que se aclara la parte superior de las células.
4. Los resultados representativos:
La microinyección citoplasmática del citocromo c imita su liberación de la mitocondria durante la apoptosis. Por lo tanto, como era de esperar, los fibroblastos rápidamente la apoptosis en la microinyección citosólica de citocromo c de la especie bovina (Fig. 1A). Para asegurarse de que el procedimiento de inyección por sí sola no es responsable de la muerte celular, la inyección de levadura de citocromo c sirve como un control importante, ya que la levadura del citocromo c es incapaz de activar las caspasas 12.
Curiosamente, post-mitóticas neuronas simpáticas son muy resistentes a la citosólica de citocromo c (Fig. 1B) 8,13. Nuestro laboratorio ha identificado que la XIAP caspasa inhibidor endógeno es un inhibidor de la clave de activación de la caspasa en las neuronas 14. Por lo tanto, para que las neuronas mueren después de la inyección del citocromo c, XIAP primero debe convertirse en inactiva. Por ejemplo, la microinyección de citocromo c en XIAP - / - las neuronas simpáticas es suficiente para permitir la activación de las caspasas y apoptosis en estas células (Fig. 2).
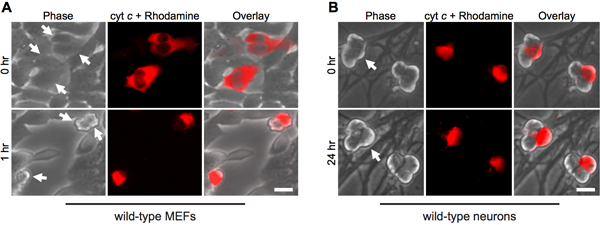
Figura 1. Microinyección citoplasmática del citocromo c provoca la rápida muerte de los fibroblastos, pero no las neuronas. A) De tipo salvaje MEFs o (B) después del día 5 de tipo salvaje neuronas simpáticas se microinyección con bovinos citocromo c (10 mg / ml), junto con rodamina-dextrano para marcar las células inyectadas. Las imágenes muestran el mismo campo de las células inmediatamente después de la inyección (0 h), o en el momento indicado. Las flechas indican las células inyectadas. Barra de escala, 20 micras.
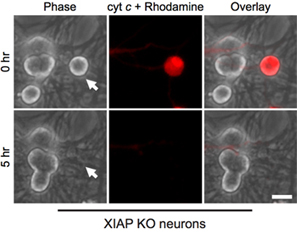
Figura 2. XIAP neuronas deficientes son susceptibles a la microinyección citoplasmática del citocromo c. Postnatal día 5 neuronas simpáticas de los ratones knock-out XIAP se microinyección con bovinos citocromo c (10 mg / ml), junto con rodamina-dextrano para marcar las células inyectadas. Las imágenes muestran el mismo campo de las células inmediatamente después de la inyección (0 h), o 5 horas después de la citocromo c microinyección (5 horas). Barra de escala, 20 micras.
Discusión
La microinyección de citocromo c directamente en el citoplasma de las células es una herramienta única y poderosa que permite estudios de la regulación post-mitocondrial de la apoptosis. Es importante destacar que esta técnica permite la activación directa de la apoptosis aguas abajo de la mitocondria, sin el uso de agentes que causan daño celular o mitocondrial.
Aunque este protocolo se ha centrado en la microinyección de citocromo c para los estudios sobre la apop...
Divulgaciones
Agradecimientos
Este trabajo fue apoyado por el NIH subvención NS042197 a MD. Azad Jammu y Cachemira fue apoyado por becas y T32GM008719 F30NS068006.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| DM IRE2 microscopio invertido | Leica | ||
| PC-10 Microinyección Extractor de agujas | Narishige | ||
| MWO-202 Micromanipulador | Narishige | ||
| FemtoJet microinyector | Eppendorf | ||
| De pared delgada Boroscilicate capilar de vidrio con microfilamentos | AM Sistemas | 615000 | 4 pulgadas de largo, 1,00 mm de diámetro exterior de 0,75 mm de diámetro interno |
| Rodamina B isotiocianato de dextrano | Sigma-Aldrich | R9379 | Peso molecular medio ~ 70.000 Da |
| Bovina proteína citocromo c | Sigma-Aldrich | C3131 |
Referencias
- Danial, N. N., Korsmeyer, S. J. Cell death: critical control points. Cell. 116, 205-219 (2004).
- Wang, X. The expanding role of mitochondria in apoptosis. Genes Dev. 15, 2922-2933 (2001).
- Hengartner, M. O. The biochemistry of apoptosis. Nature. 407, 770-776 (2000).
- Fuentes-Prior, P., Salvesen, G. S. The protein structures that shape caspase activity, specificity, activation and inhibition. Biochem. J. 384, 201-232 (2004).
- Tait, S. W., Green, D. R. Mitochondria and cell death: outer membrane permeabilization and beyond. Nat Rev Mol Cell Biol. 11, 621-632 (2010).
- Brustugun, O. T., Fladmark, K. E., Doskeland, S. O., Orrenius, S., Zhivotovsky, B. Apoptosis induced by microinjection of cytochrome c is caspase-dependent and is inhibited by Bcl-2. Cell Death Differ. 5, 660-668 (1998).
- Li, F. Cell-specific induction of apoptosis by microinjection of cytochrome c. Bcl-XL has activity independent of cytochrome c release. J. Biol. Chem. 272, 30299-30305 (1997).
- Deshmukh, M., Johnson, E. M. Evidence of a novel event during neuronal death: development of competence-to-die in response to cytoplasmic cytochrome c. Neuron. 21, 695-705 (1998).
- Vaughn, A. E., Deshmukh, M. Glucose metabolism inhibits apoptosis in neurons and cancer cells by redox inactivation of cytochrome c. Nat. Cell Biol. 10, 1477-1483 (2008).
- Yang, J. Prevention of apoptosis by Bcl-2: release of cytochrome c from mitochondria blocked. Science. 275, 1129-1132 (1997).
- Gonzales, D. H., Neupert, W. Biogenesis of mitochondrial c-type cytochromes. J Bioenerg Biomembr. 22, 753-768 (1990).
- Ellerby, H. M. Establishment of a cell-free system of neuronal apoptosis - comparison of premitochondrial, mitochondrial, and postmitochondrial phases. J. Neurosci. 17, 6165-6178 (1997).
- Neame, S. J., Rubin, L. L., Philpott, K. L. Blocking cytochrome c activity within intact neurons inhibits apoptosis. J. Cell Biol. 142, 1583-1593 (1998).
- Potts, P. R., Singh, S., Knezek, M., Thompson, C. B., Deshmukh, M. Critical function of endogenous XIAP in regulating caspase activation during sympathetic neuronal apoptosis. J. Cell Biol. 163, 789-799 (2003).
- Estus, S. Altered gene expression in neurons during programmed cell death: identification of c-jun as necessary for neuronal apoptosis. J. Cell Biol. 127, 1717-1727 (1994).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados