A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הפעלה של אפופטוזיס על ידי Microinjection cytoplasmic של ציטוכרום ג
In This Article
Summary
בפרוטוקול זה, אנו מתארים את microinjection cytoplasmic ישירה של ציטוכרום ג החלבונים לתוך fibroblasts ונוירונים אוהד העיקרי. טכניקה זו מאפשרת המבוא של ציטוכרום ג החלבונים לתוך הציטופלסמה של תאים מחקה את שחרורו של ציטוכרום ג מן המיטוכונדריה, אשר מתרחשת במהלך אפופטוזיס.
Abstract
אפופטוזיס או מות תאים מתוכנת, הוא מסלול שימור פיקוח הדוק שבאמצעותם תאים מתים 1. אפופטוזיס יכול להיות מופעלות כאשר תאים המפגש מגוון רחב של מדגיש ציטוטוקסיות. עלבונות אלה ליזום מפלי איתות כי בסופו של דבר לגרום לשחרור ציטוכרום C מהחלל intermembrane המיטוכונדרי אל הציטופלסמה 2. שחרורו של ציטוכרום C מתוך המיטוכונדריה היא אירוע שמפעיל את מפתח ההפעלה המהירה של caspases, פרוטאזות הסלולר המפתח אשר בסופו של דבר לפועל מוות של תאים 3-4.
מסלול של אפופטוזיס מוסדר בנקודות במורד הזרם של שחרור ציטוכרום C מתוך המיטוכונדריה 5. על מנת ללמוד את תקנה שלאחר המיטוכונדרי של הפעלת caspase, חוקרים רבים פנו microinjection cytoplasmic ישירה של holocytochrome ג (heme המצורפת) חלבונים לתוך התאים 6-9. ציטוכרום C הוא מקומי בדרך כלל המיטוכונדריה שם הקובץ המצורף של קבוצת heme הוא הכרחי כדי לאפשר לה להפעיל אפופטוזיס 10-11. לכן, כדי להפעיל ישירות caspases, יש צורך להזריק את החלבון holocytochrome ג במקום cDNA שלו, כי בעוד ביטוי של ציטוכרום C מתוך בונה cDNA תגרום המיקוד ואת המיטוכונדריה מצורף heme, זה יהיה מוחרם מ caspases cytosolic. לפיכך, microinjection cytosolic ישירה של חלבון מטוהרים heme המצורפת ג ציטוכרום הוא כלי שימושי לחקות לשחרר המיטוכונדריאלי ציטוכרום C ו אפופטוזיס ללא שימוש עלבונות רעילים אשר גורמים נזק הסלולר המיטוכונדריה.
במאמר זה, אנו מתארים שיטה microinjection של החלבון ציטוכרום C לתוך התאים, באמצעות העכבר fibroblasts עובריים (MEFs) ו נוירונים אוהד העיקרי כדוגמאות. בעוד פרוטוקול זה מתמקד הזרקה של ג ציטוכרום לחקירות של אפופטוזיס, טכניקות המוצג כאן ניתן להתאים בקלות עבור microinjection של חלבונים אחרים בעלי עניין.
Protocol
1. הפקה של מחטים Microinjection
- טרום מפוברק מחטים microinjection זמינים מסחרית (לדוגמה. Femtotips מ Eppendorf) ו שימושיים אם לא מבצע מספר רב של microinjections. עם זאת, עבור אלה שרוצים להקים לטווח ארוך יכולות microinjecting, אלטרנטיבה היא לייצר מחטים microinjection במעבדה באמצעות קיר דק בורוסיליקט זכוכית נימים חולץ מחט מסחרי. זה גם מאפשר את הצורה של מחטים להיות מגוונות, אשר יכול להיות שימושי עבור תאים מסוגים שונים.
- עם פולר Narishige PC-10 Microinjection מחט, לצרף את כל ארבעת משקולות להשתמש בתוכנית צעד אחד מושך (1 הגדרה שלב) עם הגדרת החום היחסי ב 58.0 (דוד מס '2). הקפידו למקם את גוף החימום במרכזו של כל נימי כך שתי מחטים וכתוצאה מכך הם באורך דומה.
- משוך כמה נימים (כ 2 נימים עבור כל חלבון של עניין).
- מחטים חנות במיכל בעת היותו בטוח לא לפגוע קצה המחט. חומרים כגון קצף או Blu-Tack ניתן להשתמש במיכלים להחזיק מחטים microinjection.
2. הכנת תערובות חלבון עבור הזרקה
- הכן חיץ microinjection 10x המכיל 1 M אשלגן כלוריד 0.1 M אשלגן זרחתי (KPI) חוצץ (תערובת equimolar של K 2 HPO 4 ו - KH 2 PO 4) ב-pH של 7.4. מאגר זה יכול להיות מאוחסן לטווח ארוך בטמפרטורת החדר.
- כדי להמחיש את הזריקה, צבע פלואורסצנטי כמו rhodamine-dextran צריך להיות הוסיף. מדולל חיץ microinjection the10x במים לפזר rhodamine-dextran אבקת לעשות microinjection 5x חיץ תמיסה המכילה 20-40 מ"ג / מ"ל rhodamine dextran.
- בחנות זו פתרון בחושך ב 4 ° C. זה צריך להספיק עד 100 ההכנות פתרון יחיד חלבון. צבעים אחרים, כמו והעמסת isothiocyanate-dextran יכול להחליף.
- הכן ציטוכרום מניות ג ידי המסת מטוהרים ציטוכרום C במים בריכוז של 20 מ"ג / מ"ל. חנות ציטוכרום C ב -80 ° C עבור אחסון לטווח ארוך ולהימנע להקפיא להפשיר מחזורים ידי אחסון של ציטוכרום C (~ 10 μL) aliquots קטן.
- הכינו תערובת חלבון 10 μL להזרקה על ידי שילוב של 2 microinjection μL חיץ 5x המכיל rhodamine-dextran עם מים μL 3 ו 5 ג ציטוכרום μL ריכוז סופי של 10 מ"ג / מ"ל ציטוכרום C במאגר 1x (100 מ"מ KCl, 10 mM KP אני, 4-8 מ"ג / מ"ל rhodamine dextran).
3. Microinjection cytoplasmic של ציטוכרום C
- רק לפני microinjection, בצנטריפוגה תערובת של ציטוכרום C ו חיץ microinjection ב g 16,000 במשך 10 דקות ב 4 ° C כדי להפריד כל חומר חלקיקי אשר עשויים לסתום מחטים microinjection.
- במהלך צנטריפוגה, להפעיל את microinjector לאפשר לחץ האוויר לבנות.
- מניחים צלחת של תאים במרכז הבמה מיקרוסקופ ולהגדיר את הפוקוס על התאים. כדי למזער את כמות הזמן כי התאים נשמרים מחוץ לחממה, התאים מוחזרים בדרך כלל החממה בתוך 30 דקות.
- פיפטה 0.5-1 μL מפני השטח העליון של התערובת לתוך החלבונים בקצה הקהה של נימי. היזהר שלא פיפטה כל החלקיקים אשר היו centrifuged לחלק התחתון של הצינור. תוך דקה, את תערובת חלבון תפיץ אל קצה המחט דרך פעולה נימי.
- הצמד את המחט היטב לבעל נימי של micromanipulator ואת המיקום את המחט כך קצהו עובר האור המועבר של המיקרוסקופ בכ זווית של ° 45.
- התאם את מיקום קצה המחט, כך שהוא ממוקם ישירות במרכז של שדה הראייה. כדי למרכז את המחט, השתמש micromanipulator להזיז את המחט תוך מבט מבעד לעינית המיקרוסקופ. הצל מחט צריך להיות גלוי. כוון את המחט כך הצל שלה נראה רק חצי אחד של שדה הראייה, המציין את קצה המחט ממורכזת מעל התאים.
- הגדר את microinjector למצב זרימה רציפה ולהגדיר את הלחץ הפועלים 20-100 hPa. כל מחט עשויה לדרוש לחץ עבודה שונים, לחץ עבודה סביר להניח שאתה צריך התאמה במהלך ההליך microinjection לשמור על זרימה קבועה.
- מנמיכים את מחט באמצעות כפתור גס למיקום מעל התאים. כדי לעשות זאת, להעלות את מישור המוקד של המיקרוסקופ למיקום מעל התאים. ואז להוריד את המחט לכיוון התאים באמצעות כפתור גס עד קצה המחט בפוקוס.
- Re-מרכז את קצה מחט בתוך שדה הראייה ולהגדיל את ההגדלה על ידי שינוי אובייקטיבי מיקרוסקופ.
- לאט לאט להוריד את המחט באמצעות unti בסדר ידית מניפולטוראני המחט הוא רק מעט מעל מישור המוקד של התאים.
- בדוק את זרימת התערובת חלבון מלהסתכל הקרינה האדום של rhodamine. תערובת חלבון צריך להיות היציאה מחט כמו זרם דק מתמיד. מחטים צריך להיות מוחלף מחדש טעון אם המחט נפגעת או אם הזרימה היא חזקה מדי. לפעמים, להטות את הכוס נימי סגור ולא ניתן לראות זרימה של המחט. במקרה זה, להחליף את המחט או להוריד אותו בזהירות לתחתית צלחת תרבות קרע בעדינות את קצה המחט.
- מקם את קצה המחט כך שהיא מצביעה לעבר תא בכ בזווית של ° 45. ואז בתנועה אחת חלקה, להנמיך את המחט תוך הזזת אותו לכיוון התא. בתנועה חלקה השני, מיד להפוך את הכיוון של המחט להסיר אותו מהתא.
- תא מוזרק בהצלחה לעיתים קרובות מעט להתנפח והוא יכול להיות מאושרת על ידי לדמיין את rhodamine ניאון אדום בתוך התא. לעיתים, התא יהיה להזריק בטעות בגרעין, אשר יהיה גלוי.
- המשך להזריק תאים על ידי התאמת הבמה מיקרוסקופ עד כ 50-100 התאים מוזרקים. כאשר נע על הבמה מיקרוסקופ, כדי להיות בטוח להעלות את המחט microinjection כך שהוא מנקה את החלק העליון של התאים.
4. נציג תוצאות:
Microinjection cytoplasmic של ציטוכרום C מחקה השקתו של המיטוכונדריה במהלך אפופטוזיס. לכן, כצפוי, fibroblasts במהירות לעבור אפופטוזיס על microinjection cytosolic של שור ציטוכרום C (איור 1A). כדי להבטיח את ההליך הזרקה לבד אינה אחראית מוות של תאים, הזרקה של שמרים ציטוכרום C משמש לשלוט חשובה, שכן שמרים ציטוכרום C אינו מסוגל להפעיל caspases 12.
מעניין, שלאחר mitotic נוירונים אוהד עמידים להפליא cytosolic ציטוכרום C (איור 1B) 8,13. המעבדה שלנו זיהתה כי XIAP מעכב אנדוגני caspase הוא מעכב המפתח של הפעלת caspase בנוירונים 14. כך, נוירונים למות בעקבות הזרקת ציטוכרום c, XIAP חייב קודם כל להיות מובטל. לדוגמה, microinjection של ציטוכרום C לתוך xiap - / - נוירונים אוהדת מספיק כדי לאפשר הפעלת אפופטוזיס caspase ו בתאים אלה (איור 2).
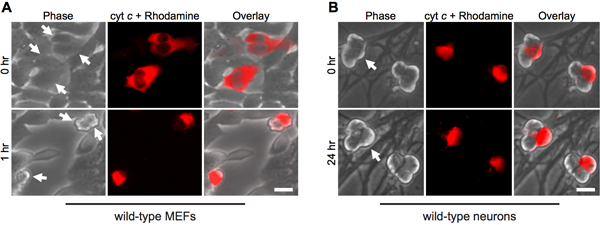
באיור 1. Microinjection cytoplasmic של ציטוכרום C גורם למוות מהיר fibroblasts, אך לא נוירונים. א) wild-type MEFs או (ב) יום הלידה 5 wild-type נוירונים אוהד היו microinjected עם שור ציטוכרום C (10 מ"ג / מ"ל) יחד עם rhodamine-dextran לסמן תאים מוזרקים. תמונות להראות את אותו שדה של הזרקת תאים מיד לאחר (0 שעות), או במועדים המצוין. החצים מצביעים על התאים מוזרקים. סרגל קנה מידה, 20 מיקרומטר.
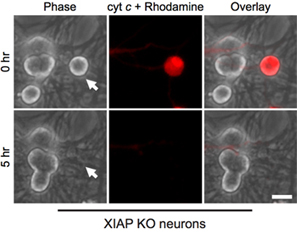
איור 2. XIAP מחסר נוירונים רגישים microinjection cytoplasmic ג ציטוכרום. אחרי לידה 5 יום נוירונים אוהד מעכברים בנוקאאוט XIAP היו microinjected עם שור ציטוכרום C (10 מ"ג / מ"ל) יחד עם rhodamine-dextran לסמן תאים מוזרקים. תמונות להראות את אותו שדה של הזרקת תאים מיד לאחר (0 שעות), או 5 שעות לאחר microinjection ציטוכרום C (5 שעות). סרגל קנה מידה, 20 מיקרומטר.
Discussion
Microinjection של ציטוכרום C ישירות לתוך הציטופלסמה של תאים הוא כלי ייחודי ורב עוצמה המאפשר ללימודי תקנה שלאחר המיטוכונדרי של אפופטוזיס. חשוב לציין, טכניקה זו מאפשרת הפעלה ישירה של הזרם אפופטוזיס של המיטוכונדריה ללא שימוש בחומרים אשר גורמים נזק הסלולר או המיטוכונדריה...
Disclosures
Acknowledgements
עבודה זו נתמכה על ידי NIH כדי להעניק NS042197 MD. AJK נתמך על ידי מענקים T32GM008719 ו F30NS068006.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
|---|---|---|---|
| DM IRE2 מיקרוסקופ הפוך | לייקה | ||
| PC-10 מחט Microinjection פולר | Narishige | ||
| MWO-202 Micromanipulator | Narishige | ||
| FemtoJet Microinjector | Eppendorf | ||
| קיר דק Boroscilicate נימי זכוכית עם Microfilament | AM מערכות | 615000 | 4 סנטימטר אורך, 1.00 מ"מ קוטר חיצוני, קוטר פנימי 0.75 מ"מ |
| Rhodamine isothiocyanate B-dextran | סיגמא אולדריץ | R9379 | משקל מולקולרי ממוצע ~ 70,000 Da |
| שור ציטוכרום חלבון ג | סיגמא אולדריץ | C3131 |
References
- Danial, N. N., Korsmeyer, S. J. Cell death: critical control points. Cell. 116, 205-219 (2004).
- Wang, X. The expanding role of mitochondria in apoptosis. Genes Dev. 15, 2922-2933 (2001).
- Hengartner, M. O. The biochemistry of apoptosis. Nature. 407, 770-776 (2000).
- Fuentes-Prior, P., Salvesen, G. S. The protein structures that shape caspase activity, specificity, activation and inhibition. Biochem. J. 384, 201-232 (2004).
- Tait, S. W., Green, D. R. Mitochondria and cell death: outer membrane permeabilization and beyond. Nat Rev Mol Cell Biol. 11, 621-632 (2010).
- Brustugun, O. T., Fladmark, K. E., Doskeland, S. O., Orrenius, S., Zhivotovsky, B. Apoptosis induced by microinjection of cytochrome c is caspase-dependent and is inhibited by Bcl-2. Cell Death Differ. 5, 660-668 (1998).
- Li, F. Cell-specific induction of apoptosis by microinjection of cytochrome c. Bcl-XL has activity independent of cytochrome c release. J. Biol. Chem. 272, 30299-30305 (1997).
- Deshmukh, M., Johnson, E. M. Evidence of a novel event during neuronal death: development of competence-to-die in response to cytoplasmic cytochrome c. Neuron. 21, 695-705 (1998).
- Vaughn, A. E., Deshmukh, M. Glucose metabolism inhibits apoptosis in neurons and cancer cells by redox inactivation of cytochrome c. Nat. Cell Biol. 10, 1477-1483 (2008).
- Yang, J. Prevention of apoptosis by Bcl-2: release of cytochrome c from mitochondria blocked. Science. 275, 1129-1132 (1997).
- Gonzales, D. H., Neupert, W. Biogenesis of mitochondrial c-type cytochromes. J Bioenerg Biomembr. 22, 753-768 (1990).
- Ellerby, H. M. Establishment of a cell-free system of neuronal apoptosis - comparison of premitochondrial, mitochondrial, and postmitochondrial phases. J. Neurosci. 17, 6165-6178 (1997).
- Neame, S. J., Rubin, L. L., Philpott, K. L. Blocking cytochrome c activity within intact neurons inhibits apoptosis. J. Cell Biol. 142, 1583-1593 (1998).
- Potts, P. R., Singh, S., Knezek, M., Thompson, C. B., Deshmukh, M. Critical function of endogenous XIAP in regulating caspase activation during sympathetic neuronal apoptosis. J. Cell Biol. 163, 789-799 (2003).
- Estus, S. Altered gene expression in neurons during programmed cell death: identification of c-jun as necessary for neuronal apoptosis. J. Cell Biol. 127, 1717-1727 (1994).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved