このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
シトクロムの細胞質マイクロインジェクションによるアポトーシスの活性化 C
要約
このプロトコルでは、我々は、シトクロムの直接細胞質マイクロインジェクションを説明します Cタンパク質。このテクニックは、シトクロムの導入が可能 Cタンパク質 Cミトコンドリアから、これは、アポトーシス中に発生します。
要約
アポトーシス、またはプログラムされた細胞死は、細胞が1を死滅することによって保存し、高度に制御された経路である。細胞は細胞傷害性ストレスの広い範囲に到達したときにアポトーシスを引き起こすことができます。これらの侮辱は、最終的にミトコンドリアの膜間腔から細胞質2〜 シトクロム cの放出を引き起こすシグナル伝達カスケードを開始する。ミトコンドリアからのシトクロム cの放出は、カスパーゼ、最終的に3〜4細胞死を実行する主要な細胞内プロテアーゼの急速な活性化をトリガーするキーイベントです。
アポトーシスの経路はミトコンドリア5からのシトクロム c の放出の上流と下流のポイントで規制されている。カスパーゼ活性化の後のミトコンドリア調節を研究するためには、多くの研究者は細胞6月9日にholocytochrome C(ヘムに接続された)タンパク質の細胞質マイクロインジェクションを指示することになっている。 シトクロム c は、通常、ヘムグループの添付ファイルはそれが10月11日アポトーシス活性化できるようにするために必要であるミトコンドリアに局在している。したがって、直接カスパーゼを活性化するために、それはcDNA構築物からシトクロム cの発現がミトコンドリアターゲティングとヘムの添付ファイルにつながる一方、それは細胞質カスパーゼから隔離されるため、holocytochrome Cタンパク質の代わりに、そのcDNAを注入する必要があります。このように、精製したヘムに接続されたシトクロム c 蛋白質の直接細胞質マイクロインジェクションは、細胞とミトコンドリアの損傷を引き起こす有毒な侮辱を使用せずに、ミトコンドリアのシトクロム c の放出とアポトーシスを模倣するために有用なツールです。
この記事では、我々はマウス胚性繊維芽細胞(MEF)と例のような主要な交感神経ニューロンを用いて、細胞内へのシトクロム c 蛋白質のマイクロインジェクションのための方法を説明します。このプロトコルは、アポトーシスの調査のためのシトクロム cの注入に焦点を当てているが、ここに示されている技術も容易に関心のある他のタンパク質のマイクロインジェクションのために適応させることができる。
プロトコル
1。マイクロインジェクションの針の生産
- プレハブマイクロインジェクションの針は、市販されている( 例えば 。エッペンドルフからFemtotips)と一microinjectionsの多数実行されていない場合に便利です。しかし、マイクロインジェクションのために長期的な能力を確立したい人のために、代替手段は薄い壁ホウケイ酸ガラス毛細管と商業ニードルプラーを使用して実験室でマイクロインジェクションの針を生成することです。これはまた、針の形状を変化させることができますさまざまな種類の細胞に有用であることができる。
- ナリシゲPC - 10マイクロインジェクションニードルプラーで、すべての4つの重みを添付し、58.0(第2のヒーター)で相対的な熱の設定でワンステップ引っ張るプログラム(ステップ1の設定)を使用します。結果の2つの針が同じような長さになるように各キャピラリーの中心に発熱体を配置してください。
- いくつかの毛細血管を(関心の各タンパク質の約2毛細血管)を引き出します。
- 針の先端を破損しないようにしている間に容器に針を保管してください。このような発泡体またはBlu -タックなどの材料は、マイクロインジェクションの針を保持するためにコンテナで使用することができます。
2。注射用タンパク質混合物の調製
- 1 M塩化カリウム及びpH7.4の0.1 Mリン酸カリウム(KPI)バッファ(K 2 HPO 4、KH 2 PO 4の等モル混合物)を含む10倍マイクロインジェクションのバッファを準備します。このバッファは、室温での長期保存することができます。
- 注射を可視化するために、ローダミン-デキストランのような蛍光色素を追加する必要があります。水中でthe10xマイクロインジェクションバッファーを希釈し、20〜40 mg / mLのローダミンデキストランを含む5倍のマイクロインジェクション緩衝液を作るためにローダミン-デキストラン粉末を溶解する。
- 4℃暗所でこのソリューション℃にて保存してください。それは、最大100個々のタンパク質溶液製剤の十分なはずです。フルオレセインイソチオシアネート - デキストランのような他の染料は、置き換えることができます。
- 20 mg / mLの濃度に水で精製シトクロム c を溶解することによってシトクロム c の株式を準備します。 -80℃ストアシトクロム c ° Cの長期保管と小さい(〜10μL)アリコートにシトクロム c を格納することにより、凍結融解を避けるため。
- 3μLの水と1 ×緩衝液(100mM KCl、10mMのKPに10 mg / mLのシトクロム cの最終濃度は5μL シトクロム cとローダミン-デキストランを含む2μL5倍のマイクロインジェクションのバッファを組み合わせることにより、注射用10μLのタンパク質混合物を準備する私 、4-8 mg / mLのローダミンデキストラン)。
3。 シトクロム cの細胞質マイクロインジェクション
- 直前にマイクロインジェクションに、℃のマイクロインジェクションの針を詰まらせる可能性のある粒子状物質を分離するために4℃で10分間16,000 gでシトクロム cおよびマイクロインジェクションバッファーの混合物を遠心分離。
- 遠心操作中に、空気の圧力が構築できるようにするインジェクターをオンにします。
- 顕微鏡ステージの中央に細胞の皿を置き、セルにフォーカスを設定します。細胞をインキュベーター外で保持される時間の量を最小限に抑えるために、細胞は通常、30分以内にインキュベーターに戻されます。
- キャピラリーの平滑末端へのタンパク質の混合物の上面からピペット0.5から1μL。チューブの底に遠心分離されているすべての粒子をピペッティングしないように注意してください。分以内に、タンパク質混合物は毛細管現象を介して針の先端に配布します。
- マイクロマニピュレータと位置の先端が約45 °の角度で、顕微鏡の透過光を通過するように針のキャピラリーホルダーにしっかりと針を取り付けます。
- それは視野の中心に直接置かれているように、針の先端の位置を調整します。センター針をするために、顕微鏡の接眼レンズをのぞきながら、針を移動するためにマイクロマニピュレーターを使用してください。針の影が見えるはずです。その影が唯一の針先がセルの上に中央揃えされていることを示す、視野の半分に見られるようにニードルを調整します。
- 連続フローモードにインジェクターを設定し、20に作動圧力を設定する - 100 hPaのを。それぞれの針は、別の作動圧力を必要とするかもしれません、と使用圧力は、おそらく一定の流れを維持するためにマイクロインジェクションの手順の間に調整が必要になります。
- ちょうど細胞上に位置する粗ノブを使って針を下ろします。これを行うには、ちょうど細胞上の位置に顕微鏡の焦点面を上げる。針の先端にフォーカスがあるまで、粗いノブを使用してセルに向かって針を下ろします。
- 再中央針の視野内の先端と顕微鏡対物を変更することにより、倍率を増加させる。
- 徐々に細かいマニピュレータノブuntiを使用して針を下げるlは針がわずかに細胞の焦点面より上です。
- ローダミンの赤色の蛍光を見ることによって、タンパク質の混合物の流れを確認してください。タンパク質混合物は薄い、定数ストリームとして針を終了する必要があります。針が危険にさらされている場合またはフローがあまりにも強い場合に針を交換して再ロードする必要があります。時には、ガラスキャピラリーの先端はクローズされ、フローが針から見られない。この問題が発生した場合は、針を交換するか、または慎重にゆっくりと破裂針の先端に培養皿の底にそれを下げる。
- それは約45 °の角度でセル方向を向いているように、針の先端を合わせます。セルに向かって移動しながらの滑らかな動きで、針を下ろします。第二滑らかな動きで、すぐに細胞からそれを削除するには、針の方向を反転させます。
- が正常に注入された細胞は、しばしばわずかに膨潤し、細胞内の赤色蛍光ローダミンを視覚化することによって確認することができます。時折、セルが誤って表示される核に注入されます。
- 約50から100の細胞が注入されるまで、顕微鏡のステージを調整することによって、細胞を注入し続ける。顕微鏡ステージを移動するとき、それは細胞の上部をクリアするようにマイクロインジェクションの針を上げてください。
4。代表的な結果:
シトクロム cの細胞質マイクロインジェクションは、アポトーシス中にミトコンドリアから放出を模倣しています。このように、予想通り、線維芽細胞は急速にウシシトクロム c(図1A)の細胞質マイクロインジェクションによりアポトーシスを起こす。酵母シトクロム c はカスパーゼ12を活性化することはできないので単独で注射の手順は、細胞死の責任ではないことを保証するために、酵母シトクロム cの注入は、重要なコントロールとして機能します。
興味深いことに、有糸分裂後交感神経ニューロンは、細胞質シトクロム c(図1B)8,13に対して非常に耐性があります。私たちの研究室では、内因性カスパーゼ阻害剤のXIAPは、ニューロン14のカスパーゼ活性化の鍵阻害剤であることを確認しています。したがって、 シトクロム c の注射後に死ぬためにニューロンは、XIAPは、まず不活性化する必要があります。例えば、XIAPへのシトクロム cのマイクロインジェクション- / -交感神経ニューロンは、これらの細胞におけるカスパーゼ活性化とアポトーシス(図2)を可能にする十分です。
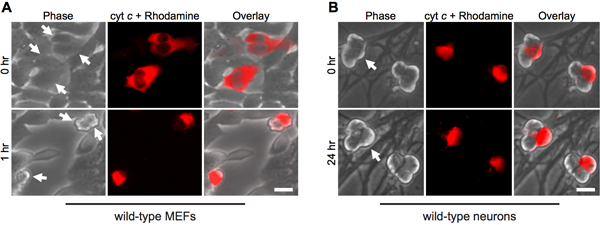
図1。 シトクロム cの細胞質マイクロインジェクションは、急速に線維芽細胞の死ではなく、神経細胞を誘導する。 A)野生型MEFには、または(B)生後5日目の野生型交感神経ニューロンは、注入された細胞をマークするためにローダミン-デキストランと一緒にウシシトクロム c(に10 mg / mL)でマイクロインジェクションした。画像はセルの同じフィールドの直後に注射(0時間)を表示、または指定された時間に。矢印は、注入された細胞を示す。スケールバー、20μmである。
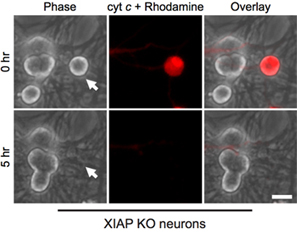
図2。 XIAP欠損ニューロンは、細胞質シトクロム c のマイクロインジェクションの影響を受けやすくなっています 。 XIAPノックアウトマウスから生後5日目交感神経のニューロンは、注入された細胞をマークするためにローダミン-デキストランと一緒にウシシトクロム c(に10 mg / mL)でマイクロインジェクションした。画像は、同じ細胞をすぐに次の注入のフィールド(0時間)、またはシトクロム c のマイクロインジェクション後の5時間(5時間)を示す。スケールバー、20μmである。
ディスカッション
直接細胞の細胞質へのシトクロム cのマイクロインジェクションは、アポトーシスの後のミトコンドリア調節の研究を可能にするユニークで強力なツールです。重要なのは、この手法は、細胞やミトコンドリアの損傷を引き起こす薬剤を使用せずに、ミトコンドリアのアポトーシスの下流の直接活性化することができます。
このプロトコルは、アポトーシスの研究...
開示事項
謝辞
この作品は、MDにNIHの助成金NS042197によってサポートされていました。 AJKは、助成金T32GM008719とF30NS068006によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
|---|---|---|---|
| DM IRE2倒立顕微鏡 | ライカ | ||
| PC - 10マイクロインジェクションニードルプラー | ナリシゲ | ||
| MWO - 202マニピュレーター | ナリシゲ | ||
| FemtoJetマイクロインジェクター | エッペンドルフ | ||
| ミクロフィラメントと薄肉Boroscilicateガラスキャピラリー | AMシステム | 615000 | 4インチの長さは、1.00ミリメートル、外径、0.75ミリメートル、内径 |
| ローダミンBイソチオシアネート - デキストラン | シグマアルドリッチ | R9379 | 平均分子量〜70,000ダ |
| ウシシトクロム c蛋白質 | シグマアルドリッチ | C3131 |
参考文献
- Danial, N. N., Korsmeyer, S. J. Cell death: critical control points. Cell. 116, 205-219 (2004).
- Wang, X. The expanding role of mitochondria in apoptosis. Genes Dev. 15, 2922-2933 (2001).
- Hengartner, M. O. The biochemistry of apoptosis. Nature. 407, 770-776 (2000).
- Fuentes-Prior, P., Salvesen, G. S. The protein structures that shape caspase activity, specificity, activation and inhibition. Biochem. J. 384, 201-232 (2004).
- Tait, S. W., Green, D. R. Mitochondria and cell death: outer membrane permeabilization and beyond. Nat Rev Mol Cell Biol. 11, 621-632 (2010).
- Brustugun, O. T., Fladmark, K. E., Doskeland, S. O., Orrenius, S., Zhivotovsky, B. Apoptosis induced by microinjection of cytochrome c is caspase-dependent and is inhibited by Bcl-2. Cell Death Differ. 5, 660-668 (1998).
- Li, F. Cell-specific induction of apoptosis by microinjection of cytochrome c. Bcl-XL has activity independent of cytochrome c release. J. Biol. Chem. 272, 30299-30305 (1997).
- Deshmukh, M., Johnson, E. M. Evidence of a novel event during neuronal death: development of competence-to-die in response to cytoplasmic cytochrome c. Neuron. 21, 695-705 (1998).
- Vaughn, A. E., Deshmukh, M. Glucose metabolism inhibits apoptosis in neurons and cancer cells by redox inactivation of cytochrome c. Nat. Cell Biol. 10, 1477-1483 (2008).
- Yang, J. Prevention of apoptosis by Bcl-2: release of cytochrome c from mitochondria blocked. Science. 275, 1129-1132 (1997).
- Gonzales, D. H., Neupert, W. Biogenesis of mitochondrial c-type cytochromes. J Bioenerg Biomembr. 22, 753-768 (1990).
- Ellerby, H. M. Establishment of a cell-free system of neuronal apoptosis - comparison of premitochondrial, mitochondrial, and postmitochondrial phases. J. Neurosci. 17, 6165-6178 (1997).
- Neame, S. J., Rubin, L. L., Philpott, K. L. Blocking cytochrome c activity within intact neurons inhibits apoptosis. J. Cell Biol. 142, 1583-1593 (1998).
- Potts, P. R., Singh, S., Knezek, M., Thompson, C. B., Deshmukh, M. Critical function of endogenous XIAP in regulating caspase activation during sympathetic neuronal apoptosis. J. Cell Biol. 163, 789-799 (2003).
- Estus, S. Altered gene expression in neurons during programmed cell death: identification of c-jun as necessary for neuronal apoptosis. J. Cell Biol. 127, 1717-1727 (1994).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved