Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Активация апоптоза Цитоплазматическая Микроинъекция цитохрома С
В этой статье
Резюме
В этом протоколе описываются прямые цитоплазматические микроинъекции цитохрома С Белка в фибробласты и первичных симпатических нейронов. Эта техника позволяет введение цитохрома С Белков в цитоплазме клетки и имитирует выпуск цитохрома С Из митохондрий, которая происходит во время апоптоза.
Аннотация
Апоптоз, или запрограммированная смерть клетки, сохраняется и строго регулируется путь по которому клетки умирают 1. Апоптоз может быть вызван, когда клетки встречи широкий спектр цитотоксического напряжений. Эти оскорбления инициировать сигнальные каскады, которые в конечном итоге вызвать высвобождение цитохрома С из митохондриальных пространства межмембранного в цитоплазму 2. Освобождение цитохрома С из митохондрий является ключевым событием, которое вызывает быструю активацию каспаз, ключ сотовой протеазы, которые в конечном итоге выполнить гибели клеток 3-4.
Путь апоптоза регулируется в точках на входе и выходе системы цитохрома релиз с из митохондрий 5. С целью изучения пост-митохондриальной регуляции активации каспазы, многие исследователи обратились к прямым цитоплазматических микроинъекции holocytochrome с (гем-прилагается) белка в клетках 6-9. Цитохром с, как правило, локализованы в митохондриях, где крепление группы гема Необходимо включить его, чтобы активировать апоптоз 10-11. Поэтому, чтобы непосредственно активировать каспазы, необходимо вводить holocytochrome протеина С, а не его кДНК, потому что в то время как экспрессия цитохрома С из кДНК конструкций приведет к митохондриальной адресности и гема вложений, то это будет поглощенных от цитозольного каспазы. Таким образом, прямой цитозольного микроинъекции очищенной гема подключением белка цитохром с является полезным инструментом, чтобы имитировать митохондриальной цитохром-с-релиз и апоптоз без использования токсичных оскорбления, которые вызывают клеточного и митохондриального повреждения.
В этой статье мы опишем метод микроинъекции белка цитохрома С в клетках, используя мышиных эмбриональных фибробластов (MEFs) и первичных симпатических нейронов в качестве примеров. Хотя этот протокол фокусируется на введении цитохрома С для исследования апоптоза, методы показано здесь также может быть легко адаптирована для микроинъекции других белков, представляющих интерес.
протокол
1. Производство Микроинъекция иглы
- Сборные иглы микроинъекции имеются в продаже (например,. Femtotips от Eppendorf) и полезны, если он не выполняет большое количество микроинъекций. Однако, для тех, кто желает установить долгосрочные возможности для microinjecting, альтернативой является производство микроинъекции иглы в лаборатории, используя тонкие стенки капилляров боросиликатного стекла и коммерческих съемник иглы. Это также позволяет форму иглы должны быть разнообразными, что может быть полезным для различных типов клеток.
- С Narishige PC-10 Микроинъекция иглы Puller, приложите все четыре веса и использовать один шаг потянув программы (этап 1 установка) с относительной термостабилизации на 58,0 (№ 2 обогревателя). Убедитесь, что место нагревательный элемент в центре каждого капилляра, так что получившиеся иглы аналогичной длины.
- Потяните несколько капилляров (около 2 капилляры для каждого белка интересов).
- Магазин иглы в контейнере и быть уверенным, чтобы не повредить кончик иглы. Такие материалы, как пенопласт или Blu-Галс могут быть использованы в контейнерах провести микроинъекции иглы.
2. Подготовка белковых смесей для инъекций
- Подготовка 10х буфера микроинъекции, содержащего 1 М хлористого калия и 0,1 М фосфат калия (KPI) буфер (эквимолярной смеси K 2 HPO 4 и KH 2 PO 4) при рН 7,4. Этот буфер может храниться долгосрочный при комнатной температуре.
- Чтобы представить себе инъекции, флуоресцентный краситель, как родамин-декстран должна быть добавлена. Развести the10x буфера микроинъекции в воде и растворяются родамин-декстран порошок, чтобы сделать 5x буферный раствор микроинъекции содержащего 20-40 мг / мл родамина декстран.
- Хранить раствор в темноте при 4 ° C. Оно должно быть достаточно для 100 индивидуальные препараты белкового раствора. Другие красители, как флуоресцеин изотиоцианата-декстран может заменить.
- Подготовка цитохром с акциями растворением очищенного цитохрома С в воде до концентрации 20 мг / мл. Магазин цитохрома С при -80 ° С в течение длительного хранения и избежать циклов замораживания-оттаивания, сохраняя цитохром с в небольших (~ 10 мкл) аликвоты.
- Подготовка 10 мкл смеси белков для инъекций путем объединения 2 мкл 5х буфера микроинъекции содержащие родамин-декстран с 3 мкл воды и 5 мкл цитохрома С для конечной концентрации 10 мг / мл цитохрома С в 1x буфера (100 мМ KCl, 10 мМ КП я, 4-8 мг / мл родамина декстран).
3. Цитоплазматическая Микроинъекция цитохрома С
- Незадолго до микроинъекции, центрифуги смеси цитохрома с и микроинъекции буфера при 16000 г в течение 10 минут при 4 ° С для отделения любых твердых частиц, которые могут засорить микроинъекции иглы.
- Во время центрифугирования, включите microinjector, чтобы давление воздуха, чтобы построить.
- Место блюдо из клетки в центре столик микроскопа и установить фокус на клетки. Чтобы свести к минимуму количество времени, что клетки остаются вне инкубатора, клетки, как правило, возвращаются в инкубаторе в течение 30 мин.
- Внесите 0.5-1 мкл от верхней поверхности белка смесь в тупой конец капилляра. Будьте осторожны, чтобы не пипетки любых частиц, которые были центрифугируют для нижней части трубы. Через минуту, белковая смесь будет распространять на кончике иглы через капиллярное действие.
- Прикрепить иглы твердо капиллярной обладатель микроманипулятора и положение иглы так, чтобы его кончик проходит через проходящем свете микроскопа примерно под углом 45 °.
- Отрегулируйте положение иглы, чтобы он расположен прямо в центре поля зрения. Расстояние до центра иглы, используйте микроманипулятора для перемещения иглы, глядя через окуляр микроскопа. Иглы тень должна быть видна. Отрегулируйте иглу так, чтобы его тень видели только в одной половине поля зрения, указывая, что кончик иглы по центру над клетками.
- Установить microinjector в режиме непрерывного потока и установить рабочее давление до 20 - 100 гПа. Каждая игла может потребоваться различные рабочие давления и рабочее давление, вероятно, потребуется корректировка во время процедуры микроинъекции для поддержания постоянного потока.
- Опустите иглу использованием грубой ручку в положение чуть выше клеток. Чтобы сделать это, поднять фокальной плоскости микроскопа позиции чуть выше клеток. Затем опустите иглу в направлении клеток с использованием грубой ручку, пока кончик иглы находится в фокусе.
- Re-центр иглы в поле зрения и увеличение увеличение путем изменения объектива микроскопа.
- Медленно опустите иглу использованием тонких Унти ручку манипуляторал иглу чуть выше фокальной плоскости клетки.
- Проверьте поток белковая смесь, глядя на красный флуоресценции родамина. Белковая смесь должна быть выходом иглы в виде тонкой, постоянный поток. Иглы должны быть заменены и заново загружается если игла находится под угрозой или если поток слишком сильный. Иногда кончик стеклянный капилляр является закрытой и не поток видно из иглу. Если это произойдет, замените иглу или осторожно опустите ее на дно культуры блюдо, чтобы мягко разрыв кончике иглы.
- Поместите кончик иглы так, чтобы она направлена в сторону ячейки примерно под углом 45 °. Затем с одним плавным движением, снижение иглы при движении его к клетке. Со вторым плавное движение, сразу же изменить направление иглы, чтобы удалить его из клетки.
- Успешно вводится ячейка часто слегка набухает и может быть подтверждено визуализации красного флуоресцентного родамина внутри клетки. Иногда, ячейка будет случайно вводится в ядро, которое будет видно.
- Продолжайте вводить клетки, регулируя столике микроскопа примерно до 50-100 клетки вводили. При перемещении столике микроскопа, убедитесь, что повышение микроинъекции иглу так, чтобы она очищает верхней части клетки.
4. Представитель Результаты:
Цитоплазматических микроинъекции цитохрома с имитирует его выхода из митохондрий в процессе апоптоза. Таким образом, как и ожидалось, фибробласты быстро подвергаются апоптозу при цитозольного микроинъекции крупного рогатого цитохром с (рис. 1А). Чтобы убедиться, что инъекции процедура сама по себе не несет ответственность за гибель клеток, инъекции дрожжей цитохрома С служит важным контроля, так как дрожжи цитохром с не в состоянии активации каспаз 12.
Интересно, что пост-митотического симпатических нейронов удивительно устойчивы к цитозольного цитохром с (рис. 1В) 8,13. Наша лаборатория выявила, что эндогенный ингибитор каспазы XIAP является ключевым ингибитор каспазы активации нейронов 14. Таким образом, для нейронов, чтобы умереть после инъекции цитохром с, XIAP должны сначала стать инактивируется. Например, микроинъекции цитохрома с в XIAP - / - симпатических нейронов является достаточным для активации каспаз и апоптоз в этих клетках (рис. 2).
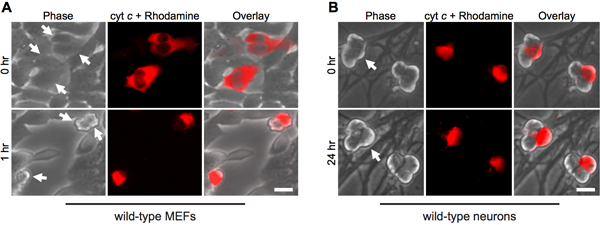
Рисунок 1. Цитоплазматическая микроинъекции цитохрома С вызывает быструю смерть в фибробластах, но не нейроны. ) Дикого типа MEFs или (В) 5-й день послеродового дикого типа симпатических нейронов microinjected бычьим цитохрома С (10 мг / мл) вместе с родамин-декстран, чтобы отметить вводили клетки. Изображения показывают же поле клетки сразу после инъекции (0 ч), или, по крайней указано раза. Стрелки указывают вводили клетки. Шкала бар, 20 мкм.
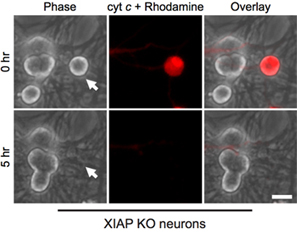
Рисунок 2. XIAP с дефицитом нейронов восприимчивы к цитоплазматической цитохрома микроинъекции с. Послеродовая день 5 симпатические нейроны от XIAP нокаутных мышей были microinjected бычьим цитохрома С (10 мг / мл) вместе с родамин-декстран, чтобы отметить вводили клетки. Изображения показывают же поле клетки сразу после инъекции (0 ч), или через 5 часов после микроинъекции цитохром с (5 ч). Шкала бар, 20 мкм.
Обсуждение
Микроинъекции цитохром с непосредственно в цитоплазме клеток является уникальным и мощным инструментом, который позволяет для исследования после митохондриальной регуляции апоптоза. Важно отметить, что эта техника позволяет прямой активации апоптоза вниз по течению митохондр?...
Раскрытие информации
Благодарности
Эта работа была поддержана NIH грант NS042197 на MD. AJK была поддержана грантами T32GM008719 и F30NS068006.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
|---|---|---|---|
| DM IRE2 инвертированного микроскопа | Leica | ||
| PC-10 Микроинъекция иглы Puller | Narishige | ||
| MWO-202 микроманипулятора | Narishige | ||
| FemtoJet Microinjector | Эппендорф | ||
| Тонкостенные Boroscilicate Капиллярный Стекло с микрофиламентов | Системы AM | 615000 | 4 дюйма длиной, 1,00 мм наружным диаметром, 0,75 мм, внутренний диаметр |
| Родамина Б изотиоцианата-Декстран | Sigma-Aldrich | R9379 | Средняя молекулярная ~ 70000 Da вес |
| Говядине белка цитохром с | Sigma-Aldrich | C3131 |
Ссылки
- Danial, N. N., Korsmeyer, S. J. Cell death: critical control points. Cell. 116, 205-219 (2004).
- Wang, X. The expanding role of mitochondria in apoptosis. Genes Dev. 15, 2922-2933 (2001).
- Hengartner, M. O. The biochemistry of apoptosis. Nature. 407, 770-776 (2000).
- Fuentes-Prior, P., Salvesen, G. S. The protein structures that shape caspase activity, specificity, activation and inhibition. Biochem. J. 384, 201-232 (2004).
- Tait, S. W., Green, D. R. Mitochondria and cell death: outer membrane permeabilization and beyond. Nat Rev Mol Cell Biol. 11, 621-632 (2010).
- Brustugun, O. T., Fladmark, K. E., Doskeland, S. O., Orrenius, S., Zhivotovsky, B. Apoptosis induced by microinjection of cytochrome c is caspase-dependent and is inhibited by Bcl-2. Cell Death Differ. 5, 660-668 (1998).
- Li, F. Cell-specific induction of apoptosis by microinjection of cytochrome c. Bcl-XL has activity independent of cytochrome c release. J. Biol. Chem. 272, 30299-30305 (1997).
- Deshmukh, M., Johnson, E. M. Evidence of a novel event during neuronal death: development of competence-to-die in response to cytoplasmic cytochrome c. Neuron. 21, 695-705 (1998).
- Vaughn, A. E., Deshmukh, M. Glucose metabolism inhibits apoptosis in neurons and cancer cells by redox inactivation of cytochrome c. Nat. Cell Biol. 10, 1477-1483 (2008).
- Yang, J. Prevention of apoptosis by Bcl-2: release of cytochrome c from mitochondria blocked. Science. 275, 1129-1132 (1997).
- Gonzales, D. H., Neupert, W. Biogenesis of mitochondrial c-type cytochromes. J Bioenerg Biomembr. 22, 753-768 (1990).
- Ellerby, H. M. Establishment of a cell-free system of neuronal apoptosis - comparison of premitochondrial, mitochondrial, and postmitochondrial phases. J. Neurosci. 17, 6165-6178 (1997).
- Neame, S. J., Rubin, L. L., Philpott, K. L. Blocking cytochrome c activity within intact neurons inhibits apoptosis. J. Cell Biol. 142, 1583-1593 (1998).
- Potts, P. R., Singh, S., Knezek, M., Thompson, C. B., Deshmukh, M. Critical function of endogenous XIAP in regulating caspase activation during sympathetic neuronal apoptosis. J. Cell Biol. 163, 789-799 (2003).
- Estus, S. Altered gene expression in neurons during programmed cell death: identification of c-jun as necessary for neuronal apoptosis. J. Cell Biol. 127, 1717-1727 (1994).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены