Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L'activation de l'apoptose par micro-injection cytoplasmique du cytochrome C
Dans cet article
Résumé
Dans ce protocole, nous décrivons la micro-injection directe cytoplasmique du cytochrome C dans des fibroblastes primaires et des neurones sympathiques. Cette technique permet l'introduction du cytochrome C dans le cytoplasme des cellules et imite la libération du cytochrome C À partir de mitochondries, ce qui se produit lors de l'apoptose.
Résumé
L'apoptose ou mort cellulaire programmée, est une voie conservées et très réglementé par lequel les cellules meurent 1. L'apoptose peut être déclenchée quand les cellules rencontrent une large gamme de contraintes cytotoxiques. Ces insultes provoquent des cascades de signalisation qui finissent par provoquer la libération du cytochrome c de l'espace intermembranaire mitochondrial vers le cytoplasme 2. La libération du cytochrome c de la mitochondrie est un événement clé qui déclenche l'activation rapide des caspases, les protéases cellulaires clés qui finalement exécuter la mort cellulaire 3-4.
La voie de l'apoptose est régulée dans les points amont et aval de la libération du cytochrome c à partir de 5 mitochondries. Afin d'étudier la régulation post-mitochondrial de l'activation des caspases, de nombreux chercheurs se sont tournés vers la micro-injection cytoplasmique directe de holocytochrome c (hème-jointe) de protéines dans les cellules 6-9. Cytochrome c est normalement localisée dans les mitochondries, où l'attachement d'un groupe hème est nécessaire pour lui permettre d'activer l'apoptose 10-11. Par conséquent, pour activer directement les caspases, il est nécessaire d'injecter la protéine holocytochrome c au lieu de son ADNc, parce que l'expression du cytochrome c de constructions d'ADNc se traduira dans le ciblage mitochondrial et l'attachement hème, il sera séquestré par les caspases cytosolique. Ainsi, la micro-injection directe cytosolique de la protéine purifiée hème-joint le cytochrome c est un outil utile pour imiter cytochrome c mitochondrial libération et l'apoptose sans l'utilisation d'agressions toxiques qui provoquent des dommages cellulaires et mitochondriales.
Dans cet article, nous décrivons une méthode pour la microinjection du cytochrome c de protéines dans les cellules, en utilisant la souris fibroblastes embryonnaires (MEF) et primaires neurones sympathiques comme exemples. Alors que ce protocole met l'accent sur l'injection de cytochrome c pour les enquêtes de l'apoptose, les techniques présentées ici peuvent également être facilement adapté à la micro-injection d'autres protéines d'intérêt.
Protocole
1. Fabrication d'aiguilles de microinjection
- Aiguilles de microinjection préfabriqués sont disponibles commercialement (par exemple. Femtotips d'Eppendorf) et sont utiles si l'on n'est pas performant un grand nombre de micro-injections. Cependant, pour ceux qui souhaitent établir à long terme des capacités de micro-injection, une alternative est de produire des aiguilles de microinjection dans le laboratoire à l'aide à paroi mince en verre borosilicate capillaires et un extracteur d'aiguilles commerciales. Cela permet aussi la forme des aiguilles d'être variée, qui peut être utile pour différents types cellulaires.
- Avec l'extracteur d'aiguilles Narishige PC-10 microinjection, joindre tous les quatre poids et l'utilisation d'un programme en une seule étape traction (Étape 1 réglage) avec le réglage de chaleur relative à 58,0 (chauffage n ° 2). Veillez à placer l'élément chauffant au centre de chaque capillaire afin que les deux aiguilles qui en résultent sont une longueur similaire.
- Tirez plusieurs capillaires (environ 2 capillaires pour chaque protéine d'intérêt).
- Aiguilles Conserver dans un récipient tout en étant sûr de ne pas endommager la pointe de l'aiguille. Des matériaux tels que mousse ou la Blu-Tack peut être utilisée dans des conteneurs à tenir les aiguilles de microinjection.
2. Préparation des mélanges de protéines pour injection
- Préparer un tampon microinjection 10x contenant 1 M de chlorure de potassium et de phosphate de potassium 0,1 M (KPI) tampon (mélange équimolaire de K 2 HPO 4 et KH 2 PO 4) à un pH de 7,4. Ce tampon peut être stocké à long terme à température ambiante.
- Pour visualiser l'injection, un colorant fluorescent comme la rhodamine-dextran doit être ajouté. Diluer tampon microinjection the10x dans l'eau et dissoudre la rhodamine-dextran en poudre pour obtenir une solution tampon contenant microinjection 5x 20-40 mg / ml de rhodamine dextrane.
- Conserver cette solution dans l'obscurité à 4 ° C. Il devrait être suffisant pour jusqu'à 100 préparations individuelles solution de protéines. D'autres colorants, comme l'isothiocyanate de fluorescéine dextrane peut se substituer.
- Préparer le cytochrome c stocks en dissolvant purifiée cytochrome c dans l'eau à une concentration de 20 mg / mL. Magasin de cytochrome c à -80 ° C pour stockage à long terme et d'éviter les cycles de gel-dégel en stockant du cytochrome c dans les petites (~ 10 uL) aliquotes.
- Préparer un mélange de protéines 10 uL pour injection par la combinaison de 2 pi de tampon 5x microinjection contenant rhodamine dextrane avec 3 d'eau et 5 uL c uL cytochrome pour une concentration finale de 10 c mg / mL dans le cytochrome 1x tampon (100 mM KCl, 10 mM KP i, 4-8 mg / ml de rhodamine dextrane).
3. Micro-injection cytoplasmique du cytochrome C
- Juste avant la microinjection, centrifuger le mélange du cytochrome c et le tampon de la micro-injection à 16.000 g pendant 10 minutes à 4 ° C pour séparer les particules qui peuvent obstruer les aiguilles de microinjection.
- Pendant la centrifugation, tournez sur la microinjecteur pour permettre à la pression d'air à construire.
- Placez un plat de cellules sur le centre de la platine du microscope et de mettre l'accent sur les cellules. Afin de minimiser la quantité de temps que les cellules sont maintenues en dehors de l'incubateur, les cellules sont normalement retournés à la couveuse dans les 30 min.
- Pipeter 0,5 à 1 uL de la surface supérieure du mélange de protéines dans l'extrémité émoussée de l'capillaire. Attention à ne pas la pipette toutes les particules qui ont été centrifugés au fond du tube. En une minute, le mélange de protéines se distribuer à la pointe de l'aiguille par capillarité.
- Fixez l'aiguille fermement à la porte capillaire du micromanipulateur et la position de l'aiguille de sorte que sa pointe passe par la lumière transmise du microscope à environ un angle de 45 °.
- Ajustez la position de l'aiguille de sorte qu'il est situé directement dans le centre du champ de vue. Pour centrer l'aiguille, utilisez le micromanipulateur pour déplacer l'aiguille tout en regardant dans l'oculaire du microscope. L'ombre aiguille doit être visible. Réglez l'aiguille de telle sorte que son ombre ne se voit que dans une moitié du champ de vue, indiquant que la pointe de l'aiguille est centrée au-dessus des cellules.
- Réglez le microinjecteur au mode flux continu et régler la pression de travail à 20 - 100 hPa. Chaque aiguille peut exiger une pression différente de travail et la pression de travail sera probablement besoin d'un ajustement lors de la procédure de micro-injection pour maintenir un flux constant.
- Abaissez l'aiguille en utilisant le bouton grossière à une position juste au-dessus des cellules. Pour ce faire, soulever le plan focal du microscope à une position juste au-dessus des cellules. Puis abaisser l'aiguille vers les cellules en utilisant le bouton jusqu'à ce que la grossière pointe de l'aiguille est au point.
- Recentrer l'aiguille dans le champ de vision et augmenter le grossissement en changeant l'objectif du microscope.
- Abaisser lentement l'aiguille à l'aide du bouton de fines unti manipulateurl l'aiguille est légèrement au-dessus du plan focal des cellules.
- Vérifier l'écoulement du mélange de protéines en regardant la fluorescence rouge de la rhodamine. Le mélange de protéines doit être sortie de l'aiguille comme un mince jet constant. Les aiguilles doivent être remplacés et rechargé si l'aiguille est compromise ou si le débit est beaucoup trop forte. Parfois, le bout du capillaire en verre est fermée et aucun débit est vu de l'aiguille. Si cela se produit, remplacer l'aiguille ou l'abaissez au fond de la boîte de culture à la douceur de rupture de la pointe de l'aiguille.
- Placez le bout de l'aiguille afin qu'elle pointe vers une cellule à environ un angle de 45 °. Puis, avec un mouvement fluide, abaisser l'aiguille tout en le déplaçant vers la cellule. Avec une deuxième motion en douceur, immédiatement inverser le sens de l'aiguille pour l'enlever de la cellule.
- Une cellule de succès seront injectés souvent légèrement gonfler et peut être confirmé par la visualisation des rhodamine fluorescente rouge dans la cellule. Parfois, une cellule sera accidentellement injecté dans le noyau, ce qui sera visible.
- Continuer à injecter des cellules en ajustant la platine du microscope jusqu'à environ 50-100 cellules sont injectées. Lors du déplacement de la platine du microscope, assurez-vous de relever l'aiguille de microinjection afin qu'il efface le sommet des cellules.
4. Les résultats représentatifs:
La micro-injection cytoplasmique de cytochrome c imite sa libération de mitochondries cours de l'apoptose. Ainsi, comme attendu, les fibroblastes rapidement en apoptose après microinjection cytosolique de bovins du cytochrome c (figure 1A). Afin de s'assurer que la procédure d'injection elle seule n'est pas responsable de la mort des cellules, l'injection de levure cytochrome c sert un contrôle important, puisque la levure du cytochrome c est incapable d'activer les caspases 12.
Fait intéressant, post-mitotiques neurones sympathiques sont remarquablement résistants aux cytosolique du cytochrome c (Fig. 1B) 8,13. Notre laboratoire a identifié que la protéine XIAP caspases endogènes inhibiteur est un inhibiteur de la clé de l'activation des caspases dans les neurones 14. Ainsi, pour les neurones de mourir après injection de cytochrome c, XIAP doit d'abord devenir inactivé. Par exemple, la microinjection du cytochrome c dans XIAP - / - neurones sympathiques est suffisante pour permettre l'activation des caspases et l'apoptose dans ces cellules (Fig. 2).
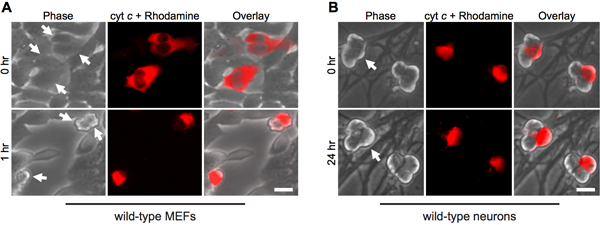
Figure 1. Micro-injection cytoplasmique du cytochrome c induit une mort rapide dans les fibroblastes, mais pas les neurones. A) de type sauvage FAE ou (B) 5 jours après la naissance de type sauvage neurones sympathiques ont été micro-injecté avec bovin cytochrome c (10 mg / mL) en collaboration avec la rhodamine-dextran pour marquer les cellules injectées. Les images montrent le même champ de cellules immédiatement après l'injection (0 h), ou aux moments indiqués. Les flèches indiquent les cellules injectées. La barre d'échelle, 20 um.
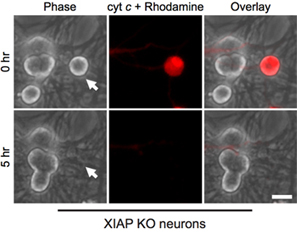
Figure 2. XIAP déficientes neurones sont sensibles à la micro-injection cytoplasmique du cytochrome c. Postnatale jour 5 neurones sympathiques de souris knockout XIAP ont été micro-injecté avec bovin cytochrome c (10 mg / mL) en collaboration avec la rhodamine-dextran pour marquer les cellules injectées. Les images montrent le même champ de cellules immédiatement après l'injection (0 h), ou 5 heures après le cytochrome c microinjection (5 h). La barre d'échelle, 20 um.
Discussion
La micro-injection de cytochrome c directement dans le cytoplasme des cellules est un outil unique et puissant qui permet d'études de la régulation post-mitochondriale de l'apoptose. Fait important, cette technique permet l'activation directe de l'apoptose aval de la mitochondrie, sans l'utilisation d'agents qui causent des dommages cellulaires ou mitochondriales.
Bien que ce protocole a porté sur la microinjection du cytochrome c pour les études...
Déclarations de divulgation
Remerciements
Ce travail a été soutenu par NIH NS042197 à MD. AJK a été soutenue par des subventions et des T32GM008719 F30NS068006.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| DM IRE2 microscope inversé | Leica | ||
| PC-10 Extracteur d'aiguilles microinjection | Narishige | ||
| Adjum-202 Micromanipulateur | Narishige | ||
| FemtoJet microinjecteur | Eppendorf | ||
| Paroi mince Boroscilicate capillaire en verre avec Microfilament | Systèmes AM | 615000 | 4 pouces de longueur, 1,00 mm de diamètre extérieur, 0,75 mm de diamètre interne |
| Rhodamine B isothiocyanate-Dextran | Sigma-Aldrich | R9379 | Poids moléculaire moyen 70 000 Da ~ |
| Bovine Cytochrome protéine C | Sigma-Aldrich | C3131 |
Références
- Danial, N. N., Korsmeyer, S. J. Cell death: critical control points. Cell. 116, 205-219 (2004).
- Wang, X. The expanding role of mitochondria in apoptosis. Genes Dev. 15, 2922-2933 (2001).
- Hengartner, M. O. The biochemistry of apoptosis. Nature. 407, 770-776 (2000).
- Fuentes-Prior, P., Salvesen, G. S. The protein structures that shape caspase activity, specificity, activation and inhibition. Biochem. J. 384, 201-232 (2004).
- Tait, S. W., Green, D. R. Mitochondria and cell death: outer membrane permeabilization and beyond. Nat Rev Mol Cell Biol. 11, 621-632 (2010).
- Brustugun, O. T., Fladmark, K. E., Doskeland, S. O., Orrenius, S., Zhivotovsky, B. Apoptosis induced by microinjection of cytochrome c is caspase-dependent and is inhibited by Bcl-2. Cell Death Differ. 5, 660-668 (1998).
- Li, F. Cell-specific induction of apoptosis by microinjection of cytochrome c. Bcl-XL has activity independent of cytochrome c release. J. Biol. Chem. 272, 30299-30305 (1997).
- Deshmukh, M., Johnson, E. M. Evidence of a novel event during neuronal death: development of competence-to-die in response to cytoplasmic cytochrome c. Neuron. 21, 695-705 (1998).
- Vaughn, A. E., Deshmukh, M. Glucose metabolism inhibits apoptosis in neurons and cancer cells by redox inactivation of cytochrome c. Nat. Cell Biol. 10, 1477-1483 (2008).
- Yang, J. Prevention of apoptosis by Bcl-2: release of cytochrome c from mitochondria blocked. Science. 275, 1129-1132 (1997).
- Gonzales, D. H., Neupert, W. Biogenesis of mitochondrial c-type cytochromes. J Bioenerg Biomembr. 22, 753-768 (1990).
- Ellerby, H. M. Establishment of a cell-free system of neuronal apoptosis - comparison of premitochondrial, mitochondrial, and postmitochondrial phases. J. Neurosci. 17, 6165-6178 (1997).
- Neame, S. J., Rubin, L. L., Philpott, K. L. Blocking cytochrome c activity within intact neurons inhibits apoptosis. J. Cell Biol. 142, 1583-1593 (1998).
- Potts, P. R., Singh, S., Knezek, M., Thompson, C. B., Deshmukh, M. Critical function of endogenous XIAP in regulating caspase activation during sympathetic neuronal apoptosis. J. Cell Biol. 163, 789-799 (2003).
- Estus, S. Altered gene expression in neurons during programmed cell death: identification of c-jun as necessary for neuronal apoptosis. J. Cell Biol. 127, 1717-1727 (1994).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon