Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sitokrom Sitoplazmik Mikroenjeksiyon Apoptoz aktivasyonu C
Bu Makalede
Özet
Bu protokol, sitokrom doğrudan sitoplazmik mikroenjeksiyon C Fibroblastlar ve birincil sempatik nöronlar içine protein. Bu teknik, sitokrom giriş için izin verir C Hücreleri ve taklit sitokrom serbest sitoplazma içine protein C Mitokondri, apoptozis sırasında oluşur.
Özet
Apoptozis veya programlanmış hücre ölümüne yardımcı hücreleri ölür 1 tarafından korunmuş ve oldukça düzenli bir yoludur . Hücrelerin sitotoksik gerilmeler geniş bir yelpazede karşılaştığınızda Apoptoz tetiklenebilir. Bu hakaretler, sonuçta, mitokondriyal arası boşlukta sitoplazma 2 sitokrom c salınımına neden sinyal kaskadlar başlatabilir. Mitokondri sitokrom c salınımı caspases, sonuçta 3-4 hücre ölümü yürütmek en önemli hücresel proteazlar hızlı aktivasyonunu tetikler kilit bir olay.
Apoptozis yol mitokondri 5 sitokrom c serbest memba ve mansap noktalarında düzenlenir. Kaspaz aktivasyonu sonrası mitokondriyal yönetmelik çalışması için, birçok araştırmacılar, holocytochrome c (heme bağlı) hücrelerin içine protein 6-9 sitoplazmik doğrudan mikroenjeksiyon çevirdiler . Sitokrom c normalde heme grubu eki, 10-11 apoptozis etkinleştirmek için sağlamak için gerekli olduğu mitokondri lokalize olur . Bu nedenle, doğrudan caspases etkinleştirmek için, sitokrom c cDNA yapıları ifade mitokondriyal hedefleme ve hem eki neden olurken, sitozolik caspases saklamış olacak çünkü holocytochrome c protein yerine cDNA enjekte etmek gereklidir. Böylece, saflaştırılmış heme bağlı sitokrom c protein doğrudan sitozolik mikroenjeksiyon, hücresel ve mitokondriyal hasara yol açan toksik hakaret kullanmadan mitokondrial sitokrom c salınımı ve apoptoz taklit etmek için yararlı bir araçtır.
Bu makalede, fare embriyonik fibroblastlar (MEFS) ve örnek olarak birincil sempatik nöronlar kullanarak, sitokrom c proteinin hücre içine mikroenjeksiyon için bir yöntem açıklanmaktadır. Bu protokol apopitoz araştırmalar için sitokrom c enjeksiyon odaklanırken, burada gösterilen teknikleri da kolayca diğer ilgi proteinlerin mikroenjeksiyon için adapte olabilir.
Protokol
1. Mikroenjeksiyon İğneleri Üretimi
- Prefabriklerin mikroenjeksiyon iğneler ticari olarak mevcuttur (örn. Eppendorf Femtotips) ve bir microinjections bir sayıda performans ise yararlıdır. Ancak, uzun vadeli yetenekleri microinjecting kurmak isteyenler için alternatif bir ince duvar borosilikat cam kapilerleri ve ticari bir iğne çektirmenin kullanarak laboratuvar mikroenjeksiyon iğne üretmektir. Bu aynı zamanda farklı hücre türleri için yararlı olabilir çeşitlendirilecek iğne şeklini sağlar.
- Narishige PC-10 Mikroenjeksiyon İğne Çektirme, tüm dört farklı ağırlık takın ve 58.0 göreceli ısı ayarı (No.2 ısıtıcı) ile bir adım çekme programı (Adım 1 ayar) kullanabilirsiniz. Çıkan iki iğne benzer bir uzunluk, böylece her kılcal merkezi ısıtma elemanı yerleştirmek için emin olun.
- Birkaç kılcal damarlar (kılcal damarların yaklaşık 2 ilgi her protein için) çekin.
- Bir kapta saklayın iğne iğne ucu zarar vermemek için emin olmak. Mikroenjeksiyon iğneler, köpük ya da Blu-Tack gibi malzemeler tutmak için konteyner kullanılabilir.
2. Enjeksiyon için protein karışımlar hazırlanması
- 7.4 pH 1 M potasyum klorür ve 0.1 M potasyum fosfat (KPI) tamponu (K 2 HPO 4 ve KH 2 PO 4 ekimolar karışımı) içeren bir 10x mikroenjeksiyon tampon hazırlayın. Bu tampon, uzun süreli oda sıcaklığında saklanabilir.
- Enjeksiyon görselleştirmek için rodamin-dekstran gibi bir floresan boya eklenmesi gerekiyor. The10x mikroenjeksiyon tampon su seyreltilir ve 20-40 mg / ml rodamin dekstran içeren 5x mikroenjeksiyon tampon çözelti yapmak için rodamin-dekstran tozu çözülür.
- Karanlıkta bu çözüm Mağaza, 4 ° C 100'e kadar bireysel protein çözüm hazırlıkları için yeterli olmalıdır. Floresein izotiyosiyanat-dekstran gibi diğer boyalar, ikame edebilir.
- 20 mg / ml 'lik bir konsantrasyon, arıtılmış sitokrom c suda çözünür sitokrom c stokları hazırlayın . -80 Saklayınız sitokrom c ° C uzun süreli depolama ve sitokrom c küçük (~ 10 mcL) alikotları saklayarak, donma-çözülme döngüleri önlemek için.
- 1x tampon (100 mM KCl, 10 mM KP son konsantrasyon 10 mg / ml sitokrom c 3 mcL su ve 5 mcL sitokrom c rodamin-dekstran içeren 2 mcL 5x mikroenjeksiyon tampon birleştirerek enjeksiyon için 10 mcL protein karışımı hazırlayın i, 4-8 mg / ml rodamin dekstran).
3. Sitokrom c Sitoplazmik Mikroenjeksiyon
- Mikroenjeksiyon hemen önce, 4, 10 dakika 16.000 g sitokrom c ve mikroenjeksiyon tampon karışımı santrifüj ° C mikroenjeksiyon iğneler tıkayabilir herhangi bir partikül madde ayrı.
- Santrifüj sırasında, hava basıncı oluşturmak için izin mikroenjektör açmak.
- Hücrelerin mikroskop sahne ortasına bir tabak koyun ve hücrelere odaklanmak. Hücrelerin inkübatör dışında tutulmasını zaman miktarını en aza indirmek için, hücreleri genellikle inkübatör 30 dakika içinde iade edilir.
- Pipet 0.5-1 kılcal künt ucunu protein karışımı üst yüzeyi mcL. Parçacıkları tüpün dibine santrifüj edilmiştir herhangi bir pipetle için dikkatli olun. Bir dakika içinde, protein karışımı kapiler eylem yoluyla iğne ucu dağıtacak.
- Mikromanipülatör ve pozisyon iğne ucu yaklaşık 45 derecelik bir açıyla mikroskop iletilen ışık geçer böylece kılcal sahibine sıkıca iğne takın.
- Doğrudan görüş alanının merkezinde yer alır, böylece iğne ucunun konumunu ayarlayın. Iğne merkezi için, mikroskop mercek aracılığıyla bakarken iğne taşımak için mikromanipülatör kullanın. Iğne gölge görünür olmalıdır. Iğne, onun gölgesi sadece iğne ucu hücreleri üzerinde merkezli olduğunu belirten görüş alanında bir yarısında görülür şekilde ayarlayın.
- Mikroenjektör Sürekli Flow moduna ayarlayın ve çalışma basıncı 20 - 100 hPa. Her iğne, farklı bir çalışma basıncı gerektirebilir, ve çalışma basıncı, büyük olasılıkla sabit bir akış sağlamak için mikroenjeksiyon işlemi sırasında ayarlanması gerekecektir.
- Yukarıda hücreler sadece bir pozisyon için kaba düğmesini kullanarak iğne indirin. Bunu yapmak için mikroskop odak düzlemine hücreleri üzerinde bir konuma yükseltmek. Sonra kaba düğmesini kullanarak hücrelerin doğru iğne, iğne ucu odak kadar düşük olur.
- Re merkezi görüş alanı içinde iğne ucu ve mikroskop objektif değiştirmeden büyütme oranını artırın.
- Yavaş yavaş, ince manipülatör topuzu unti kullanarak iğne düşükl iğne hücrelerin odak düzlemi üzerinde sadece biraz.
- Rodamin kırmızı floresan protein karışımı akışını kontrol edin. Protein karışımı ince, sürekli olarak iğne çıkmadan olmalıdır. İğneler ve iğne tehlikeye yeniden yüklenmiş değiştirilmesi ya da akışı çok güçlü olmalıdır Bazen, kılcal cam ucu kapalı ve iğne akış görülür. Bu durum ortaya çıkarsa, iğne değiştirmek veya iğne ucu hafifçe rüptürü dikkatlice kültür çanak alt düşük.
- Iğne ucu, yaklaşık 45 derecelik bir açıyla bir hücreyi dönük şekilde yerleştirin. Hücre doğru hareket ederken Sonra tek bir düzgün hareket, iğne düşük. Ikinci bir yumuşak hareket ile, hemen hücre çıkarmak için iğne yönü ters.
- Hücre başarıyla enjekte genellikle biraz şişer ve hücre içinde kırmızı floresan rodamin görselleştirme tarafından teyit edilebilir. Bazen, bir hücrenin çekirdeği, görünür olacaktır yanlışlıkla enjekte edilir.
- Mikroskop aşamasına kadar yaklaşık 50-100 hücreleri enjekte edilir ayarlayarak hücre enjekte etmek için devam edin. Mikroskop sahne taşırken, üst hücreleri temizler böylece mikroenjeksiyon iğne yükseltmek için emin olun.
4. Temsilcisi Sonuçlar:
Sitokrom c sitoplazmik mikroenjeksiyon apoptozis sırasında, mitokondride serbest taklit eder. Bu nedenle, beklendiği gibi, fibroblastlar sığır sitokrom c (Şekil 1A) sitozolik mikroenjeksiyon üzerine apoptozis hızla geçmesi. Maya sitokrom c caspases 12 aktive aciz olduğundan, yalnız enjeksiyon prosedürü hücre ölümünden sorumlu olmadığından emin olmak için, maya sitokrom c enjeksiyon, önemli bir kontrol olarak hizmet vermektedir .
İlginçtir ki, post-mitotik sempatik nöronlar sitozolik sitokrom c (Şekil 1B) 8,13 dikkat çekici dayanıklıdır. Laboratuvar endojen kaspaz inhibitörü XIAP nöronlar 14 kaspaz aktivasyonu önemli bir inhibitörü olduğunu tespit etmiştir. Bu nedenle, sitokrom c enjeksiyonu takiben ölmek nöronlar için, XIAP ilk inaktive haline gelmelidir . Örneğin, sitokrom c xiap içine mikroenjeksiyon - / - sempatik nöronlar, bu hücrelerde kaspaz aktivasyonu ve apoptozis (Şekil 2) için yeterli .
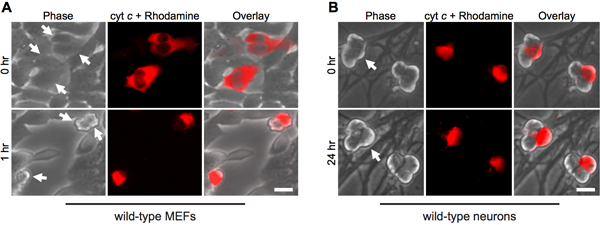
Şekil 1. Sitokrom c Sitoplazmik mikroenjeksiyon nöronlar fibroblastlar hızlı ölüme neden olur, ama değil . A) Wild-tip MEFS veya (B) doğum sonrası 5 gün yabani tip sempatik nöronlar ile birlikte enjekte hücreleri işaretlemek için rodamin-dekstran sığır sitokrom c (10 mg / ml) ile microinjected. Görüntü aynı hücreleri hemen sonra enjeksiyon (0 saat) alanında, ya da belirtilen zaman gösterir. Oklar enjekte edilen hücreler gösterir. Ölçeği bar, 20 mm.
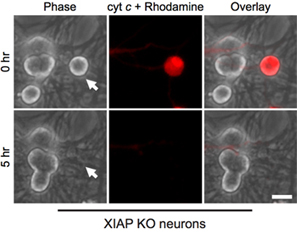
Şekil 2. XIAP eksikliği nöronların sitoplazmik sitokrom c mikroenjeksiyon duyarlı. XIAP knockout farelerde postnatal 5. günde sempatik nöronlar enjekte hücreleri işaretlemek için rodamin-dekstran ile birlikte sığır sitokrom c (10 mg / ml) ile microinjected. Görüntüler hücreler hemen aşağıdaki enjeksiyon alanında aynı (0 saat), veya 5 saat sonra sitokrom c mikroenjeksiyon (5 saat) göstermektedir. Ölçeği bar, 20 mm.
Tartışmalar
Sitokrom c, doğrudan hücre sitoplazma içine mikroenjeksiyon apopitoz sonrası mitokondriyal düzenleme çalışmaları için olanak sağlayan bir benzersiz ve güçlü bir araçtır. Önemlisi, bu teknik, hücresel veya mitokondriyal hasara yol açan ajanların kullanımı olmadan mitokondri apoptozis downstream doğrudan aktivasyonu için olanak sağlar.
Bu protokol, apoptozis çalışmaları için sitokrom c mikroenjeksiyon odaklanmış olsa da, genel ilkeleri Burada g...
Açıklamalar
Teşekkürler
Bu çalışma, MD, Ulusal Sağlık Enstitüsü, hibe NS042197 tarafından desteklenen oldu. Ajk hibe T32GM008719 ve F30NS068006 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifin Adı | Şirket | Katalog numarası | Yorumlar |
|---|---|---|---|
| DM IRE2 Ters Mikroskop | Leica | ||
| PC-10 Mikroenjeksiyon İğne Çektirme | Narishige | ||
| MWO-202 Mikromanipülatör | Narishige | ||
| FemtoJet mikroenjektör | Eppendorf | ||
| Microfilament İnce duvar Boroscilicate Kılcal Cam | AM Sistemleri | 615000 | 4 inç uzunluğunda, 1.00 mm dış çapı, 0,75 mm iç çapı |
| Rodamin B izotiyosiyanat-Dextran | Sigma-Aldrich | R9379 | Ortalama moleküler ağırlık ~ 70.000 Da |
| Sığır Sitokrom c Protein | Sigma-Aldrich | C3131 |
Referanslar
- Danial, N. N., Korsmeyer, S. J. Cell death: critical control points. Cell. 116, 205-219 (2004).
- Wang, X. The expanding role of mitochondria in apoptosis. Genes Dev. 15, 2922-2933 (2001).
- Hengartner, M. O. The biochemistry of apoptosis. Nature. 407, 770-776 (2000).
- Fuentes-Prior, P., Salvesen, G. S. The protein structures that shape caspase activity, specificity, activation and inhibition. Biochem. J. 384, 201-232 (2004).
- Tait, S. W., Green, D. R. Mitochondria and cell death: outer membrane permeabilization and beyond. Nat Rev Mol Cell Biol. 11, 621-632 (2010).
- Brustugun, O. T., Fladmark, K. E., Doskeland, S. O., Orrenius, S., Zhivotovsky, B. Apoptosis induced by microinjection of cytochrome c is caspase-dependent and is inhibited by Bcl-2. Cell Death Differ. 5, 660-668 (1998).
- Li, F. Cell-specific induction of apoptosis by microinjection of cytochrome c. Bcl-XL has activity independent of cytochrome c release. J. Biol. Chem. 272, 30299-30305 (1997).
- Deshmukh, M., Johnson, E. M. Evidence of a novel event during neuronal death: development of competence-to-die in response to cytoplasmic cytochrome c. Neuron. 21, 695-705 (1998).
- Vaughn, A. E., Deshmukh, M. Glucose metabolism inhibits apoptosis in neurons and cancer cells by redox inactivation of cytochrome c. Nat. Cell Biol. 10, 1477-1483 (2008).
- Yang, J. Prevention of apoptosis by Bcl-2: release of cytochrome c from mitochondria blocked. Science. 275, 1129-1132 (1997).
- Gonzales, D. H., Neupert, W. Biogenesis of mitochondrial c-type cytochromes. J Bioenerg Biomembr. 22, 753-768 (1990).
- Ellerby, H. M. Establishment of a cell-free system of neuronal apoptosis - comparison of premitochondrial, mitochondrial, and postmitochondrial phases. J. Neurosci. 17, 6165-6178 (1997).
- Neame, S. J., Rubin, L. L., Philpott, K. L. Blocking cytochrome c activity within intact neurons inhibits apoptosis. J. Cell Biol. 142, 1583-1593 (1998).
- Potts, P. R., Singh, S., Knezek, M., Thompson, C. B., Deshmukh, M. Critical function of endogenous XIAP in regulating caspase activation during sympathetic neuronal apoptosis. J. Cell Biol. 163, 789-799 (2003).
- Estus, S. Altered gene expression in neurons during programmed cell death: identification of c-jun as necessary for neuronal apoptosis. J. Cell Biol. 127, 1717-1727 (1994).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır