Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La detección de óxido nítrico y el radical anión superóxido por espectroscopía de resonancia paramagnética de electrones de las células utilizando atrapadores
En este artículo
Resumen
Resonancia de electrones paramagnético (EPR), espectroscopía fue empleado para detectar óxido nítrico a partir de células endoteliales aórticas bovinas y aniones radicales superóxido de los neutrófilos humanos utilizando hierro (II)-N-metil-D-glucamina ditiocarbamato, Fe (mgd) 2 Y 5,5-dimetil-1-pyroroline-N-óxido, DMPO, respectivamente.
Resumen
El nitrógeno reactivo / especies de oxígeno (ROS / RNS) a bajas concentraciones jugar un papel importante en la regulación de la función celular, de señalización, y la respuesta inmune, pero en concentraciones no regulados son perjudiciales para la viabilidad celular 1, 2. Mientras que los sistemas vivos han evolucionado con los mecanismos de defensa antioxidantes endógenos y la dieta para regular la generación de ROS, ROS se producen continuamente, como subproductos naturales del metabolismo normal del oxígeno y puede causar daño oxidativo a las biomoléculas que resultan en la pérdida de función de las proteínas, ADN división, o de los lípidos peroxidación de los tres, y en última instancia con el estrés oxidativo que conduce a la lesión celular o la muerte 4.
Radical anión superóxido (O 2 • -) es el principal precursor de algunas de las especies más altamente oxidantes conocidos que existen en los sistemas biológicos, tales como peroxinitrito y el radical hidroxilo. La generación de O 2 • - señala el primer signo de ruptura oxidativa, y por lo tanto, ict detección y / o retención en los sistemas biológicos es importante. En esta demostración, O 2 • - fue generada a partir de los neutrófilos polimorfonucleares (PMN). A través de la estimulación quimiotáctica con forbol-12-miristato-13-acetato (PMA), PMN genera O 2 • - a través de la activación de la nicotinamida adenina dinucleótido fosfato (NADPH) oxidasa 5.
El óxido nítrico (NO) sintasa, que se presenta en tres isoformas, como inducible, neuronal y NOS endotelial, o iNOS, nNOS o eNOS, respectivamente, cataliza la conversión de L-arginina a L-citrulina, utilizando NADPH para producir N º 6 . Aquí, NO generado a partir de células endoteliales. Bajo condiciones de estrés oxidativo, NOSe por ejemplo puede cambiar de la producción de NO a O 2 • - en un proceso llamado desacoplamiento, que se cree que está causada por la oxidación del grupo hemo 7 o el factor de co-, tetrahidrobiopterina (BH 4) 8.
Hay sólo unos pocosmétodos fiables para la detección de radicales libres en los sistemas biológicos, pero están limitadas por la especificidad y sensibilidad. Atrapamiento centrifugado se utiliza comúnmente para la identificación de los radicales libres e implica la reacción de adición de un radical a una trampa de giro formando un aducto giro persistente que puede ser detectado por resonancia paramagnética electrónica (EPR), espectroscopía. Los aductos de varios radicales presentan espectro característico que puede ser utilizado para identificar a los radicales que se generan y pueden proporcionar una gran cantidad de información acerca de la naturaleza y la cinética de la producción de radicales 9.
Los nitronas cíclicos, 5,5-dimetil-pirrolina-N-óxido, DMPO 10, la fosforil-sustituido DEPMPO 11, y el éster-sustituido, EMPO 12 y BMPO 13, han sido ampliamente empleado como atrapadores - el giro último trampas exhibe ya las vidas medias de O 2 • - aducto. Hierro (II)-N-metil-D-glucamina ditiocarbamato, Fe (MGD) 2 </> Sub se utiliza comúnmente para atrapar NO debido a la alta tasa de formación de aducto y la alta estabilidad del aducto giro 14.
Protocolo
1. Cultivo de las células endoteliales aórticas bovinas (BAEC)
- Técnicas adecuadas de asepsia fueron seguidos.
- En un baño de agua, medio caliente sin antibióticos a 37 ° C.
Nota: El medio se compone de fenol libre Dulbecco modificado de Eagle (DMEM) con 4,5 g / l de D-glucosa, 4 mM de L-glutamina, 1% sin aminoácidos esenciales, suplementado con fetal al 10% de suero bovino (FBS) y 2,5 mg / l de factor de crecimiento endotelial.
- Retirar los T75 matraz que contenía las células de la incubadora y limpiar la superficie del matraz con etanol al 70% antes de colocarlo dentro de la campana.
- Eliminar el medio de edad usando un aspirador y lavar dos veces con 5 ml de solución salina tampón de fosfato de Dulbecco (DPBS).
- Añadir 2 ml de tripsina y esperar a 4-5 min para separar las células mientras que periódicamente inspeccionar bajo el microscopio.
- Añadir 3 ml del medio y repetidamente mezclar utilizando una pipeta para separada tél las células y crean una suspensión homogénea.
- Transferir 5 ml del medio con tripsina a un tubo de 15 ml y se centrifuga a 121 g durante 5 min.
- Eliminar el sobrenadante utilizando un aspirador. Añadir 5 ml de DPBS y mezclar bien. Centrifugar a 121g durante 5 min.
- Aspirar el sobrenadante y resuspender el sedimento celular mediante la adición de 6 ml del medio.
- En una placa de 6 pocillos, añadir 1 ml de la suspensión de células a cada pocillo a continuación, añadir 1 ml del medio. Mezclar la suspensión con una pipeta.
- Marque la placa y se incuba durante la noche a 37 ° C y 5% de CO 2.
2A. La detección de NO con la célula BAEC
- Técnicas adecuadas de asepsia fueron seguidos.
- Retirar la placa de 6 pocillos de la incubadora y aspirar el medio desde el primer pocillo. Se lavan las células dos veces con 1 ml DPBS.
- Añadir 210 l de 1,9 mM de sulfato de hierro heptahidratado (II) (FeSO 4 .7 H 2 O, prepararlos frescos mediante la disolución de 0,8 mg en1 DPBS ml con CaCl 2 y MgCl 2) y 210 l de amonio N-metil-D-glucamina ditiocarbamato (MGD, prepararlos frescos mediante la disolución de 2,7 mg en 500 ml con DPBS CaCl 2 y MgCl 2) con una proporción de 1:7 . (Nota:. Esta relación, cuando se utilice MGD exceso ha sido empleada convencionalmente para la preparación de Fe 2 +-MGD complejo debido al hecho de que el rendimiento para el Fe 3 +-mgd se maximiza en presencia de exceso de MGD La adición de ascorbato en solución para estabilizar el Fe 2 +-MGD no es necesario puesto que el NO 3-Fe +-mgd se forma endógenamente reduce a la detectable EPR NO-Fe 2 +-MGD por ascorbato, hidroquinona, o cisteína con una eficiencia de conversión de hasta a 99,9% .. El estado de espín diamagnético baja de Fe 2 + permite la detección de NO utilizando células plana o un tubo capilar sin la necesidad de un dispositivo de baja temperatura) 15.
- Agitar la suspensión resultante bien y añadir 4,6 μl de ionóforo de calcio (ICa) (preparado a partir de una solución madre de 1,9 mM disolviendo 1 mg en 1 ml de DMSO).
- Agitar la solución de nuevo y se incuba a 37 ° C durante 36 minutos a fin de permitir una mayor reducción de NO-Fe 3 +-MGD a la detectable EPR NO-Fe 2 +-MGD.
- Recoger el sobrenadante (425 l) en un tubo Eppendorf y la transferencia a una celda EPR plana (o de un tubo capilar 50 l).
- Parámetros de adquisición del EPR son los siguientes: la frecuencia de microondas: 9,8 GHz; el jardín central: 3427 G, la modulación de amplitud: 6,0 g; anchura de barrido: 100 g; ganancia del receptor: 1 x 10 5; potencia de microondas: 10 mW; número total de exploraciones: 121; tiempo de barrido: 10 s, y la constante de tiempo: 20 ms (Nota: Ya que los parámetros pueden variar de un instrumento y las condiciones experimentales a otro, por lo tanto, sólo el centro del campo, la frecuencia y la modulación de amplitud son los parámetros más importantes a considerar.).
- Registrar el espectro a temperatura ambiente y los espectros de 2-D se integnominal para reducir el ruido de fondo y la línea base corregida con Bruker WinEPR software de procesamiento de datos o cualquier otro software de procesamiento de datos. Para la cuantificación de la formación de aductos, parcelas estándar de la intensidad de las concentraciones en función de la señal (o área) puede ser construido con un SNAP donador de NO.
2B. eNOS desenganche Experimento
- Retirar la placa de 6 pocillos de la incubadora y aspirar el medio desde el segundo pozo y lavar dos veces con 1 ml de DPBS.
- Un donante peroxinitrito, 5-amino-3-(4-morfolinil) -1,2,3-oxadiazolium cloruro (SIN-1) fue utilizado para desacoplar NOSe 16. Añadir 100 l de 0,5 mM SIN-1 (M r 206,6 g / mol, de 10 mM de solución madre recién preparada por disolución de 1 mg SIN-1 en 500 l de PBS sin iones Ca / Mg) y ml diluido a 2 con DPBS y 10% de FBS.
- Incubar durante 2 horas a 37 ° C y 5% de CO 2.
- Retirar la placa de la incubadora y se lava dos veces con DPBS.
- Añadir 210 l de2,8 mM de FeSO 4 .7 H 2 O y 210 l de 19,6 mM MGD recién preparada de acuerdo con el procedimiento mencionado anteriormente.
- Agitar la solución y añadir 4,6 l de 1,9 mM ICa.
- Agitar la solución de nuevo y se incuba a 37 ° C durante 36 min.
- Recoger el sobrenadante (425 l) en un tubo Eppendorf y la transferencia a una celda plana EPR.
- Parámetros de adquisición del EPR son los siguientes: la frecuencia de microondas: 9,8 GHz; el jardín central: 3427 G, la modulación de amplitud: 6 G, anchura de barrido: 100 g, la ganancia del receptor: 1 x 10 5; potencia de microondas: 10 mW; número total de exploraciones: 121; tiempo de barrido: s 10, y la constante de tiempo: 20 ms.
- Registrar el espectro y los espectros de 2-D fueron integrados para reducir el ruido de fondo y la línea base corregida como se mencionó anteriormente.
3. La detección de O 2 • - de los neutrófilos polimorfonucleares (PMN)
- Los neutrófilos fueron aisladas de muestras de sangre humana como se ha descrito previamente 17.
- Hacer una solución madre de 1 M DMPO * en PBS que contenía 0,1 mM de ácido dietilentriaminapentaacético (DTPA). DMPO tiene un punto de fusión de 25-29 ° C por lo que es más conveniente para pipetear líquidos DMPO (densidad de ~ 1,02 g / ml a 25 ° C) en un frasco de vidrio (Nota: No utilizar los viales de plástico para el pesaje ya pura DMPO reacciona con plástico). Frozen DMPO se pueden fundir por el chorro de agua tibia en la que el vial (Nota: no deje correr el agua caliente como DMPO puede descomponerse).
- Es importante usar alta pureza DMPO (> 99%) ya que algunas de las trampas de espín comercialmente disponibles contienen impurezas paramagnéticas, y por lo tanto, es imperativo para ejecutar espectro EPR de la solución DMPO solos (10 mM en este caso). Es crítico que no hay señal de fondo es evidente (véase la Figura 3A).
- Preparar solución madre (1 mg / ml) de forbol-12-miristato-13-acetato (PMA) en DMSO. Hacer alícuotas mediante la dilución de la solución a 10 mg / ml en PBS.
- En una 1.5 ml tubo Eppendorf, preparar una solución con un volumen total de 0,6 ml, siguiendo la secuencia de adición: ~ 10 6 células por ml de PMN, D-glucosa (1 mg / ml) y la albúmina (1 mg / ml), 10 DMPO mM y 0,2 mg / ml de PMA. (Nota: PMA es el radical activador y se debe agregar pasado).
- Transferir la solución a una célula del EPR plana.
- EPR parámetros de adquisición de las condiciones son las siguientes: la frecuencia de microondas: 9,8 GHz; el jardín central: 3486 G, la modulación de amplitud: 0,5 G, anchura de barrido: 100 g, la ganancia del receptor: 5 x 10 5, el número total de análisis: 10, el tiempo de barrido: 30 s ; potencia de microondas: de 20 MW, y la constante de tiempo: 81 ms. Para la cuantificación de la formación de aducto, parcelas estándar de intensidad frente a la concentración de la señal (o área) puede construirse utilizando los nitróxidos estables tales como TEMPO o 3-carboxílico PROXYL-.
* Nota importante sobre el uso de DMPO: Mediante el uso de una celda plana, se puede aumentar la densidad celular y aumentar así la señalintensidad del aducto giro pero la vida media de O 2 • - aducto de DMPO es corto (t 1/2 ~ 1 min) que se descompone a DMPO-OH. DMPO puede sustituirse utilizando las mismas concentraciones de EMPO, BMPO o DEPMPO que están disponibles comercialmente para la estabilidad aducto aumento con t 1/2 ~ 8 y 14 min, respectivamente.
4. Los resultados representativos
Haga girar la captura de ningún radical se realizó con Fe 2 +-MGD. Figura 2A y 2B muestran ninguna señal de EPR de Fe 2 +-MGD o una mezcla de Fe 2 +-MGD con el CAI, lo que indica que no hay ninguna señal de fondo NO proviene de estos reactivos. BAEC a la estimulación con ICa libera NO que reacciona con el Fe 2 +-MGD para formar el aducto giro, el NO-Fe 2 +-MGD, y muestra una señal triplete característico con hiperfina constante (HFSC) un valor de N = 12,66 G y factor g de g = 2,040. (Figura 2C). El HFsc valor se determinó usando el programa de simulación winsim que puede ser descargado desde sitio web de base de datos de NIEHS EPR Software. El HFSC experimental es consistente con el valor de la bibliografía de una N G = 12,70 g = 2,041 y 18 para el NO Fe-2 + DGM-aducto. De manera similar, el efecto de SIN-1 en BAEC bajó la producción de NO debido a NOSe desacoplamiento como se muestra en la Figura 2D.
DMPO trampa de giro se utiliza para O 2 • - la detección. DMPO por sí solo no dar una señal como se muestra en las figura 3A que confirman que la trampa giro está libre de impurezas paramagnéticas. Figura 3B es el espectro de DMPO y PMN solamente, y de manera similar, no hay ninguna señal detectable que sugiere que el DMPO no causa activación de la enzima NADPH oxidasa. Figura 3C muestra la señal observada EPR a la estimulación por PMA de PMN. Los valores de HFSC para esta señal se determina que es un N = 14,71 g, y unabeta;-H = 11,40 G y un γ-H = 1,25 G, y son consistentes con los valores de la literatura de un N = 14,3 g, una β-H = 11,7 T y un γ-H = 1,3 G 19 para DMPO-S 2 H aducto.

Figura 1. Diagrama de flujo para la detección de los radicales de los neutrófilos y BAEC utilizando atrapamiento giro EPR. (A) PMN fueron mezclados con DMPO y PMA, y la mezcla resultante transferido a una célula EPR plana para la adquisición de datos. (B) BAEC fueron cultivadas en una placa, y se lavó con DPBS. La trampa de la vuelta Fe (MGD) 2 fue introducido junto con el CAI. La solución se mezcló a fondo y se incuba. La mezcla se transfirió a una celda EPR plana para EPR adquisición de datos.
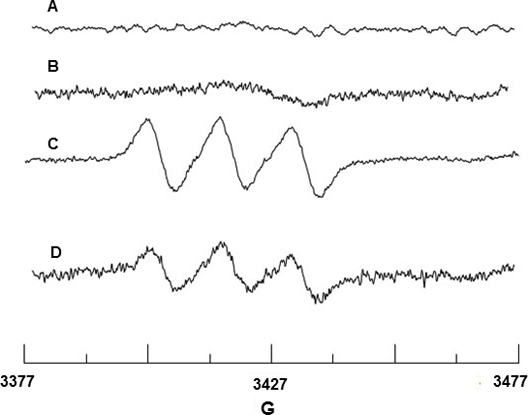
Figura 2. EPR detección de NO de BAEC. (A) Espectro de Fe 2 +-MGD sólo (B) Espectro de Fe 2 +-MGD + ICa solamente. (C) Espectro trío ocasionados por la ausencia de captura por Fe 2 +-MGD utilizando CAI-estimulado las células. (D) Espectro mostrando disminución en la producción de NO debido a 0,5 mM de SIN-1 tratamiento de las células.
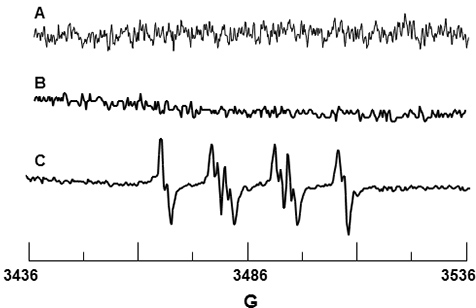
Figura 3. EPR detección de DMPO-O 2 H desde los neutrófilos activados. (A) Espectro de DMPO 10 mM solamente. (B) Espectro de PMN solo en la presencia de DMPO 10 mM. (C) Espectro de PMN activado por PMA en presencia de 10 mM de DMPO.
Access restricted. Please log in or start a trial to view this content.
Discusión
Atrapamiento EPR giro ha sido empleado en una amplia gama de aplicaciones biomédicas para la cuantificación y la identificación de los radicales libres. Atrapamiento Spin es altamente sensible, capaz de detectar los radicales en concentraciones que van desde nM a mM tanto por lo que es adecuado para aplicación en los sistemas biológicos. La formación del aducto paramagnético, NO-Fe 2 +-MGD, es la base de NO detección a través de EPR. Fe 2 +-MGD reacciona con rapidez NO 18
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue financiado por el NIH Nacional del Corazón, los Pulmones y la Sangre subvención RO1 HL81248.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| Medio DMEM libre de fenol Alta glucosa en 1X | GIBCO | 31053 | |
| 0,25% de tripsina-EDTA | GIBCO | 25200 | |
| L-glutamina | Fisher Scientific | BP379-100 | |
| MEM aminoácidos no esenciales | GIBCO | 11140 | |
| Suero bovino fetal | Atlanta Productos Biológicos | S11550 | |
| Factor de crecimiento endotelial | Millipore | 02-102 | |
| ICa | Enzo Ciencias de la Vida | A-23187 | Disolver en DMSO |
| SIN-1 | Enzo Ciencias de la Vida | BML-CN245-0020 | |
| DMPO | Dojindo Laboratories | D048-10 | |
| FeSO 4 .7 H 2 O | Sigma Aldrich | 215422-250G | Disolver en PBS con Ca y Mg |
| MGD | Enzo Ciencias de la Vida | ALX-400-014-M050 | Disolver en PBS con Ca 2 + y Mg 2 + |
| Células BAEC | Sistemas de células | 2B2-C75 | |
| DMSO | Fisher Scientific | BP231-100 | |
| DPBS | Sigma Aldrich | D8537 | |
| DPBS con CaCl 2 y MgCl 2 | Sigma Aldrich | D8662 | |
| Forbol-miristato acetato (PMA) | Sigma Aldrich | 79346-1mg |
Referencias
- Winterbourn, C. C. Reconciling the chemistry and biology of reactive oxygen species. Nat. Chem. Biol. 4, 278-286 (2008).
- Winterbourn, C. C., Hampton, M. B. Thiol chemistry and specificity in redox signaling. Free Radic. Biol. Med. 45, 549-561 (2008).
- Oxygen, Gene Expression, and Cellular Function. Clerch, L. B., Massaro, D. J. , (1997).
- Gutteridge, J. M. C., Halliwell, B. Antioxidants: Molecules, medicines, and myths. Biochem. Biophys. Res. Commun. 393, 561-564 (2010).
- Sumimoto, H. Structure, regulation and evolution of Nox-family NADPH oxidases that produce reactive oxygen species. FEBS J. 275, 3249-3277 (2008).
- Ignarro, L. J. Editor Nitric Oxide: Biology and Pathobiology. , Academic Press. San Diego, CA. (2009).
- Moreau, M. Differential effects of alkyl- and arylguanidines on the stability and reactivity of inducible NOS heme-dioxygen complexes. Biochemistry. 45, 3988-3999 (2006).
- Vasquez-Vivar, J. Superoxide generation by endothelial nitric oxide synthase: the influence of cofactors. Proc. Natl. Acad. Sci. U. S. A. 95, 9220-9225 (1998).
- Villamena, F. A., Zweier, J. L. Detection of reactive oxygen and nitrogen species by EPR spin trapping. Antioxid. Redox Signal. 6, 619-629 (2004).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping of superoxide and hydroxyl radical: practical aspects. Arch. Biochem. Biophys. 200, 1-16 (1980).
- Frejaville, C. 5-Diethoxyphosphoryl-5-methyl-1-pyrroline N-oxide (DEPMPO): a new phosphorylated nitrone for the efficient in vitro and in vivo spin trapping of oxygen-centered radicals. J. Chem. Soc., Chem. Commun. , 1793-1794 (1994).
- Olive, G., Mercier, A., Le Moigne, F., Rockenbauer, A., Tordo, P. 2-Ethoxycarbonyl-2-methyl-3,4-dihydro-2H-pyrrole-1-oxide: Evaluation of the spin trapping properties. Free Radical. Biol. Med. 28, 403-408 (2000).
- Villamena, F. A., Zweier, J. L. Superoxide radical trapping and spin adduct decay of 5-tert-butoxycarbonyl-5-methyl-1-pyrroline N-oxide (BocMPO): kinetics and theoretical analysis. J. Chem. Soc., Perkin Trans. 2, 1340-1344 (2002).
- Tsuchiya, K. Nitric oxide-forming reactions of the water-soluble nitric oxide spin-trapping agent, MGD. Free Radical Biol. Med. 27, 347-355 (1999).
- Vanin, A. F., Poltorakov, A. P., Mikoyan, V. D., Kubrina, L. N., van Faassen, E. Why iron-dithiocarbamates ensure detection of nitric oxide in cells and tissues. Nitric Oxide. 15, 295-311 (2006).
- RojasWahl, R. U. Decomposition mechanism of 3-N-morpholinosydnonimine (SIN-1): A density functional study on intrinsic structures and reactivities. J. Mol. Model. 10, 121-129 (2004).
- Klempner, M. S., Gallin, J. I. Separation and functional characterization of human neutrophil subpopulations. Blood. 51, 659-669 (1978).
- Pou, S. Spin trapping of nitric oxide by ferro-chelates: kinetic and in vivo pharmacokinetic studies. Biochim. Biophys. Acta. 1427, 216-226 (1999).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping. Kinetics of the reaction of superoxide and hydroxyl radicals with nitrones. J. Am. Chem. Soc. 102, 4994-4999 (1980).
- Britigan, B. E., Rosen, G. M. Spin-trapping and human neutrophils. Limits of detection of hydroxyl radical. J. Biol. Chem. 264, 12299-12302 (1989).
- Frejaville, C. 5-(Diethoxyphosphoryl)-5-methyl-1-pyrroline N-oxide: A new efficient phosphorylated nitrone for the in vitro and in vivo spin trapping of oxygen-centered radicals. J. Med. Chem. 38, 258-265 (1995).
- Snyrychova, I. Improvement of the sensitivity of EPR spin trapping in biological systems by cyclodextrins: A model study with thylakoids and photosystem II particles. Free Radical Biol. Med. 48, 264-274 (2010).
- Han, Y. Lipophilic beta-cyclodextrin cyclic-nitrone conjugate: Synthesis and spin trapping studies. J. Org. Chem. 74, 5369-5380 (2009).
- Han, Y., Tuccio, B., Lauricella, R., Villamena, F. A. Improved spin trapping properties by beta-cyclodextrin-cyclic nitrone conjugate. J. Org. Chem. 73, 7108-7117 (2008).
- Hardy, M. Detection, characterization, and decay kinetics of ROS and thiyl adducts of mito-DEPMPO spin trap. Chem. Res. Toxicol. 20, 1053-1060 (2007).
- Kim, S. -U. Fast reactivity of a cyclic nitrone-calix[4]pyrrole conjugate with superoxide radical anion: Theoretical and experimental studies. J. Am. Chem. Soc. 132, 17157-17173 (2010).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados