このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
一酸化窒素とスピントラップを使用して、細胞からの電子常磁性共鳴分光法によるスーパーオキシドアニオンラジカルの検出
要約
電子常磁性共鳴(EPR)分光法はウシ大動脈内皮細胞および鉄(II)-N-メチル-D-グルカミンジチオ、Feを(MGD)を用いてヒト好中球からのスーパーオキシドラジカルアニオンから一酸化窒素を検出するために採用した 2と、それぞれ5,5 - ジメチル-1 - pyroroline-N-オキシド、DMPO、。
要約
低濃度で反応性窒素/酸素種(ROS / RNS)は、シグナル伝達、細胞機能の調節に重要な役割を果たしていると、免疫応答が無秩序な濃度で細胞生存率を1、2に有害である。生きているシステムでは、ROSの生成を調節する内因性および栄養抗酸化防御機構と進化してきた一方で、ROSは、酸素の正常な代謝の副産物自然に連続的に製造されており、タンパク質の機能の喪失、DNAの切断、または脂質に生じる生体分子への酸化的損傷を引き起こす可能性があります過3、最終的に細胞傷害または死亡を4につながる酸化ストレスに。
スーパーオキシドアニオンラジカル(O 2• - )は、ペルオキシナイトライトとヒドロキシルラジカルのような生物学的システムに存在することが知られている最も高度な酸化種のいくつかの主要な前駆体である。 O 2の生成• -私は、したがって、酸化的バーストの最初の兆候を通知し、TSの検出および/または生物学的システムの隔離が重要である。このデモでは、O 2• -多形核好中球(多形核白血球)から生成されました。ニコチンアミドアデニンジヌクレオチドリン酸(NADPH)オキシダーゼ5の活性化を介して-ホルボール-12 -ミリステート-13 -アセテート(PMA)と走化性刺激により、PMN。•O 2を生成します 。
3つのアイソフォームで提供一酸化窒素(NO)合成酵素は、誘導-、神経と血管内皮-NOS、またはiNOSの、nNOSのか、eNOSのは、それぞれ、番号6を生成しないようにNADPHを用いて、L-シトルリンにL-アルギニンの変換を触媒として。ここでは、内皮細胞からNOを生成しません。酸化的ストレス条件下で、例えばeNOSのは•O 2、NOを生産に切り替えることができます-ヘム7または補助因子の酸化によって引き起こされると考えられている脱共役と呼ばれるプロセスで、テトラヒドロビオプテリン(BH 4)8。
少数がありますしかし、生体系におけるフリーラジカルの検出のための信頼できる方法は特異性と感度によって制限されます。スピントラッピングは、一般的にフリーラジカルの同定に使用され、電子常磁性共鳴(EPR)分光法によって検出することができる永続的なスピン付加物を形成するスピントラップへのラジカルの付加反応を伴うされています。様々なラジカル付加物は、生成されるラジカルを識別し、ラジカルの産生9の性質と動態に関する豊富な情報を提供することができます使用することができる独特のスペクトルを示す。
環状ニトロン、5,5 -ジメチル-ピロリン-N-オキシド、DMPO 10、ホスホリル置換されDEPMPO 11、エステル置換EMPO 12 BMPO 13は 、広くスピントラップとして採用されている-後者のスピン付加-トラップは、O 2•のために長い半減期を示す。鉄(II)-N-メチル-D-グルカミンジチオカルバミン酸のFe(MGD)2 </ SUB>は、一般的に付加体形成とスピン付加物14の高安定度の高い率のためにNOを捕捉するために使用されていません。
プロトコル
1。ウシ大動脈内皮細胞(BAEC)の培養
- 適切な無菌テクニックが続いていた。
- 37抗生物質なしで水浴、暖かい培地℃で
注:培地は4.5 g / LのD-グルコースとフェノールフリーダルベッコ改変イーグル培地(DMEM)で構成されており、10%ウシ胎児血清(FBS)および2.5を添加した4 mM L-グルタミン、1%非必須アミノ酸、 mg / Lの内皮細胞増殖因子。
- インキュベーターからT75フラスコを含むセルを削除し、フードの内側に配置する前に、70%エタノールでフラスコの表面を清掃してください。
- アスピレーターを使用して、古い培地を除去し、ダルベッコのリン酸緩衝生理食塩水(DPBS)の5 mlで2回洗浄する。
- トリプシンの2ミリリットルを追加し、定期的に顕微鏡下で検査しながら切断する細胞4-5分間待ちます。
- 培地3mlを追加して、繰り返して、別のtにピペットを用いて混在させる彼は細胞とも懸濁液を作成します。
- 5分間121グラムで15 mlのチューブと遠心分離機にトリプシンで培地5mlを転送します。
- アスピレーターを用いて上清を取り除きます。 DPBS 5mlを加え、よく混ぜます。 5分間121グラムで遠心します。
- 上清を吸引除去し、培地6mlを加えることによって細胞ペレットを再懸濁する。
- 6ウェルプレートに、ウェルを培地1mlを追加するたびに細胞懸濁液1 mlを加える。ピペットを用いて懸濁液を混ぜる。
- ラベルプレートと37℃、5%CO 2を一晩インキュベートする。
2A。 BAEC細胞とNOの検出
- 適切な無菌テクニックが続いていた。
- インキュベーターから6ウェルプレートを取り外し、最初のウェルから培地を吸引除去する。 1 mlのDPBSで細胞を2回洗浄します。
- 1.9 mMの硫酸鉄(II)七水和物(のFeSO 4·7H 2 O、で0.8 mgを溶解することによって新たに準備する210μlを加え1 mlのCaCl 2とMgCl 2を持つDPBS)とアンモニウム210μlの午前1時07分の比を用いてN-メチル-D-グルカミンジチオカルバメート(MGD、CaCl 2とMgCl 2を 500μlのDPBSで2.7 mgを溶解することにより、新たに調製) (注:過剰MGDが使用されているこの比率は、従来のFe 3の収率は+-MGDを過剰MGDの存在下で最大化されているという事実に起因+ MGD複雑なのFe 2準備のために採用されているのに加え。 NO-のFe 3 +が -MGD形成されたので、+-MGDは必要ありませんFe 2 +を安定させるために溶液中でアスコルビン酸は内因性アスコルビン酸、ヒドロキノン、または最大の変換効率を持つシステイン+ MGD EPR検出可能なNO-Feの2に削減され99.9%...のFe 2低スピン反磁性の状態が+ NO)低温装置を必要とせずにフラットセルまたはキャピラリーチューブを用いた 15 の検出することができます 。
- よくスワール得られた懸濁液を、4.6μを追加するカルシウムイオノフォアのL(CAI)(1ミリリットルのDMSOに1mgを溶解することにより1.9 mMのストック溶液から調製)。
- スワール再びソリューションと37℃36分のためにCをさらにNO-Feの3の削減を可能にするためには、EPR検出可能なNO-Fe 2 +の -MGDに+ MGD。
- エッペンドルフチューブとEPRフラットセル(または50μlのキャピラリーチューブへの)への転送の上清(425μl)を収集します。
- EPR取得パラメータは以下のとおりです。マイクロ波周波数:9.8 GHzの、中央のフィールド:3427 G;変調振幅:6.0 G、掃引幅:100 G;レシーバゲイン:1×10 5、マイクロ波電力:10 mWで、スキャンの総数:121;掃引時間:10秒、および時定数:20ミリ秒(注:パラメータはひとつの楽器と実験条件ごとに異なりますので、したがって、唯一のセンターフィールド周波数と変調振幅が考慮すべき最も重要なパラメータである。)
- 室温でのスペクトルを記録し、2次元スペクトルは、INTEGたブルカーWinEPRデータ処理ソフトウェアやその他のデータ処理ソフトウェアを用いて補正し、バックグラウンドノイズやベースラインを減らすために評価した。付加体形成の定量化については、濃度対信号強度(又は面積)の標準的なプロットは、NOドナーSNAPを使用しない構築することができます。
2B。 eNOSのアンカップリング実験
- インキュベーターから6ウェルプレートを取り外し、第2ウェルから培地を吸引し、1 mlのDPBSで2回洗浄する。
- ペルオキシナイトライトのドナー、5 -アミノ-3 - (4 -モルホリニル)-1,2,3 - oxadiazolium塩化物(SIN-1)はeNOSの16を切り離すために使用された。 0.5mMのSIN-1(M R 206.6たてないのCa / Mgのイオンを含むPBS 500μlの1 mgのSIN-1を溶解して調製10mMストック溶液からg /モル)、希に2ミリリットルのDPBSの100μlを加えおよび10%FBS。
- 37℃で2時間インキュベート℃、5%CO 2。
- インキュベーターからプレートを削除し、DPBSで2回洗浄する。
- 210μlを加え2.8mmでのFeSO 4·7H 2 O、19.6 mMの210μlを新たに上記の手順に従って調製MGD。
- 渦解と1.9 mMのCAIの4.6μlを追加します。
- スワール再びソリューションと36分間37℃でインキュベートする。
- エッペンドルフチューブとEPRフラットセルへの転送の上清(425μl)を収集します。
- EPR取得パラメータは以下のとおりです。マイクロ波周波数:9.8 GHzの、中央のフィールド:3427 G;変調振幅:6 G;掃引幅:100 G;レシーバゲイン:1×10 5、マイクロ波電力:10 mWで、スキャンの総数:121;掃引時間:10秒、および一定時間:20ミリ秒。
- スペクトルを記録し、2次元スペクトルは、前述したように補正し、バックグラウンドノイズやベースラインを減らすために統合されました。
3。 O 2の検出• -多形核好中球からの(多形核白血球)
- 以前に17に記載のように好中球は、ヒトの血液サンプルから単離された。
- ジエチレントリアミン5酢酸(DTPA)は0.1mMを含むPBSで1 M DMPO *のストック溶液を作成します。 DMPOは、25から29の融点を有する°C、それがガラスバイアル(注に液体DMPO(密度〜1.02グラム/ mlの25℃)ピペッティングする方が便利ですので、:純粋なDMPOので、計量プラスチックバイアルを使用しないでください。 )プラスチックと反応します 。凍結DMPOは、バイアル(:DMPOが分解可能性があるのでお湯を実行しないでください注)へとルーク温水を実行することによって溶融させることができる。
- それ以来、高純度DMPOを(> 99%)を使用することが重要である市販のスピントラップの一部は、常磁性不純物を含んでおり、したがって、それは単独でだけDMPO溶液のEPRスペクトル(このケースでは10 mM)を実行することが不可欠です。それはバックグラウンド信号( 図3Aを参照)は明らかではないことが重要です。
- DMSO中のホルボール-12 - ミリステート-13 - アセテート(PMA)のストック溶液(1 mg / ml)を準備します。 PBSで10μg/ mlの解決策を希釈することにより、アリコートを行います。
- 1。5ミリリットルエッペンドルフチューブには、添加の順序に従うことによって0.6ミリリットルの合計体積で解決策を準備します。PMNのmlあたり〜10 6細胞、D-グルコース(1 mg / ml)とアルブミン(1 mg / ml)を、10 mMのDMPOとPMA 0.2μg/ mlの。(注:PMAは、急進的な活性化因子であると最後に追加する必要があります)。
- EPRフラットセルに溶液を移します。
- EPR取得パラメータの条件は次のとおりです。マイクロ波周波数:9.8 GHzの、中央のフィールド:3486 G;変調振幅:0.5 G、掃引幅:100 G;レシーバゲイン:5×10 5;スキャンの総数:10;掃引時間:30秒、マイクロ波電力:20 mWで、そして一定時間:81 msです。付加体形成の定量化については、濃度対信号強度(または地域)の標準的なプロットは、そのようなテンポや-3 - カルボン酸-PROXYLとして安定したニトロキシドを用いて構築することができます。
DMPOの利用に関する重要な注意:フラットセルを使用することにより、一つの細胞密度を高め、それによって信号を増加させることができスピンアダクトの強さがO 2の半減期• - DMPOの付加物が短い(T 1/2〜1分)DMPO-OHに分解する。 DMPOは、t 1/2〜8とそれぞれ14分、と増加した付加物の安定性のために市販されているEMPO、BMPOまたはDEPMPOの同じ濃度を用いて置換することができます。
4。代表的な結果
のFe 2からのEPRシグナルを示していない+ MGD又はFe 2の混合物は、CAIと+-MGDバックグラウンド信号があり、これらの試薬 に由来しないことを示すラジカル+ MGD 図2Aおよび2BのFe 2を用いて行われたNOのスピン捕捉。のFe 2と反応してCAIのリリースNO刺激によりBAECスピン付加物を形成するために+-MGD、NO-のFe 2 +-MGDと、N = 12.66 Gの超微細分裂定数(HFSC)の値を持つ特徴的なトリプレット信号を示し、 G = 2.040のg因子。 ( 図2C)。 HFSC値は、NIEHS EPRソフトウェアデータベースのWebサイトからダウンロードすることができますWINSIMシミュレーションプログラムを用いて決定した。実験的なHFSCは、NO-のFe 2 +-MGD付加のためにN = 12.70 Gとg = 2.041 18の文献値と一致しています。同様に、BAEC上にSIN-1の効果は、 図2Dに示すように、eNOSのは、脱共役によるNO産生を低下させません。
検出- DMPOスピントラップは、O 2•使用されました。スピントラップは常磁性不純物から自由であることを確認し、図3Aに示すように、DMPOは、単独でシグナルを与えなかった。 図3Bは、唯一のDMPOとPMNのスペクトルであり、同様に、DMPOが発生しないことを示唆して検出可能なシグナルはありません酵素NADPHオキシダーゼの活性化を図3Cは、PMAによるPMNの刺激時に 観察されたEPR信号を示しています。この信号のHFSCの値は、N = 14.71 G、&であると決定されたβ、-H = 11.40 G、γ-H = 1.25 G、およびN = 14.3 G、β-H = 11.7 Gとγ-H = DMPO-O 1.3 G 19の文献値と一致している2 H付加。

図1:EPRスピントラップを用いた好中球およびBAECからラジカルを検出するためのフローチャート。 (A)PMNはDMPOとPMAと混合し、得られた混合物は、データ取得のためのEPRフラットセルに転送されます。 (B)BAECは、プレート上に成長し、DPBSで洗浄した。スピントラップのFe(MGD)2 CAIと一緒に追加されました。溶液が十分に混合し、インキュベートした。混合物は、EPRのデータ取得のためのEPRフラットセルに移した。
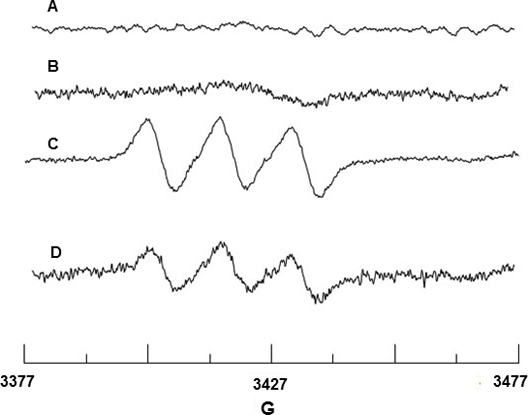
図2 BからのNOのEPR検出AEC。のFe 2 + MGD + CAIの()のFe 2スペクトラム+ MGDのみ(B)スペクトルのみ。 (C)のFe 2 NOトラップに起因するトリプレットスペクトルは+-MGD CAI-刺激した細胞を使用します。 (D)スペクトルは、0.5 mMの細胞のSIN-1処理によるNO産生の減少を示している。
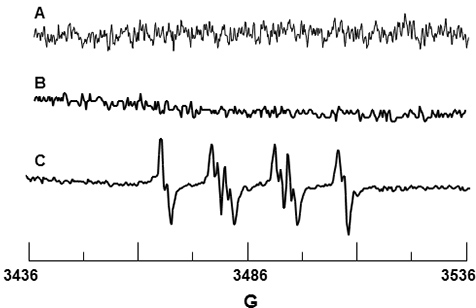
図3活性化好中球からのDMPO-O 2 HのEPRを検出します。 10 mMのDMPOの(A)スペクトルのみ。 (B)の10 mM DMPOの存在下で単独でPMNのスペクトル。 (C)PMNのスペクトルは、10 mMのDMPOの存在下でPMAによって活性化。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
EPRスピントラップは、フリーラジカルを定量化し、識別するための生物医学アプリケーションの広い範囲で採用されている。スピントラッピングは、nMからこのように生物系のアプリケーションに適していμMの範囲の濃度でラジカルを検出することができる、非常に敏感である。常磁性の付加物の形成、NO-のFe 2 +-MGDは、EPR を経由して NOの検出の基礎となっています。のFe 2...
Access restricted. Please log in or start a trial to view this content.
開示事項
利害の衝突が宣言されません。
謝辞
この作品は、NIHの国立心臓、肺、血液研究所の助成金RO1 HL81248によって資金を供給された。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(オプション) |
| フェノールフリーDMEM培地 高グルコース1X | GIBCO | 31053 | |
| 0.25%トリプシン-EDTA | GIBCO | 25200 | |
| L-グルタミン | フィッシャー·サイエンティフィック | BP379-100 | |
| MEM非必須アミノ酸 | GIBCO | 11140 | |
| ウシ胎仔血清 | アトランタバイオ | S11550 | |
| 内皮細胞増殖因子 | ミリポア | 02から102 | |
| CAI | エンツォ生命科学 | A-23187 | DMSOに溶解 |
| SIN-1 | エンツォ生命科学 | BML-CN245-0020 | |
| DMPO | 同仁化学研究所 | D048-10 | |
| のFeSO 4·7H 2 O | シグマアルドリッチ | 215422-250G | CaとMgを含むPBSに溶解し |
| MGD | エンツォ生命科学 | ALX-400-014-M050 | のCa 2 +およびMg 2を含むPBSに溶解+ |
| BAEC細胞 | セルシステム | 2B2-C75 | |
| DMSO | フィッシャー·サイエンティフィック | BP231-100 | |
| DPBS | シグマアルドリッチ | D8537 | |
| のCaCl 2とMgCl 2とDPBS | シグマldrich | D8662 | |
| ホルボールミリステートアセテート(PMA) | シグマアルドリッチ | 79346-1mgの |
参考文献
- Winterbourn, C. C. Reconciling the chemistry and biology of reactive oxygen species. Nat. Chem. Biol. 4, 278-286 (2008).
- Winterbourn, C. C., Hampton, M. B. Thiol chemistry and specificity in redox signaling. Free Radic. Biol. Med. 45, 549-561 (2008).
- Oxygen, Gene Expression, and Cellular Function. Clerch, L. B., Massaro, D. J. , (1997).
- Gutteridge, J. M. C., Halliwell, B. Antioxidants: Molecules, medicines, and myths. Biochem. Biophys. Res. Commun. 393, 561-564 (2010).
- Sumimoto, H. Structure, regulation and evolution of Nox-family NADPH oxidases that produce reactive oxygen species. FEBS J. 275, 3249-3277 (2008).
- Ignarro, L. J. Editor Nitric Oxide: Biology and Pathobiology. , Academic Press. San Diego, CA. (2009).
- Moreau, M. Differential effects of alkyl- and arylguanidines on the stability and reactivity of inducible NOS heme-dioxygen complexes. Biochemistry. 45, 3988-3999 (2006).
- Vasquez-Vivar, J. Superoxide generation by endothelial nitric oxide synthase: the influence of cofactors. Proc. Natl. Acad. Sci. U. S. A. 95, 9220-9225 (1998).
- Villamena, F. A., Zweier, J. L. Detection of reactive oxygen and nitrogen species by EPR spin trapping. Antioxid. Redox Signal. 6, 619-629 (2004).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping of superoxide and hydroxyl radical: practical aspects. Arch. Biochem. Biophys. 200, 1-16 (1980).
- Frejaville, C. 5-Diethoxyphosphoryl-5-methyl-1-pyrroline N-oxide (DEPMPO): a new phosphorylated nitrone for the efficient in vitro and in vivo spin trapping of oxygen-centered radicals. J. Chem. Soc., Chem. Commun. , 1793-1794 (1994).
- Olive, G., Mercier, A., Le Moigne, F., Rockenbauer, A., Tordo, P. 2-Ethoxycarbonyl-2-methyl-3,4-dihydro-2H-pyrrole-1-oxide: Evaluation of the spin trapping properties. Free Radical. Biol. Med. 28, 403-408 (2000).
- Villamena, F. A., Zweier, J. L. Superoxide radical trapping and spin adduct decay of 5-tert-butoxycarbonyl-5-methyl-1-pyrroline N-oxide (BocMPO): kinetics and theoretical analysis. J. Chem. Soc., Perkin Trans. 2, 1340-1344 (2002).
- Tsuchiya, K. Nitric oxide-forming reactions of the water-soluble nitric oxide spin-trapping agent, MGD. Free Radical Biol. Med. 27, 347-355 (1999).
- Vanin, A. F., Poltorakov, A. P., Mikoyan, V. D., Kubrina, L. N., van Faassen, E. Why iron-dithiocarbamates ensure detection of nitric oxide in cells and tissues. Nitric Oxide. 15, 295-311 (2006).
- RojasWahl, R. U. Decomposition mechanism of 3-N-morpholinosydnonimine (SIN-1): A density functional study on intrinsic structures and reactivities. J. Mol. Model. 10, 121-129 (2004).
- Klempner, M. S., Gallin, J. I. Separation and functional characterization of human neutrophil subpopulations. Blood. 51, 659-669 (1978).
- Pou, S. Spin trapping of nitric oxide by ferro-chelates: kinetic and in vivo pharmacokinetic studies. Biochim. Biophys. Acta. 1427, 216-226 (1999).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping. Kinetics of the reaction of superoxide and hydroxyl radicals with nitrones. J. Am. Chem. Soc. 102, 4994-4999 (1980).
- Britigan, B. E., Rosen, G. M. Spin-trapping and human neutrophils. Limits of detection of hydroxyl radical. J. Biol. Chem. 264, 12299-12302 (1989).
- Frejaville, C. 5-(Diethoxyphosphoryl)-5-methyl-1-pyrroline N-oxide: A new efficient phosphorylated nitrone for the in vitro and in vivo spin trapping of oxygen-centered radicals. J. Med. Chem. 38, 258-265 (1995).
- Snyrychova, I. Improvement of the sensitivity of EPR spin trapping in biological systems by cyclodextrins: A model study with thylakoids and photosystem II particles. Free Radical Biol. Med. 48, 264-274 (2010).
- Han, Y. Lipophilic beta-cyclodextrin cyclic-nitrone conjugate: Synthesis and spin trapping studies. J. Org. Chem. 74, 5369-5380 (2009).
- Han, Y., Tuccio, B., Lauricella, R., Villamena, F. A. Improved spin trapping properties by beta-cyclodextrin-cyclic nitrone conjugate. J. Org. Chem. 73, 7108-7117 (2008).
- Hardy, M. Detection, characterization, and decay kinetics of ROS and thiyl adducts of mito-DEPMPO spin trap. Chem. Res. Toxicol. 20, 1053-1060 (2007).
- Kim, S. -U. Fast reactivity of a cyclic nitrone-calix[4]pyrrole conjugate with superoxide radical anion: Theoretical and experimental studies. J. Am. Chem. Soc. 132, 17157-17173 (2010).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved