Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Определение оксида азота и супероксид анион-радикал электронов парамагнитного резонанса от клеток с использованием спиновых ловушек
В этой статье
Резюме
Электронного парамагнитного резонанса (ЭПР) спектроскопии был использован для обнаружения окиси азота из бычьей аорты эндотелиальных клеток и супероксид-анион-радикал из нейтрофилов человека использовании железа (II)-N-метил-D-глюкамин дитиокарбаматных, Fe (МГД) 2 И 5,5-диметил-1-pyroroline-N-оксид, DMPO соответственно.
Аннотация
Reactive nitrogen/oxygen species (ROS/RNS) at low concentrations play an important role in regulating cell function, signaling, and immune response but in unregulated concentrations are detrimental to cell viability1, 2. While living systems have evolved with endogenous and dietary antioxidant defense mechanisms to regulate ROS generation, ROS are produced continuously as natural by-products of normal metabolism of oxygen and can cause oxidative damage to biomolecules resulting in loss of protein function, DNA cleavage, or lipid peroxidation3, and ultimately to oxidative stress leading to cell injury or death4.
Superoxide radical anion (O2•-) is the major precursor of some of the most highly oxidizing species known to exist in biological systems such as peroxynitrite and hydroxyl radical. The generation of O2•- signals the first sign of oxidative burst, and therefore, its detection and/or sequestration in biological systems is important. In this demonstration, O2•- was generated from polymorphonuclear neutrophils (PMNs). Through chemotactic stimulation with phorbol-12-myristate-13-acetate (PMA), PMN generates O2•- via activation of nicotinamide adenine dinucleotide phosphate (NADPH) oxidase5.
Nitric oxide (NO) synthase which comes in three isoforms, as inducible-, neuronal- and endothelial-NOS, or iNOS, nNOS or eNOS, respectively, catalyzes the conversion of L- arginine to L-citrulline, using NADPH to produce NO6. Here, we generated NO from endothelial cells. Under oxidative stress conditions, eNOS for example can switch from producing NO to O2•- in a process called uncoupling, which is believed to be caused by oxidation of heme7 or the co-factor, tetrahydrobiopterin (BH4)8.
There are only few reliable methods for the detection of free radicals in biological systems but are limited by specificity and sensitivity. Spin trapping is commonly used for the identification of free radicals and involves the addition reaction of a radical to a spin trap forming a persistent spin adduct which can be detected by electron paramagnetic resonance (EPR) spectroscopy. The various radical adducts exhibit distinctive spectrum which can be used to identify the radicals being generated and can provide a wealth of information about the nature and kinetics of radical production9.
The cyclic nitrones, 5,5-dimethyl-pyrroline-N-oxide, DMPO10, the phosphoryl-substituted DEPMPO11, and the ester-substituted, EMPO12 and BMPO13, have been widely employed as spin traps--the latter spin traps exhibiting longer half-lives for O2•- adduct. Iron (II)-N-methyl-D-glucamine dithiocarbamate, Fe(MGD)2 is commonly used to trap NO due to high rate of adduct formation and the high stability of the spin adduct14.
протокол
1. Культура говядине аорты эндотелиальных клеток (КАЭБ)
- Правильное асептики были соблюдены.
- В ванну с водой, теплой среде без антибиотиков при температуре 37 ° C.
Примечание: среда состоит из фенола среде без Дульбеко изменения Орла (DMEM) с 4,5 г / л D-глюкозы, 4 мМ L-глутамина, 1%, без незаменимых аминокислот, с добавлением 10% эмбриональной телячьей сыворотки (FBS) и 2.5 мг / л, фактор роста эндотелия.
- Удалить T75 колбы, содержащие клетки из инкубатора и очистки поверхности колбы с 70% этанола, прежде чем поместить его внутрь капота.
- Удалите старый среде с помощью аспиратора и мыть два раза с 5 мл фосфатного буфера Дульбеко физиологического раствора (DPBS).
- Добавить 2 мл трипсина и ждать в течение 4-5 мин для клеток оторваться, периодически осмотра под микроскопом.
- Добавьте 3 мл среды и повторно перемешать с помощью пипетки в отдельные тОн клеток и создать еще подвески.
- Передача 5 мл среды с трипсином до 15 мл и трубы центрифуги в 121 г в течение 5 мин.
- Удаляют супернатант использованием аспиратора. Добавить 5 мл DPBS и тщательно перемешать. Центрифуга при 121g в течение 5 мин.
- Аспирируйте супернатант и повторно приостанавливать осадок клеток, добавляя 6 мл среды.
- На 6-и плиты, добавить 1 мл клеточной суспензии в каждую лунку добавьте 1 мл среды. Смешать подвески с помощью пипетки.
- Этикетка пластины и инкубировать в течение ночи при 37 ° С и 5% CO 2.
2А. Обнаружение NO с сотового КАЭБ
- Правильное асептики были соблюдены.
- Удалите 6-луночного планшета из инкубатора и аспирации среды от первой скважины. Промойте клетки в два раза с 1 DPBS мл.
- Добавить 210 мкл 1,9 мм железа (II) сульфат гептагидрат (FeSO 4 · 7H 2 O, готовить свежий, растворяя 0,8 мг в1 мл DPBS с CaCl 2 и MgCl 2) и 210 мкл аммония N-метил-D-глюкамин дитиокарбаматных (МГД, готовить свежий, растворяя 2,7 мг в 500 мкл DPBS с CaCl 2 и MgCl 2), используя соотношение 1:7 . (Примечание:. Это соотношение, где избыток МГД используется была обычно используются для подготовки Fe 2 +-комплекса МГД в связи с тем, что выход на Fe 3 + МГД максимальна в присутствии избытка МГД добавлением аскорбиновой кислоты в растворах для стабилизации Fe 2 +-МГД не нужно, так как NO-Fe 3 + МГД формируется эндогенно сводится к ЭПР обнаружено NO-Fe 2 +-МГД по аскорбиновая кислота, гидрохинон, или цистеина с эффективностью преобразования до до 99,9% .. низкое состояние диамагнитных спина Fe 2 + позволяет обнаруживать NO с использованием плоских клеток или капиллярной трубке без необходимости низкой температуры устройства) 15.
- Swirl Полученную суспензию хорошо и добавить 4,6 μл кальция ионофором (CAI) (получают из маточного раствора 1,9 мм путем растворения 1 мг в 1 мл ДМСО).
- Swirl решение снова и инкубировать при температуре 37 ° С в течение 36 мин, с тем чтобы в дальнейшем позволит снижение NO-Fe 3 + в МГД ЭПР обнаружено NO-Fe 2 +-МГД.
- Соберите супернатант (425 мл) в пробирку Эппендорфа и передачи ЭПР плоских ячейки (или 50 мкл капиллярной трубке).
- Параметры ЭПР приобретения являются: СВЧ: 9,8 ГГц; центре поля: 3427 G; амплитудной модуляции: 6,0 G, развертки ширина: 100 G, усиление приемника: 1 х 10 5, микроволновая мощность: 10 мВт; общего числа сканирований: 121; Время развертки: 10 сек, а постоянная времени: 20 мс (Примечание: Поскольку параметры будут варьироваться в зависимости от инструмента и условий эксперимента к другому, следовательно, только в центре поля, частота и амплитуда модуляции являются наиболее важными параметрами для рассмотрения.).
- Запись спектров при комнатной температуре и 2-D спектры целострассчитаны на снижение шума и базовых исправить с помощью Bruker WinEPR данных программное обеспечение обработки или другой обработки данных, программного обеспечения. Для количественной оценки аддуктов, стандартные участки концентрации по сравнению с интенсивностью сигнала (или площадь) можно построить с помощью NO-доноры SNAP.
2B. Енос разобщение эксперимент
- Удалите 6-луночного планшета из инкубатора и аспирации среды от второй скважины и мыть два раза с 1 DPBS мл.
- Пероксинитрита доноров, 5-амино-3-(4-морфолинил) -1,2,3-oxadiazolium хлорид (SIN-1) был использован для отделить Енос 16. Добавить 100 мкл 0,5 мМ SIN-1 (М т 206,6 г / моль, от 10 мм маточный раствор свежеприготовленный растворением 1 мг SIN-1 в 500 мкл PBS, не Ca / Mg ионов) и разбавленной до 2 мл DPBS и 10% FBS.
- Выдержите в течение 2 ч при 37 ° С и 5% CO 2.
- Снимите пластины из инкубатора и мыть дважды DPBS.
- Добавить 210 мкл2,8 мм FeSO 4 · 7H 2 O и 210 мкл 19.6 мм МГД свежеприготовленный в соответствии с процедурой, упомянутых выше.
- Swirl решение и добавить 4,6 мкл 1,9 мМ CaI.
- Swirl решение снова и инкубировать при температуре 37 ° С в течение 36 мин.
- Соберите супернатант (425 мл) в пробирку Эппендорфа и передачи ЭПР плоских клеток.
- Параметры ЭПР приобретения являются: СВЧ: 9,8 ГГц; центре поля: 3427 G; амплитудной модуляции: 6 G; развертки ширина: 100 G, усиление приемника: 1 х 10 5, микроволновая мощность: 10 мВт; общего числа сканирований: 121; Время развертки: 10 сек, а постоянная времени: 20 мс.
- Запись спектров и 2-D спектры были объединены для уменьшения фонового шума и базовых исправлены как уже говорилось выше.
3. Обнаружение O 2 • - из полиморфноядерных нейтрофилов (PMNs)
- Нейтрофилы выделяли из образца крови человека, как описано выше 17.
- Сделать маточного раствора 1 М DMPO * в PBS, содержащем 0,1 мМ диэтилентриамин-pentaacetic кислоты (DTPA). DMPO имеет температуру плавления 25-29 ° С, так удобнее, чтобы жидкость пипеткой DMPO (плотность ~ 1,02 г / мл при 25 ° С) в стеклянном флаконе (Примечание: не использовать пластиковые флаконы для взвешивания с чистой DMPO вступает в реакцию с пластмассой). Замороженные DMPO можно расплавить, запустив теплой водой на флаконе (Примечание: не запускать горячую воду, как DMPO могут разлагаться).
- Важно использовать высокую чистоту DMPO (> 99%), так как некоторые коммерчески доступные ловушки спина содержат парамагнитные примеси, и, следовательно, необходимо запустить спектр ЭПР только решение DMPO в одиночку (10 мм в данном случае). Очень важно, чтобы не фонового сигнала очевидна (см. рис 3А).
- Подготовка исходного раствора (1 мг / мл) форбол-12-миристат-13-ацетат (PMA) в ДМСО. Сделать аликвоты путем разбавления раствора до 10 мкг / мл в PBS.
- В 1.5 мл Eppendorf трубки, приготовить раствор с общим объемом 0,6 мл, следуя последовательности того: ~ 10 6 клеток на мл ПМН, D-глюкозы (1 мг / мл) и альбумин (1 мг / мл), 10 DMPO мМ и 0,2 мкг / мл РМА. (Примечание: PMA-радикал и активатора должна быть добавлена последней).
- Передача решения ЭПР плоских клеток.
- ЭПР приобретение параметры условий: СВЧ: 9,8 ГГц; центре поля: 3486 G; амплитудной модуляции: 0,5 G, развертки ширина: 100 G, усиление приемника: 5 х 10 5, общее количество сканирований: 10; Время развертки: 30 сек , микроволновая мощность: 20 мВт, а постоянная времени: 81 мс. Для количественной оценки аддуктов, стандартные участки концентрации по сравнению с интенсивностью сигнала (или площадь) можно построить, используя стабильные нитроксильные, таких как темп или 3-карбоновой кислоты PROXYL.
* Важное замечание по использованию DMPO: С помощью плоской ячейке, можно увеличить плотность клеток и тем самым увеличивая сигналИнтенсивность аддукт спина, но период полураспада O 2 • - аддукт DMPO короткая (T 1/2 ~ 1 мин), который разлагается на DMPO-ОН. DMPO можно заменить, используя те же концентрации EMPO, BMPO или DEPMPO которые имеются в продаже для повышения стабильности аддукт с T 1/2 ~ 8 и 14 мин соответственно.
4. Представитель Результаты
Спиновая захвата никаких радикальных проводили с использованием Fe 2 +-МГД. Рисунок 2А и 2В не показывают сигнал ЭПР от Fe 2 +-MGD или смеси Fe 2 +-МГД с Цай, о том, что нет никакого фона сигнал исходит от этих реагентов. КАЭБ при стимуляции CaI выпускает NO, который реагирует с Fe 2 +-МГД, чтобы сформировать спина аддукт, NO-Fe 2 +-МГД, и показывает характерный сигнал триплет с сверхтонким расщеплением постоянной (HFSC) значение N = 12,66 G и г-фактор G = 2,040. (Рис. 2). ВЧSC стоимость была определена с помощью программы WINSIM моделирования, которые можно загрузить с веб-сайта NIEHS ЭПР базы данных программного обеспечения. Экспериментальные HFSC согласуется с литературными значение N = 12,70 G и G = 2,041 18 NO-Fe 2 +-аддукт МГД. Кроме того, эффект SIN-1 на КАЭБ снизил NO производства в связи с Енос расцепления как показано на рисунке 2D.
DMPO спиновой ловушки использовали для O 2 • - обнаружение. DMPO не только дать сигнал, как показано на рисунке 3A, подтверждающие, что спина ловушка свободного от парамагнитных примесей. Рисунок 3B является спектр DMPO и PMNs только, а так же нет обнаруженный сигнал, предполагая, что DMPO не вызывает активация фермента оксидазы NADPH. Рисунок 3C показывает наблюдаемого сигнала ЭПР при стимуляции ПМН на PMA. HFSC значения этого сигнала было установлено, что N = 14,71 G, ибета-,-Н = 11,40 G и γ-H = 1,25 G, и в соответствии с литературой значения N = 14,3 G, β-H = 11,7 г и γ-H = 1,3 G 19 DMPO-O 2 H аддукта.

Рисунок 1. Схема для обнаружения радикалов из нейтрофилов и КАЭБ использованием ЭПР захвата спин. (A) PMNs были смешаны с DMPO и PMA, и полученную смесь передается ЭПР плоских ячейки для сбора данных. (B) КАЭБ выращивали на пластине, и промывают DPBS. Спиновой ловушки Fe (МГД) 2 была добавлена вместе с Кай. Раствор тщательно перемешивают и инкубируют. Смесь была передана ЭПР плоских ячейки для приобретения данных ЭПР.
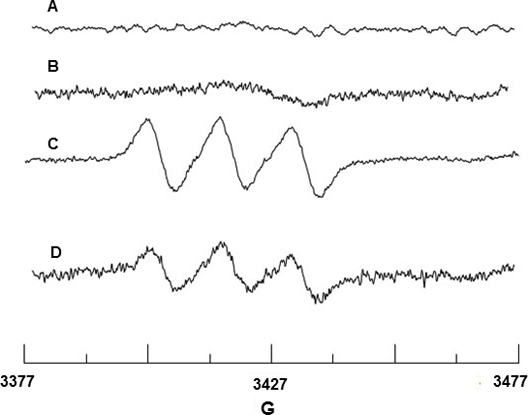
Рисунок 2. ЭПР обнаружения NO с BAEC. (A) спектр Fe 2 +-МГД только (B) спектр Fe 2 + + МГД CaI только. (C) Триплет спектр результате NO захватом Fe 2 +-МГД использованием CaI стимулированных клеток. (D) Спектр показывает снижение производства из-за NO до 0,5 мм SIN-1 обработка клеток.
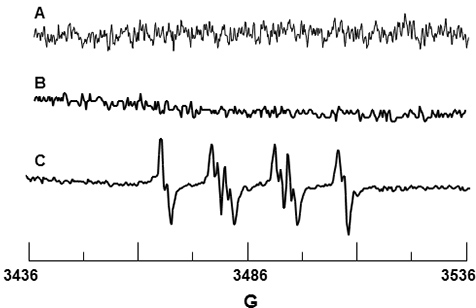
Рисунок 3. ЭПР обнаружения DMPO-O 2 H от активированных нейтрофилов. (А) Спектр 10 мМ DMPO только. (Б) Спектр ПМН только в присутствии 10 мМ DMPO. (C) Спектр ПМН активируется PMA в присутствии 10 мМ DMPO.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
ЭПР спин захват был использован в широком диапазоне биомедицинских приложений для количественной оценки и выявления свободных радикалов. Спин захвата обладает высокой чувствительностью, способны обнаруживать радикалы в концентрациях от нМ до мкМ что делает его пригодным для примен?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа финансировалась NIH Национальный институт сердца, легких и крови институт грант RO1 HL81248.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии (опционально) |
| Фенол среде без DMEM Высокая глюкоза 1X | GIBCO | 31053 | |
| 0,25% Трипсин-EDTA | GIBCO | 25200 | |
| L-Глютамин | Fisher Scientific | BP379-100 | |
| MEM без Незаменимые аминокислоты | GIBCO | 11140 | |
| Фетальной телячьей сыворотки | Атланты биологические | S11550 | |
| Фактор роста эндотелия | Millipore | 02-102 | |
| CaI | Энцо наук о жизни | А-23187 | Растворите в ДМСО |
| SIN-1 | Энцо наук о жизни | BML-CN245-0020 | |
| DMPO | Dojindo лаборатории | D048-10 | |
| FeSO 4 · 7H 2 O | Sigma Aldrich | 215422-250G | Растворите в PBS с Са и Mg |
| МГД | Энцо наук о жизни | ALX-400-014-M050 | Растворите в PBS с Са 2 + и Mg 2 + |
| КАЭБ клеток | Сотовые системы | 2B2-C75 | |
| ДМСО | Fisher Scientific | BP231-100 | |
| DPBS | Sigma Aldrich | D8537 | |
| DPBS с CaCl 2 и MgCl 2 | Sigmaldrich | D8662 | |
| Форбол-миристат ацетат (PMA) | Sigma Aldrich | 79346-1 мг |
Ссылки
- Winterbourn, C. C. Reconciling the chemistry and biology of reactive oxygen species. Nat. Chem. Biol. 4, 278-286 (2008).
- Winterbourn, C. C., Hampton, M. B. Thiol chemistry and specificity in redox signaling. Free Radic. Biol. Med. 45, 549-561 (2008).
- Oxygen, Gene Expression, and Cellular Function. Clerch, L. B., Massaro, D. J. , (1997).
- Gutteridge, J. M. C., Halliwell, B. Antioxidants: Molecules, medicines, and myths. Biochem. Biophys. Res. Commun. 393, 561-564 (2010).
- Sumimoto, H. Structure, regulation and evolution of Nox-family NADPH oxidases that produce reactive oxygen species. FEBS J. 275, 3249-3277 (2008).
- Ignarro, L. J. Editor Nitric Oxide: Biology and Pathobiology. , Academic Press. San Diego, CA. (2009).
- Moreau, M. Differential effects of alkyl- and arylguanidines on the stability and reactivity of inducible NOS heme-dioxygen complexes. Biochemistry. 45, 3988-3999 (2006).
- Vasquez-Vivar, J. Superoxide generation by endothelial nitric oxide synthase: the influence of cofactors. Proc. Natl. Acad. Sci. U. S. A. 95, 9220-9225 (1998).
- Villamena, F. A., Zweier, J. L. Detection of reactive oxygen and nitrogen species by EPR spin trapping. Antioxid. Redox Signal. 6, 619-629 (2004).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping of superoxide and hydroxyl radical: practical aspects. Arch. Biochem. Biophys. 200, 1-16 (1980).
- Frejaville, C. 5-Diethoxyphosphoryl-5-methyl-1-pyrroline N-oxide (DEPMPO): a new phosphorylated nitrone for the efficient in vitro and in vivo spin trapping of oxygen-centered radicals. J. Chem. Soc., Chem. Commun. , 1793-1794 (1994).
- Olive, G., Mercier, A., Le Moigne, F., Rockenbauer, A., Tordo, P. 2-Ethoxycarbonyl-2-methyl-3,4-dihydro-2H-pyrrole-1-oxide: Evaluation of the spin trapping properties. Free Radical. Biol. Med. 28, 403-408 (2000).
- Villamena, F. A., Zweier, J. L. Superoxide radical trapping and spin adduct decay of 5-tert-butoxycarbonyl-5-methyl-1-pyrroline N-oxide (BocMPO): kinetics and theoretical analysis. J. Chem. Soc., Perkin Trans. 2, 1340-1344 (2002).
- Tsuchiya, K. Nitric oxide-forming reactions of the water-soluble nitric oxide spin-trapping agent, MGD. Free Radical Biol. Med. 27, 347-355 (1999).
- Vanin, A. F., Poltorakov, A. P., Mikoyan, V. D., Kubrina, L. N., van Faassen, E. Why iron-dithiocarbamates ensure detection of nitric oxide in cells and tissues. Nitric Oxide. 15, 295-311 (2006).
- RojasWahl, R. U. Decomposition mechanism of 3-N-morpholinosydnonimine (SIN-1): A density functional study on intrinsic structures and reactivities. J. Mol. Model. 10, 121-129 (2004).
- Klempner, M. S., Gallin, J. I. Separation and functional characterization of human neutrophil subpopulations. Blood. 51, 659-669 (1978).
- Pou, S. Spin trapping of nitric oxide by ferro-chelates: kinetic and in vivo pharmacokinetic studies. Biochim. Biophys. Acta. 1427, 216-226 (1999).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping. Kinetics of the reaction of superoxide and hydroxyl radicals with nitrones. J. Am. Chem. Soc. 102, 4994-4999 (1980).
- Britigan, B. E., Rosen, G. M. Spin-trapping and human neutrophils. Limits of detection of hydroxyl radical. J. Biol. Chem. 264, 12299-12302 (1989).
- Frejaville, C. 5-(Diethoxyphosphoryl)-5-methyl-1-pyrroline N-oxide: A new efficient phosphorylated nitrone for the in vitro and in vivo spin trapping of oxygen-centered radicals. J. Med. Chem. 38, 258-265 (1995).
- Snyrychova, I. Improvement of the sensitivity of EPR spin trapping in biological systems by cyclodextrins: A model study with thylakoids and photosystem II particles. Free Radical Biol. Med. 48, 264-274 (2010).
- Han, Y. Lipophilic beta-cyclodextrin cyclic-nitrone conjugate: Synthesis and spin trapping studies. J. Org. Chem. 74, 5369-5380 (2009).
- Han, Y., Tuccio, B., Lauricella, R., Villamena, F. A. Improved spin trapping properties by beta-cyclodextrin-cyclic nitrone conjugate. J. Org. Chem. 73, 7108-7117 (2008).
- Hardy, M. Detection, characterization, and decay kinetics of ROS and thiyl adducts of mito-DEPMPO spin trap. Chem. Res. Toxicol. 20, 1053-1060 (2007).
- Kim, S. -U. Fast reactivity of a cyclic nitrone-calix[4]pyrrole conjugate with superoxide radical anion: Theoretical and experimental studies. J. Am. Chem. Soc. 132, 17157-17173 (2010).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены