Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Nitrik Oksit ve hücreler arası Elektron Paramanyetik Rezonans Spektroskopisi ile süperoksit Radikal Anyon tespiti Spin Tuzakları kullanarak
Bu Makalede
Özet
Elektron paramanyetik rezonans (EPR) spektroskopisi demir (II)-N-metil-D-glukamin ditiokarbamat, Fe (MGD) kullanılarak, insan nötrofil gelen sığır aort endotelyal hücreler ve süperoksit anyon radikal nitrik oksit tespit etmek için kullanılmıştır 2 Ve 5,5-dimetil-1-pyroroline-N-oksit, sırasıyla, DMPO,.
Özet
Düşük konsantrasyonlarda reaktif nitrojen / oksijen türlerinin (ROS / RNS) sinyalizasyon, hücre fonksiyonunu düzenlenmesinde önemli bir rol oynayabilir ve bağışıklık yanıtı ancak düzenlenmemiş konsantrasyonlarda hücre canlılığı 1, 2 için zararlıdır. Canlı sistemlerde ROS üretimi düzenleyen endojen ve diyet antioksidan savunma mekanizmaları ile büyürken, ROS normal oksijen metabolizmasının yan ürünleri doğal olarak sürekli olarak üretilir ve protein fonksiyon kaybı, DNA bölünme veya lipid sonuçlanan biyomoleküllere oksidatif hasara neden olabilir peroksidasyonu 3 ve sonuçta hücre hasarına ya da ölüme yol açan 4 oksidatif stres.
Süperoksit radikal anyonu (O 2 • -) gibi peroksinitrit ve radikal hidroksil gibi biyolojik sistemler mevcut olduğu bilinmektedir en çok oksitleyici türler bazı önemli öncüsüdür. O 2 kuşak • - dolayısıyla oksidatif patlama ilk işareti işaret ve its algılama ve / veya biyolojik sistemler sekestrasyon önemlidir. Bu gösteri de, O 2 • - polimorfonükleer nötrofiller (PMN) elde edildi. Forbol-12-miristat-13-asetat (PMA) ile kemotaktik uyarılması yoluyla, PMN O 2 • üretir - nikotinamid adenin dinükleotid fosfat (NADPH) oksidaz 5 aktivasyonu yoluyla.
Üç izoformları gelir nitrik oksit (NO) sentaz, indüklenebilen-, nöronal-ve endotel-NOS veya iNOS, nNOS ve eNOS, sırasıyla, NO 6 üretmek için, NADPH ile, L-sitrulin, L-arjininin dönüşüm katalize olarak . Burada, endotel hücrelerinden NO oluşturulur. Oksidatif stres koşulları altında, örneğin eNOS O 2 • NO üreten geçiş yapabilirsiniz - Heme 7 veya co-faktör, tetrahidrobiyopterin (BH 4) 8 oksidasyonu neden olduğuna inanılan ayrılmasının adı verilen bir süreç içinde.
Sadece birkaç vardırancak biyolojik sistemlerde serbest radikallerin saptanması için güvenilir yöntemler özgüllük ve duyarlılığı ile sınırlıdır. Sıkma bindirme yaygın olarak serbest radikallerin belirlenmesi için kullanılan ve elektron paramanyetik rezonans (EPR) spektroskopi ile tespit edilebilir bir kalıcı sıkma adükt oluşturan bir spin tuzağı bir radikal ilavesiyle reaksiyon kapsamaktadır. Çeşitli radikal adducts oluşturulmakta radikalleri tespit etmek ve radikal üretiminin 9 doğasına ve kinetik hakkında bilgi zenginliği sağlayabilir kullanılabilir ayırt edici spektrumu sergilemesi.
Siklik nitrones, 5,5-dimetil-pirolin-N-oksit, DMPO 10, fosforil-ikameli DEPMPO 11 ve ester-ikameli, EMPO 12 ve 13 BMPO, yaygın olarak dönme tuzağı olarak kullanılan edilmiştir - ikinci dönme adduct - tuzakları O 2 • için Uzun yarılanma ömrü sergileyerek. Demir (II)-N-metil-D-glukamin ditiokarbamat, Fe (MGD) 2 <Alt /> genel adükt oluşumu ve sıkma adükt 14 arasında yüksek stabilite yüksek oranlı NO bağlı olarak yakalamak için kullanılır.
Protokol
1. Sığır aort endotel hücreleri (BAEC) Kültür
- Uygun aseptik teknikler takip edildi.
- 37 antibiyotik olmayan bir su banyosu, sıcak ortamda ° C.
Not: orta 4.5 g / L D-glikoz ile fenol serbest Dulbecco'nun değiştirilmiş Eagle ortamı (DMEM) oluşur,% 10 fetal bovin serumu (FBS) ve 2.5 ile desteklenmiş 4 mM L-glutamin,% 1 olmayan amino asitler, mg / L endotelyal büyüme faktörü.
- Inkübatör gelen T75 şişeyi içeren hücrelerin çıkarın ve kapağı içine yerleştirmeden önce% 70 etanol ile balonun yüzeyi temizleyin.
- Bir aspiratör kullanarak eski orta çıkarın ve Dulbecco fosfat tamponu salin (DPBS) 5 ml iki kez yıkayın.
- Tripsin 2 ml ekleyin ve periyodik mikroskop altında incelerken ayırmak için hücreler için 4-5 dakika bekleyin.
- Orta 3 ml ekleyin ve tekrar tekrar ayrı t için bir pipet ile karıştırıno hücreleri ve hatta süspansiyon oluşturun.
- 5 dakika boyunca 121 g bir 15 ml tüpü ve santrifüj ile tripsin ile orta 5 ml transfer edin.
- Bir aspiratörü kullanarak süpernatantı. DPBS 5 ml ekleyin ve iyice karıştırın. 5 dakika 121g santrifüjleyin.
- Süpernatant aspire ve orta 6 ml ekleyerek hücre peleti tekrar askıya.
- Bir 6-kuyucuklu plak üzerinde, çok daha sonra, orta ve 1 ml ilave her bir hücre süspansiyonu 1 ml ilave edilir. Bir pipet kullanarak süspansiyonu karıştırın.
- Plakası etiketlemek ve 37, bir gece boyunca inkübe ° C'de ve% 5 CO2.
2A. BAEC Hücre ile NO Algılama
- Uygun aseptik teknikler takip edildi.
- Kuluçka den 6-kuyucuklu plak kaldırmak ve birinci ve ikinci orta aspire. 1 ml DPBS ile iki kez yıkanır hücreleri.
- 1.9 mM demir (II) sülfat heptahidrat (FeSO 4 .7 H 2 O, 0,8 mg eriterek taze hazırlamak 210 ul ekle01:07 oranında kullanılarak 1 CaCI2 ve MgCl2 ile DPBS ml) ve amonyum N-metil-D-glukamin ditiokarbamat (MGD, CaCI2 ve MgCl2 içeren 500 ul DPBS içinde 2.7 mg çözülerek taze olarak hazırlamak) arasında 210 ul . (Not:. aşırı MGD kullanılır Bu oran, geleneksel Fe 3 verim +-MGD aşırı MGD varlığında maksimize olmasından dolayı +-MGD kompleksi Fe 2 hazırlanması için kullanılan edilmiş bir ek Fe 2 stabilize etmek için çözelti içinde askorbat +-MGD NO-Fe 3 yana oluşan +-MGD endojen askorbat, hidrokinon, ya kadar olan dönüşüm verimle sistein ile +-mgd 2 NO-Fe EPR saptanabilir indirgenir gerekli değildir % 99,9 '.. Fe 2 düşük spin diamanyetik devlet + NO) düşük sıcaklık cihazın gerek kalmadan düz hücre veya kapiler tüpü kullanarak 15 algılanmasını sağlar.
- Swirl edilen süspansiyon iyi ve 4.6 μ ekleyinkalsiyum iyonofor l (CAI) (1 ml DMSO içinde 1 mg eriterek 1,9 mM bir stok çözeltisi hazırlanır.)
- Swirl yine çözüm ve sırayla 36 dakika ° C daha-Fe 3 NO azaltılması NO-Fe 2 +-MGD EPR tespit etmek +-MGD izin vermek için 37 de inkübe edilir.
- Bir Eppendorf tüp ve EPR yassı hücreli (veya 50 ul kılcal tüp) için transfer süpernatant (425 ul) toplayın.
- EPR satın parametreler şunlardır: mikrodalga frekansı: 9.8 GHz; merkezi alanı: 3427 G, modülasyon genliği: 6.0 G; süpürme genişliği: 100 G; alıcı kazancı: 1 x 10 5; mikrodalga gücü: 10 mW; taramaları toplam sayısı: 121; tarama süresi: 10 sn; ve zaman sabiti: 20 ms (Not: parametreleri tek enstrüman ve deneysel koşullar diğerine değişir bu yana, bu nedenle, sadece merkez alan, frekans ve modülasyon genliği dikkat edilmesi gereken en önemli parametrelerdir.).
- Oda sıcaklığında spektrumları kaydetme ve 2-D spektrumları INTEG edildiBruker WinEPR Bilgi İşlem yazılım veya diğer veri işleme yazılımı kullanılarak düzeltilebilir arka plan gürültü ve bazal azaltmak için puan. Adduct oluşumu ölçümü için, konsantrasyon karşı sinyal yoğunluğu (veya bölge) standart araziler bir donör SNAP NO kullanarak inşa edilebilir.
2B. eNOS ayrılmasının Deney
- Kuluçka den 6-kuyucuklu plak kaldırmak ve ikinci kuyudan orta aspire ve 1 ml DPBS ile iki kez yıkanır.
- A peroksinitrit donör, 5-amino-3-(4-morfolinil) -1,2,3-oxadiazolium klorür (SIN-1) eNOS 16 çözüme kavuşturmak için kullanıldı. 0,5 mM SIN-1 (M r 206,6 taze olarak herhangi bir Ca / Mg iyonları ile 500 ul PBS içerisinde 1 mg sin-1 çözülmesiyle hazırlanmıştır 10 mM stok çözeltisinden g / mol) ve seyreltik ila 2 ml ile DPBS 100 ul ekleme ve% 10 FBS.
- 37 de 2 saat süre ile inkübe ° C'de ve% 5 CO2.
- Inkübatör gelen plaka çıkarın ve DPBS iki kez yıkayın.
- 210 ul ekle2,8 mM FeSO 4 0,7 H2O ve 19.6 mM 210 ul taze yukarıda belirtilen yönteme göre hazırlanan mgd.
- Swirl çözüm ve 1.9 mM Cai 4.6 ul ekleyin.
- Swirl yine çözüm ve 36 dakika 37 ° C'de inkübe edin.
- Bir Eppendorf tüp ve EPR düz hücre transferi (425 ul) süpernatant toplayın.
- EPR satın parametreler şunlardır: mikrodalga frekansı: 9.8 GHz; merkezi alanı: 3427 G, modülasyon genliği: 6 G; süpürme genişliği: 100 G; alıcı kazancı: 1 x 10 5; mikrodalga gücü: 10 mW; taramaları toplam sayısı: 121; tarama süresi: 10 sn; ve sabit süresi: 20 ms.
- Spektrumları kaydedin ve 2-B spektrumları yukarıda belirtildiği gibi düzeltilmiş arka plan gürültü ve bazal azaltmak için entegre edildi.
3. O 2 tespiti • - polimorfonükleer nötrofiller den (PMN)
- Daha önce tarif edildiği gibi 17, insan nötrofil kan örneği ile izole edildi.
- Dietilentriamin-pentaasetik asit (DTPA) 0.1 mM içeren PBS içinde 1 M * DMPO bir stok çözelti yapmak. DMPO 25-29 bir erime noktasına sahiptir ° C de bir cam şişeye (Not sıvı DMPO (yoğunluk ~ 1.02 g / ml 25 ° C) Pipeti daha kullanışlı hale getirir: saf DMPO beri tartım için plastik şişeleri kullanmayın ) plastik ile reaksiyona girer. Dondurulmuş DMPO flakon (: DMPO bozulabilir olarak sıcak su tüketmemek Not) üzerine ılık su çalıştırarak eritebilir.
- O zamandan beri yüksek saflıkta DMPO (>% 99) kullanılması önemlidir ticari olarak mevcut sıkma tuzakları bazı paramanyetik safsızlıklar içerir, ve bu yüzden, sadece tek başına DMPO çözeltisi EPR tayfı (bu durumda, 10 mM) çalıştırmak için zaruridir. Bu arka plan sinyali (Şekil 3A bakınız) bellidir önemlidir.
- DMSO içinde forbol-12-miristat-13-asetat (PMA) bir stok çözelti (1 mg / ml) hazırlamak. 10 mikrogram / ml PBS içinde çözüm seyreltilmesiyle alikotları olun.
- Bir 1 'de.5 ml Eppendorf tüpüne, ek olarak, sırası takip ederek 0,6 ml'lik toplam hacmi, bir solüsyon hazırlanır: PMN ml başına 10 ~ 6 hücreleri, D-glükoz (1 mg / ml) ve albumin (1 mg / ml), 10 mM DMPO ve PMA ile 0,2 mg / ml. (Not: PMA radikal aktivatörü ve son olarak ilave edilmelidir).
- EPR yassı hücreli çözüm aktarın.
- EPR satın parametreleri Mikrodalga frekansı: 9.8 GHz; merkezi alanı: 3486 G, modülasyon genliği: 0.5 G; süpürme genişliği: 100 G; alıcı kazancı: 5 x 10 5; taramaları toplam sayısı: 10; tarama süresi: 30 s ; mikrodalga gücü: 20 mW; ve zaman sabiti: 81 ms. Adduct oluşumu ölçümü için, konsantrasyon karşı sinyal yoğunluğu (veya bölge) standart araziler gibi TEMPO veya 3-karboksilik asit-PROXYL olarak istikrarlı nitroxides kullanarak inşa edilebilir.
DMPO kullanımına * önemli not: düz bir hücre kullanılarak, tek bir hücre yoğunluğu artırır ve böylece sinyali artan edebilirSpin adduct ama O 2 'nin yarı ömrü yoğunluğu • - DMPO of adduct DMPO-OH parçalanmasına neden olan (t 1/2 ~ 1 dak) kısa. DMPO t 1/2 ~ 8 ve sırasıyla 14 dakika olan artan adükt stabilite için ticari olarak temin edilebilir EMPO, BMPO ya DEPMPO aynı konsantrasyonu kullanılarak ikame edilebilir.
4. Temsilcisi Sonuçlar
Spin NO radikal yakalama Fe 2 +-MGD. Şekil 2A ve 2B ile yapıldı Fe 2 hiçbir EPR sinyal göstermiyor +-MGD veya Fe 2 karışımı arka plan sinyali YOK Bu reaktiflerin kaynaklı olduğunu gösteren, CAI ile +-MGD. CAI ile uyarılması üzerine BAEC Fe 2 ile reaksiyona girerek hangi NO bültenleri spin katkısı, NO-Fe 2 +-MGD oluşturmak için +-MGD, ve aşırı yarılma sabiti (hfsc) N = 12.66 G değeri ve karakteristik üçlü sinyali gösteriyor g = 2.040 g-faktörü. (Şekil 2C). Hfsc değeri NIEHS EPR Yazılım veritabanı web sitesinden indirilebilir WINSIM simülasyon programı kullanılarak belirlendi. Deneysel hfsc NO-Fe-2 + MGD adükt için bir N = 12,70 ve G = 2,041 g, 18 literatürde değeri ile tutarlıdır. Benzer şekilde, BAEC üzerine SIN-1 etkisi Şekil 2B'de gösterildiği gibi ayrılmasının nedeni eNOS üretimi NO indirilir.
Algılama - DMPO sıkma tuzağı O 2 • için kullanılmıştır. Spin tuzak paramanyetik pislik olduğunu onaylayan Şekil 3A gösterildiği gibi tek başına DMPO bir sinyal vermedi. Şekil 3B DMPO spektrumu ve PMN sadece ve benzer şekilde, DMPO neden olmaz düşündüren saptanabilir sinyal yok Enzim NADPH oksidaz aktivasyonu. Şekil 3C PMA ile PMN stimülasyonu üzerine gözlemlenen EPR sinyali gösterir. Bu sinyal için bir değer hfsc N = 14,71 G, bir & olarak belirlenmiştirbeta;-H = 11,40 G ve bir γ-H = 1.25 g, ve bir N = 14.3 G, bir β-H = 11.7 G ve bir γ-H literatürde değerleri DMPO-O için = 1.3 g 19 ile tutarlıdır 2 H adükt.

Şekil 1. EPR Spin hapsi kullanarak nötrofiller ve BAEC gelen radikallerin tespiti için akış çizelgesi. (A) PMNs'nin DMPO ve PMA ile karıştırılmış ve ortaya çıkan karışım verilerini elde etme için bir düz EPR hücre aktarılır. (B) BAEC bir plaka üzerinde yetiştirilir ve DPBS ile yıkandı. Spin tuzak Fe (MGD) 2 CAI ile birlikte eklendi. Çözeltisi iyice karıştırılır ve inkübe edildi. Karışım EPR veri toplama için bir EPR düz hücreler nakledildi.
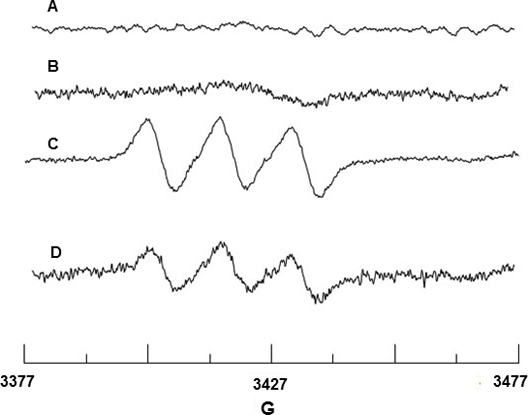
B'den NO Şekil 2. EPR tespitiAEC. Fe 2 (A) Spectrum +-MGD sadece (B) +-MGD + CAI sadece Fe 2 Spektrum. (C) Fe 2 NO hapsi kaynaklanan Üçüz spektrumu +-MGD kullanarak hücrelerin CAI-uyarılmış. (D) nedeniyle 0,5 mM hücrelerinin SIN-1 tedaviye NO üretimindeki düşüş gösteren Spectrum.
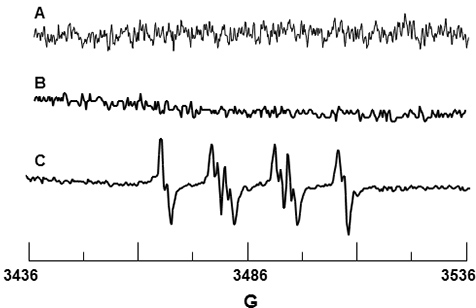
Aktif hale gelen nötrofiller DMPO-O 2 H Şekil 3. EPR algılama. 10 mM DMPO sadece (A) Spektrumu. (B) 10 mM DMPO varlığında başına PMN Spektrumu. (C) PMN Spektrumu 10 mM DMPO varlığında PMA ile aktive.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
EPR Spin hapsi serbest radikaller ve niceleme tanımlamak için biyomedikal uygulamalarda geniş bir istihdam edilmiştir. Sıkma bindirme derece hassas nM den böylece biyolojik sistemler uygulama için uygun hale uM arasında değişen konsantrasyonlarda radikalleri saptayabilir. Paramanyetik katkısı, NO-Fe 2 +-MGD, oluşumu EPR ile NO algılama temelidir. ~ Oranında 10 6 M -1 s -1 NO hızla 18 Fe 2 +-MGD tepki. NO-Fe 2 +-MGD addu...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma NIH Ulusal Kalp, Akciğer ve Kan Enstitüsü hibe RO1 HL81248 tarafından finanse edildi.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
| Fenol ücretsiz DMEM Yüksek glukoz 1X | GIBCO | 31053 | |
| % 0.25 tripsin-EDTA | GIBCO | 25200 | |
| L-Glutamine | Fisher Scientific | BP379-100 | |
| MEM Olmayan Esansiyel Amino asitler | GIBCO | 11140 | |
| Sığır fetüs serumu | Atlanta Biologicals | S11550 | |
| Endotelyal büyüme faktörü | Millipore | 02-102 | |
| Cai | Enzo Yaşam Bilimleri | A-23187 | DMSO içinde eritilir |
| SIN-1 | Enzo Yaşam Bilimleri | BML-CN245-0020 | |
| DMPO | Dojindo Laboratuvarları | D048-10 | |
| FeSO 4 .7 H 2 O | Sigma Aldrich | 215.422-250G | Ca ve Mg ile birlikte, PBS içerisinde çözünmesi |
| MGD | Enzo Yaşam Bilimleri | ALX-400-014-M050 | Ca 2 + ve Mg 2 ile PBS içinde eritilir + |
| BAEC hücreleri | Hücre Sistemleri | 2B2-C75 | |
| DMSO | Fisher Scientific | BP231-100 | |
| DPBS | Sigma Aldrich | D8537 | |
| CaCI2 ve MgCl2 ile DPBS | Sigma Aldrich | D8662 | |
| Forbol miristat asetat-(PMA) | Sigma Aldrich | 79.346-1MG |
Referanslar
- Winterbourn, C. C. Reconciling the chemistry and biology of reactive oxygen species. Nat. Chem. Biol. 4, 278-286 (2008).
- Winterbourn, C. C., Hampton, M. B. Thiol chemistry and specificity in redox signaling. Free Radic. Biol. Med. 45, 549-561 (2008).
- Oxygen, Gene Expression, and Cellular Function. Clerch, L. B., Massaro, D. J. , (1997).
- Gutteridge, J. M. C., Halliwell, B. Antioxidants: Molecules, medicines, and myths. Biochem. Biophys. Res. Commun. 393, 561-564 (2010).
- Sumimoto, H. Structure, regulation and evolution of Nox-family NADPH oxidases that produce reactive oxygen species. FEBS J. 275, 3249-3277 (2008).
- Ignarro, L. J. Editor Nitric Oxide: Biology and Pathobiology. , Academic Press. San Diego, CA. (2009).
- Moreau, M. Differential effects of alkyl- and arylguanidines on the stability and reactivity of inducible NOS heme-dioxygen complexes. Biochemistry. 45, 3988-3999 (2006).
- Vasquez-Vivar, J. Superoxide generation by endothelial nitric oxide synthase: the influence of cofactors. Proc. Natl. Acad. Sci. U. S. A. 95, 9220-9225 (1998).
- Villamena, F. A., Zweier, J. L. Detection of reactive oxygen and nitrogen species by EPR spin trapping. Antioxid. Redox Signal. 6, 619-629 (2004).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping of superoxide and hydroxyl radical: practical aspects. Arch. Biochem. Biophys. 200, 1-16 (1980).
- Frejaville, C. 5-Diethoxyphosphoryl-5-methyl-1-pyrroline N-oxide (DEPMPO): a new phosphorylated nitrone for the efficient in vitro and in vivo spin trapping of oxygen-centered radicals. J. Chem. Soc., Chem. Commun. , 1793-1794 (1994).
- Olive, G., Mercier, A., Le Moigne, F., Rockenbauer, A., Tordo, P. 2-Ethoxycarbonyl-2-methyl-3,4-dihydro-2H-pyrrole-1-oxide: Evaluation of the spin trapping properties. Free Radical. Biol. Med. 28, 403-408 (2000).
- Villamena, F. A., Zweier, J. L. Superoxide radical trapping and spin adduct decay of 5-tert-butoxycarbonyl-5-methyl-1-pyrroline N-oxide (BocMPO): kinetics and theoretical analysis. J. Chem. Soc., Perkin Trans. 2, 1340-1344 (2002).
- Tsuchiya, K. Nitric oxide-forming reactions of the water-soluble nitric oxide spin-trapping agent, MGD. Free Radical Biol. Med. 27, 347-355 (1999).
- Vanin, A. F., Poltorakov, A. P., Mikoyan, V. D., Kubrina, L. N., van Faassen, E. Why iron-dithiocarbamates ensure detection of nitric oxide in cells and tissues. Nitric Oxide. 15, 295-311 (2006).
- RojasWahl, R. U. Decomposition mechanism of 3-N-morpholinosydnonimine (SIN-1): A density functional study on intrinsic structures and reactivities. J. Mol. Model. 10, 121-129 (2004).
- Klempner, M. S., Gallin, J. I. Separation and functional characterization of human neutrophil subpopulations. Blood. 51, 659-669 (1978).
- Pou, S. Spin trapping of nitric oxide by ferro-chelates: kinetic and in vivo pharmacokinetic studies. Biochim. Biophys. Acta. 1427, 216-226 (1999).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping. Kinetics of the reaction of superoxide and hydroxyl radicals with nitrones. J. Am. Chem. Soc. 102, 4994-4999 (1980).
- Britigan, B. E., Rosen, G. M. Spin-trapping and human neutrophils. Limits of detection of hydroxyl radical. J. Biol. Chem. 264, 12299-12302 (1989).
- Frejaville, C. 5-(Diethoxyphosphoryl)-5-methyl-1-pyrroline N-oxide: A new efficient phosphorylated nitrone for the in vitro and in vivo spin trapping of oxygen-centered radicals. J. Med. Chem. 38, 258-265 (1995).
- Snyrychova, I. Improvement of the sensitivity of EPR spin trapping in biological systems by cyclodextrins: A model study with thylakoids and photosystem II particles. Free Radical Biol. Med. 48, 264-274 (2010).
- Han, Y. Lipophilic beta-cyclodextrin cyclic-nitrone conjugate: Synthesis and spin trapping studies. J. Org. Chem. 74, 5369-5380 (2009).
- Han, Y., Tuccio, B., Lauricella, R., Villamena, F. A. Improved spin trapping properties by beta-cyclodextrin-cyclic nitrone conjugate. J. Org. Chem. 73, 7108-7117 (2008).
- Hardy, M. Detection, characterization, and decay kinetics of ROS and thiyl adducts of mito-DEPMPO spin trap. Chem. Res. Toxicol. 20, 1053-1060 (2007).
- Kim, S. -U. Fast reactivity of a cyclic nitrone-calix[4]pyrrole conjugate with superoxide radical anion: Theoretical and experimental studies. J. Am. Chem. Soc. 132, 17157-17173 (2010).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır