A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זיהוי של תחמוצת החנקן אניון קיצוני superoxide ידי ספקטרוסקופיה פאראמגנטיים אלקטרונים תהודה בין תאים באמצעות מלכודות ספין
In This Article
Summary
פאראמגנטיים אלקטרונים תהודה (EPR) ספקטרוסקופיה הועסק לזהות תחמוצת החנקן מתאי אנדותל העורקים שור ו אניון קיצוני superoxide של נויטרופילים האדם באמצעות ברזל (II)-N-methyl-D-glucamine dithiocarbamate, Fe (MGD) 2 ו - 5,5-דימתיל-1-pyroroline-N-אוקסיד, DMPO, בהתאמה.
Abstract
חנקן מגיב / מינים חמצן (ROS / RNS) בריכוזים נמוכים יש תפקיד חשוב בוויסות תפקוד התא, איתות, ואת התגובה החיסונית, אך בריכוזים לא מוסדרים ופוגעים כדאיות התא 1, 2. בעוד מערכות החיים התפתחו עם מנגנוני ההגנה אנדוגני נוגדי חמצון תזונתיים להסדרת ROS דור, ROS מיוצרים ללא הרף טבעי תוצרי לוואי של חילוף החומרים הנורמלי של חמצן יכול לגרום נזק חמצוני ביומולקולות וכתוצאה מכך אובדן תפקוד החלבון, מחשוף ה-DNA, או שומנים בדם peroxidation 3, ובסופו של דבר סטרס חמצוני שמוביל לפציעה או מוות התא 4.
אניון קיצוני superoxide (O 2 • -) הוא המבשר העיקרי של כמה מינים ביותר ביותר חמצון הידועים קיימות במערכות ביולוגיות כגון peroxynitrite ו הידרוקסיל הרדיקלי. דור של O 2 • - מסמל הסימן הראשון של פרץ חמצוני, ולכן, אניTS ו איתור / או התפיסה במערכות ביולוגיות חשוב. בהפגנה זו, O 2 • - נוצר מ נויטרופילים polymorphonuclear (PMNs). באמצעות גירוי chemotactic עם phorbol-12-myristate אצטט-13 (PMA), PMN מייצר O 2 • - באמצעות הפעלת nicotinamide אדנין מונואמין פוספט (NADPH) dinucleotide 5.
תחמוצת החנקן (NO) synthase אשר מגיע בשלושה isoforms, כמו מושרה-, עצבי ו-האנדותל-NOS, או אינוס, nNOS או אינס, בהתאמה, מזרז את ההמרה של L-ארגינין ל L-Citrulline, באמצעות NADPH לייצר NO 6 . הנה, אנחנו שנוצר NO מתאי אנדותל. בתנאי סטרס חמצוני, אינס למשל יכול לעבור מייצור אין O 2 • - בתהליך הנקרא שיחררה את סוגר, אשר ככל הנראה נגרם על ידי חמצון של heme 7 או שיתוף גורם, tetrahydrobiopterin (BH 4) 8.
יש רק מעטיםשיטות אמינות לגילוי של רדיקלים חופשיים במערכות ביולוגיות, אלא מוגבלים על ידי סגוליות ורגישות. השמנה ספין משמש בדרך כלל לצורך זיהוי של רדיקלים חופשיים כרוך התגובה תוספת של קיצוני במלכודת הספין ויוצרים adduct ספין מתמשך, אשר ניתן לאתרם באמצעות ספקטרוסקופיית תהודה אלקטרונים (EPR) פאראמגנטיים. את adducts קיצוניים שונים מציגים מגוון ייחודי אשר ניתן להשתמש בהם כדי לזהות את הרדיקלים הנוצרים והוא יכול לספק מידע רב על הטבע ועל קינטיקה של ייצור רדיקלי 9.
Nitrones את מוט ההיגוי, 5,5-דימתיל-pyrroline-N-אוקסיד, DMPO 10, DEPMPO phosphoryl-להחליף 11, אסתר, להחליף, EMPO 12 ו BMPO 13, היה בשימוש זמן רב כמו מלכודות ספין - הספין האחרון מלכודות להציג עוד מחצית חיים של O 2 • - adduct. ברזל (II)-N-methyl-D-glucamine dithiocarbamate, Fe (MGD) 2 </> תת הוא נפוץ ללכוד NO בשל שיעור גבוה של היווצרות adduct ויציבות גבוהה של adduct ספין 14.
Protocol
1. התרבות של תאים אבי העורקים שור אנדותל (BAEC)
- טכניקות אספטיים ראויים היו במעקב.
- ב בינוני אמבטיה, מים חמים ללא אנטיביוטיקה ב 37 ° C.
הערה: בינוני מורכב בינוני פנול חינם שונה Dulbecco של הנשרים (DMEM) עם 4.5 גלוקוז-D גר '/ ל', 4 מ"מ L-גלוטמין, 1% לא חיוניות חומצות אמינו, בתוספת 10% בסרום שור עוברית (FBS) ו - 2.5 מ"ג / ל 'צמיחה האנדותל גורם.
- הסר את T75 תאים בקבוק שהכיל מן החממה ולנקות את פני השטח של הבקבוק עם אתנול 70% לפני הצבתו בתוך מכסה המנוע.
- הסר את המדיום הישן באמצעות aspirator ולשטוף פעמיים עם 5 מ"ל של חיץ פוספט Dulbecco של מי מלח (DPBS).
- הוסף 2 מ"ל של טריפסין ולחכות 4-5 דקות עבור תאים לנתק תוך מעת לעת לבדוק תחת מיקרוסקופ.
- הוסף 3 מ"ל של מדיום שוב ושוב מערבבים בעזרת פיפטה כדי לא נפרדהוא התאים וליצור אפילו השעיה.
- העברת 5 מ"ל של מדיום עם טריפסין לצינור 15 מ"ל ו - 121 גרם צנטריפוגות ב 5 דקות.
- הסר את supernatant באמצעות aspirator. הוסף 5 מ"ל של DPBS ומערבבים היטב. סרכזת ב 121g במשך 5 דקות.
- Aspirate supernatant מחדש להשעות את התא גלולה ידי הוספת 6 מ"ל של המדיום.
- על צלחת 6-היטב, להוסיף 1 מ"ל של תרחיף תאים זה טוב ולאחר מכן להוסיף 1 מ"ל של המדיום. מערבבים את ההשעיה באמצעות פיפטה.
- לתייג את הצלחת דגירה לילה ב 37 מעלות צלזיוס, 5% CO 2.
2 א. זיהוי של NO עם תא BAEC
- טכניקות אספטיים ראויים היו במעקב.
- הסר את צלחת 6-היטב החממה ואת לשאוב מבאר בינוני 1. שוטפים את התאים פעמיים עם 1 DPBS מ"ל.
- הוסף μl 210 של 1.9 mM heptahydrate ברזל סולפט (ב) (4 FeSO 0.7 H 2 O, להכין טרי על ידי המסת 0.8 מ"ג1 DPBS מ"ל עם CaCl 2 ו MgCl 2) ו 210 μl של N-methyl-D-glucamine אמוניום dithiocarbamate (MGD, להכין טרי על ידי המסת 2.7 מ"ג ב -500 DPBS μl עם CaCl 2 ו MgCl 2) באמצעות יחס של 1:07 . (הערה:. זה היחס שבו MGD עודף משמש הועסק כמקובל להכנת Fe 2 +-MGD מורכבת בשל העובדה כי התשואה עבור Fe 3 +-MGD מוגדל בנוכחות MGD עודף תוספת של ascorbate בפתרון לייצב את Fe 2 +-MGD אין צורך מאז 3 NO-Fe +-MGD נוצר מצטמצם endogenously כדי להבחין EPR NO-Fe 2 +-MGD ידי ascorbate, הידרוקינון, או ציסטאין עם יעילות המרה של עד ל 99.9% .. ספין נמוך diamagnetic מדינת Fe 2 + מאפשר איתור של NO באמצעות תאים שטוח או צינור נימי ללא צורך במכשיר בטמפרטורה נמוכה) 15.
- מערבולת ההשעיה וכתוצאה מכך גם ולהוסיף 4.6 μאני ionophore של סידן (Cai) (מוכן מפתרון מלאי של mM 1.9 ידי המסת 1 מ"ג 1 מ"ל DMSO).
- הפתרון מערבולת שוב דגירה על 37 מעלות צלזיוס במשך 36 דקות על מנת להמשיך לאפשר הפחתה של NO-Fe 3 +-MGD כדי להבחין EPR NO-Fe 2 +-MGD.
- איסוף supernatant (425 μl) בצינור Eppendorf והעברת לתא EPR שטוח (או צינור נימי 50 μl).
- פרמטרים EPR הרכישה הם: תדר מיקרוגל: 9.8 GHz, מרכז המגרש: 3427 G, אפנון אמפליטודה: 6.0 G, רוחב סריקה: 100 גרם; רווח מקלט: 1 x 10 5: כוח מיקרוגל: 10 mW, המספר הכולל של סריקות: 121; זמן סריקה: 10 שניות, וזמן קבוע: 20 ms (הערה: מאז פרמטרים משתנים ממכשיר אחד למשנהו תנאי הניסוי, אם כן, רק את מרכז המגרש, תדירות אפנון משרעת הם הפרמטרים החשובים ביותר שיש להביא בחשבון.).
- רשום את ספקטרום בטמפרטורת החדר ספקטרה 2-D היו integדורג להפחית את רעשי הרקע ואת הבסיס לתקן באמצעות Bruker WinEPR תוכנת עיבוד נתונים או תוכנה אחר לעיבוד נתונים. על כימות של היווצרות adduct, מגרשים סטנדרטיים של ריכוז העוצמה מול אות (או אזור) ניתן לבנות באמצעות SNAP NO התורם.
2B. אינס ניסוי שיחררה את סוגר
- הסר את צלחת 6-היטב החממה ואת לשאוב מבאר בינוני 2 ולשטוף פעמיים עם 1 DPBS מ"ל.
- התורם peroxynitrite, 5-אמינו-3-(4-morpholinyl) -1,2,3-oxadiazolium כלוריד (SIN-1) שימש ניתקת אינס 16. הוסף 100 μl של 0.5 מ"מ Sin-1 (M-R 206.6 g / mol, מפתרון 10 mM המניות מוכן טרי על ידי המסת 1 מ"ג SIN-1 ב 500 μl של PBS עם יוני אין CA / מ"ג) כדי לדלל 2 מ"ל עם DPBS ו 10% FBS.
- דגירה של 2 שעות ב 37 מעלות צלזיוס, 5% CO 2.
- הסר את הצלחת מן החממה ולשטוף פעמיים עם DPBS.
- הוסף μl 210 של2.8 מ"מ FeSO 4 0.7 H 2 O ו - μl 210 מ"מ 19.6 MGD מוכן טרי על פי הנוהל הנ"ל.
- הפתרון לערבל ומוסיפים 4.6 μl של צאי mM 1.9.
- הפתרון מערבולת שוב דגירה על 37 מעלות צלזיוס במשך 36 דקות.
- איסוף supernatant (425 μl) בצינור Eppendorf והעברת לתא שטוח EPR.
- פרמטרים EPR הרכישה הם: תדר מיקרוגל: 9.8 GHz, מרכז המגרש: 3427 G, אפנון משרעת: 6 G, רוחב סריקה: 100 גרם; רווח מקלט: 1 x 10 5: כוח מיקרוגל: 10 mW, המספר הכולל של סריקות: 121; זמן סריקה: 10 שניות, וזמן קבוע: ms 20.
- רשום את ספקטרום ו ספקטרה 2-D שולבו כדי להפחית את רעשי הרקע ואת הבסיס לתקן כאמור לעיל.
3. זיהוי של O 2 • - מ נויטרופילים Polymorphonuclear (PMNs)
- נויטרופילים בודדו דגימת דם האדם כפי שתואר קודם לכן 17.
- להפוך את פתרון מלאי של 1 M DMPO * ב PBS המכיל 0.1 מ"מ diethylenetriamine-pentaacetic חומצה (DTPA). DMPO יש נקודת התכה של 25-29 מעלות צלזיוס כל כך נוח יותר פיפטה DMPO נוזלי (~ 1.02 גרם / מ"ל צפיפות של 25 מעלות צלזיוס) כדי בקבוקון זכוכית (הערה: אין להשתמש צלוחיות פלסטיק במשקל מאז DMPO טהור מגיב עם פלסטיק). קפוא DMPO ניתן נמס על ידי מים זורמים פושר על הבקבוקון (הערה: לא להפעיל את המים החמים כמו DMPO עלול להתפרק).
- חשוב להשתמש טוהר DMPO גבוהה (> 99%) מאז כמה מלכודות ספין זמינים מסחרית מכילים זיהומים פאראמגנטיים, ועל כן, חובה להפעיל מגוון EPR של פתרון פשוט DMPO בלבד (10 מ"מ במקרה זה). זה קריטי, כי אין אות הרקע ניכר (ראה איור 3 א).
- הכן פתרון המניות (1 מ"ג / מ"ל) של phorbol-12-myristate אצטט-13 (PMA) ב DMSO. הפוך את aliquots ידי דילול הפתרון מיקרוגרם 10 / מ"ל ב PBS.
- ב 1.5 מ"ל צינור Eppendorf, להכין את הפתרון עם נפח כולל של 0.6 מ"ל על ידי ביצוע רצף בנוסף: ~~~HEAD=NNS 10 6 תאים לכל מ"ל של PMN, D-גלוקוז (1 מ"ג / מ"ל) ואלבומין (1 מ"ג / מ"ל), 10 DMPO mM ו 0.2 מיקרוגרם / מ"ל של PMA. (הערה: PMA הוא activator הרדיקלי יש להוסיף אחרון).
- מעבירים את הפתרון לתא שטוח EPR.
- EPR רכישה תנאי פרמטרים: תדר מיקרוגל: 9.8 GHz, מרכז המגרש: 3486 G, אפנון אמפליטודה: 0.5 G, רוחב סריקה: 100 גרם; רווח מקלט: 5 X 10 5, המספר הכולל של סריקות: 10, זמן סריקה: 30 שניות ; כוח מיקרוגל: 20 mW, וזמן קבוע: ms 81. על כימות של היווצרות adduct, מגרשים סטנדרטיים של ריכוז העוצמה מול אות (או אזור) ניתן לבנות באמצעות nitroxides יציבים כגון קצב או 3-carboxylic חומצה PROXYL.
* הערה חשובה על השימוש DMPO: באמצעות תא שטוחה, ניתן להגדיל את צפיפות התאים ועל ידי כך להגדיל את האותעוצמת adduct ספין אבל מחצית חיים של O 2 • - adduct של DMPO קצר (t 1/2 ~ 1 דק '), אשר מתפרק כדי DMPO-OH. DMPO ניתן להחליף באמצעות ריכוזים של אותו EMPO, BMPO או DEPMPO אשר זמינים מסחרית ליציבות adduct מוגברת עם T 1/2 ~ 8 ו - 14 דקות, בהתאמה.
4. נציג תוצאות
ספין לכידה של NO הרדיקלי בוצעה באמצעות Fe 2 +-MGD. איור 2a ו-2b להראות שום סימן EPR מ Fe 2 +-MGD או תערובת של Fe 2 +-MGD עם קאי, המציין כי אין אות NO רקע מקורו ריאגנטים אלה. BAEC על גירוי עם צאי משחרר NO אשר מגיב עם Fe 2 +-MGD ליצירת adduct ספין, NO-Fe 2 +-MGD, ומראה אות שלישיה אופיינית עם פיצול הערך hyperfine (hfsc) קבוע של 12.66 = N ו - G G-גורם של G = 2.040. (איור 2 ג). HFערך SC נקבע באמצעות תוכנת סימולציה WINSIM שניתן להורדה באתר NIEHS EPR מסד נתונים תוכנה. Hfsc הניסוי עולה בקנה אחד עם הערך בספרות של N = 12.70 G ו-G = 2.041 18 עבור NO-Fe 2 +-MGD adduct. כמו כן, ההשפעה של SIN-1 על BAEC הוריד את ייצור NO בשל אינס קשירה והתרה כפי שמוצג באיור 2 ד.
מלכודת DMPO ספין שימש O 2 • - זיהוי. DMPO לבד לא נתן אות כפי שמוצג באיור 3 א המאשרת כי במלכודת הספין הוא ללא זיהומים פאראמגנטיים. איור 3 ב הוא הספקטרום של DMPO ו PMNs בלבד, כמו כן, אין כל סימן לזיהוי המצביע על כך DMPO אינו גורם הפעלת האנזים NADPH אוקסידאז. איור 3 ג מראה את האות EPR שנצפה על ידי גירוי של PMN PMA. הערכים hfsc לאות זה נקבעו להיות N = 14.71 G, A &בטא;-H = 11.40 G ו-H γ = 1.25 G, עולים בקנה אחד עם ערכי הספרות של N = 14.3 G, β-H = 11.7 G ו-H γ = 1.3 גרם 19 עבור DMPO-O 2 H adduct.

באיור 1. תרשים זרימה לצורך זיהוי של רדיקלים של נויטרופילים BAEC באמצעות השמנה ספין EPR. (א) PMNs היו מעורבים עם DMPO ו PMA, ואת התערובת וכתוצאה מכך הועבר לתא שטוח EPR לרכישת נתונים. (ב) BAEC גדלו על צלחת, ושטפה עם DPBS. מלכודת ספין פה (MGD) 2 נוספה יחד עם קאי. הפתרון היה מעורב באופן יסודי מודגרות. תערובת הועבר לתא שטוח EPR לרכישת נתונים EPR.
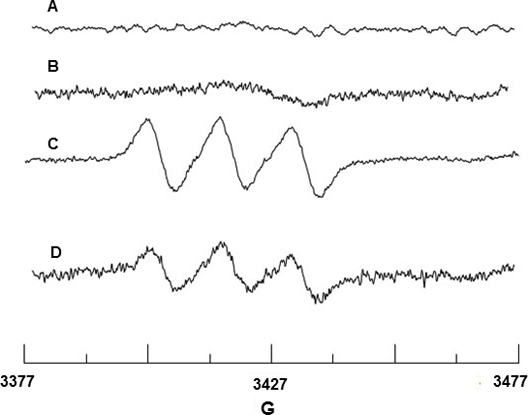
2. איור EPR זיהוי של NO מ-BAEC. (א) ספקטרום של Fe 2 +-MGD רק (ב) ספקטרום של Fe 2 + +-MGD צאי בלבד. (ג) קשת שלישיה כתוצאה השמנה NO על ידי Fe 2 +-MGD באמצעות צאי, גירוי התאים. (ד) ספקטרום מראה ירידה בייצור NO בשל 0.5 מ"מ SIN-1 טיפול של תאים.
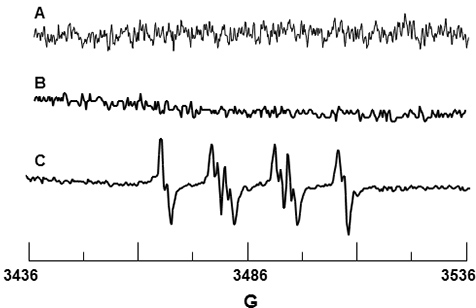
3. איור EPR זיהוי של DMPO-O 2 H מ נויטרופילים הופעלו. (א) ספקטרום של DMPO 10 מ"מ בלבד. (ב) ספקטרום של PMN לבד בנוכחות DMPO 10 מ"מ. (ג) ספקטרום של PMN מופעל על ידי PMA בנוכחות DMPO 10 מ"מ.
Access restricted. Please log in or start a trial to view this content.
Discussion
השמנה EPR ספין כבר המועסקים במגוון רחב של יישומים ביו לכימות וזיהוי רדיקלים חופשיים. השמנה ספין הוא רגיש במיוחד, מסוגל לאתר רדיקלים בריכוזים הנעים בין ננומטר ל מיקרומטר ובכך מתאים ליישום במערכות ביולוגיות. היווצרות adduct פאראמגנטיים, NO-Fe 2 +-MGD, הוא הבסיס של זיהוי ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
עבודה זו מומנה על ידי המוסד הלאומי לבריאות הלב, ריאות ודם המכון מענק RO1 HL81248.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | הערות (לא חובה) |
| פנול בינוני ללא DMEM גלוקוז גבוה 1X | GIBCO | 31053 | |
| 0.25% טריפסין-EDTA | GIBCO | 25200 | |
| L-גלוטמין | פישר סיינטיפיק | BP379-100 | |
| ממ ללא חומצות האמינו החיוניות | GIBCO | 11140 | |
| בסרום שור עוברית | אטלנטה ביולוגיות | S11550 | |
| צמיחה האנדותל גורם | Millipore | 02-102 | |
| צאי | אנזו מדעי החיים | A-23187 | להמיס DMSO |
| SIN-1 | אנזו מדעי החיים | BML-CN245-0020 | |
| DMPO | Dojindo מעבדות | D048-10 | |
| FeSO 4 0.7 H 2 O | סיגמא אולדריץ' | 215422-250 גרם | להמיס PBS עם Ca ו Mg |
| MGD | אנזו מדעי החיים | ALX-400-014-M050 | להמיס PBS עם Ca 2 + ו - Mg 2 + |
| BAEC תאים | מערכות תא | 2B2-C75 | |
| DMSO | פישר סיינטיפיק | BP231-100 | |
| DPBS | סיגמא אולדריץ' | D8537 | |
| DPBS עם CaCl 2 ו MgCl 2 | סיגמאldrich | D8662 | |
| Phorbol-myristate אצטט (PMA) | סיגמא אולדריץ' | 79346-במינון של 1 |
References
- Winterbourn, C. C. Reconciling the chemistry and biology of reactive oxygen species. Nat. Chem. Biol. 4, 278-286 (2008).
- Winterbourn, C. C., Hampton, M. B. Thiol chemistry and specificity in redox signaling. Free Radic. Biol. Med. 45, 549-561 (2008).
- Oxygen, Gene Expression, and Cellular Function. Clerch, L. B., Massaro, D. J. , (1997).
- Gutteridge, J. M. C., Halliwell, B. Antioxidants: Molecules, medicines, and myths. Biochem. Biophys. Res. Commun. 393, 561-564 (2010).
- Sumimoto, H. Structure, regulation and evolution of Nox-family NADPH oxidases that produce reactive oxygen species. FEBS J. 275, 3249-3277 (2008).
- Ignarro, L. J. Editor Nitric Oxide: Biology and Pathobiology. , Academic Press. San Diego, CA. (2009).
- Moreau, M. Differential effects of alkyl- and arylguanidines on the stability and reactivity of inducible NOS heme-dioxygen complexes. Biochemistry. 45, 3988-3999 (2006).
- Vasquez-Vivar, J. Superoxide generation by endothelial nitric oxide synthase: the influence of cofactors. Proc. Natl. Acad. Sci. U. S. A. 95, 9220-9225 (1998).
- Villamena, F. A., Zweier, J. L. Detection of reactive oxygen and nitrogen species by EPR spin trapping. Antioxid. Redox Signal. 6, 619-629 (2004).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping of superoxide and hydroxyl radical: practical aspects. Arch. Biochem. Biophys. 200, 1-16 (1980).
- Frejaville, C. 5-Diethoxyphosphoryl-5-methyl-1-pyrroline N-oxide (DEPMPO): a new phosphorylated nitrone for the efficient in vitro and in vivo spin trapping of oxygen-centered radicals. J. Chem. Soc., Chem. Commun. , 1793-1794 (1994).
- Olive, G., Mercier, A., Le Moigne, F., Rockenbauer, A., Tordo, P. 2-Ethoxycarbonyl-2-methyl-3,4-dihydro-2H-pyrrole-1-oxide: Evaluation of the spin trapping properties. Free Radical. Biol. Med. 28, 403-408 (2000).
- Villamena, F. A., Zweier, J. L. Superoxide radical trapping and spin adduct decay of 5-tert-butoxycarbonyl-5-methyl-1-pyrroline N-oxide (BocMPO): kinetics and theoretical analysis. J. Chem. Soc., Perkin Trans. 2, 1340-1344 (2002).
- Tsuchiya, K. Nitric oxide-forming reactions of the water-soluble nitric oxide spin-trapping agent, MGD. Free Radical Biol. Med. 27, 347-355 (1999).
- Vanin, A. F., Poltorakov, A. P., Mikoyan, V. D., Kubrina, L. N., van Faassen, E. Why iron-dithiocarbamates ensure detection of nitric oxide in cells and tissues. Nitric Oxide. 15, 295-311 (2006).
- RojasWahl, R. U. Decomposition mechanism of 3-N-morpholinosydnonimine (SIN-1): A density functional study on intrinsic structures and reactivities. J. Mol. Model. 10, 121-129 (2004).
- Klempner, M. S., Gallin, J. I. Separation and functional characterization of human neutrophil subpopulations. Blood. 51, 659-669 (1978).
- Pou, S. Spin trapping of nitric oxide by ferro-chelates: kinetic and in vivo pharmacokinetic studies. Biochim. Biophys. Acta. 1427, 216-226 (1999).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping. Kinetics of the reaction of superoxide and hydroxyl radicals with nitrones. J. Am. Chem. Soc. 102, 4994-4999 (1980).
- Britigan, B. E., Rosen, G. M. Spin-trapping and human neutrophils. Limits of detection of hydroxyl radical. J. Biol. Chem. 264, 12299-12302 (1989).
- Frejaville, C. 5-(Diethoxyphosphoryl)-5-methyl-1-pyrroline N-oxide: A new efficient phosphorylated nitrone for the in vitro and in vivo spin trapping of oxygen-centered radicals. J. Med. Chem. 38, 258-265 (1995).
- Snyrychova, I. Improvement of the sensitivity of EPR spin trapping in biological systems by cyclodextrins: A model study with thylakoids and photosystem II particles. Free Radical Biol. Med. 48, 264-274 (2010).
- Han, Y. Lipophilic beta-cyclodextrin cyclic-nitrone conjugate: Synthesis and spin trapping studies. J. Org. Chem. 74, 5369-5380 (2009).
- Han, Y., Tuccio, B., Lauricella, R., Villamena, F. A. Improved spin trapping properties by beta-cyclodextrin-cyclic nitrone conjugate. J. Org. Chem. 73, 7108-7117 (2008).
- Hardy, M. Detection, characterization, and decay kinetics of ROS and thiyl adducts of mito-DEPMPO spin trap. Chem. Res. Toxicol. 20, 1053-1060 (2007).
- Kim, S. -U. Fast reactivity of a cyclic nitrone-calix[4]pyrrole conjugate with superoxide radical anion: Theoretical and experimental studies. J. Am. Chem. Soc. 132, 17157-17173 (2010).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved