Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Détection de l'oxyde nitrique et de l'anion superoxyde radical par spectroscopie de résonance paramagnétique électronique à partir de cellules en utilisant des pièges de spin
Dans cet article
Résumé
Résonance paramagnétique électronique (RPE) a été utilisé pour détecter l'oxyde nitrique à partir de cellules endothéliales aortiques bovines et de l'anion superoxyde radical de neutrophiles humains en utilisant le fer (II)-N-méthyl-D-glucamine dithiocarbamate, Fe (MGD) 2 Et de 5,5-diméthyl-1-pyroroline-N-oxyde, DMPO, respectivement.
Résumé
Azote réactif / espèces oxygénées (ROS / RNS) à des concentrations faibles jouent un rôle important dans la régulation de la fonction des cellules, de signalisation, et la réponse immunitaire, mais à des concentrations non réglementés sont préjudiciables à la viabilité des cellules 1, 2. Alors que les systèmes vivants ont évolué avec endogènes et alimentaires mécanismes de défense antioxydants pour réglementer ROS génération, ROS sont produites en continu tant que sous-produits naturels du métabolisme normal de l'oxygène et peut causer des dommages oxydatifs à des biomolécules entraînant la perte de la fonction des protéines, coupure de l'ADN, ou des lipides peroxydation 3, et, finalement, à un stress oxydatif conduisant à des blessures ou la mort cellulaire 4.
Anion superoxyde radical (O 2 • -) est le précurseur d'majeure partie des espèces plus fortement oxydants connus dans des systèmes biologiques tels que le peroxynitrite radical hydroxyle et. La génération de O 2 • - signale le premier signe de la flambée oxydative, et, par conséquent, its de détection et / ou de séquestration dans les systèmes biologiques est important. Dans cette démonstration, O 2 • - a été générée à partir de polynucléaires neutrophiles (PMN). Grâce à la stimulation chimiotactique avec le phorbol-12-myristate-13-acétate (PMA), PMN génère O 2 • - via l'activation de la nicotinamide adénine dinucléotide phosphate (NADPH) oxydase 5.
D'oxyde nitrique (NO) synthase qui se décline en trois isoformes, comme inductible, endothéliale et neuronale-NOS, ou iNOS, nNOS ou de eNOS, respectivement, catalyse la conversion de la L-arginine en L-citrulline, en utilisant le NADPH pour produire NO 6 . Ici, nous avons généré NO par les cellules endothéliales. Dans des conditions de stress oxydatif, eNOS par exemple, peut passer de la production de NO à O 2 • - dans un processus appelé découplage, qui est censé être causé par l'oxydation de l'hème 7 ou le co-facteur, tétrahydrobioptérine (BH 4) 8.
Il ya seulement quelquesméthodes fiables pour la détection de radicaux libres dans les systèmes biologiques, mais sont limités par la spécificité et la sensibilité. Piégeage de spin est couramment utilisé pour l'identification de radicaux libres et comprend la réaction d'addition d'un radical à un accepteur de spin formant un produit d'addition de spin persistant qui peut être détectée par résonance paramagnétique électronique (RPE). Les adduits différents radicaux présentent spectre distinctif qui peut être utilisé pour identifier les radicaux étant générées et peuvent fournir une mine de renseignements sur la nature et la cinétique de la production de radicaux 9.
Les nitrones cycliques, 5,5-diméthyl-pyrroline-N-oxyde, DMPO 10, l'phosphoryle substitué DEPMPO 11, et l'ester-substitué, EMPO 12 et 13, BMPO ont été largement utilisé comme pièges de spin - le spin-ci pièges présentant plus des demi-vies pour O 2 • - adduit. Fer (II)-N-méthyl-D-glucamine dithiocarbamate, Fe (MGD) 2 </ Sub> est couramment utilisé pour piéger NO en raison de taux élevé de la formation d'adduits et la grande stabilité de l'adduit de spin 14.
Protocole
1. Culture de cellules endothéliales aortiques bovines (CEAB)
- Des techniques d'asepsie ont été respectées.
- Dans un bain d'eau, milieu chaud sans antibiotiques à 37 ° C.
Remarque: Le milieu est constitué de phénol milieu exempt de Eagle modifié par Dulbecco (DMEM) avec 4,5 g / L D-glucose, 4 mM de L-glutamine, 1% non-acides aminés essentiels, supplémenté avec 10% de sérum bovin (FBS) et 2,5 mg / L facteur de croissance endothélial.
- Retirer les cellules T75 flacon contenant de l'incubateur et nettoyer la surface de la fiole avec de l'éthanol 70% avant de le placer à l'intérieur du capot.
- Retirez l'ancien milieu à l'aide d'un aspirateur et laver deux fois avec 5 ml de solution saline de Dulbecco tampon phosphate (DPBS).
- Ajouter 2 ml de trypsine et d'attendre 4-5 min pour les cellules à se détacher tout inspecter périodiquement sous le microscope.
- Ajouter 3 ml du milieu et à plusieurs reprises mélanger à l'aide d'une pipette de séparer til cellules et créer une suspension même.
- Transférer 5 ml du milieu avec de la trypsine dans un tube de 15 ml et centrifuger à 121 g pendant 5 min.
- Eliminer le surnageant à l'aide d'un aspirateur. Ajouter 5 ml de DPBS et bien mélanger. Centrifuger à 121g pendant 5 min.
- Aspirer le surnageant et remettre en suspension le culot cellulaire en ajoutant 6 ml du milieu.
- Sur une plaque à 6 puits, ajouter 1 ml de la suspension cellulaire dans chaque puits, puis ajouter 1 ml du milieu. Mélanger la suspension en utilisant une pipette.
- Etiqueter la plaque et laisser incuber une nuit à 37 ° C et 5% de CO 2.
2A. Détection de NO avec la revue Cell BAEC
- Des techniques d'asepsie ont été respectées.
- Retirer la plaque de 6 puits de l'incubateur et aspirer le milieu à partir du premier puits. Laver les cellules deux fois avec 1 ml de DPBS.
- Ajouter ul 210 de 1,9 mm de fer heptahydraté sulfate (II) (FeSO 4 .7 H 2 O, fraîchement préparer en dissolvant 0,8 mg de1 ml DPBS avec CaCl 2 et MgCl 2) et 210 de pl d'ammonium N-méthyl-D-glucamine dithiocarbamate (MGD, préparer fraîchement en dissolvant 2,7 mg dans 500 ul DPBS avec CaCl 2 et MgCl 2) en utilisant un ratio de 1:7 . (Note:. Ce rapport, où MGD excès est utilisé a été classiquement utilisé pour la préparation de Fe 2 +-MGD complexe en raison du fait que le rendement de Fe 3 +-MGD est maximisée en présence d'excès de MGD L'ajout de ascorbate en solution pour stabiliser le Fe 2 +-MGD n'est pas nécessaire que l'3 N-Fe +-MGD formé de façon endogène est réduit à l'EPE détectable NO-Fe 2 +-MGD par l'ascorbate, l'hydroquinone, ou la cystéine avec de l'efficacité de conversion jusqu'à à 99,9% .. l'état bas spin diamagnétique en Fe 2 + permet la détection de NO en utilisant la cellule plate ou capillaire sans la nécessité d'un dispositif de basse température) 15.
- Swirl la suspension résultante et ajouter 4,6 μl de calcium ionophore (CAI) (préparé à partir d'une solution stock de 1,9 mM en dissolvant 1 mg dans 1 ml de DMSO).
- Swirl à nouveau la solution et incuber à 37 ° C pendant 36 min afin de continuer à permettre la réduction des NO-Fe 3 +-MGD à l'EPR détectable NO-Fe 2 +-MGD.
- Recueillir le surnageant (425 pi) dans un tube Eppendorf et le transfert à un EPR cellule plate (ou à un 50 tube capillaire ul).
- Les paramètres d'acquisition EPR sont: la fréquence micro-ondes: 9,8 GHz; centre du terrain: 3427 G; modulation d'amplitude: 6,0 G; largeur de balayage: 100 G; gain du récepteur: 1 x 10 5; puissance micro-onde: 10 mW, le nombre total de balayages: 121; temps de balayage: 10 s et la constante de temps: 20 ms (Remarque: Depuis paramètres varient d'un instrument et les conditions expérimentales à l'autre, par conséquent, seul le centre du terrain, la fréquence et l'amplitude de modulation sont les paramètres les plus importants à considérer.).
- Enregistrez les spectres à température ambiante, et les spectres 2-D ont été Integnominale pour réduire le bruit de fond et de référence corrigée à l'aide du logiciel Bruker WinEPR traitement des données ou tout autre logiciel de traitement de données. Pour la quantification de la formation d'adduits, parcelles standards de l'intensité du signal par rapport à la concentration (ou région) peut être construit en utilisant un composant logiciel enfichable donneur de NO.
2B. eNOS Dételage Expérience
- Retirer la plaque de 6 puits de l'incubateur et aspirer le milieu de la deuxième puits et laver deux fois avec du DPBS ml 1.
- Un donneur de peroxynitrite, 5-amino-3-(4-morpholinyl) -1,2,3-oxadiazolium chlorure de (SIN-1) a été utilisé pour découpler eNOS 16. Ajouter 100 ul de 0,5 mM sin-1 (M r 206,6 g / mol, de 10 mM solution mère fraîchement préparée en dissolvant 1 mg SIN-1 dans 500 ul de PBS sans ions Ca / Mg) et diluée à 2 ml avec du DPBS et 10% de FBS.
- Incuber pendant 2 h à 37 ° C et 5% de CO 2.
- Retirer la plaque de l'incubateur et laver deux fois avec du DPBS.
- Ajouter ul 210 de2,8 mM FeSO 4 .7 H 2 O et de 19,6 pi 210 mM MGD fraîchement préparée selon le procédé mentionné ci-dessus.
- Swirl la solution et ajouter 4,6 ul de 1,9 mM CaI.
- Swirl à nouveau la solution et incuber à 37 ° C pendant 36 min.
- Recueillir le surnageant (425 pi) dans un tube Eppendorf et le transfert dans une cellule EPR plat.
- Les paramètres d'acquisition EPR sont: la fréquence micro-ondes: 9,8 GHz; centre du terrain: 3427 G; modulation d'amplitude: 6 G; largeur de balayage: 100 G; gain du récepteur: 1 x 10 5; puissance micro-onde: 10 mW, le nombre total de balayages: 121; temps de balayage: 10 s et la constante de temps: 20 ms.
- Enregistrez les spectres et les spectres 2-D ont été intégrées pour réduire le bruit de fond et de référence corrigée comme indiqué ci-dessus.
3. Détection de O 2 • - de polynucléaires neutrophiles (PMN)
- Les neutrophiles ont été isolés à partir du sang humain comme décrit précédemment 17.
- Préparer une solution mère de 1 M DMPO * dans du PBS contenant 0,1 mM diéthylènetriamine-pentaacétique (DTPA). DMPO a un point de fusion de 25-29 ° C de sorte qu'il est plus commode de pipeter liquide DMPO (densité ~ 1,02 g / ml à 25 ° C) dans un flacon en verre (Note: ne pas utiliser les flacons en plastique pour la pesée depuis pur DMPO réagit avec du plastique). Frozen DMPO peut être fondu par l'eau courante tiède sur le flacon de (Note: ne pas laisser couler l'eau chaude que DMPO peut se décomposer).
- Il est important d'utiliser une grande pureté DMPO (> 99%) étant donné que certains des pièges de spin disponibles dans le commerce contiennent des impuretés paramagnétiques, et, par conséquent, il est impératif d'exécuter spectre RPE d'un peu de la solution DMPO seul (10 mM dans ce cas). Il est essentiel qu'aucun signal de fond est évident (voir figure 3A).
- Préparer une solution mère (1 mg / ml) de phorbol-12-myristate-13-acétate (PMA) dans le DMSO. Faire aliquotes en diluant la solution à 10 pg / ml dans du PBS.
- Dans un 1.5 ml tube Eppendorf, préparer une solution avec un volume total de 0,6 ml en suivant la séquence d'addition: ~ 10 6 cellules par ml de PMN, D-glucose (1 mg / ml) et de l'albumine (1 mg / ml), 10 mM DMPO et 0,2 ug / ml de PMA. (Remarque: PMA est le radical activateur et devrait être ajouté en dernier).
- Transférer la solution dans une cellule EPR plat.
- EPR paramètres d'acquisition conditions sont les suivantes: la fréquence micro-ondes: 9,8 GHz; centre du terrain: 3486 G; modulation d'amplitude: 0,5 G; largeur de balayage: 100 G; gain du récepteur: 5 x 10 5, le nombre total de balayages: 10; temps de balayage: 30 s ; puissance micro-onde: 20 mW, et la constante de temps: 81 ms. Pour la quantification de la formation d'adduits, parcelles types d'intensité de signal la concentration en fonction (ou de la zone) peut être construit en utilisant les nitroxydes stables tels que TEMPO ou 3-carboxylique-PROXYL.
* Note importante sur l'utilisation de DMPO: En utilisant une cellule à plat, on peut augmenter la densité cellulaire et augmenter ainsi le signal del'intensité de l'adduit de spin, mais la demi-vie de 2 O • - produit d'addition de DMPO est court (t 1/2 ~ 1 min) qui se décompose pour DMPO-OH. DMPO peut être substitué en utilisant les mêmes concentrations de EMPO, BMPO ou DEPMPO qui sont disponibles dans le commerce pour la stabilité accrue avec adduit t 1/2 ~ 8 et 14 min, respectivement.
4. Les résultats représentatifs
Spin piégeage du NO radicale a été réalisée en utilisant Fe 2 +-MGD. Figure 2A et 2B montrent aucun signal EPR de Fe 2 +-MGD ou un mélange de Fe 2 +-MGD avec Cai, indiquant qu'aucun signal de fond NO provient de ces réactifs. BAEC lors de la stimulation avec Cai libère du NO qui réagit avec Fe 2 +-MGD pour former l'adduit de spin, NO-Fe 2 +-MGD, et montre un signal triplet caractéristique avec la séparation hyperfine constante (HFSC) la valeur d'un N = 12,66 G et g-facteur de g = 2,040. (Figure 2C). Le hfvaleur a été déterminée en utilisant sc le programme de simulation WINSIM qui peut être téléchargé à partir du NIEHS EPR site Base de données du logiciel. Le HFSC expérimentale est conforme à la valeur de la littérature d'un G N = 12,70 g = 2,041 et 18 pour NO 2 + Fe-MGD-adduit. De même, l'effet de SIN-1 sur BAEC abaissé la production de NO en raison de eNOS découplage comme le montre la figure 2D.
DMPO de spin piège a été utilisé pour O 2 • - la détection. DMPO seul ne donne pas un signal, comme indiqué dans les figure 3A confirmant que le spin est exempt d'impuretés paramagnétiques. Figure 3B est le spectre de DMPO et les PMN seulement, et de même, il n'ya pas de signal détectable suggérant que le DMPO ne provoque pas de l'activation de la NADPH oxydase enzyme. figure 3C montre le signal observé EPR lors de la stimulation de PMN par le PMA. Les valeurs HFSC pour ce signal a été déterminé à être un N = 14,71 G, une β-H = 11,40 G et une γ-H = 1,25 G, et sont compatibles avec les valeurs de la littérature d'un N = 14,3 G, un β-H = 11,7 G et une γ-H = 1,3 G 19 pour DMPO-O 2 H adduit.

Figure 1. Diagramme pour la détection des radicaux de neutrophiles et de piégeage de spin utilisant BAEC EPR. (A) PMN ont été mélangés avec DMPO et de la PMA, et le mélange résultant transféré dans une cellule EPR plat pour l'acquisition de données. (B) BAEC ont été cultivées sur une plaque, et on le lave avec du DPBS. Le spin Fe (MGD) 2 a été ajouté avec Cai. La solution a été soigneusement mélangé et incubé. Le mélange a été transféré dans une cellule EPR plat pour l'EPR d'acquisition de données.
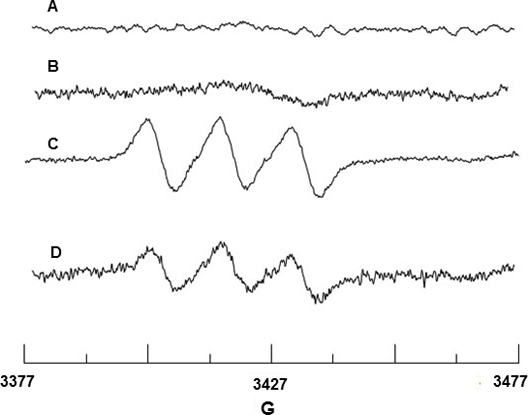
Figure 2. De détection EPR de NO de BAEC. (A) du spectre de Fe 2 +-MGD seulement (B) du spectre de Fe 2 +-MGD + CaI seulement. (C) spectre résultant de triplet NO piégeage par Fe 2 +-MGD utilisant CaI-cellules stimulées. (D) du spectre montrant la diminution de la production de NO en raison de 0,5 mM SIN-1 le traitement des cellules.
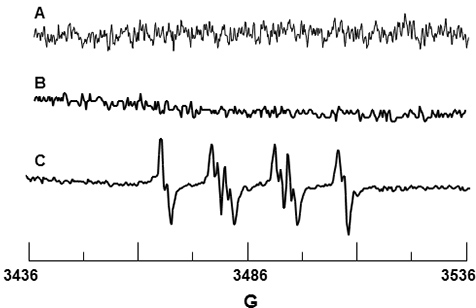
Figure 3. Détection EPR de DMPO-O 2 H à partir de neutrophiles activés. (A) du spectre de 10 mm seulement DMPO. (B) du spectre des PMN seul en présence de 10 mM DMPO. (C) du spectre des PMN activés par la PMA, dans la présence de 10 mM DMPO.
Discussion
Piégeage de spin EPR a été employé dans un large éventail d'applications biomédicales pour la quantification et l'identification des radicaux libres. Piégeage de spin est très sensible, capable de détecter les radicaux à des concentrations allant de nM à uM fait la rendant appropriée pour l'application dans les systèmes biologiques. La formation de l'adduit paramagnétique, NO-Fe 2 +-MGD, est à la base de non détection par l'intermédiaire d'EPR. Fe 2 +-MGD...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été financé par le NIH Cœur nationale, Lung, and Blood Institute subvention RO1 HL81248.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires (optionnel) |
| Phénol un milieu exempt de DMEM Glucose à haute 1X | GIBCO | 31053 | |
| 0,25% de trypsine-EDTA | GIBCO | 25200 | |
| L-glutamine | Fisher Scientific | BP379-100 | |
| MEM acides aminés non essentiels | GIBCO | 11140 | |
| De sérum foetal bovin | Atlanta Biologicals | S11550 | |
| Facteur de croissance endothélial | Millipore | 02-102 | |
| CaI | Enzo Life Sciences | A-23187 | Dissoudre dans du DMSO |
| SIN-1 | Enzo Life Sciences | BML-CN245-0020 | |
| DMPO | Laboratoires Dojindo | D048-10 | |
| FeSO 4 .7 H 2 O | Sigma-Aldrich | 215422-250G | Dissoudre dans du PBS avec Ca et Mg |
| MGD | Enzo Life Sciences | ALX-400-014-M050 | Dissoudre dans du PBS avec Ca 2 + et Mg 2 + |
| Cellules BAEC | Cell Systems | 2B2-C75 | |
| DMSO | Fisher Scientific | BP231-100 | |
| DPBS | Sigma-Aldrich | D8537 | |
| DPBS avec du CaCl 2 et MgCl 2 | Sigma Uneldrich | D8662 | |
| Phorbol-myristate acétate (PMA) | Sigma-Aldrich | 79346-1MG |
Références
- Winterbourn, C. C. Reconciling the chemistry and biology of reactive oxygen species. Nat. Chem. Biol. 4, 278-286 (2008).
- Winterbourn, C. C., Hampton, M. B. Thiol chemistry and specificity in redox signaling. Free Radic. Biol. Med. 45, 549-561 (2008).
- Clerch, L. B., Massaro, D. J. . Oxygen, Gene Expression, and Cellular Function. , (1997).
- Gutteridge, J. M. C., Halliwell, B. Antioxidants: Molecules, medicines, and myths. Biochem. Biophys. Res. Commun. 393, 561-564 (2010).
- Sumimoto, H. Structure, regulation and evolution of Nox-family NADPH oxidases that produce reactive oxygen species. FEBS J. 275, 3249-3277 (2008).
- Ignarro, L. J. . Editor Nitric Oxide: Biology and Pathobiology. , (2009).
- Moreau, M. Differential effects of alkyl- and arylguanidines on the stability and reactivity of inducible NOS heme-dioxygen complexes. Biochemistry. 45, 3988-3999 (2006).
- Vasquez-Vivar, J. Superoxide generation by endothelial nitric oxide synthase: the influence of cofactors. Proc. Natl. Acad. Sci. U. S. A. 95, 9220-9225 (1998).
- Villamena, F. A., Zweier, J. L. Detection of reactive oxygen and nitrogen species by EPR spin trapping. Antioxid. Redox Signal. 6, 619-629 (2004).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping of superoxide and hydroxyl radical: practical aspects. Arch. Biochem. Biophys. 200, 1-16 (1980).
- Frejaville, C. 5-Diethoxyphosphoryl-5-methyl-1-pyrroline N-oxide (DEPMPO): a new phosphorylated nitrone for the efficient in vitro and in vivo spin trapping of oxygen-centered radicals. J. Chem. Soc., Chem. Commun. , 1793-1794 (1994).
- Olive, G., Mercier, A., Le Moigne, F., Rockenbauer, A., Tordo, P. 2-Ethoxycarbonyl-2-methyl-3,4-dihydro-2H-pyrrole-1-oxide: Evaluation of the spin trapping properties. Free Radical. Biol. Med. 28, 403-408 (2000).
- Villamena, F. A., Zweier, J. L. Superoxide radical trapping and spin adduct decay of 5-tert-butoxycarbonyl-5-methyl-1-pyrroline N-oxide (BocMPO): kinetics and theoretical analysis. J. Chem. Soc., Perkin Trans. 2, 1340-1344 (2002).
- Tsuchiya, K. Nitric oxide-forming reactions of the water-soluble nitric oxide spin-trapping agent, MGD. Free Radical Biol. Med. 27, 347-355 (1999).
- Vanin, A. F., Poltorakov, A. P., Mikoyan, V. D., Kubrina, L. N., van Faassen, E. Why iron-dithiocarbamates ensure detection of nitric oxide in cells and tissues. Nitric Oxide. 15, 295-311 (2006).
- RojasWahl, R. U. Decomposition mechanism of 3-N-morpholinosydnonimine (SIN-1): A density functional study on intrinsic structures and reactivities. J. Mol. Model. 10, 121-129 (2004).
- Klempner, M. S., Gallin, J. I. Separation and functional characterization of human neutrophil subpopulations. Blood. 51, 659-669 (1978).
- Pou, S. Spin trapping of nitric oxide by ferro-chelates: kinetic and in vivo pharmacokinetic studies. Biochim. Biophys. Acta. 1427, 216-226 (1999).
- Finkelstein, E., Rosen, G. M., Rauckman, E. J. Spin trapping. Kinetics of the reaction of superoxide and hydroxyl radicals with nitrones. J. Am. Chem. Soc. 102, 4994-4999 (1980).
- Britigan, B. E., Rosen, G. M. Spin-trapping and human neutrophils. Limits of detection of hydroxyl radical. J. Biol. Chem. 264, 12299-12302 (1989).
- Frejaville, C. 5-(Diethoxyphosphoryl)-5-methyl-1-pyrroline N-oxide: A new efficient phosphorylated nitrone for the in vitro and in vivo spin trapping of oxygen-centered radicals. J. Med. Chem. 38, 258-265 (1995).
- Snyrychova, I. Improvement of the sensitivity of EPR spin trapping in biological systems by cyclodextrins: A model study with thylakoids and photosystem II particles. Free Radical Biol. Med. 48, 264-274 (2010).
- Han, Y. Lipophilic beta-cyclodextrin cyclic-nitrone conjugate: Synthesis and spin trapping studies. J. Org. Chem. 74, 5369-5380 (2009).
- Han, Y., Tuccio, B., Lauricella, R., Villamena, F. A. Improved spin trapping properties by beta-cyclodextrin-cyclic nitrone conjugate. J. Org. Chem. 73, 7108-7117 (2008).
- Hardy, M. Detection, characterization, and decay kinetics of ROS and thiyl adducts of mito-DEPMPO spin trap. Chem. Res. Toxicol. 20, 1053-1060 (2007).
- Kim, S. -. U. Fast reactivity of a cyclic nitrone-calix[4]pyrrole conjugate with superoxide radical anion: Theoretical and experimental studies. J. Am. Chem. Soc. 132, 17157-17173 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon