Method Article
La huella de ADN de Mycobacterium leprae Uso de las cepas Repita Variable Tandem Número (VNTR) - Análisis de longitud de fragmentos (FLA)
En este artículo
Resumen
La lepra, causada por Mycobacterium leprae, Sigue siendo endémica en muchos lugares. Con el fin de aprender acerca de la propagación y el modo de transmisión de la lepra, es importante determinar qué cepa del M. leprae Ha infectado a un paciente. Un número variable de repeticiones en tándem (VNTR) escribir es uno de esos métodos.
Resumen
El estudio de la transmisión de la lepra es particularmente difícil, ya que el agente causal, Mycobacterium leprae, no se pueden cultivar en el laboratorio. Las únicas fuentes de las bacterias son los enfermos de lepra, y armadillos infectados experimentalmente y los ratones desnudos. Así, muchos de los métodos utilizados en la epidemiología moderna no están disponibles para el estudio de la lepra. A pesar de un extenso programa global de tratamiento de drogas para la lepra implementado por la OMS 1, la lepra sigue siendo endémica en muchos países, con aproximadamente 250.000 nuevos casos cada año. 2 Toda la M. leprae genoma ha sido mapeado 3,4 y muchos loci han sido identificados que han repetido los segmentos de dos o más pares de bases (llamados micro y minisatélites). 5 cepas clínicas de M. leprae puede variar en el número de segmentos repetidos en tándem (repeticiones cortas en tándem, STR) en muchos de estos lugares. 5,6,7 repetir tándem número variable (VNTR) 5 de análisis se ha utilizado para distinguir las diferentes cepas del bacilo de la lepra. Algunos de los lugares parecen ser más estables que otros, que muestran una menor variación en el número de repeticiones, mientras que otros parecen cambiar más rápidamente, a veces en el mismo paciente. Mientras que la variabilidad de ciertas VNTRs ha planteado preguntas acerca de su idoneidad para la tipificación de cepas 7,8,9, los datos emergentes sugieren que el análisis de múltiples loci, que son diversos en su estabilidad, se puede utilizar como una herramienta epidemiológica útil. Múltiples locus VNTR análisis (MLVA) 10 se ha utilizado para estudiar la evolución de la lepra y la transmisión en varios países incluyendo a China 11,12, 8 Malawi, Filipinas 10,13, y Brasil 14. MLVA implica varios pasos. En primer lugar, el ADN bacteriano se extrae junto con el ADN del huésped de tejido de biopsias clínicas o manchas raja la piel (SSS). El 10 loci deseados se amplifican a partir del ADN extraído a través de la reacción en cadena de polimerasa (PCR). Cebadores fluorescente marcada por 4-5 diferentes loci se utilizan por reacción, con 18 loci que se amplifica en un total de cuatro reacciones. 10 Los productos de PCR puede ser sometido a electroforesis en gel de agarosa para verificar la presencia de los segmentos de ADN deseada, y luego presentado para el análisis de fluorescencia de longitud de fragmentos (FLA) mediante electroforesis capilar. ADN de las bacterias armadillo pasajes con un número conocido de copias de repetición para cada locus se utiliza como control positivo. Los cromatogramas FLA son examinados usando el software del escáner de pico y la longitud del fragmento se convierte en el número de copias VNTR (alelo). Finalmente, los haplotipos VNTR se analizan los patrones, y cuando se combina con los datos clínicos del paciente puede ser usado para rastrear la distribución de los tipos de cepa.
Protocolo
El propósito de este artículo de vídeo es proporcionar una visión general del flujo de trabajo junto con el formato de los datos y la interpretación de los investigadores que bien podría ser a partir de este tipo de trabajo (Figura 1). Se incluye la demostración de las técnicas, protocolos simplificados y consejos prácticos descritos en trabajos ya publicados. 5,10
Flujo de trabajo general y los servicios de laboratorio:
Debe haber por lo menos 3 áreas de trabajo separadas para este tipo de investigación. El laboratorio debe tener 1) un área de pre-PCR con una campana de PCR (caja de aire limpio o área de trabajo aislados) para la preparación de imprimación (dilución, preparación y mezcla de alícuotas), 2) separar la bio-seguridad para el manejo de caja y la adición de ADN a las mezclas de PCR, y 3) un área de trabajo post-PCR para la preparación y la carga de geles y para la preparación de muestras para la FLA. Primers y muestras de ADN se debe mantener en el congelador por separado y refrigeradores. Primer contaminación es uno de los principales problemas y más persistente en el trabajo de laboratorio de este tipo. Pipetas de cebadores y las mezclas de PCR no se debe utilizar para el ADN. No debe haber sistemas separados de pipetas para el pre-PCR, PCR y post-PCR áreas de trabajo. Por lo general, un investigador puede procesar 12-18 muestras en un período de 12-24 horas con equipo estándar de laboratorio.
Antes de comenzar cada fase del trabajo:
- Use una bata de laboratorio y guantes. Los guantes deben ser usados en cualquier momento las muestras biológicas, cebadores, ADN y el bromuro de etidio se manejan. Cambiar los guantes con frecuencia.
- Trabajar en una campana de PCR gabinete, gabinete de bioseguridad o área de trabajo limpia.
- Utilice papel de banco de dulce o un cojín.
- Establecer recipientes para desechos apropiado para líquidos y puntas de pipeta.
- Limpie con el interior de la campana de PCR y pipetas con etanol al 70%.
- Pipetas tema y área de trabajo a la luz UV durante 15 minutos antes de la PCR establecido. (La luz ultravioleta entrecruzamientos de ADN contaminantes de la superficie.)
- Siempre use aerosoles puntas de pipeta de prevención para los materiales que contienen ADN, primers y reactivos PCR.
- Centrífuga cualquier tubo / tiras / placas que contienen líquido antes de la apertura para evitar el escape de aerosoles y la contaminación cruzada por la manipulación.
1. M. leprae preparación del ADN
Muestras clínicas que contienen M. leprae se obtienen de los enfermos de lepra que acuden a clínicas de piel. Rutina de muestras de diagnóstico pueden ser biopsias de piel ponche, pruebas de corte de piel o hisopos nasales. Por lo general, biopsias por punción o frotis de cortes de piel son los mejores para la epidemiología molecular, ya que son limpias y contienen cantidades suficientes de M. leprae. El uso de estos materiales para la investigación deben ser aprobados de acuerdo con las directrices institucionales.
- Preservar la biopsia o citología hendidura muestras de piel en un frasco con tapa de rosca con 1 ml de etanol al 70%.
- Centrifugar cada muestra en una velocidad variable de sobremesa centrifugar a 12.000 xg durante 15 minutos.
- Eliminar el sobrenadante y colocarlo en un tubo de microcentrífuga. Si es necesario, puede ser útil volver a centrifugar las muestras y la recuperación del tejido adicional o de ADN posterior.
- Añadir 500 l de tampón fosfato salino (PBS) a las muestras de tejido y remoje por 1 hora para el intercambio de conservante etanol residual y rehidratar la muestra.
- Centrifugar las muestras en una centrífuga de sobremesa a 12.000 xg durante 20 minutos. Deseche la solución de PBS en un contenedor de residuos parcialmente llena con una solución desinfectante.
- Extraer el ADN de bacterias mediante la sangre y el kit de Qiagen DNeasy tejido siguiendo las pautas prescritas.
- ADN extraído debe ser alícuotas en 4 viales. Almacenar 2 partes alícuotas a -80 ° C para su uso futuro si / cuando la reproducibilidad de los resultados de las pruebas que se requiera o cuando las nuevas tecnologías estén disponibles. Guardar una alícuota a -20 ° C y una a 4 ° C para un uso más inmediato.
- Es prudente preparar un 'blanco de extracción ", junto con las muestras de tejido. El blanco es sometido a todos los mismos tratamientos descritos anteriormente, pero se realiza sin el tejido. PCR en blanco junto con la extracción de las muestras de pacientes para garantizar que la técnica del operador de extracción es correcta y que los reactivos están libres de contaminación de ADN.
2. Primer preparación
- Cartillas para los loci para los que no son los datos más extensa cepa tipo se muestran en la Tabla 1. Cuatro o cinco primers se combinan para multiplex PCR. Una cartilla para cada lugar lleva una etiqueta de 5 'químicos fluorescentes que se detectaron durante el análisis de longitud de fragmentos de electroforesis capilar (FLA).
- Para cada combinación de PCR múltiple, el primer etiquetados y cebador inverso correspondiente para cada locus se combinan por separado en tubos Eppendorf: primers adelante en un tubo, invierta en otro. Cebadores de archivo se preparan como soluciones 100μM (Figura 2a), una parte de los cualesse diluye 10 veces con una concentración de 10 mM con TE (Tris-EDTA 1x, pH 8,0). Alícuotas restantes de las 100 soluciones de imprimación M se almacenan a -20 ° C para su uso posterior.
- Cantidades iguales de cada cebador M 10 se mezclan dando lugar a 2μM concentraciones finales de cada cebador. Cuando las combinaciones de los cebadores se añade a la mezcla de PCR (Tabla 3), la concentración final de cada cebador se reduce a 0,2 micras.
Cuando los cebadores combinado se añaden a la mezcla de PCR (Tabla 3), las concentraciones finales gota a 0.2μM cada uno.
3. Amplificación del ADN bacteriano utilizando PCR múltiple
- PCR de configuración
- Anote el número de muestras que se utilizarán y preparar una hoja de trabajo con los reactivos necesarios y su volumen antes de la recogida de los plásticos y los materiales necesarios otros.
- Marque los tubos estériles / tiras / placas que se utilizarán para la PCR con el número de muestras. Recuerde que debe incluir controles positivos y negativos.
- Limpiar el termociclador con una solución de limpieza (por ejemplo, Decon ELIMINase) y el programa de acuerdo a la Tabla 2. Cámbiese los guantes después de la limpieza y antes de manipular los cebos y otros reactivos.
- Prepare Mastermix PCR de acuerdo a la Tabla 3 y la etiqueta de los tubos PCR / tiras / placa con la combinación de imprimación y el número de muestras que se utilizarán.
- 18μl alícuota de Mastermix a cada tubo de PCR de muestras etiquetadas o así. Cambiar los guantes.
- Limpie una separada de bio-seguridad del gabinete y pipetas con etanol al 70% para ayudar a limpiar y desinfectar el área de trabajo y herramientas, a continuación, sujeta el área de trabajo y las pipetas a la luz UV durante 15 minutos para reticular los contaminantes de ADN. Cambiar los guantes.
- En la limpieza de bio-seguridad del gabinete, añadir 2μl de la plantilla de ADN para la Mastermix PCR en cada tubo / placa y la adquisición de un volumen total de 20μl (figura 2b). Use aerosoles puntas de pipeta de prevención para todos los materiales líquidos.
- Centrifugar los tubos de PCR / tiras / placas brevemente para mezclar el contenido.
- Coloque los tubos de muestra / tiras / placa en el termociclador e iniciar el programa de PCR.
- Cuando el programa está completo, retirar los productos del termociclador y se almacenan a 4 ° C hasta la electroforesis.
4. Electroforesis en gel de los productos de PCR
* Este protocolo ha sido la norma durante muchos años y es un paso opcional que se puede emplear si la confirmación de los productos de PCR se desea antes de enviarlos a FLA.
- En un área de trabajo independiente post-PCR, preparar un 2% en gel de agarosa. Use 2,0 g de agarosa powder/100ml de 1x TBE (Tris / Borato / EDTA) solución tampón en un matraz. Calentar la mezcla de alrededor de 1.5-2 minutos en un horno de microondas. Agitar el contenido, la calefacción de nuevo si es necesario para disolver la agarosa. Dejar enfriar un poco y verter el gel en una forma con un peine con pozos suficientes para las muestras.
- Eliminar los productos de PCR a partir de 4 ° C y centrifugar durante unos 30 segundos.
- Mezcle 2-5μl de producto de PCR con 0,5-1μl de tampón de carga de gel 5x o 6x (tampón de carga se dispone de varias empresas, o puede ser mezclado en el laboratorio. Las recetas están disponibles en línea.)
- La carga de los pozos del gel con la mezcla tampón 6μl muestra / carga. Añadir una escalera molecular de un bien (de preferencia una escalera de 20 pb).
- Ejecute el gel a 100V durante aproximadamente 90 minutos.
- Remojar la gelatina en una solución de bromuro de etidio durante 15-30 minutos, y luego en agua destilada ultrapura para la misma cantidad de tiempo.
- La imagen del gel, mientras que la luz ultravioleta se aplica. Debe haber una banda para cada uno de los segmentos de ADN 4-5 en la combinación (Figura 3).
- Deseche el gel de acuerdo con la política de riesgo de la institución materiales. Solución de bromuro de etidio puede ser utilizado varias veces antes de su eliminación adecuada.
5. Preparación de muestras para el análisis de longitud de fragmentos (FLA)
- En un tubo Eppendorf limpio, prepare una mezcla maestra que contiene 12μl de Hi-Di solución de formamida a partir de una alícuota fresca y 0.3μl de GeneScan -500 estándar LIZ tamaño (ambos de Applied Biosystems) para cada muestra a analizar. (Hi-Di formamida químicamente desnaturaliza las hebras de ADN antes de la electroforesis capilar, eliminando la necesidad de calefacción.) Con una placa de 96 pocillos de reacción óptica de calidad, 12.3μl alícuota de la mezcla de formamida-LIZ a cada pozo se utiliza para las muestras y establecer el plato a un lado.
- Hacer un mapa de la placa para su registro indica que es muestra de ADN en cada pocillo (Figura 4).
- Utilizando tubos / tiras o una placa de 96 pocillos, añadir 1μl de producto de PCR (parte 3) a 59μl de agua de calidad PCR creación de una dilución 1:60 del producto de PCR. Diluciones pueden ser ajustados en base a intensidad de la señal de los datos FLA o el brillo de las bandas de gel. Concentraciones incluso más bajas de ADN puedeser suficiente (1:120 o 1:180).
- Añadir 1μl de los gases de producto de PCR para la correcta y en la placa que contiene la mezcla de formamida-LIZ.
- Velocidad y eficacia puede ser mucho mayor si el PCR se llevó a cabo también en una placa de 96 pocillos. Uno simplemente puede alinear tres placas como en la secuencia: una placa con los productos de PCR, placas 2 con agua destilada para la dilución de los productos de PCR, y la placa de 3 con formamida y la escalera de tamaño para el análisis de longitud de fragmentos. Una pipeta multicanal permite un rápido proceso de preparación de FLA.
Análisis de muestras a través de Genetic Analyzer
- Calibrar el analizador genético para detectar la flurophores aplicada por las instrucciones del fabricante. Asegúrese de utilizar un medio de contraste-set que incluye LIZ.
- Reponer el agua de enjuague recipientes y añadir nuevos Running Buffer con EDTA (1x) (Applied Biosystems) para amortiguar las cámaras.
- Añadir un tabique de hendidura pre-silicio a la placa y se coloca la placa en la bandeja de la celebración de diseño. Pulse el botón 'bandeja' botón en el analizador genético para llevar adelante el muestreador automático. Coloque la bandeja en muestreador automático y cierre la puerta a la Genetic Analyzer.
- Crear o importar una hoja de cálculo para el análisis. Archivos importables tienen una extensión. PLT y se encuentran en formato delimitado por tabuladores. Los archivos se pueden modificar en Excel (Microsoft) o programas similares.
- Las muestras se inyectan en el capilar (50 cm de longitud, POP-7 polímero) mediante la aplicación de un voltaje de inyección de 1,6 kV durante 15 s. La electroforesis capilar funciona a una tensión de 15 kV a 60 ° C durante 1800 segundos. Todo el proceso tarda unos 45 minutos.
- Una vez que una carrera se ha completado, los datos de cada muestra analizada se convierten en archivos con extensión. Fsa y se coloca en una carpeta de la placa (Figura 4b). Cada archivo de datos es de aproximadamente 100 KB de tamaño y se pueden almacenar en una unidad flash o comprimidos y correo electrónico. Los archivos de datos se pueden ver utilizando el software adecuado, como GeneMapper ABI o escáner Peak.
6. Análisis de los resultados de longitud de fragmentos
- El análisis de los datos de la electroforesis capilar fluorescente requiere un software especial. Si el software no está disponible, vaya al sitio web de Applied Biosystems y descargar Scanner Peak. El software es gratuito y funciona bastante bien. https://products.appliedbiosystems.com/ab/en/US/adirect/ab?cmd=catNavigate2&catID=603624
- Scanner abierta pico y 'Start New Project' seguido de 'Agregar archivo'. Cargar el seleccionado. Fsa archivos de datos en el programa, incluidos los controles positivos y negativos.
- Seleccione (resalte) y "analizar" todos los archivos cargados. Asegúrese de que cada muestra se ajusta al estándar de tamaño ": GS500 (-250) y el método de análisis:. Dimensionamiento Default-pp Prensa" Analizar ".
- Examinar el tamaño en pares de bases de cada pico de color producidos por los fragmentos de ADN en las muestras.
- Registro de cada valor del tamaño máximo de pares de bases y compararlo con el máximo control positivo.
- Picos en las muestras de control positivo se comparan favorablemente con el número de pares de bases y números de repeticiones en tándem de los Cuadros 4-7.
- Determinar el número de segmentos cortos de repeticiones en tándem están presentes en cada uno de los alelos de la muestra, en comparación con el control positivo. Usamos NHDP63 que ha sido secuenciado por el número de copias en cada locus VNTR que se examina. 4
- Introduzca los datos registrados en una hoja de cálculo para realizar análisis comparativos y / o matemáticas. "Huellas dactilares" VNTR o haplotipos, son cadenas de alelos en loci definidos que son característicos de una M. leprae cepa.
7. Resultados representante
Electroforesis en gel de los productos de PCR se espera que produzca una banda para cada locus en la combinación de imprimación (Figura 3). En la figura 3, hay dos secciones en el gel: la parte superior tiene una combinación de muestras de PCR y las muestras parte inferior Combinación 2. Cada sección contiene una escalera de base 20 par molecular, seguido por los productos de PCR obtenidos a partir de ocho muestras de los pacientes. Una combinación también tiene un control negativo y, finalmente, un control positivo (NHDP63 cepa). (Los controles para la combinación de dos estaban en un gel diferente). Tenga en cuenta que la mayoría de las muestras de clara pantalla de 5 bandas, una para cada locus en la combinación. En algunos casos, las bandas pueden ser muy juntos para que aparezca como loci separados como resultado la aparición de tan sólo 4 bandas.
Espera que los tamaños de amplificación se muestran en la Tabla 1. Nuestro laboratorio utiliza NHDP63 cepa de M. leprae como control positivo. Hay dos tipos de segmentos de repetición se han estudiado: los loci de microsatélites (con 1-5 repeticiones de base) y loci minisatélites (con segmentos de más de 5 pares de bases repetidas varias veces). 5
La interpretación de los archivos de datos de electroforesis capilar se basa en dos normas: una interna de fragmentos de ADN de tamaño estándar llamado GeneScan-500LIZ (ABI) y una muestra de control externo positivo de amplificación de ADN bacteriano.
Los cromatogramas FLA, visto el uso de software de escáner de pico, se puede ver en las figuras 5a, 5b y 6.
Scanner pico proporciona datos sobre el tamaño de amplificación (eje x en pares de bases) y la intensidad de la señal (eje Y). (Figura 5b) Datos adicionales sobre el área del pico, etc también están disponibles, aunque el tamaño y los valores máximos de altura son los más importantes. Picos de menos de 100 unidades de altura, generalmente se consideran demasiado débiles para una señal de ser confiable.
La Figura 6 compara el control positivo (NHDP63) y dos muestras de pacientes, mostrando una variación en el número de repeticiones en tándem en el locus (GTA) 9. En el control positivo, la secuencia (GTA) se repite 10 veces. El VNTR NHDP63 y tamaño de amplificación fueron verificados a través de la secuenciación de genes. Paciente 4 de PCR de amplificación es de 3 pb menor que el control positivo que indica que hay sólo 9 unidades de repetición, mientras que el paciente 6 tiene una amplificación que es de 3 pb más grande que NHDP63 revelando 11 repeticiones de (GTA). El paciente 2 tenía bajo índice bacteriano (BI), con poco o nada de la replicación del ADN PCR, por lo tanto, no hay señal de FLA.
Dificultad en la interpretación de los datos FLA a veces se produce como resultado de "tartamudeo". Durante la reacción de PCR, el ADN polimerasa puede producir fragmentos que son una o más repeticiones más o menos largo que el alelo de origen. Estos son generalmente reconocidos como los picos de menor altura que rodea el pico principal. Que será "en la escalera", es decir, el número correcto de pares de bases de la repetida de un segmento mayor o menor que el pico principal. El resultado es una familia de picos del mismo color. Figura 7 muestra esto con locus (TA) 10.
Otra dificultad que se encuentra a veces con la FLA incluye 'A +' o 'A-cola ", en el que la ADN polimerasa añade una sola base [por lo general la adenina (A)] en el extremo 3' del segmento de ADN copia. Esto se muestra en FLA como un pico a la derecha de un pico principal o tartamudeo que es un par de bases más grande que el pico adyacente como se muestra en la Figura 8. No se debe confundir con un pico principal o tartamudeo. Un pico principal y sus cola-A se consideran una sola especie. A la cola-no altera el número de repeticiones de VNTR. (Algunos equipos de la polimerasa de ADN están diseñados para promover específicamente la A-colas con el fin de reducir este efecto de confusión. Promoción completa A-cola tiende a producir un solo pico en lugar de un par de picos).
La extracción de ADN y PCR productos contienen M. leprae y el ADN humano, sin embargo, con la excepción de (TA) 18, los cebadores son lo suficientemente específicos que sólo amplificar el ADN de la bacteria, y hay poca o ninguna amplificación del ADN humano. (TA) 18 a menudo produce un pico de 242 pares de bases que es a partir de ADN humano y que no se ve en las muestras de ADN pasajes armadillo (Figura 9).
La vida útil de los cebadores en general es bueno siempre y cuando se mantiene a -20 ° C, sólo se elimina para su uso inmediato, y después se almacenan a 4 ° C hasta que se consumen. Cebadores debe ser estable a 4 ° C durante 1-2 semanas. A pesar de que la mejor combinación de cebadores para PCR es un poco lento, se recomienda que sólo una combinación de imprimación suficiente para su uso inmediato que se prepare. Combinaciones de iniciadores parece algo mermados cuando se almacena por periodos prolongados.
TE debe alícuotas de las grandes acciones, y las alícuotas pueden ser almacenadas o bien congelados oa temperatura ambiente. Mayores alícuotas de 200-400μl son buenos para la dilución de las poblaciones de imprimación deshidratada o concentrada (Figura 2a). Pequeñas alícuotas de 10-50 l son útiles para complementar los volúmenes de combinaciones de cebadores 3 y 4. TE es barato y las alícuotas deben ser desechados después de su uso.
Kits multiplex enzima son bastante caros y deben mantenerse congelados (-20 ° C) hasta su uso. Después de la preparación de PCR, las soluciones multiplex no usada debe devolverse inmediatamente a 4 ° C. El pequeño Qiagen Multiplex PCR Kit viene con 3 tubos de mezcla múltiple, cada uno con 0.85ml (850μl) de solución, suficiente para alrededor de 65-70 PCR.
Generalmente, lo mejor es evitar repetirse, los cambios de temperatura importantes de los materiales utilizados en este tipo de trabajo de laboratorio, incluyendo las muestras de ADN, primers y soluciones multiplex kit. Todos los materiales deben ser almacenados a -20 ° C hasta que sea necesario, y luego se mantiene a 4 ° C hasta que se consumen. Almacenamiento a largo plazo del ADN se debe a -80 ° C.
Todos los materiales que contienen pasó tejidos, cartillas y / o el ADN debe ser esterilizado en autoclave y eliminarse cuando ya no sea de alguna utilidad. Todas las muestras tratadascon bromuro de etidio o formamida deben ser tratados como residuos peligrosos y disponer de acuerdo con la política de riesgo de la institución materiales.
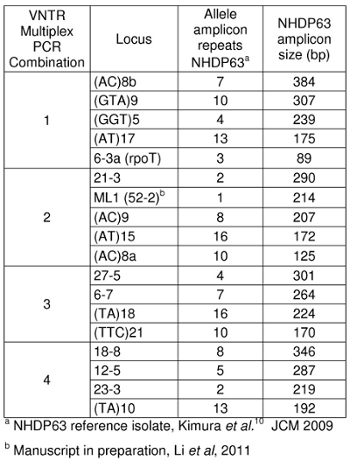
Tabla 1: tamaños amplicón de cepa NHDP63
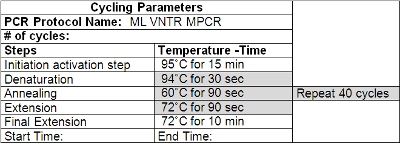
Tabla 2: Parámetros de Ciclismo de VNTR PCR

Tabla 3: Preparación de la PCR
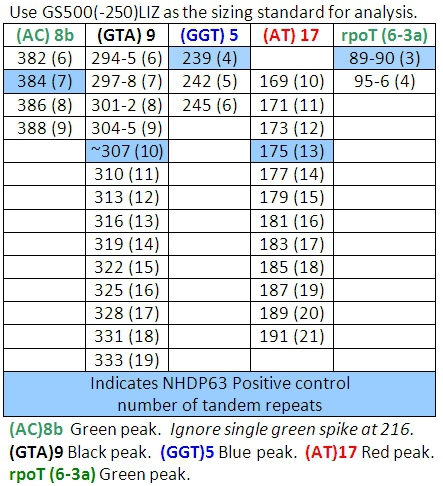
Tabla 4: Llamadas de alelos de una combinación
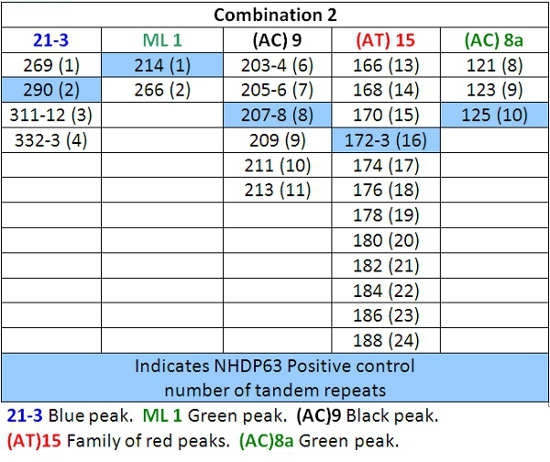
Tabla 5: Llamadas de alelos para la combinación de dos
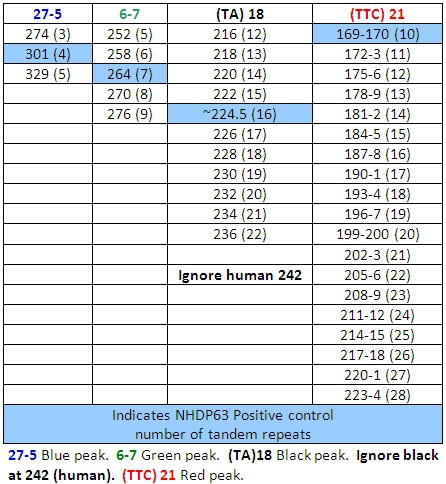
Tabla 6: Llamadas de alelos para la combinación de tres
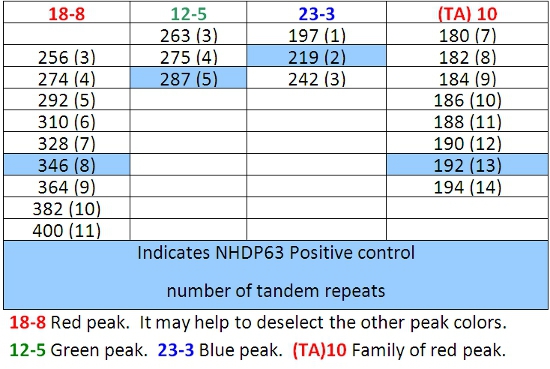
Tabla 7: Las llamadas de alelos para la combinación de 4

Figura 1: VNTR-FLA Diagrama de flujo del proceso
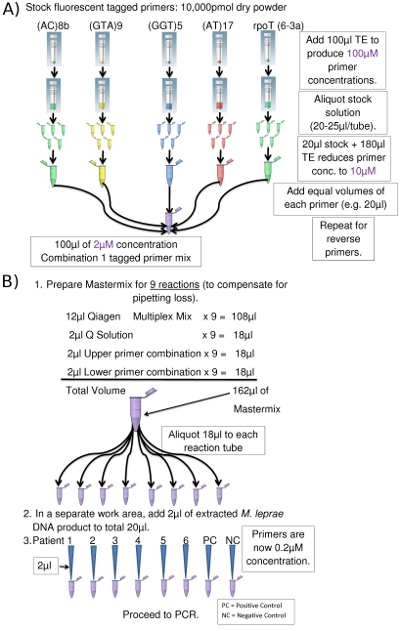
Figura 2. (A) Preparación de una combinación de cebadores superior (tubo de Eppendorf imagen cortesía de www.clker.com ). (B) PCR de configuración (para 8 PCR) (tubo de Eppendorf imagen cortesía de www.clker.com)
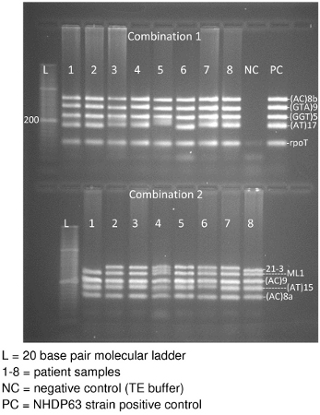
Figura 3. En gel de agarosa de las combinaciones de 1 y 2 de ADN producto de PCR VNTR
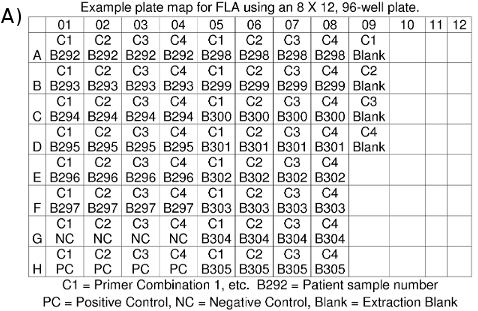
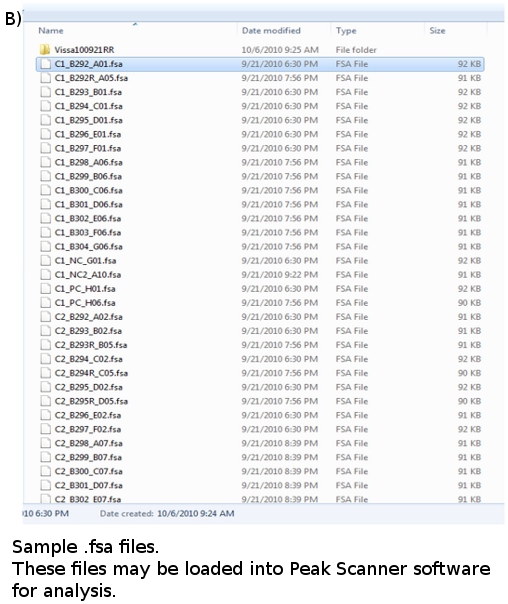
Figura 4. . (A) FLA Plate mapa (b) FLA archivos de datos: *. fsa
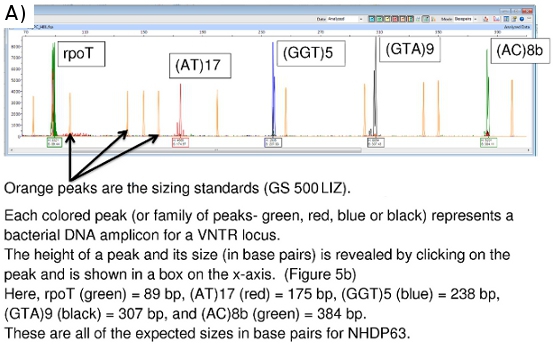
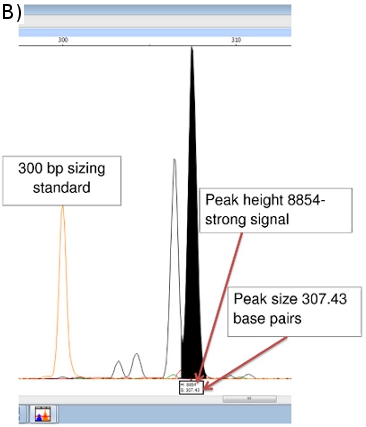
Figura 5. (A) FLA Cromatograma de control positivo (NHDP63) para los loci VNTR Combinación 1. (B) los datos pico de escaneo para tamaño de amplificación y la abundancia de (GTA) 9
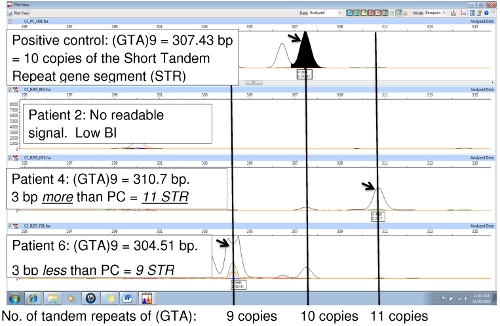
Figura 6. Comparación de las muestras de PCR para el PC (NHDP63) para el locus (GTA) 9
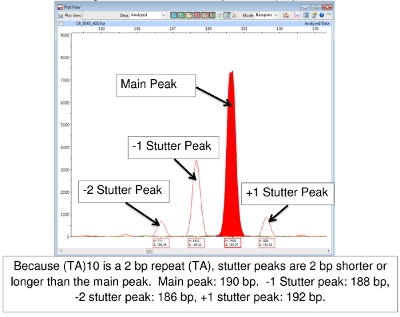
Figura 7. Principal y Picos de tartamudeo (TA) 10
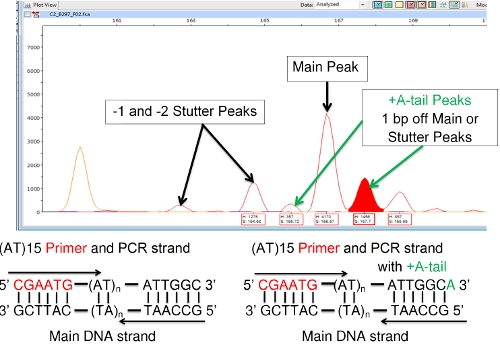
Figura 8: A + (A-cola) los picos adyacentes a las principales cumbres o tartamudeo.
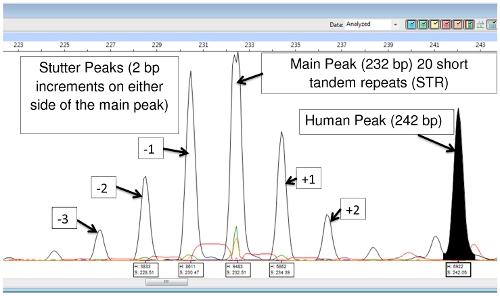
Figura 9: (TA) 18 pico principal, Picos de tartamudeo y el Pico del ADN humano
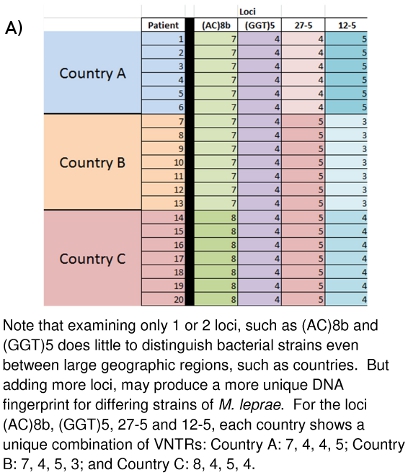
Figura 10:. (A) la diferenciación de cepas de M. leprae sobre la base de datos VNTR (B) La diferenciación de la cepa M. leprae sobre la base de huellas dactilares de ADN MLVA
Discusión
La recogida de muestras de piel de pacientes con lepra requiere médicos clínicos especializados o técnicos que trabajan en las clínicas de la piel. Los trabajadores de laboratorio que manipula las muestras deben tener mucho cuidado al usar batas, guantes y protección para los ojos y trabajar en un gabinete de bioseguridad al manipular muestras de tejido humano infectado o armadillo. Desinfección de superficies y herramientas también es fundamental. Trabajar en un lugar limpio, estéril bio-seguridad del gabinete es importante para evitar la contaminación de las muestras de ADN.
La extracción de ADN se ha convertido en relativamente fácil gracias al desarrollo de kits de extracción de empresas como Qiagen. Instrucciones deben ser seguidas cuidadosamente. Todas las muestras deben mantenerse en frío, cuando no esté en uso. Evitar la repetición, cambios extremos de temperatura para las muestras.
Cebadores de ADN utilizado en este trabajo se pueden pedir de varias empresas que han sido citados en la lista de referencias bibliográficas al final de este documento. Se debe tener cuidado al trabajar con los primers en un ambiente libre de ADN con el fin de evitar la contaminación. Cebadores vienen en forma de polvo seco y se debe mezclar con TE y se diluye a una concentración de 100μM, se separa en cantidades más pequeñas (Figura 2a). Las soluciones de trabajo de los cebadores se vuelve a diluir a concentraciones de 10μM. Una vez más, no utilizan las muestras de ADN en las áreas / campanas que se utilizan cebos y preparados.
Los productos de PCR también deben mantenerse en frío, cuando no esté en uso.
Un 3% de agarosa preparación del gel le dará una mejor separación de las bandas de ADN, pero tarda más en ejecutarse. Con fines puramente cualitativa, el 2% es suficiente. Solución de bromuro de etidio utilizado para teñir el ADN en geles de agarosa es una genotoxina muy activo que se absorbe por la piel. Manejar esta solución y geles teñidos con él usando mucho cuidado y estar siempre asegúrese de usar guantes. Lávese las manos minuciosamente después de manipular el ADN de muestras o materiales de bromuro de etidio. Disponer de una solución de tinción con bromuro de etidio, lavar y geles de acuerdo con las directrices institucionales. Geles no son habitualmente requeridos, este paso puede ser eliminada una vez métodos FLA se han establecido. Es mucho tiempo y reactivos.
La solución de formamida utilizados en la preparación de muestras para la FLA es también muy tóxico y debe ser manejado con cuidado. Lávese las manos después de su uso. Disponer de ella siguiendo las directrices institucionales.
Lectura de los resultados de la FLA utilizando el software del escáner pico puede ser un reto. Un conjunto básico de llamadas alelos (número de repeticiones en tándem) ha sido desarrollado en CSU (Tablas 4-7). (Cabe señalar que los cuadros 7.4 no sea definitiva. Como otras cepas de M. leprae se estudian, los alelos con el número de copias fuera de los rangos mencionados pueden ser encontrados.) Uno de los retos en particular es "tartamudeo" picos. Estas son las familias de los picos, sobre todo de los ROS que sólo implican 2-3 repeticiones de pares de bases, tales como (TA) 10. A veces la selección de la punta correcta para leer es difícil (Figura 7). En esta figura, el pico en el control positivo de 190 pb es el pico principal. Picos más bajos de altura, que son 2, 4, o incluso 6 pares de bases de mayor o menor que el pico principal se denominan "picos de tartamudear. A-cola también puede causar confusión. A-cola se ha descrito anteriormente en el texto y en la Figura 8. Por último, si los productos de PCR son muy abundantes en las muestras, los picos pueden aparecer con un aumento doble. En este caso, lea el centro de la forma de pico. (Ver Figura 6, los pacientes 6.)
Gestión de datos puede ser una tarea formidable para este tipo de trabajo. Es importante registrar toda la información pertinente para todos los experimentos, tales como: fecha de una tarea o procedimiento, el operador tira / la placa de los mapas, las órdenes de FLA, las condiciones de PCR y las recetas, las fechas de los geles y las fotografías, las temperaturas de almacenamiento, las diluciones de ADN de la plantilla, FLA lugares de almacenamiento de archivos electrónicos, etc organización y una gestión de datos puede ahorrar horas de tiempo dedicado a buscar información específica en el futuro.
El trabajo de laboratorio se describe aquí ha estado ocurriendo desde hace varios años en la Universidad Estatal de Colorado y en otros lugares alrededor del mundo. La imagen grande de lo que todos los datos recogidos medios y la forma en que pueden ser de uso en el futuro está empezando a surgir. Figuras 10A y 10B muestran cómo estas huellas de ADN se pueden utilizar para distinguir diferentes M. leprae entre los países (10A) o incluso entre las familias (10B). Casos de la familia y la comunidad vinculada Se ha demostrado que para llevar a M. leprae de tipos de cepas similares o idénticos VNTR. La esperanza es que tal vez sea posible para obtener una mayor comprensión del modo (s) de transmisión de la lepra, para que un sistema de detección precoz de las redes de transmisión puede ser desarrollado para los meses la gentet en situación de riesgo, y que el tratamiento farmacológico curativo puede comenzar antes de daño neurológico permanente y dermatológicos que se hace.
Divulgaciones
Agradecimientos
El financiamiento fue proporcionado por el NIH / NIAID subvención RO1-AI-63457 y concesión de suplemento de ARRA SR1-AI-63457 S1. Reconocemos las contribuciones de todos los miembros actuales y pasados del grupo de laboratorios y colaboradores.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| Sangre y DNeasy Tissue Kit | Qiagen | 69504 | |
| Multiplex PCR Kit | Qiagen | 206143 | |
| Cartilla de ADN | Varios | ||
| En gel de agarosa | Varios | ||
| Gel de 5x o 6x tampón de carga | New England Biolabs | B7021S | Recetas disponibles para hacer su propia * |
| Solución de bromuro de etidio | Varios | Diluir en contra. | |
| Hi-Di formamida Solución | Applied Biosystems | 4311320 | |
| Gene exploración -500 LIZ | Applied Biosystems | 4322682 |
* Http://biowww.net/buffer-reagent/6X-Gel-loading-buffer-bromophenol-blue-sucrose.html
| Equipo | Comentarios |
|---|---|
| 2 refrigeradores | 4 ° C: 1 para las muestras de ADN, uno de los cebadores y reactivos Multiplex |
| Un horno de microondas | O la manera adecuada para la calefacción de agarosa y agua para hacer geles |
| Un autoclave | O de olla a presión para la esterilización de los materiales |
| PCR máquina | Termociclador |
| 2 juegos de pipetas | 0,5-10 l, l 10-100, 20-200 l, 1000 l 1 juego de primers, 1 juego de ADN |
| Gel de electroforesis submarina caja | Con las formas y peines para la preparación de los geles. |
| Electroforesis de la fuente de alimentación | Con cables para la conexión a la caja de gel |
| Bloque de calor | Para tubos Eppendorf |
| Centrífugo | Para los tubos Eppendorf / tiras |
| Sistema de electroforesis capilar (analizador genético) | O el acceso a una institución que puede realizar este análisis |
| Plásticos | Aerosol desechables puntas de pipeta, tubos Eppendorf, tiras de 8 pocillos, placas de 96 pozos, algunos de calidad óptica |
| Ordenador con conexión a Internet |
Referencias
- World Health Organization. Chemotherapy of leprosy for control programmes. Technical Report Series. 675, 18-22 (1982).
- Cole, S. T. Massive gene decay in the leprosy bacillus. Nature. 409, 1007-1011 (2001).
- . Leproma Web Server. Leproma Web Server [Internet]. , (2004).
- Groathouse, N. A. Multiple Polymorphic Loci for Molecular Typing of Strains of Mycobacterium leprae. J. of Clinical Microbiology. 42, 1666-1672 (2004).
- Young, S. K. Use of Short Tandem Repeat Sequences to Study Mycobacterium leprae in Leprosy Patients in Malawi and India. Public Library of Science: Neglected Tropical Diseases. 2, E214-E214 (2008).
- Monot, M. Are Variable-Number Tandem Repeats Appropriate for Genotyping Mycobacterium leprae. J. of Clinical Microbiology. 46, 2291-2297 (2008).
- Kimura, M. Rapid Variable Number Tandem-Repeat Genotyping for Mycobacterium leprae Clinical Specimens. J. of Clinical Microbiology. 47, 1757-1766 (2009).
- Weng, X. i. a. o. m. a. n. Identification and Distribution of Mycobacterium leprae Genotypes in a Region of High Leprosy Prevalence in China: a 3-Year Molecular Epidemiological Study. J. of Clinical Microbiology. 45, 1728-1734 (2007).
- Weng, X. Transmission of leprosy in Qiubei County, Yunnan, China: Insights from an eight year molecular epidemiology investigation. Infection, Genetics and Evolution. , (2010).
- Sakamuri, R. M. Population-Based Molecular Epidemiology of Leprosy in Cebu, Philippines. J. of Clinical Microbiology. 47, 2844-2854 (2009).
- Fontes, A. N. B. Genetic diversity of Mycobacterium leprae isolates from Brazilian leprosy patients. Leprosy Review. 80, 302-315 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados