Method Article
DNA Fingerprinting von Mycobacterium leprae Die Stämme mit variablen Anzahl Tandem Repeat (VNTR) - Fragment Length Analysis (FLA)
In diesem Artikel
Zusammenfassung
Lepra, verursacht durch Mycobacterium leprae, Ist immer noch in vielen Orten endemisch. Um über die Verbreitung und Art der Übertragung der Lepra zu lernen, ist es wichtig zu ermitteln, welche Belastung der M. leprae Hat ein Patient infiziert. Variable Anzahl von Tandem Repeats (VNTR-Typisierung) ist eine solche Methode.
Zusammenfassung
Das Studium der Übertragung von Lepra ist besonders schwierig, da der Erreger, Mycobacterium leprae, kann nicht im Labor kultiviert werden. Die einzige Quelle für die Bakterien sind Lepra-Patienten und experimentell infizierten Gürteltiere und Nacktmäuse. So sind viele der Methoden in der modernen Epidemiologie verwendet werden, nicht für das Studium der Lepra zur Verfügung. Trotz einer umfangreichen weltweiten medikamentösen Behandlung Programm für die Lepra durch die WHO 1 implementiert, bleibt Lepra endemisch in vielen Ländern mit rund 250.000 Neuerkrankungen pro Jahr. 2 Die gesamte M. leprae Genom wurde 3,4 abgebildet und viele Loci identifiziert worden, die haben Segmenten von 2 oder mehr Basenpaare wiederholt (so genannte Mikro-und Minisatelliten). 5 Klinische Stämme von M. leprae kann in der Anzahl der Tandem wiederholte Segmente (short tandem repeats, STR) auf vielen dieser Loci variieren. 5,6,7 Variable Anzahl Tandem-Repeat (VNTR) 5 Analyse verwendet wurde, um verschiedene Stämme des Lepra-Bazillen zu unterscheiden. Einige der loci scheinen stabiler zu sein als andere, zeigen weniger Schwankungen in wiederholen Zahlen, während andere sich schneller ändern, manchmal in den gleichen Patienten zu sein scheinen. Während die Variabilität bestimmter VNTRs hat Fragen hinsichtlich ihrer Eignung für Stammtypisierung 7,8,9 brachte, legen die Schwellenländer Daten, die Analyse mehrerer Loci, die vielfältig in ihrer Stabilität sind, können als wertvolle epidemiologische Instrument verwendet werden. Multiple locus VNTR-Analyse (MLVA) 10 wurde verwendet, um die Lepra Entwicklung und Übertragung in mehreren Ländern, darunter China 11,12, Malawi 8, auf den Philippinen 10,13 und Brasilien 14 studierst. MLVA umfasst mehrere Schritte. Erstens ist die bakterielle DNA zusammen mit Wirtsgewebe DNA aus klinischen Biopsien oder Schlitz Haut schmiert (SSS) extrahiert. 10 Die gewünschte loci dann aus der extrahierten DNA mittels Polymerase-Kettenreaktion (PCR) amplifiziert. Fluoreszenzmarkierten Primer für 4-5 verschiedene Loci pro Reaktion eingesetzt, mit 18 Loci in insgesamt vier Reaktionen verstärkt. 10 Die PCR-Produkte auf Agarose-Gelelektrophorese unterworfen werden können, um das Vorhandensein des gewünschten DNA-Abschnitte zu überprüfen, und dann eingereicht für Leuchtstofflampen-Fragment-Längen-Analyse (FLA) mittels Kapillarelektrophorese. DNA aus Gürteltier passagiert Bakterien mit einer bekannten Anzahl von wiederholten Kopien für jeden Locus wird als positive Kontrolle verwendet. Die FLA-Chromatogramme werden dann unter Verwendung Peak-Scanner-Software-und Fragment-Länge ist auf die Anzahl der VNTR Kopien (Allel) umgewandelt. Schließlich werden die VNTR Haplotypen nach Mustern analysiert und, wenn sie mit Patienten klinische Daten kombiniert werden verwendet, um Verteilung der Belastung Arten zu verfolgen.
Protokoll
Der Zweck dieses Video Artikels ist es, einen Überblick über den Workflow zusammen mit Datenformat und Interpretation für die Forscher, dass nur sein Ausgangspunkt dieser Art von Arbeit (Abbildung 1) vorsehen. Es umfasst Demonstration von Techniken, vereinfachte Protokolle und praktische Tipps in früher veröffentlichten Werke beschrieben. 5,10
Allgemeine Work Flow-und Laboreinrichtungen:
Es sollte mindestens 3 separate Arbeitsbereiche für diese Art der Forschung sein. Das Labor sollte 1) eine Prä-PCR-Bereich mit einem PCR-Haube (saubere Luft Box oder isoliert Arbeitsbereich) für die Primer-Vorbereitung (Verdünnung aliquoten Vorbereitung und Mischen), 2) eine eigene Bio-safe Schrank für den Umgang und die Zugabe von DNA die PCR Mischungen, und 3) eine post-PCR Arbeitsbereich für die Vorbereitung und Be-Gelen und zur Probenvorbereitung für FLA. Primer und DNA-Proben sollten in separaten Kühl-und Gefriergeräten gehalten werden. Primer Kontamination ist eine der wichtigsten und hartnäckigsten Probleme im Labor von diesem Typ. Pipetten für Primer und PCR-Mixe verwendet werden, sollten nicht für DNA verwendet werden. Es sollten getrennte Sätze von Pipetten für die Prä-PCR, PCR-und Post-PCR Arbeitsbereiche werden. Generell kann ein Forscher 12-18 Proben in einem 12-24 Stunden mit Standard-Laborausrüstung Prozess.
Vor Beginn jeder Phase der Arbeit:
- Tragen Sie einen Laborkittel und Handschuhe. Sollten Handschuhe getragen jederzeit biologischen Proben, Primer, DNA und Ethidiumbromid werden behandelt werden. Wechseln Sie die Handschuhe regelmäßig.
- Arbeiten Sie in einer PCR Kabinett Kapuze, Biosicherheitswerkbank oder saubere Arbeitsfläche.
- Verwenden Sie ein frisches Bank Papier oder Pad.
- Set up Abfallbehältern geeignet für Flüssigkeiten und Pipettenspitzen.
- Wischen Sie mit der Innenseite des PCR Kapuze und Pipetten mit 70% Ethanol.
- Betreff Pipetten und Arbeitsbereich mit UV-Licht für 15 Minuten vor PCR eingerichtet. (UV-Licht vernetzt Oberfläche DNA Verunreinigungen.)
- Verwenden Sie immer Aerosol Prävention Pipettenspitzen für Materialien, die DNA, Primer und PCR-Reagenzien.
- Centrifuge alle Rohre / Streifen / Platten mit Flüssigkeit vor dem Öffnen, um die Aerosol Flucht-und Cross-Kontamination durch den Umgang zu verhindern.
1. M. leprae DNA-Präparation
Klinische Proben mit M. leprae sind von Lepra-Patienten, die Hautkliniken Besuch erhalten. Routine diagnostischen Proben kann die Haut Stanzbiopsien, Schlitz Haut schmiert oder Nasenabstriche werden. Im Allgemeinen sind Stanzbiopsien oder Schlitze Haut schmiert das Beste für molekulare Epidemiologie, weil sie sauber und sind ausreichende Mengen an M. leprae. Die Verwendung dieser Materialien für die Forschung muss nach den Richtlinien des Instituts genehmigt werden.
- Preserve Biopsie oder Schlitz Hautabstrich Proben in einem Schraubverschluss Fläschchen mit 1 ml 70% Ethanol.
- Centrifuge jede Probe in einem drehzahlgeregelten Tischzentrifuge bei 12.000 xg für 15 Minuten.
- Entfernen Sie den Überstand und legen Sie sie in ein Mikrozentrifugenröhrchen. Falls notwendig, kann es sinnvoll sein, re-Zentrifuge dieser Proben und erholen zusätzliche Gewebe oder DNA später.
- Add 500 ul Phosphat-gepufferter Kochsalzlösung (PBS), die Gewebeproben und genießen für 1 Stunde, um restliches Ethanol Konservierungsmittel Austausch und rehydrieren der Probe.
- Zentrifugieren Sie die Proben in einer Tischzentrifuge bei 12.000 xg für 20 Minuten. Entsorgen Sie die PBS-Lösung in einen Abfallbehälter teilweise mit Desinfektionslösung gefüllt.
- Auszug bakterielle DNA mit dem Qiagen DNeasy Blood and Tissue Kit nach den Richtlinien vorgeschrieben ist.
- Die extrahierte DNA sollte in 4 Durchstechflaschen aliquotiert werden. Store 2 Aliquots bei -80 ° C für eine spätere Verwendung, wenn / falls die Reproduzierbarkeit der Messergebnisse erforderlich ist oder wenn neue Technologien verfügbar werden. Shop ein Aliquot bei -20 ° C und einer bei 4 ° C für mehr sofortigen Einsatz.
- Es ist ratsam, eine "Entnahme blank 'zusammen mit den Gewebeproben vorzubereiten. Der Rohling wird für alle die gleichen Behandlungen skizzierten jedoch ohne Gewebe durchgeführt unterzogen. PCR die Extraktion blank zusammen mit den Patientenproben zu gewährleisten, dass der Betreiber Extraktionstechnik richtig ist und dass Reagenzien sind frei von DNA-Kontaminationen.
2. Primer Vorbereitung
- Primer für die Loci, für die es das größte Stamm Typ Daten sind in Tabelle 1 aufgeführt. Vier oder 5-Primer sind für Multiplex-PCR kombiniert. Ein Primer für jeden Locus trägt eine 5 'fluoreszierende chemische Markierung, die während der Kapillar-Elektrophorese-Fragment-Längen-Analyse (FLA) erkannt werden.
- Für jeden Multiplex-PCR-Kombination werden die markierten Primer und die entsprechenden Reverse-Primer für jeden Locus in separaten Eppendorf-Röhrchen kombiniert: Forward-Primer in einer Röhre, in einem anderen rückgängig zu machen. Lager-Primer sind als 100 &mgr; Lösungen (Abbildung 2a) vorbereitet, von denen ein Teilverdünnt 10x zu einer Konzentration von 10 uM mit TE (1x Tris-EDTA, pH 8,0). Verbleibende Aliquots der 100 uM Primer-Lösungen sind bei -20 ° C für eine spätere Verwendung gespeichert.
- Gleiche Mengen von je 10 uM Primer vermischt sich in 2 um Endkonzentrationen von jedem Primer. Wenn der Primer-Kombinationen, die PCR-Ansatz (Tabelle 3) hinzugefügt werden, fällt die endgültige Konzentration von jedem Primer und 0,2 uM.
Wenn die kombinierte Primer zur PCR-Gemische (Tabelle 3) hinzugefügt werden, Endkonzentrationen zu 0,2 um jeden Tropfen.
3. Amplifying bakterielle DNA mit Multiplex-PCR
- PCR-Setup
- Notieren Sie die Anzahl der Proben, die verwendet werden und bereiten Sie ein Arbeitsblatt mit den erforderlichen Reagenzien und ihre Volumina vor dem Sammeln der erforderlichen Kunststoffen und anderen Materialien.
- Beschriften Sie die sterilen Röhrchen / Streifen / Platten für die PCR mit Probe-Nummern verwendet werden. Denken Sie daran, positive und negative Kontrollen beinhalten.
- Wischen Sie den Thermocycler mit einer Reinigungslösung (wie Decon Eliminase) und das Programm ist nach Tabelle 2. Wechseln Sie die Handschuhe nach dem Reinigen und vor dem Umgang mit Primer und andere Reagenzien.
- Bereiten PCR Mastermix gemäß Tabelle 3 und beschriften Sie die PCR-Röhrchen / Streifen / Platte mit dem Primer-Kombination und Anzahl der Proben verwendet werden.
- Aliquot 18μl des Mastermix zu jedem markierten PCR-Probenröhrchen oder gut. Wechseln Sie die Handschuhe.
- Wischen Sie eine separate Bio-Werkbank und Pipetten mit 70% Ethanol zu helfen, reinigen und desinfizieren den Arbeitsbereich und Werkzeuge, dann unterliegen dem Arbeitsbereich und Pipetten mit UV-Licht für 15 Minuten zu vernetzen beliebige DNA-Verunreinigungen. Wechseln Sie die Handschuhe.
- In der sauberen biologisch sichere Schrank, fügen 2μl der DNA-Vorlage zum Mastermix in jedes PCR-Röhrchen / Platte auch auf ein Gesamtvolumen von 20 &mgr; l (Abb. 2b) zu erwerben. Aerosol Prävention Pipettenspitzen für alle flüssigen Materialien.
- Zentrifugieren Sie die PCR-Röhrchen / Streifen / Platten kurz vermischen.
- Legen Sie die Probenröhrchen / Streifen / Platte in den Thermocycler und starten Sie das PCR-Programm.
- Wenn das Programm beendet ist, entfernen Sie die Produkte aus dem Thermocycler und lagern bei 4 ° C bis Elektrophorese.
4. Gel-Elektrophorese von PCR-Produkten
* Dieses Protokoll ist seit vielen Jahren Standard und ist ein optionaler Schritt, eingesetzt werden, wenn die Bestätigung von PCR-Produkten ist vor der Versendung für FLA wünschen kann.
- In einem separaten post-PCR Arbeitsbereich, bereiten Sie einen 2% igen Agarosegel. Verwenden Sie 2,0 g Agarose powder/100ml von 1x TBE (Tris / Borat / EDTA)-Puffer-Lösung in einem Kolben. Erhitzen Sie die Mischung für ca. 1,5-2 Minuten in der Mikrowelle. Swirl den Inhalt, Heizung wieder, wenn notwendig, um die Agarose zu lösen. Etwas abkühlen lassen und gießen Sie das Gel in eine Form mit einem Kamm mit genügend Brunnen für die Proben.
- Entfernen Sie die PCR-Produkte von 4 ° C und Zentrifuge für ca. 30 Sekunden.
- Mix 2-5μl der PCR-Produkt mit 0,5-1μl von 5x oder 6x Gelladepuffer (Ladepuffer wird von verschiedenen Firmen, oder auch bis in das Labor gemischt werden. Rezepte sind online verfügbar.)
- Laden Sie die Vertiefungen des Gels mit dem 6μl sample / Ladepuffer mischen. Fügen Sie einen molekularen Leitern zu einem gut (vorzugsweise ein 20 bp Leiter).
- Führen Sie das Gel bei 100 V für ca. 90 Minuten.
- Weichen Sie das Gel in Ethidiumbromid-Lösung für 15-30 Minuten, dann in hochreinem destilliertem Wasser für eine gleiche Menge an Zeit.
- Bild des Gels, während UV-Licht angewendet wird. Es sollte eine Band für jeden der 4-5 DNA-Segmente in der Kombination (Abbildung 3).
- Entsorgen Sie das Gel in Übereinstimmung mit der Institution Gefahrstoffen Politik. Ethidiumbromid-Lösung kann mehrere Male vor der ordnungsgemäßen Entsorgung genutzt werden.
5. Probenvorbereitung für die Fragment-Längen-Analyse (FLA)
- In ein sauberes Eppendorf-Röhrchen, bereiten Sie einen Master-Gemisch mit 12μl der Hallo-Di Formamid-Lösung aus einer frischen Aliquot und 0.3μl der GeneScan -500 LIZ Sizing Standard (beide von Applied Biosystems) für jede Probe getestet werden. (Hallo-Di Formamid chemisch denaturiert die DNA-Stränge vor Kapillarelektrophorese, wodurch die Notwendigkeit für die Heizung.) Mit einem 96-well optische Qualität Reaktionsplatte, aliquoten 12.3μl der Formamid-LIZ-Mix, um jedes Wohlbefinden für Proben und genutzt den Teller beiseite.
- Machen Sie eine Platte Karte für Ihre Unterlagen angibt, welche DNA-Probe in jede Vertiefung wird (Abbildung 4a).
- Mit Röhren / Streifen oder eine 96-Well-Platte, fügen 1μl des PCR-Produkt (aus Teil 3) zu 59μl der PCR Wasserqualität Schaffung einer 1:60 Verdünnung des PCR-Produkts. Verdünnungen können je nach Signalstärke von der FLA Daten oder Helligkeit des Gelbanden eingestellt werden. Noch niedrigere Konzentrationen von DNA kannausreichend sein (1:120 oder 1:180).
- Add 1μl des verdünnten PCR-Produkt auf den richtigen und in den Teller mit dem Formamid-LIZ Mischung.
- Schnelligkeit und Effizienz kann erheblich gesteigert werden, wenn die PCR wurde auch in einer 96-Well-Platte durchgeführt. Man kann einfach line up 3 solche Platten in der Reihenfolge: Platte 1 mit PCR-Produkten, Plate 2 mit sterilem Wasser zur Verdünnung der PCR-Produkte und Plate 3 mit Formamid und Dimensionierung Leiter für Fragment-Längen-Analyse. Ein Mehrkanalpipette ermöglicht eine schnelle Prozess der FLA Vorbereitung.
Probenanalyse über Genetic Analyzer
- Kalibrieren Sie den Genetic Analyzer, um die aufgebrachte flurophores pro Anweisungen des Herstellers zu erkennen. Achten Sie darauf, ein Farbstoff-Set, das LIZ schließt verwenden.
- Nachfüllen Wasser abspülen Container und fügen Sie neue Laufpuffer mit EDTA (1x) (Applied Biosystems) mit den Kammern Puffer.
- Fügen Sie eine pre-Schlitz Silizium Septum auf den Teller und legen Sie die Platte in der entworfenen hält Tablett. Drücken Sie die "Tray"-Taste auf der Genetic Analyzer, um den Autosampler vorne zu bringen. Legen Tablett auf Autosampler und schließen Sie die Tür zum Genetic Analyzer.
- Erstellen oder Importieren einer Tabellenkalkulation für die Analyse. Importierbare Dateien haben eine. Plt-Erweiterung und sind in durch Tabulatorzeichen getrennten Format. Dateien können in Excel (Microsoft) oder ähnliche Programme geändert werden.
- Die Proben werden in die Kapillare (50-cm Länge, POP-7-Polymer) durch Anlegen einer Injektion Spannung von 1,6 kV für 15 s. injiziert Die Kapillarelektrophorese läuft bei einer Spannung von 15 kV bei 60 ° C für 1800 Sekunden. Der gesamte Prozess dauert etwa 45 Minuten.
- Nach einem Lauf abgeschlossen ist, werden die Daten für jede Probe analysiert in Dateien mit einer. Fsa Erweiterung konvertiert und in einem Teller Dateiordner (Abbildung 4b). Jede Datei ist etwa 100 kB groß und kann auf einem USB-Stick gespeichert oder gezippt und per E-Mail. Daten-Dateien können mit geeigneter Software, wie z. B. ABI GeneMapper oder Peak Scanner.
6. Die Analyse der Fragment-Längen-Ergebnisse
- Die Analyse der Daten von fluoreszierenden Kapillarelektrophorese erfordert spezielle Software. Wenn eine solche Software nicht verfügbar ist, gehen die Applied Biosystems Website und laden Peak-Scanner. Die Software ist kostenlos und funktioniert ziemlich gut. https://products.appliedbiosystems.com/ab/en/US/adirect/ab?cmd=catNavigate2&catID=603624
- Öffnen Peak-Scanner und 'Start New Project' von 'Add Files' gefolgt. Laden Sie die ausgewählten. Fsa Dateien in das Programm, einschließlich der positiven und negativen Kontrollen.
- Wählen (markieren) und "analysieren" alle geladenen Dateien. Seien Sie sicher, dass jede Probe auf "Size Standard eingestellt ist: GS500 (-250) und Analysemethode:. Sizing Standard-pp Press" Analysieren ".
- Überprüfen Sie die Größe in Basenpaaren der einzelnen farbigen Spitzen durch die DNA-Fragmente in den Proben hergestellt.
- Rekord jeden Peak Größe Wert in Basenpaaren und vergleichen Sie es mit der positiven Kontrolle Höhepunkt.
- Peaks im positiven Kontrollproben sollten Vergleich mit den Zahlen von Basenpaaren und die entsprechenden Zahlen der Tandem-Repeats in den Tabellen 4-7 aufgeführt.
- Ermitteln Sie, wie viele short tandem repeat Segmente sind in jeder Probe Allel im Vergleich mit der positiven Kontrolle. Wir verwenden NHDP63, die für die Anzahl der VNTR Kopien wurde an jedem Locus untersucht sequenziert. 4
- Geben Sie die aufgezeichneten Daten in eine Tabellenkalkulation für eine vergleichende und / oder mathematische Analysen. VNTR "Fingerabdrücke" oder Haplotypen, sind Strings von Allelen an definierten Loci, die charakteristisch für einen M. sind leprae Belastung.
7. Repräsentative Ergebnisse
Gel-Elektrophorese der PCR-Produkte wird hoffentlich produzieren eine Band für jeden Ort in der Primer-Kombination (Abbildung 3). In Abbildung 3 gibt es 2 Sektionen, um das Gel: das Oberteil hat 1 PCR-Proben und der untere Teil Combination 2 Proben Kombination. Jeder Abschnitt enthält eine 20-Basenpaar-molekulare Leiter, durch PCR-Produkte von 8 Patienten gewonnenen Proben verfolgt. Kombination 1 hat auch eine negative Kontrolle und schließlich eine positive Kontrolle (NHDP63 Stamm). (Die Bedienelemente für die Kombination 2 wurden auf einem anderen Gel.) Beachten Sie, dass die meisten Proben deutlich sichtbar 5 Bands, 1 für jeden Locus in der Kombination. In einigen Fällen können Bänder werden zu dicht beieinander als separate loci was das Auftreten von nur 4 Bands auftreten.
Erwartete Amplikongrößen sind in Tabelle 1 aufgeführt. Unser Labor verwendet NHDP63 Stamm von M. leprae als positive Kontrolle. Zwei Arten von wiederholten Segmente wurden untersucht: Mikrosatelliten-Loci (mit 1-5 Basis Wiederholungen) und Minisatellit loci (mit Segmenten von mehr als 5 Basenpaare mehrfach wiederholt). 5
Interpretation der Daten-Dateien von Kapillarelektrophorese beruht auf 2-Standards: ein internes DNA-Fragment Sizing Standard namens GeneScan-500LIZ (ABI) und eine externe positive Kontrollprobe von amplifizierten bakteriellen DNA.
Die FLA-Chromatogramme, eine Anzeige mit Peak-Scanner-Software kann in den Abbildungen 5a, 5b und 6 zu sehen.
Peak-Scanner liefert Daten über Amplicongröße (x-Achse in Basenpaaren) und Signalstärke (y-Achse). (Abbildung 5b) Zusätzliche Daten auf Peakfläche, etc. stehen ebenfalls zur Verfügung, obwohl die Größe und die Peakhöhe Werte am wichtigsten sind. Peaks weniger als 100 Einheiten in der Höhe sind in der Regel als zu schwach ein Signal zuverlässig zu sein.
Abbildung 6 vergleicht die positive Kontrolle (NHDP63) und zwei Patientenproben, die eine Variation in der Anzahl der Tandem-Wiederholungen am Locus (GTA) 9. In der positiven Kontrolle, wobei die Reihenfolge (GTA) wird 10 mal wiederholt. Die NHDP63 VNTR und Amplicongröße wurden durch Gen-Sequenzierung verifiziert. Patient 4 ist PCR Amplikon ist 3 bp kleiner als die positive Kontrolle anzeigt, gibt es nur 9 wiederholenden Einheiten, während Patient 6 ist ein Amplikon, dass 3 bp größer als NHDP63 enthüllt 11 wiederholt der (GTA) ist. Patient 2 hatte eine geringe bakterielle Index (BI) mit wenig oder keiner DNA PCR-Replikation, daher keine FLA-Signal.
Schwierigkeitsgrad in FLA Interpretation der Daten tritt manchmal als Folge von "Stottern". Während der PCR-Reaktion, kann die DNA-Polymerase zu erzeugen Fragmente, 1 oder mehr Wiederholungen länger oder kürzer als die Quelle-Allels sind. Diese sind meist als Peaks geringerer Höhe um den Hauptgipfel anerkannt. Sie werden "auf der Leiter", also die richtige Anzahl der Basenpaare des wiederholen Segment größer oder kleiner als der Hauptpeak. Das Ergebnis ist eine Familie von Gipfeln der gleichen Farbe. Abbildung 7 zeigt dies mit Locus (TA) 10.
Eine weitere Schwierigkeit manchmal mit FLA begegnet beinhaltet '+ A "oder" A-Tailing ", in dem die DNA-Polymerase einer einzigen Base [Regel Adenin (A)], um das 3'-Ende der kopierten DNA-Segment ergänzt. Dies zeigt sich in FLA als Peak auf der rechten Seite eine Haupt-oder stottern peak, dass 1 Basenpaar größer als die benachbarten Gipfel, wie in Abbildung 8 dargestellt ist. Es sollte nicht mit einem Haupt-oder stottern peak verwechselt werden. Ein Hauptpeak und seine A-Schwanz sind als eine einzige Spezies. Die A-Schwanz, ändert nichts an der Anzahl der VNTR wiederholt. (Einige DNA-Polymerase-Kits sind speziell für den zu fördern A-Tailing, um diese verwirrenden Effekt zu reduzieren. Förderung komplette A-Tailing neigt dazu, einen einzelnen Peak, anstatt ein paar Spitzen zu produzieren.)
Die DNA-Extraktion und PCR-Produkte enthalten sowohl M. leprae und der menschlichen DNA, jedoch mit Ausnahme von (TA) 18, werden die Primer spezifisch genug, dass sie nur verstärken die bakterielle DNA, und es gibt wenig oder gar keine menschlichen DNA-Amplifikation. (TA) 18 erzeugt oft einen Spitzenwert bei 242 Basenpaaren, die aus menschlicher DNA ist und nicht in Gürteltier passagiert DNA-Proben (Abb. 9) zu sehen.
Die Haltbarkeit der Primer ist im Allgemeinen gut, sofern sie bei -20 ° C, nur für den sofortigen Einsatz entfernt gehalten werden, und dann bei 4 ° C gelagert bis zum Verzehr. Grundierungen sollten bei 4 ° C für 1-2 Wochen stabil. Obwohl machen Primer-Kombinationen für die PCR ist etwas zeitaufwendig, ist es empfehlenswert, nur so viel Primer-Kombination für den sofortigen Einsatz vorbereitet werden. Primer-Kombinationen scheinen etwas verschlechtern, wenn über einen längeren Zeitraum gespeichert.
TE sollte aus größeren Beständen aliquotiert werden, und Aliquots gespeichert entweder eingefroren oder bei Zimmertemperatur aufbewahrt werden. Größere Portionen von 200-400μl sind gut für die Verdünnung getrocknet oder konzentriert Primer Aktien (Abbildung 2a). Kleinere Portionen von 10-50 ul sind nützlich für die Ergänzung der Volumina von Primer-Kombinationen 3 und 4. TE ist kostengünstig und Aliquots sollten nach dem Gebrauch weggeworfen werden.
Multiplex-Enzym-Kits sind recht teuer und sollten eingefroren werden (-20 ° C) bis zur Verwendung. Nach PCR-Ansatz, nicht verwendete Multiplex-Lösungen ab sofort bis 4 zurückgegeben ° C. Der kleine Qiagen Multiplex PCR Kit kommt mit 3 Rohren von Multiplex-Mix mit je 0.85ml (850μl) der Lösung; genug für etwa 65-70 PCRs.
Im Allgemeinen ist es am besten, wiederholt, große Temperaturschwankungen für die Materialien in dieser Art von Arbeit im Labor, einschließlich der DNA-Proben, Grundierungen und Multiplex-Kit-Lösungen verwendet werden, vermeiden. Alle Materialien sollten bei -20 ° C gelagert werden, bis sie benötigt, und dann bei 4 ° C aufbewahrt bis zum Verzehr. Langfristige Speicherung von DNA sollte bei -80 ° C.
Alle Materialien, die verbrachte Gewebe, Primer und / oder DNA sollten autoklaviert und entsorgt werden, wenn nicht mehr von Nutzen. Alle Proben behandeltmit Ethidiumbromid oder Formamid sollten als Sondermüll behandelt und entsorgt werden in Übereinstimmung mit der Institution Gefahrstoffen Politik.
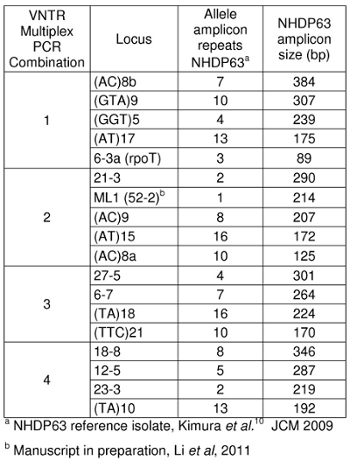
Tabelle 1: Amplikongrößen für DMS NHDP63
Tabelle 2: Radfahren Parameter für VNTR PCR

Tabelle 3: Vorbereitung der PCR
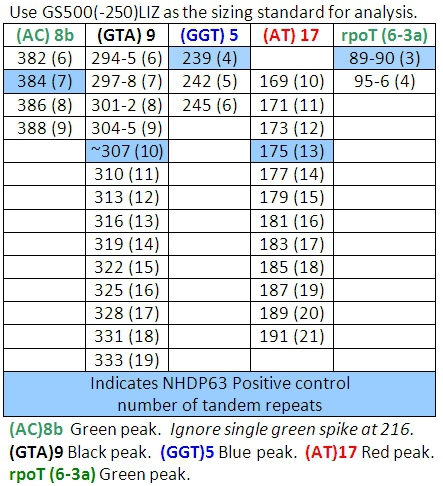
Tabelle 4: Allele fordert Kombination 1
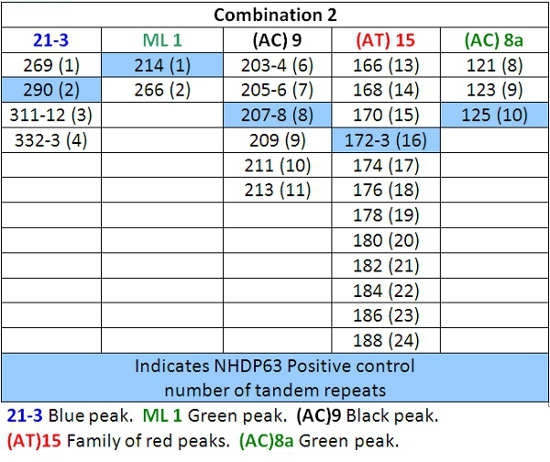
Tabelle 5: Allele fordert Kombination 2
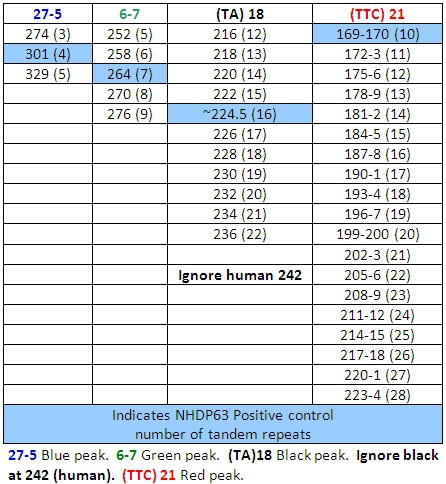
Tabelle 6: Allele fordert Kombination 3
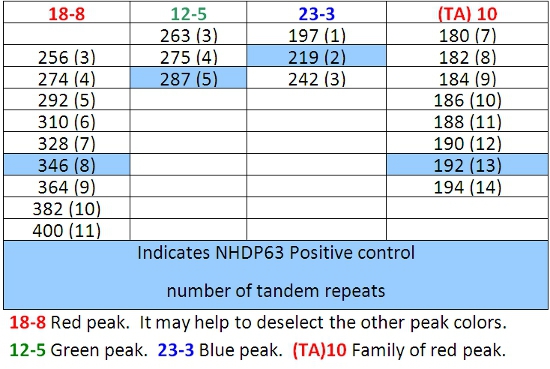
Tabelle 7: Allele fordert Kombination 4

Abbildung 1: VNTR-FLA Prozessflussdiagramm
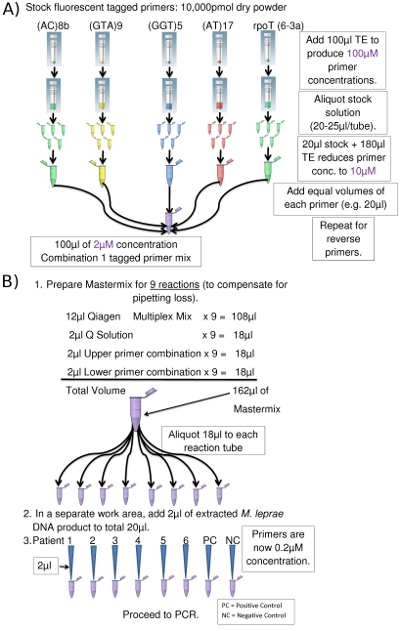
Abbildung 2. (A) Herstellung der Kombination 1 Oberer Primer (Eppendorf-Röhrchen Bild mit freundlicher Genehmigung von www.clker.com ). (B) PCR Setup (für 8 PCRs) (Eppendorf-Röhrchen Bild mit freundlicher Genehmigung von www.clker.com)
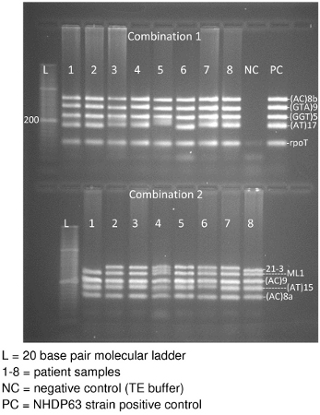
Abbildung 3. Agarosegel der Kombinationen 1 und 2 VNTR-PCR-Produkt DNA
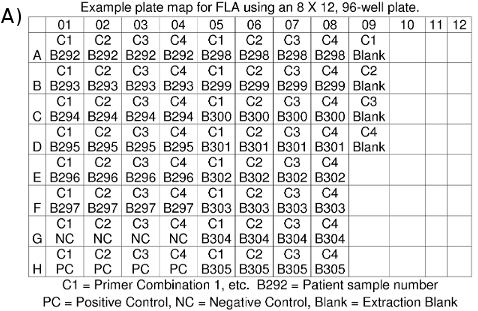
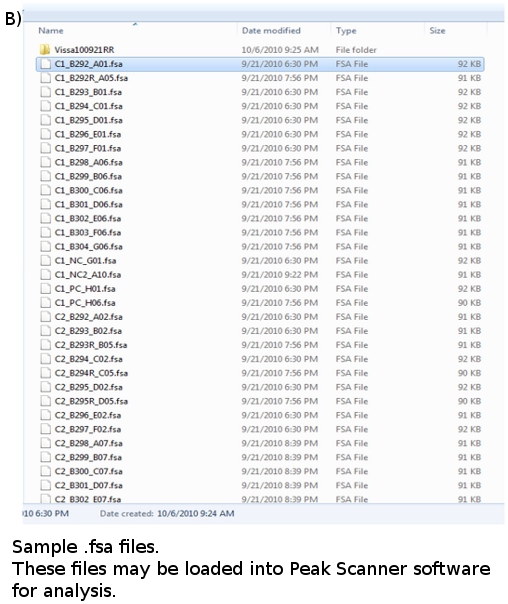
Abbildung 4. . (A) FLA Platte Map (b) FLA-Dateien: *. fsa
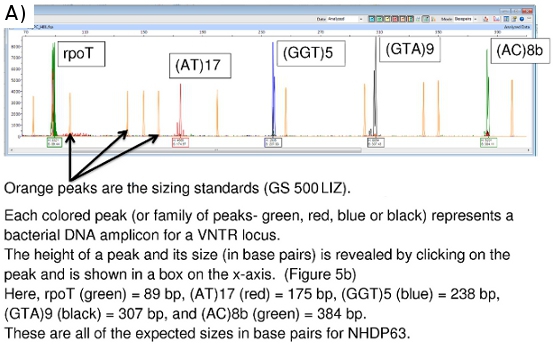
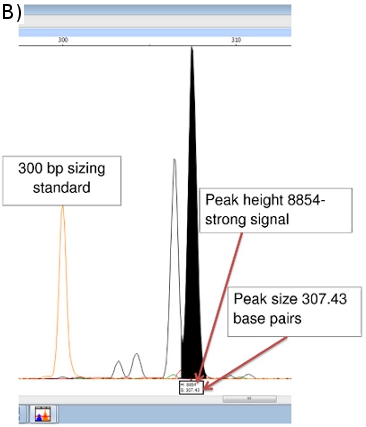
Abbildung 5. (A) FLA Chromatogramm Positive Control (NHDP63) für Kombination 1 VNTR-Loci. (B) Peak Scanner-Daten für Amplikon Größe und Fülle (GTA) 9
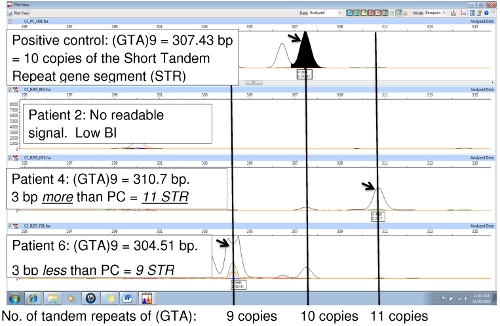
Abbildung 6. Vergleich von PCR-Proben an den PC (NHDP63) für locus (GTA) 9
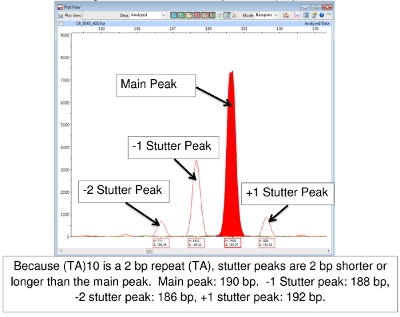
Abbildung 7. Haupt-und Stutter Peaks für (TA) 10
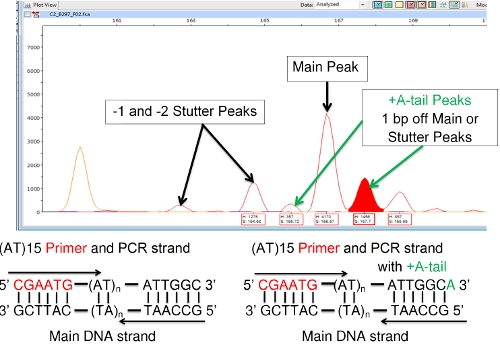
Abbildung 8: + A (A-Schwanz) Peaks Angrenzend an Haupt-oder Stutter Peaks.
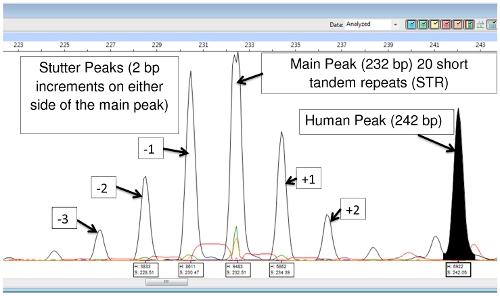
Abbildung 9: (TA) 18 Haupt-Peak, Stutter Peaks and Human DNA Peak-
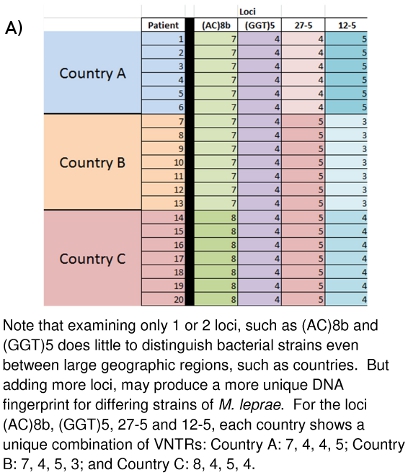
Abbildung 10:. (A) Strain Differenzierung von M. leprae auf VNTR Daten (B) Strain Differenzierung von M. leprae auf MLVA DNA Fingerprint Basis
Diskussion
Die Sammlung von Hautproben von Lepra-Patienten erfordert qualifizierte Ärzte oder Techniker arbeiten an Hautkliniken. Labormitarbeiter Umgang mit diesen Proben müssen mit großer Sorgfalt zu Laborkittel, Schutzhandschuhe und Schutzbrille tragen zu tragen und in einem Bio-Sicherheitsschrank Arbeit beim Umgang mit infizierten Proben menschlichen oder Gürteltier Gewebe. Desinfektion von Oberflächen und Tools ist ebenfalls entscheidend. Arbeiten in einem sauberen, sterilen biologisch sichere Schrank ist zur Vermeidung von Kontamination von DNA-Proben wichtig.
DNA-Extraktion hat sich relativ einfach durch die Entwicklung der Extraktion Kits von Firmen wie Qiagen. Anfahrt müssen unbedingt beachtet werden. Alle Proben sollten kühl gehalten werden, wenn nicht in Gebrauch ist. Vermeiden Sie wiederholte, extreme Temperaturschwankungen für die Proben.
DNA-Primer in dieser Arbeit verwendet werden kann aus verschiedenen Unternehmen, die in der Liste der Literaturangaben wurden am Ende dieses Beitrags zitiert bestellt werden. Es ist darauf zu mit Primern in einem DNA-freien Umgebung zu arbeiten, um eine Kontamination zu vermeiden. Primer kommen als trockenes Pulver und muss mit TE gemischt und verdünnt, um eine 100 &mgr; Konzentration, dann in kleineren Mengen (Abbildung 2a) getrennt. Working-Lösungen von Primer sind weiter auf 10 um Konzentrationen verdünnt. Auch hier verwenden Sie keine DNA-Proben in den Bereichen / Hauben wo Primer verwendet und sind bereit.
PCR-Produkte sollten auch gehalten, wenn nicht in Gebrauch ist kalt.
Eine 3% Agarosegel Vorbereitung wird eine bessere DNA-Bande Trennung, dauert aber länger zu laufen. Für rein qualitative Zwecke, 2% in der Regel ausreichend. Ethidiumbromidlösung zur Färbung der DNA in Agarosegelen verwendet ist ein hochaktiver genotoxische Wirkung, die durch die Haut absorbiert wird. Handle dieser Lösung und Gele mit ihm mit großer Sorgfalt und stets sicher, dass das Tragen von Handschuhen gefärbt. Waschen Sie Ihre Hände nach dem Umgang mit allen DNA-Proben oder Ethidiumbromid Materialien. Entsorgen Ethidiumbromidfärbung Lösung, waschen und Gele nach den Richtlinien des Instituts. Gele werden nicht routinemäßig erforderlich, kann dieser Schritt entfallen, sobald FLA-Methoden festgelegt wurden. Es ist Zeit und Reagenzien verbraucht.
Die Formamidlösung in Vorbereitung der Proben für die FLA verwendet wird, auch sehr giftig und sollte mit Sorgfalt behandelt werden. Waschen Sie Ihre Hände nach dem Gebrauch. Entsorgen Sie folgende Richtlinien des Instituts.
Beim Lesen der Ergebnisse der FLA mit Peak-Scanner-Software kann eine Herausforderung sein. Eine Reihe grundlegender Allel Anrufe (Anzahl der Tandem-Repeats) hat der CSU (Tabellen 4-7) entwickelt worden. (Anzumerken ist, dass Tabellen 4-7 nicht all inclusive sein. Wie auch andere Stämme von M. leprae studiert werden, Allele mit Kopie Zahlen außerhalb der Bereiche aufgeführt gefunden werden kann.) Eine besondere Herausforderung besteht darin, 'stottern' Gipfel. Dies sind Familien von Gipfeln, vor allem von Verdachtsanzeigen, die nur um 2-3 Basenpaare wiederholt, wie (TA) 10. Manchmal Auswahl der richtigen Höhepunkt zu lesen ist schwierig (Abbildung 7). In dieser Abbildung ist der Höhepunkt in der positiven Kontrolle bei 190 bp der Hauptpeak. Peaks geringer Höhe, die 2 sind, 4 oder sogar 6 Basenpaare größer oder kleiner als der Hauptgipfel heißen "stottern Gipfel." A-Tailing kann auch zu Verwechslungen führen. A-Tailing ist bereits im Text und in Abbildung 8 beschrieben. Schließlich, wenn PCR-Produkte sehr häufig in den Proben sind, kann Peaks mit einer Doppel-Spitze erscheinen. In diesem Fall lesen Sie die Mitte des Peaks zu bilden. (Siehe Abbildung 6, Patient 6).
Datenmanagement kann eine gewaltige Aufgabe für diese Art von Arbeit sein. Es ist wichtig, alle relevanten Informationen für alle Experimente wie Rekord: Datum einer Aufgabe oder eines Verfahrens, Betreiber, Streifen / Platte Karten, FLA Bestellungen, PCR-Bedingungen und Rezepte, Termine von Gelen und Fotografien, Lagertemperaturen, DNA-Template Verdünnungen, FLA elektronische Datei Lagerorte, etc. Eine gute Organisation und Datenverwaltung, kann Ihnen Stunden Zeit damit verbracht, auf der Suche nach spezifischen Informationen in die Zukunft.
Das Labor hier beschriebenen Arbeiten hat schon seit mehreren Jahren an der Colorado State University und an anderen Orten auf der ganzen Welt. Das große Bild von dem, was all der gesammelten Daten bedeutet und wie es bezüglich der künftigen Nutzung ist im Entstehen begriffen. 10A und 10B zeigen, wie diese DNA-Fingerprints verwendet werden, um verschiedene M. zu unterscheiden leprae Stämme zwischen den Ländern (10A) oder auch zwischen Familien (10B). Familie und Gemeinschaft verbunden Fällen hat sich gezeigt, M. tragen leprae von ähnlichen oder identischen VNTR Belastung Typen. Die Hoffnung ist, dass es möglich sein, weitere Einblicke in die Wirkungsweise (n) der Lepra Übertragung zu gewinnen, so dass eine Früherkennung von Übertragungsnetzen für jene Leute mos entwickelt werden könnent in Gefahr, und das heilende medikamentöse Therapie beginnen kann, bevor bleibende neurologische und dermatologische Schaden entsteht.
Offenlegungen
Danksagungen
Die Finanzierung wurde durch die NIH / NIAID gewähren RO1-AI-63457 und ARRA gewähren ergänzen RO1-AI-63457 S1 zur Verfügung gestellt. Wir erkennen die Beiträge aller aktuellen und ehemaligen Mitgliedern des Labors Gruppe und Mitarbeiter.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| DNeasy Blood and Tissue Kit | Qiagen | 69504 | |
| Multiplex PCR Kit | Qiagen | 206143 | |
| DNA-Primer | Verschiedene | ||
| Agarose Gel | Verschiedene | ||
| 5x oder 6x Gel-Ladepuffer | New England Biolabs | B7021S | Rezepte zur Verfügung, um Ihre eigenen * machen |
| Ethidiumbromid-Lösung | Verschiedene | Verdünnen von con. | |
| Hallo-Di Formamidlösung | Applied Biosystems | 4311320 | |
| Gene Scan -500 LIZ | Applied Biosystems | 4322682 |
* Http://biowww.net/buffer-reagent/6X-Gel-loading-buffer-bromophenol-blue-sucrose.html
| Ausstattung | Kommentare |
|---|---|
| 2 Kühlschränke | 4 ° C: 1 für die DNA-Proben, 1 für Grundierungen und Multiplex-Reagenzien |
| 1 Mikrowellenherd | Oder geeigneter Weise für Heizung und Wasser Agarose Gele machen |
| 1-Autoklaven | Oder Dampfkochtopf für die Sterilisation Materialien |
| PCR-Maschine | Thermocycler |
| 2 Sätze von Pipetten | 0,5-10 ul, 10-100 ul, 20-200 ul, 1000 ul 1 Satz für Primer, 1 Satz für DNA |
| Submarine Gelelektrophorese box | Mit Formen und Kämme für Herstellung von Gelen. |
| Elektrophorese-Netzteil | Mit Kabel für den Anschluss an Gel-Box |
| Heizblock | Für Eppendorf-Röhrchen |
| Zentrifuge | Für Eppendorf-Röhrchen / Streifen |
| Kapillarelektrophorese-System (Genetic Analyzer) | Oder um eine Institution, die diese Analyse durchzuführen zugreifen können |
| Plastics | Einweg-Aerosol-Pipettenspitzen, Eppendorf-Röhrchen, 8-Well-Streifen, 96-Well-Platten, einige optische Qualität |
| Computer mit Internet-Anschluss |
Referenzen
- World Health Organization. Chemotherapy of leprosy for control programmes. Technical Report Series. 675, 18-22 (1982).
- Cole, S. T. Massive gene decay in the leprosy bacillus. Nature. 409, 1007-1011 (2001).
- . Leproma Web Server. Leproma Web Server [Internet]. , (2004).
- Groathouse, N. A. Multiple Polymorphic Loci for Molecular Typing of Strains of Mycobacterium leprae. J. of Clinical Microbiology. 42, 1666-1672 (2004).
- Young, S. K. Use of Short Tandem Repeat Sequences to Study Mycobacterium leprae in Leprosy Patients in Malawi and India. Public Library of Science: Neglected Tropical Diseases. 2, E214-E214 (2008).
- Monot, M. Are Variable-Number Tandem Repeats Appropriate for Genotyping Mycobacterium leprae. J. of Clinical Microbiology. 46, 2291-2297 (2008).
- Kimura, M. Rapid Variable Number Tandem-Repeat Genotyping for Mycobacterium leprae Clinical Specimens. J. of Clinical Microbiology. 47, 1757-1766 (2009).
- Weng, X. i. a. o. m. a. n. Identification and Distribution of Mycobacterium leprae Genotypes in a Region of High Leprosy Prevalence in China: a 3-Year Molecular Epidemiological Study. J. of Clinical Microbiology. 45, 1728-1734 (2007).
- Weng, X. Transmission of leprosy in Qiubei County, Yunnan, China: Insights from an eight year molecular epidemiology investigation. Infection, Genetics and Evolution. , (2010).
- Sakamuri, R. M. Population-Based Molecular Epidemiology of Leprosy in Cebu, Philippines. J. of Clinical Microbiology. 47, 2844-2854 (2009).
- Fontes, A. N. B. Genetic diversity of Mycobacterium leprae isolates from Brazilian leprosy patients. Leprosy Review. 80, 302-315 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten