Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Desarrollo de una manera unilateral-lesionado 6-OHDA modelo de ratón de la enfermedad de Parkinson
En este artículo
Resumen
Un protocolo para realizar unilaterales 6-OHDA lesiones del haz medial del cerebro anterior en ratones se ha descrito. Este método tiene una baja tasa de mortalidad (13,3%) con el 89% de los animales sobrevivientes que muestran la pérdida de> 95% de la dopamina estriatal y 90,63 ± -4,02% sesgo ipsiversive de rotación hacia el lado de la lesión.
Resumen
El unilateralmente lesionado 6-hyroxydopamine (6-OHDA)-lesionado modelo de rata de la enfermedad de Parkinson (EP) ha demostrado ser muy valiosa para avanzar en nuestra comprensión de los mecanismos que subyacen a los síntomas parkinsonianos, ya que recapitula los cambios en los circuitos de los ganglios basales y la farmacología observada en parkinsonianos los pacientes 1-4. Sin embargo, los cambios precisos celulares y moleculares que ocurren en estriatales córtico-sinapsis de las vías de salida dentro del cuerpo estriado, que es la región de entrada principal de los ganglios basales siendo difícil de alcanzar, y esto se cree que es el sitio donde anormalidades patológicas subyacentes síntomas parkinsonianos surgen 3 , 5.
En la EP, la comprensión de los mecanismos que subyacen a los cambios en la degeneración basal circuitos de los ganglios siguiente de la vía nigro-estriado se ha hecho avanzar por el desarrollo de cromosoma artificial bacteriano (BAC) ratones sobre-expresión de proteínas fluorescentes verdes impulsados por promover8, lo que les permite ser estudiados en forma aislada:;: específica para las dos vías de salida del estriado (EGFP-D2 y A2A-eGFP vía indirecta eGFP-D1 vía directa) rs. Por ejemplo, estudios recientes han sugerido que existen cambios patológicos en la plasticidad sináptica en ratones con Parkinson 9,10. Sin embargo, estos estudios utilizaron ratones jóvenes y los modelos agudos de parkinsonismo. No está claro si los cambios descritos en las ratas adultas con un nivel estable 6-OHDA lesiones también ocurren en estos modelos. Otros grupos han intentado generar un establo de manera unilateral-lesionado 6-OHDA modelo de ratón adulto de la DP a través de lesionar el paquete de medial del cerebro anterior (MFB), por desgracia, la tasa de mortalidad en este estudio fue muy alta, con sólo el 14% de sobrevivir a la cirugía para el 21 días o más, 11. Estudios más recientes han generado dentro de la sustancia nigra lesiones tanto con una baja tasa de mortalidad pérdida de> 80% de las neuronas dopaminérgicas, sin embargo la expresión de L-DOPA discinesia inducida por 11,12,13,14 fue variableen estos estudios. Otro modelo de ratón bien establecido de la enfermedad de Parkinson es el ratón MPTP lesionado 15. Si bien este modelo ha demostrado ser útil en la evaluación de los posibles agentes neuroprotectores 16, que es menos adecuado para la comprensión de los mecanismos subyacentes a los síntomas de la EP, ya que este modelo no suele inducir a los déficits motores, y muestra una gran variabilidad en la magnitud de la lesión 17, 18 .
Aquí hemos desarrollado un estable unilateral 6-OHDA lesionado modelo de ratón de la EP mediante la administración directa de 6-OHDA en el BMF, que de forma sistemática causa la pérdida> 95% de dopamina estriatal (medido por HPLC), así como producir el comportamiento los desequilibrios observados en el bien caracterizado modelo unilateral de ratas 6-OHDA lesionado de la EP. Este modelo de ratón de nuevo desarrollo de la EP será un valioso instrumento para comprender los mecanismos que subyacen a la generación de los síntomas parkinsonianos.
Protocolo
1. Vivienda y preparación de los ratones
- Mantener una colonia de cromosoma artificial bacteriano (BAC), impulsados ratones transgénicos 8 (ratón mutante Regional Resource Center (MMRRC) en un FVB 12:12 h ciclo luz-oscuridad con acceso libre a comida y agua. Estos ratones son ratones FVB puros, y no es necesario cruzar estos ratones con cualquier otra cepa, ya sea con fines de reproducción, o para asegurar el éxito del procedimiento de lesión por 6-OHDA.
- Con el fin de generar un modelo de Parkinson, los ratones adultos con edades entre 31-42 días después del parto (P31-42) son necesarios para cirugías de 6-OHDA lesión y farsa.
- Para reducir el riesgo de infección, administrar Baytril (antibiótico) en el agua potable durante 24 horas antes de la cirugía.
2. Preparación de los medicamentos para la cirugía
Una premedicación de desipramina y pargilina se administra generalmente a los roedores antes de la inyección de 6-hidroxidopamina (6-OHDA) para aumentar la selectividad y el FEPicacy de 6-OHDA lesiones inducidas. El inhibidor de la absorción de noradrenalina / 5HT, desipramina disminuye 6-OHDA inducida por noradrenalina y 5HT agotamiento 22, mientras que el inhibidor de monoamina oxidasa, pargilina mejora la sensibilidad de los terminales dopaminérgicos a 6-OHDA, reduce la descomposición extrasinápticos de 6-hidroxidopamina 31.
- La premedicación (clorhidrato de desipramina (HCl) y HCl pargilina) se pueden hacer en grandes volúmenes y se almacenó a -80 ° C hasta su uso. Pesar la cantidad apropiada de desipramina HCl para abastecer cada ratón con 25 mg / kg para el número de animales que reciben la cirugía en ese día. El bajo peso del ratón hace que sea difícil para entregar pequeños volúmenes con precisión, por lo tanto preparar hidrocloruro de desipramina a una concentración de 2,5 mg / ml y se administra al animal a 10 ml / kg. El peso del componente de la sal del compuesto debe tenerse en cuenta tal que la concentración correcta se consigue. Corrección para el peso de laDe HCl sal en clorhidrato de desipramina: Peso molecular (MW) de desipramina HCl: 302,84 MW HCl: 36,46 MW de base libre: 266,38 Factor de corrección: 302,84 / 266,38 = 1,137 para 10 ml de solución: = 2.5mg/ml desipramina x x 10.0ml Factor de corrección = 2.5mg/ml x 1,137 = x 10.0ml 28.43mg de clorhidrato de desipramina
- Pesar la cantidad apropiada de pargilina HCl para abastecer cada ratón con 5mg/kg para el número de animales que recibieron la cirugía ese día. Corregir para el componente de sal del compuesto como se ha descrito anteriormente. El bajo peso del ratón hace que sea difícil para entregar pequeños volúmenes con precisión, por lo tanto preparar hidrocloruro de pargilina a una concentración de 0,5 mg / ml y administrar al animal a 10 ml / kg.
Corregir el peso de la sal HCl en hidrocloruro de pargilina:
MW de pargilina HCl: 195,69 MW HCl: 36,46
MW de base libre: 159,23 Factor de corrección: 195,69 / 159,23 = 1,229
Para 10 ml de solución de pesaje de salida:
= 0,5 mg / ml x pargilina 10,0 ml x factor de corrección
= 0,5 mg / ml x 10,0 ml x 1,229
= 6.15mg de clorhidrato de pargilina - Combinar 28.43mg desipramina HCl y 6.15mg pargilina HCl en un vaso de 10 ml cilindro graduado, y añadir 8 ml de solución salina estéril (0,9%). Vortex y calor a 45 ° C hasta que la mezcla se disuelve. El pH de la solución de ahora será de alrededor de 3, que si se administra a los ratones causar molestias y complicaciones post-operatorias que implica la función del tracto urinario y gastrointestinal. Añadir gotas de NaOH (1M) hasta que el pH es 7,4. Completar el volumen a 10 ml con solución salina estéril (0,9%), y el vórtice. Sello, fecha y congelar a ~ 80 ° C. Dado que pargilina HCl no es soluble en solución salina a temperatura ambiente, durante todo el período quirúrgico, almacenar la mezcla premedicación en un baño de agua calentada a 37 ° C en la sala de operaciones.
- Soluciones de 6-OHDA debe prepararse inmediatamente antes de la cirugía. El vehículo utilizado para disolver 6-OHDA hidrobromuro (6-OHDA.Br) solución es solución salina estéril (0,9%) solución que contiene ácido ascórbico (0,2%). El ácido ascórbico es necesaria para estabilizar 6-OHDA.Br, ya que evita la oxidación de la 6-OHDA.Br a una forma inactiva. Pesar 0,2 g de ácido ascórbico, a continuación, añadir a un vacío de 1 litro cilindro graduado, de arriba hasta 1 L con solución salina estéril (0,9%) y se agita. Label, la fecha, y se almacena a 80 ° C hasta su utilización.
- Pesar la cantidad apropiada de 6-OHDA.HBr para hacer un 15,0 mg / ml de solución para abastecer cada ratón con 3,0 g. Desde el 6-OHDA.Br es ligero y sensible al calor evitar la exposición a la luz, y el lugar en el hielo antes del pesaje.
Correcto para el peso de la sal de HBr en 6-OHDA.HBr:
MW de 6-OHDA.HBr: 250,09 MW HBr: 79,9 MW de base libre: 170,19
Factor de corrección: 250,09 / 170,19 = 1,47
Por 0,5 ml de solución de pesaje de salida:
= 15,0 mg / ml de 6-OHDA x 0,5 ml x factor de corrección
= 15,0 mg / ml de 6-OHDA x 0,5 ml x 1,47
= 11,03 mg de 6-OHDA.HBr - Pesar 6-OHDA.HBr en un tubo estéril 1,0 ml de cubierta en papel de aluminio, y añadir 0,5 ml de vehículo (solución salina estéril (0,9%), ácido ascórbico 0,02% pH 7,4). Vortex hasta que la mezcla se disuelve, la etiqueta, y el lugar inmediatamente en hielo hasta su uso. Nótese que la solución 6-OHDA debe ser utilizado dentro de aproximadamente 6 horas después de la preparación. Si la solución se vuelve marrón oscuro, ya sea directamente después de la preparación, o durante la cirugía, esto indica que el 6-OHDA.HBr se ha convertido en oxidado, y ya no es una neurotoxina eficaz, por lo que debe ser desechado y se preparó una vez más.
- Para farsa que funciona con los animales, conforman un volumen equivalente de vehículo (solución salina estéril (0,9%), ácido ascórbico 0,02% pH 7,4) a la que los animales con 6-OHDA lesionadas recibirán, y el lugar en un tubo de 1,0 ml de agua estéril envuelta en papel de estaño, la etiqueta y el lugar inmediatamente en hielo hasta su uso.
3. Configuración del aparato quirúrgico
Los instrumentos quirúrgicos deben esterilizarse mediante un autoclave, antes de to cirugía. Entre cada operación, instrumentos quirúrgicos deben esterilizarse en etanol al 95% seguido por calentamiento a 250 ° C durante 2 minutos. Todos los experimentos deben realizarse en conformidad con las directrices de los Comités de atención adecuadas animales de la institución afiliada y el país.
- Limpie todas las superficies y el equipo con alcohol isopropílico antes de configurar el equipo. Use guantes estériles para el manejo de equipos de cirugía limpia.
- Puesta en marcha de una jaula de recuperación del ratón con toallas de papel en la base. Se coloca bajo una lámpara de calentamiento o en la parte superior de una almohadilla caliente.
- Establecer el carro anestesia, asegurando que la entrada de oxígeno está conectado y abierto, y el depósito de isoflurano está completamente llena. Establecer el flujo de oxígeno a 1 l / min, y el isoflurano al 2-4%. Idealmente, habrá dos orificios de salida de la máquina de anestesia para entregar la mezcla de oxígeno isoflurano a una cámara de inducción, así como para el mantenimiento mientras el animal está en el marco estereotáxico.
- Correct montaje del aparato de infusión es fundamental para garantizar las lesiones de éxito, como el aire atrapado o bloqueo en la aguja disminuye el volumen de 6-OHDA infundido en el sitio de la lesión. Montar el aparato de infusión como se demuestra en la figura 1. Rosca una tuerca de metal RN en un lado de la tubería de PEEK (RN compresión kit (accesorio 1/16 pulgadas ª)), seguido por la férula PEEK taza, entonces el manguito de empalme canónica PFA. Orientar a los casquillos de modo que el cono en la canónica férula PFA se deslice hacia la parte de acoplamiento de la taza de PEEK férula. Coloque en el centro de doble enganche pequeña RN (# 1), lo que garantiza la conexión esté firme. En el otro extremo de la doble pequeño acoplador cubo RN insertar la aguja de calibre 33 de la inyección. Pase la aguja a través de una de las tuercas de metal RN y apriete. Asegurarse de que la aguja de calibre 33 se encuentra en un ángulo de 180 ° a la doble pequeño cubo RN acoplador (# 1). En el otro extremo de la tubería de PEEK, hilo una de las tuercas de metal RN seguido por un casquillo de PEEK, entonces el PFA férula. Inserte la tuerca de un metalª casquillo de montaje en una segunda de doble enganche pequeño centro de RN y apretar la conexión. En el otro extremo de un pequeño segundero de doble enganche RN centro (# 2) insertar el luer a los pequeños centro adaptador de RN (adaptador luer), y apretar la conexión.
- A continuación, el aparato de infusión se debe cebar (ver Figura 1). Llene el l 250 y 1,0 l jeringas Hamilton con agua estéril, lo que garantiza que no haya burbujas de aire. Coloque la jeringa 250 l para el adaptador luer y el émbolo de la jeringa 250 l de agua de tal manera que se libera a través de la aguja de calibre 33 de inyección en el otro extremo del tubo. Continuar empujando el agua a través del sistema mientras se tira la jeringa 250 l fuera del adaptador luer, dejando una pequeña gota de agua sobre el extremo del adaptador luer. Presione sobre el émbolo de la jeringa 1,0 l hasta un pequeño cordón de agua se expulsa. Introduzca con cuidado la jeringa 1,0 l en el adaptador luer, asegúrese de que el agua de cuentas en la jeringa 1,0 l se conecta con el agua de grano presentes on el adaptador luer, y completamente insertar la jeringa 1,0 l en el adaptador luer. Asegúrese de que no haya burbujas en el pequeño de doble enganche RN centro.
- Ahora que el sistema está cebada, el aparato de perfusión puede ser asegurada al marco estereotáxico y bomba de infusión. Fijar el pequeño doble RN acoplador cubo con la aguja de calibre 33 de inyección unido al brazo manipulador del marco estereotáxico, entonces sujetar la jeringa 1,0 l de la bomba de perfusión, de tal manera que cuando la bomba de perfusión comienza la jeringa se presiona contra la abrazadera y no puede moverse. Programa de la bomba de infusión para permitir una velocidad de infusión de 0,1 l / min.
4. Unilateral de 6-OHDA lesión de la cirugía
- Treinta minutos antes de las operaciones, peso de cada animal y registrar el peso. Sistémicamente administrar clorhidrato de desipramina (2,5 mg / ml, Sigma Aldrich) y clorhidrato de pargilina (0,5 mg / ml, Sigma Aldrich) (0,9% de solución salina estéril, pH 7,4) a 10 ml / kg por inyección intraperitoneal (ip) a un ratónutilizando una aguja 27G unida a una jeringa de 1 ml. Por ejemplo, un ratón 30,0 g recibiría 300 l de la premedicación. Calentar el disco de la calefacción y colocar este debajo de la oreja y la barra de incisivos. El disco calefacción ayudará a mantener la temperatura del animal durante la cirugía y mantener al animal en una altura ideal para adaptarse a las orejas y los incisivos barras del marco estereotáxico.
- Quince minutos después de la administración de la desipramina HCl y la solución de HCl pargilina, coloque el ratón en una cámara cerrada la anestesia, y anestesiar al animal usar la inhalación de isoflurano (2-3% de O 2). El animal es lo suficientemente anestesiado cuando no muestra respuesta a la pizca de la pata trasera y no reflejo de parpadeo.
- Afeitado de la parte superior de la cabeza del ratón, y aplicar el analgésico lidocaína tópica directamente sobre la piel usando un algodón. Cinco minutos después de la aplicación de lidocaína, esterilizar la cabeza del animal con una solución de Betadine.
- Colocar el animal en un marco estereotáxico adaptado para ratones. En primer lugar colocar al animal en la barras de los incisivos (ajuste de los incisivos de barras: -3,0 a 2,0 mm), con la mascarilla de anestesia se coloca sobre la cara del animal. Ajustar el flujo de oxígeno a 1 l / min, y el isoflurano a 1.5-2%. La barra incisivo debe estar a un nivel relativo a los auriculares de tal manera que la parte superior del cráneo es nivel. Inserte los auriculares (5,0 mm de diámetro). Los auriculares se han insertado correctamente cuando la cabeza es completamente plana, y no se puede mover en cualquier dirección.
- Corte a lo largo de la línea media de la piel en la parte superior de la cabeza del ratón utilizando una hoja de bisturí, y retraer la piel. Secar la superficie del cráneo con una gasa.
- Empujando hacia abajo el émbolo de la jeringa 1,0 l, y colocar la aguja de calibre 33 de inyección en el tubo 1 ml de cubierta en una lámina de estaño que contiene 6-OHDA solución (15 mg / ml). Retrotraer lentamente el émbolo de la jeringa 1,0 l mientras se mantiene la aguja de calibre 33 de inyección sumergida en la solución de 6-OHDA (15 mg / ml).
- Crear una incisión de 1 cm a lo largo de la mitadla línea del cráneo. Avanzar la punta de la aguja de inyección hacia Bregma, dispensar una pequeña cantidad de 6-OHDA solución de la aguja de calibre 33 de inyección para formar una pequeña gota. Lentamente baje la punta de la aguja de inyección a Bregma, cuando el talón toca Bregma detener el avance de la punta de la aguja y registrar estas coordenadas. Retirar la aguja de inyección 2 mm en la dirección dorsal, y se mueven a lo largo de la sutura sagital en una dirección rostral caudal hacia lambda. Avance una pequeña cantidad de 6-OHDA solución de la aguja de calibre 33 de inyección para formar una pequeña gota. Lentamente baje la punta de la aguja de inyección a Lambda, cuando el cordón de contactos Lambda detener el avance de la punta de la aguja y registrar estas coordenadas. El lateral medial (ML), dorsal y ventral (DV) las coordenadas deben ser idénticos para bregma y lambda, si no es así, ajustar la barra de incisivos consecuencia de las coordenadas de AP, y las barras de los oídos de las coordenadas ML. Mover la aguja a las coordenadas AP: -1,2 mm, ML: -1,1 mm con respecto a Bregma de acuerdo con el Atlas del cerebro del ratón en estereotáxica Coordenadas 25. Retirar la aguja, y sin rebabas un agujero en el cráneo con una aguja de calibre 25.
- Volver la aguja de inyección a lo anterior coordenadas, e inserte la aguja a DV:-5mm. Infundir 0,2 l de 6-OHDA o vehículo unilateralmente en el haz prosencéfalo mediana a una velocidad de 0,1 l / min (3 mg totales). Al término de la administración de 6-OHDA o vehículo, deje la aguja en su lugar durante otros cinco minutos para permitir la difusión de distancia del sitio de inyección.
- Lentamente retraer la aguja.
- Cierre de la incisión en el cuero cabelludo con tres puntos de sutura, y entregar 1 ml de solución de Ringer lactato por vía subcutánea (sc).
- Quite el animal del marco estereotáxico, y colocar en la jaula de recuperación hasta que se recupere la conciencia.
5. Cuidado post-operatorio de la 6-OHDA lesionadas animales
- Coloque los animales en jaulas (3 ratones por jaula) y permiten el libre acceso a los alimentos y sugared agua (10 mM). Proporcionar Nutra-gel y KMR (reemplazo de la leche de gato) en envases de alimentos en el suelo de la jaula para estimular el apetito y la motilidad gastrointestinal.
- Inspeccione los ratones al día después de la cirugía durante 2 semanas 24. En cada inspección se debe prestar especial atención a la vigilancia de los animales mediante la evaluación de la capacidad del animal para moverse por la jaula. Ingesta de alimentos y agua desde el período de observación último, así como la presencia y la consistencia de la materia fecal también deben ser observados. Un común complicación postoperatoria es la deshidratación esto es evidente por la retracción lenta del pliegue cutáneo la piel siguiente. Si esto se observa entregar 1 ml de solución de lactato de Ringer sc durante 1 semana o hasta mejorar los síntomas. En el caso de los machos, los genitales deberían ser observados cuidadosamente para el prolapso del pene identificado por enrojecimiento del pene. Si esto ocurre aplicar el gel mucol que el pene del animal afectado, y entregar 1 ml de solución de lactato de Ringer sc durante 1 semanao hasta que los síntomas mejoren.
- Pesar animales diarios para monitorear los cambios en el peso corporal.
- En el caso donde la inyección ip ha causado un pequeño desgarro en el sistema gastrointestinal, infección abdominal puede resultar. Por lo tanto, evaluar la prsence de la infección del abdomen, evidente por distensión abdominal hinchada. Tratar mediante la administración de Baytril en el agua drining durante 3-4 días o hasta mejorar los síntomas.
6. Parkinsoniano evaluación
Para estimar la magnitud de la lesión, la evaluación conductual se llevó a cabo de 14-21 días después de la cirugía con 6-OHDA lesión, cuando la cantidad de agotamiento de la dopamina es máxima y estable 26.
- Después de la inyección intraperitoneal de 0,01 ml / g de solución salina estéril al 0,9%, los ratones en lugar de cilindros de vidrio (11 cm x 9.5 cm) y registrar su actividad con una cámara de vídeo (CG9, Sanyo).
- Observando el video, contar el número de rotaciones completas de 360 ° se realizan tanto en el ipsiversive y contraversive dirección con relación a la lesión.
- Cuanto mayor es el sesgo hacia rotaciones ipsiversive, más parkinsoniano el animal, por lo tanto calcular la proporción de rotaciones ipsiversive como un porcentaje de red (contraversive y ipsiversive) comportamiento rotacional.
7. Determinación del contenido de dopamina en el estriado por HPLC
- Por lo menos 21 días después de la cirugía de la lesión por 6-OHDA, y tras la finalización de los estudios de comportamiento, sacrificar a los ratones por un exceso de dosis de anestesia, y retirar con cuidado el cerebro. Conserve una rebanada de cuerpo estriado (230 m) de cada hemisferio en cada ratón, y coloque inmediatamente después de la congelación de seccionamiento y almacenar a -80 ° C hasta la preparación de las muestras del cuerpo estriado.
- El tampón de muestra de HPLC (0,1 M PCA con 2 mM de glutatión) evita que la dopamina extraído de las muestras estriatales de descomponerse.
Para 100 ml de tampón de muestra:
= 100 ml de grado HPLC H 2 O
= 0,862 ml de PCA (70%) (SIGMa)
= 61,5 mg de glutatión (reducido)
Medir el grado HPLC H 2 O, agregar el PCA, se disuelve el glutatión en la solución, mezclar bien y filtrar. El tampón de la muestra se puede almacenar a 4 ° C durante hasta 1 mes. - Descongele rebanadas estriatales en hielo, a continuación, homogeneizar en tampón de muestra 200 l utilizando un disruptor de células por ultrasonidos (Fisher Sonic, EE.UU.). Mantener las muestras en hielo en todo momento y homogeneizar cada muestra tres veces durante 10 segundos cada uno asegurar que las muestras se deja enfriar entre períodos de homogeneización.
- Ponga a un lado 20 l de cada muestra homogeneizada (almacenar a -80 ° C) durante un ensayo de la proteína.
- Centrifugar las muestras (20.800 xg, 20 minutos (4 ° C, Eppendorf 58 - 04R, EE.UU.)), a continuación, separar el sobrenadante y filtrar con un 0,2 micras membrana de PVDF (Pall, Cat #: 1935-28143-310) y congelar a -80 ° C hasta su análisis por HPLC. Conserve la proteína de pellets como para back-up de la proteína de ensayo.
- Preparación de la fase móvil para la CLAR para ejecutar through la columna de HPLC.
Para 1 l de fase móvil:
60 mM NaH 2 PO 4. H 2 O (monobásico) = 8,27 g
30 mM de ácido cítrico = 5,7 g
0,13 mM de ácido etilendiaminotetraacético (EDTA), sal disódica deshidratar = 48 mg
0,16 mM de sodio dodecil sulfato (SDS) = 45 mg
850 ml de agua grado HPLC (La Calera, Cat #: 8.801-7)
15% v / v de acetonitrilo-190 (pH 3,35) = 150 ml de grado HPLC (Caledon, Cat. #: 1401 a 7)
~ 2 l de 10 M de NaOH (en grado HPLC H2O)
Todos los reactivos deben ser ≥ 99,0% de pureza y de calidad para HPLC siempre que sea posible. El agua y acetonitrilo debe ser de grado HPLC. Fase móvil debe ser utilizado dentro de una semana de preparación. Han dedicado, objetos de vidrio limpios y revuelva bares exclusivamente para la preparación de la fase móvil (un cilindro de vidrio para medir L 1 y al menos 2 frascos de vidrio 1 L). Antes de preparar la fase móvil han dos matraces limpios 1 L preparado, una para hacer la solución en una y para transferirla a durante la filtración y degassing. Permitir la fase móvil a circular a través de la HPLC durante la noche y comprobar que la línea de base es plana antes de su uso. - Medir 700 ml de agua de calidad HPLC en un cilindro de vidrio para medir y disolver el. NaH 2 PO 4. H 2 O, ácido cítrico, EDTA y SDS en lo Llenar el agua a 850 ml.
- Ajustar el pH a 3,35 con 10 M de NaOH, a continuación, agregue el acetonitrilo y mezclar la solución con una barra de teflón recubierto revuelo.
- Ponga una barra de agitación en el segundo frasco limpio y vacío L 1 y filtro de vacío en la fase móvil a través de un 0,22 micras HVLP filtro Millipore: (Cat #: SLGP033RS). Moje el filtro en 85:15 H 2 O / ACN antes de la filtración. Una vez que el móvil está completamente filtró, desgasificar la fase móvil por agitación bajo vacío durante al menos 10 minutos.
- Preparar los estándares contra los cuales se realizará la concentración de dopamina estriatal de las muestras medidas. Las normas se ejecuta a través de la HPLC al principio y al final de cada lote de muestras estriatales. Un 1mg / ml de solución madre de dopamina puede hacerse con antelación y se almacena en 20 ml de alícuotas a -80 ° C. Para preparar la solución madre se disuelven 5 mg dopamina en 5 ml de tampón de muestra (véase más arriba) y se mezcla a fondo. Comienza la preparación de los estándares por los que tomaron 5 l de 1 mg / ml de solución madre, y agregó que a 2,5 ml de tampón de muestra y mezclar a fondo para obtener un mg 2 / ml solución de dopamina.
- Cuatro normas se ejecutan a través de la HPLC para producir una curva de concentración. Para las concentraciones de dopamina son: 100 ng / ml, 50 ng / ml, 25 ng / ml, y 12,5 ng / ml. Con el fin de generar estos cuatro concentraciones de dopamina tomar 10 l de la solución de dopamina 2 g / ml preparada en 7,10). y se agrega a 190 l de tampón de muestra para darle un 100 ng / ml de solución de la dopamina. Siguiendo este realizar una dilución 1:1 de serie del 100 ng / ml de solución de dopamina con tampón de muestra. Basta con tomar 100 l de 100 ng / ml de la dopamina y añadir 100 ml de tampón de muestra y se mezcla para producir 50 ng / ml dopamina, luego tomar la 100l de 50 ng / ml de dopamina y añadir 100 ml de tampón de muestra y se mezcla para producir 25 ng / ml de dopamina y así sucesivamente.
- Para preparar el sistema de HPLC (Waters 1525μ bomba binaria, 717plus Autosampler, simetría C-18 de fase inversa, columna (15 cm x 4,6 mm de diámetro, el tamaño de 5 micras de partículas) (30 ° C), detector electroquímico (ESA Coulochem III) equipado con una célula de doble electrodo analítica (SEC 5011A) y controlado por el software Breeze (Waters)) purga primero el sistema con fase móvil al seleccionar el protocolo de purga en el software de ordenador o siguiendo las instrucciones del fabricante. Este intercambio toda la solución anterior en el sistema de HPLC con fase móvil fresco.
- Establecer los potenciales electroquímicos a 400 mV y -300 mV para los electrodos primero y segundo respectivamente. Después de esto, se equilibre el sistema mediante la ejecución de por lo menos durante 2 horas y, preferiblemente, durante la noche con la fase móvil a una velocidad de flujo de 1 ml / min. En el equilibrio de las células debe estar encendido y el nuevo inicioADing monitoreado, cuando la lectura se estabiliza el sistema está listo para ser utilizado. Durante la primera hora de la equilibración dejar que la fase móvil que sale del sistema entra en un contenedor desperdicio, siguiendo este puede permitir que la fase móvil para recircular a través del sistema de HPLC poniendo la manguera de salida en el matraz de la fase móvil.
- Descongele muestras estriatales en hielo, a continuación, se inyectan 20 l de cada estándar dopamina seguido por 2 x 20 l de cada muestra y un 20 l de cada estándar dopamina en el sistema de HPLC equilibrada con el caudal de la fase móvil a 1 ml / min.
- Utilizar el software del sistema HPLC para analizar el área de los picos de dopamina producidos por los patrones y las muestras. Comparando el área de los picos de dopamina presentes en las muestras estriatales a la curva de concentración de dopamina estándar identificar la cantidad de dopamina presente en 20 l de cada muestra estriado. Escalar esta cifra hasta encontrar el regalo total de la dopamina en el estriado rebanada entera.
- Perform un ensayo de proteína de de serie en el l 20 de la homogenato de estriatal que usted fija a un lado en 7,4). Esto le medir la cantidad de proteína presente en las muestras estriatales en mg / ml de. A partir de este calcular la cantidad de la dopamina en las muestras de estriatales como un valor en ng / mg de lo que permite que usted pueda comparar las concentraciones de dopamina entre hemisferios y entre los ratones.
8. Los resultados representativos
Quince a veinte uno días después de la cirugía 6-OHDA-lesión, cuando la cantidad de muerte de la célula causada por la neurotoxina ha llegado a completion26, la medición de la tendencia espontánea 360 ° rotaciones de después de la administración de solución salina (ip) 28 se puede utilizar para evaluar el éxito, de 6 de -OHDA-lesionado (Figura 2). Este método de evaluación de la conducta es simple y rápido, y evita efectos potenciales de cebado causadas por agentes dopaminérgicas tales como anfetamina o desafíos de apomorfina. Por otra parte, la evaluación de la rotación de espontánea es una predilección por considerar una mejorctor de los animales con <95% la disminución de dopamina en comparación a la prueba de la extremidad anterior de colocación de la pata 27. Al correlacionar los niveles estriatales de dopamina a partir de muestras estriatales (preparado sobre la terminación de los estudios de comportamiento utilizando HPLC) con porcentaje de espontáneos rotaciones ipsiversive en cada animal, hemos encontrado que los animales que presentan un 70% o más rotaciones ipsiversive hacia la lesión 6-OHDA han perdido> 95% de dopamina estriatal (Figura 3) 27. Tras parciales 6-OHDA lesiones inducidas (59,44 ± 17,20) (Figura 3) del haz medial del cerebro anterior, no hubo sesgo de rotación entre las partes frente ipsiversive contraversive en la medición de las rotaciones espontáneas (40,91 ± 8,01) (Figura 2). Así, como se ha encontrado después de 6-OHDA administración al BMF en ratas, es posible hacer que una profunda pérdida de dopaminérgicas nigro-estriatal neuronas, y la administración de solución salina (IP) es un método preciso para la detección de la extensión de 6-OHDA lesión en estos animales.
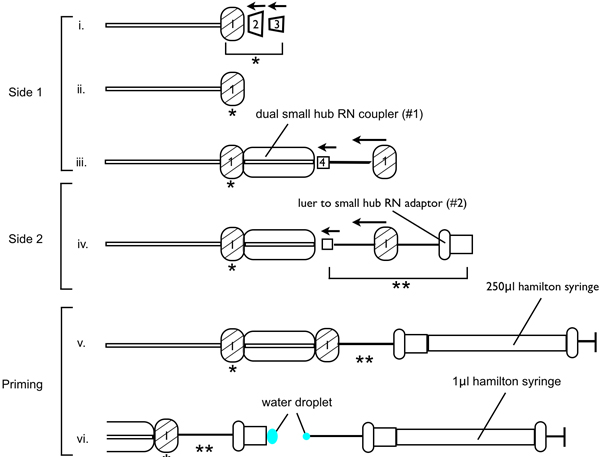
Figura 1. Esquema para demostrar el montaje del aparato de aguja de inyección de 6-OHDA lesión cirugías.
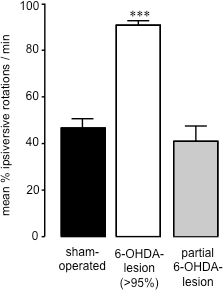
Figura 2. Evaluación del comportamiento de rotación en el simulacro de accionamiento y la 6-OHDA los ratones lesionados. Rotaciones espontáneos en ratones y la farsa que funciona con 6-OHDA lesionado. Los datos se presentan como media porcentuales rotaciones ipsiversive ± SEM, donde contraversive neta y las rotaciones son ipsiversive 100%. Bares abiertos: farsa que funciona con animales, barras grises: 6-OHDA lesionadas animales con> la pérdida de dopamina del 95%, barras negras: los animales que se sometieron a cirugía de 6-OHDA lesión que se lesionó parcialmente. *** P <0,001 en comparación con el simulacro que funcionan con los animales. ANOVA de una vía seguida de la prueba de comparación múltiple de Dunn (s el jamón que funciona: n = 17; 6-OHDA lesionado (> 95%): n = 23; parcial 6-OHDA lesión: n = 3).
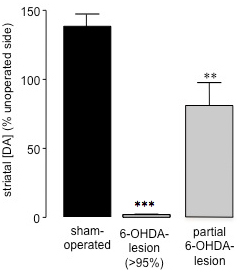
Figura 3. Evaluación de los niveles de dopamina estriatal en simulacro de accionamiento y 6-OHDA ratones lesionados por HPLC. El contenido de dopamina estriatal se determinó en el hemisferio operado y no operado de la farsa y los animales con 6-OHDA lesionadas. Los datos se presentan como media ± SEM de porcentaje de los niveles de dopamina estriatal en el cuerpo estriado no se operan. Bares abiertos: farsa que funciona con animales, barras grises: 6-OHDA lesionadas animales con> la pérdida de dopamina del 95%, barras negras: los animales que se sometieron a cirugía de 6-OHDA lesión que se lesionó parcialmente. *** P <0,001, ** p <0,01 en comparación con el simulacro que funcionan con los animales. ANOVA de una vía seguida de la prueba de comparación múltiple de Dunn (simulacro de accionamiento: n = 17, 6-OHDA lesionado (> 95%): n = 23, parcial de 6-OHDA lesión: n = 3).
EAK ">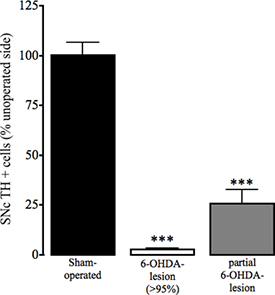
Figura 4. Evaluación de la inmunorreactividad de la tirosina hidroxilasa en el SNC en el simulacro de accionamiento y la 6-OHDA los ratones lesionados. Como marcador de la pérdida de células de la dopamina en la sustancia nigra pars compacta (SNc), la pérdida de la tirosina hidroxilasa (TH) inmunohistoquímica positiva en el hemisferio operado y no operado de la farsa y los animales con 6-OHDA lesionadas se determinó como se describe en Thiele et al. En prensa. Los datos se presentan como media ± SEM de porcentaje de células positivas a TH en el estriado no se operan. Bares abiertos: farsa que funciona con animales, barras grises: 6-OHDA lesionadas animales con> la pérdida de dopamina del 95%, barras negras: los animales que se sometieron a cirugía de 6-OHDA lesión que se lesionó parcialmente. *** P <0,001, ** p <0,01 en comparación con el simulacro que funcionan con los animales. ANOVA de una vía seguida por compañías múltiples de DunnRison prueba (simulacro de accionamiento: n = 17, 6-OHDA lesionado (> 95%): n = 23, parcial de 6-OHDA lesión: n = 3).
Discusión
Este protocolo describe un método para la generación de un modelo estable unilateral ratón 6-OHDA lesionado de la enfermedad de Parkinson, que es extremadamente reproducibles, con una tasa de éxito lesión alta, y una baja tasa de mortalidad. El éxito de la cirugía lesión 6-OHDA se puede estimar fácilmente mediante la medición de comportamiento rotacional espontánea con rotaciones ipsiversive> 70% indicativos de> 95% la disminución de dopamina en el cuerpo estriado lesionado 27. La cuantifica...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el Departamento de Asuntos Exteriores y Comercio Internacional (Gobierno de Canadá), Universidad de Toronto Connaught Fondo, la Fundación Canadiense para la Innovación, NSERC, la Fundación Krembil y la confianza de Parkinson Cure.
Materiales
Nombre del reactivo Empresa Número de catálogo Comentarios (opcional)
| Name | Company | Catalog Number | Comments |
| Desipramina HCl | Sigma-Aldrich, Oakville, ON, Canadá | D125 | 25mg/kg |
| Pargilina HCl | Sigma-Aldrich, Oakville, ON, Canadá | P8013 | 5mg/kg |
| 6-OHDA HBr | Sigma-Aldrich, Oakville, ON, Canadá | H116 | 3 mg / ratón |
| Marco estereotáxica | Kopf Instruments, Tujunga, California, EE.UU. | Modelo 900 | |
| La oreja del ratón tazas | Kopf Instruments, Tujunga, California, EE.UU. | Modelo 921 auriculares Zygoma | |
| Ratón incisivo bar | Kopf Instruments, Tujunga, California, EE.UU. | Modelo 923B | |
| Máscara de ratón de la anestesia | Kopf Instruments, Tujunga, California, EE.UU. | Modelo 923B | |
| Cebado kit (que contiene jeringa 250ml) | Hamilton Company, Reno, NV, EE.UU. | PRMKIT 81120 | |
| RN kit de ajuste de compresión (1 mm) | Hamilton Company, Reno, NV, EE.UU. | 55750-01 | |
| PEEK tubo de RN kit accesorio de compresión< (1/16 ª Pulgadas) | Hamilton Company, Reno, NV, EE.UU. | 55751-01 | |
| De doble núcleo pequeño RN acoplador | Hamilton Company, Reno, NV, EE.UU. | 55752-01 | |
| Luer a los pequeños centro adaptador de RN | Hamilton Company, Reno, NV, EE.UU. | 55753-01 | |
| 1 ml jeringa modelo 25S 7001KH | Hamilton Company, Reno, NV, EE.UU. | 80100 | |
| * 33G extraíble aguja (RN), paquete de 6. . Personalizado 1 pulgadas con 45 <° de bisel | Hamilton Company, Reno, NV, EE.UU. | 7803-05 | |
| Tijeras | Herramientas de Ciencias Bellas, Vancouver, BC, Canadá. | 14084-08 | |
| Bisturí | Herramientas de Ciencias Bellas, Vancouver, BC, Canadá | 10003-12 | |
| Las hojas de bisturí | Herramientas de Ciencias Bellas, Vancouver, BC, Canadá | 10035-20 | |
| Pinza | Herramientas de Ciencias Bellas, Vancouver, BC, Canadá | 11608-15 | |
| Hemostats | Herramientas de Ciencias Bellas, Vancouver, BC, Canadá. | 13004-14 | |
| Isoflurano | Abad | 02241315 | 2-3% |
| Suters (Vicryl 4.0) | Syneture | SS-683 | |
| Esterilizador | Herramientas de Ciencias Bellas, Vancouver, BC, Canadá | 18000-45 | |
| Bomba de Infusión | Aparato de Harvard | Doctorado 22/2000 | |
| Agujas (27 g) | Becton Dickinson | 305109 | |
| Agujas (25 g) | Becton Dickinson | 305127 | |
| Jeringas (1 ml) | BD jeringa | 309692 | |
| Anestesia carro | LEI médica | M2000 | |
| Baytril | CDMV, St. Hyacinthe, Quebec | 102207 | |
| Lidocaína | CDMV, St. Hyacinthe, Quebec | 3914 | |
| Betadine solución | CDMV, St. Hyacinthe, Quebec | 19955 |
Referencias
- Costall, B., Naylor, R. J., Pycock, C. Non-specific supersensitivity of striatal dopamine receptors after 6-hydroxydopamine lesion of the nigrostriatal pathway. Eur. J. Pharmacol. 35, 276-283 (1976).
- Maneuf, Y. P., Mitchell, I. J., Crossman, A. R., Brotchie, J. M. On the role of enkephalin cotransmission in the GABAergic striatal efferents to the globus pallidus. Exp. Neurol. 125, 65-71 (1994).
- Robertson, G. S., Robertson, H. A. Evidence that L-dopa-induced rotational behavior is dependent on both striatal and nigral mechanisms. J. Neurosci. 9, 3326-3331 (1989).
- Ungerstedt, U., Arbuthnott, G. W. Quantitative recording of rotational behavior in rats after 6-hydroxy-dopamine lesions of the nigrostriatal dopamine system. Brain Res. 24, 485-493 (1970).
- Brotchie, J. M. Novel approaches to the symptomatic treatment of parkinsonian syndromes: alternatives and adjuncts to dopamine-replacement. Curr. Opin. Neurol. 10, 340-345 (1997).
- Besson, M. J., Graybiel, A. M., Nastuk, M. A. [3H]SCH 23390 binding to D1 dopamine receptors in the basal ganglia of the cat and primate: delineation of striosomal compartments and pallidal and nigral subdivisions. Neuroscience. 26, 101-119 (1988).
- Gerfen, C. R. D1 and D2 dopamine receptor-regulated gene expression of striatonigral and striatopallidal neurons. Science. 250, 1429-1432 (1990).
- Schiffmann, S. N., Jacobs, O., Vanderhaeghen, J. J. Striatal restricted adenosine A2 receptor (RDC8) is expressed by enkephalin but not by substance P neurons: an in situ hybridization histochemistry study. J. Neurochem. 57, 1062-1067 (1991).
- Hutchison, W. D. Differential neuronal activity in segments of globus pallidus in Parkinson's disease patients. Neuroreport. 5, 1533-1537 (1994).
- Pan, H. S., Penney, J. B., Young, A. B. Gamma-aminobutyric acid and benzodiazepine receptor changes induced by unilateral 6-hydroxydopamine lesions of the medial forebrain bundle. J. Neurochem. 45, 1396-1404 (1985).
- Pan, H. S., Walters, J. R. Unilateral lesion of the nigrostriatal pathway decreases the firing rate and alters the firing pattern of globus pallidus neurons in the rat. Synapse. 2, 650-656 (1988).
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Kreitzer, A. C., Malenka, R. C. Endocannabinoid-mediated rescue of striatal LTD and motor deficits in Parkinson's disease models. Nature. 445, 643-647 (2007).
- Shen, W., Flajolet, M., Greengard, P., Surmeier, D. J. Dichotomous dopaminergic control of striatal synaptic plasticity. Science. 321, 848-851 (2008).
- Lundblad, M., Picconi, B., Lindgren, H., Cenci, M. A. A model of L-DOPA-induced dyskinesia in 6-hydroxydopamine lesioned mice: relation to motor and cellular parameters of nigrostriatal function. Neurobiol. Dis. 16, 110-123 (2004).
- Grealish, S., Mattsson, B., Draxler, P., Bjorklund, A. Characterisation of behavioural and neurodegenerative changes induced by intranigral 6-hydroxydopamine lesions in a mouse model of Parkinson's disease. Eur. J. Neurosci. 31, 2266-2278 (2010).
- Dauer, W., Przedborski, S. Parkinson's disease: mechanisms and models. Neuron. 39, 889-909 (2003).
- Francardo, V. Impact of the lesion procedure on the profiles of motor impairment and molecular responsiveness to L-DOPA in the 6-hydroxydopamine mouse model of Parkinson's disease. Neurobiol. Dis. 42, 327-340 (2011).
- Jakowec, M. W., Petzinger, G. M. 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-lesioned model of parkinson's disease, with emphasis on mice and nonhuman primates. Comp. Med. 54, 497-513 (2004).
- Visanji, N. P., Brotchie, J. M. MPTP-Induced Models of Parkinson's Disease in Mice and Non-Human Primates. Curr. Protoc. Pharmacol. Chapter 5, 42-42 (2005).
- Sedelis, M., Schwarting, R. K., Huston, J. P. Behavioral phenotyping of the MPTP mouse model of Parkinson's disease. Behav. Brain Res. 125, 109-125 (2001).
- Schallert, T., Fleming, S. M., Leasure, J. L., Tillerson, J. L., Bland, S. T. CNS plasticity and assessment of forelimb sensorimotor outcome in unilateral rat models of stroke, cortical ablation, parkinsonism and spinal cord injury. Neuropharmacology. 39, 777-787 (2000).
- Paul, M. L., Currie, R. W., Robertson, H. A. Priming of a D1 dopamine receptor behavioural response is dissociated from striatal immediate-early gene activity. Neuroscience. 66, 347-359 (1995).
- Breese, G. R., Traylor, T. D. Effect of 6-hydroxydopamine on brain norepinephrine and dopamine evidence for selective degeneration of catecholamine neurons. J. Pharmacol Exp. Ther. 174, 413-420 (1970).
- Breese, G. R., Chase, T. N., Kopin, I. J. Metabolism of tyramine-3H and octopamine-3H by rat brain. Biochem. Pharmacol. 18, 863-869 (1969).
- Frankin, K. B. J., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (2008).
- Cornell-Bell, A. H., Finkbeiner, S. M., Cooper, M. S., Smith, S. J. Glutamate induces calcium waves in cultured astrocytes: long-range glial signaling. Science. 247, 470-473 (1990).
- Iancu, R., Mohapel, P., Brundin, P., Paul, G. Behavioral characterization of a unilateral 6-OHDA-lesion model of Parkinson's disease in mice. Behav. Brain Res. 162, 1-10 (2005).
- Tan, Y., Williams, E. A., Lancia, A. J., Zahm, D. S. On the altered expression of tyrosine hydroxylase and calbindin-D 28kD immunoreactivities and viability of neurons in the ventral tegmental area of Tsai following injections of 6-hydroxydopamine in the medial forebrain bundle in the rat. Brain Res. 869, 56-68 (2000).
- Thiele, S. L. Generation of a model of L-DOPA-induced dyskinesia in two different mouse strains. J. Neurosci. Methods. 197, 193-208 (2011).
- Henry, B., Crossman, A. R., Brotchie, J. M. Characterization of a rodent model in which to investigate the molecular and cellular mechanisms underlying the pathophysiology of L-dopa-induced dyskinesia. Adv. Neurol. 78, 53-61 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados