このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
パーキンソン病の単方向、病変6-OHDAモデルマウスの開発
要約
マウスの内側前脳束の片側6-OHDAの病変を行うためのプロトコルが記述されています。このメソッドは、線条体ドーパミンと90.63の> 95%の損失を示す生存動物の89%と低い死亡率(13.3%)±-4.02%病変の側に向かってipsiversive回転バイアスを持っています。
要約
パーキンソン病(PD)の一方的病変6 hyroxydopamine(6-OHDA) - 病変ラットモデルは、それが反復するで観察された大脳基底核回路と薬理学の変化をするので、パーキンソン症状の根底にあるメカニズムの理解を進める上で貴重であることが証明されているパーキンソン病患者の1-4。しかし、大脳基底核の主要な入力領域である線条体、内の出力経路の皮質-線条体シナプスで発生した正確な細胞および分子の変化は、とらえどころのないまま、これはパーキンソン病の症状の根底にある病理学的な異常が3を発生するサイトであると考えられている5。
PDでは、黒質 - 線条体経路の変性後に大脳基底核回路の変化のメカニズムを理解することが大幅に細菌人工染色体(BAC)マウスの開発促進によって駆動される過剰発現緑色蛍光タンパク質によって進められてきたそれらを分離して検討することができます8、:;:2線条体出力経路(EGFP-D2とEGFP-リパーゼA2a、間接的な経路EGFP-D1直接経路)の特定にはサインインしてください。たとえば、最近の研究では、パーキンソン病マウス9,10におけるシナプス可塑性の病理学的変化があることを示唆している。しかし、これらの研究は、若年マウスとパーキンソニズムの急性モデルを利用した。それは安定した6-OHDA病変を有する成人ラットでは説明した変更も、これらのモデルで発生するかどうかは不明である。他のグループが内側前脳束(MFB)をlesioning PDの安定した一方、病変6-OHDAの大人のマウスモデルを生成しようとしています、残念なことに、本研究では死亡率はわずか14%は21の手術を生き残ったと、非常に高かった日以上11。最近の研究は、低死亡率の両方で、イントラ黒質病変を生成したドーパミン作動性ニューロンの> 80%の損失、L-DOPA誘発ジスキネジア11,12,13,14のしかし、式は変数であったこれらの研究インチPDの別の十分に確立されたマウスモデルでは、MPTP-病変マウス15である。このモデルは、潜在的な神経保護剤16の評価に有用であることが証明されたこのモデルは頻繁に運動障害を誘導するために失敗し、病変17の範囲の広い変動を示すように、それは、PDのメカニズムの基礎となる症状を理解するにはあまり適していながら、18 。
ここでは、安定した片側6-OHDA-病変マウス一貫して線条体ドーパミンの> 95%の損失が発生するMFB(HPLCにより測定)に6-OHDAの直接投与によるPDのモデルと同様に、行動を生産を開発しました不均衡はPDのよく特徴付け片側6-OHDA-病変ラットモデルで観察された。 PDは、この新しく開発されたマウスモデルでは、パーキンソン症状の発生のメカニズムを理解する上で貴重なツールを証明します。
プロトコル
1。ハウジングとマウスの準備
- これらのマウスは、純粋なFVBマウスです。食物と水に自由にアクセスしてトランスジェニックマウスの午前12時12時間明暗サイクルで8(変異マウス地域資源センター(MMRRC)FVB駆動細菌人工染色体(BAC)のコロニーを維持し、それはどちらの繁殖目的のために、他の株で、これらのマウスを横断する、または6-OHDA病変の手順の成功を確実にする必要はありません。
- パーキンソン病モデルを生成するために、生後31から42歳の大人のマウス(P31-42)が6-OHDA病変と偽手術が必要になります。
- 感染のリスクを軽減するために、手術前24時間の飲料水にバイトリルを(抗生物質)を管理。
2。手術のための薬剤の調製
デシプラミンとパルギリンの前投薬は通常、選択性とEFFを高めるために6 - ヒドロキシ注入(6-OHDA)前にげっ歯類に投与される6-OHDA誘発性病変のicacy。ノルアドレナリン/ 5HT取り込み阻害薬、デシプラミンは、モノアミン酸化酵素阻害薬に対し、6-OHDA誘発性ノルアドレナリンおよび5HT枯渇22を減少させ、パージリンは、6 -ヒドロキシ31シナプス内訳を減らすことで、6-OHDAにドーパミン端末の感度を向上させます。
- 前投薬(デシプラミン塩酸塩(塩酸)とパージリン塩酸)が大量に作られ、-80℃で使用時まで保存することができます。その日に手術を受ける動物の数は25 mg / kgの各マウスを供給するデシプラミン塩酸の適切な量を量る。マウスの低体重は、それが正確に少量を提供することは困難になり、したがって2.5 mg / mlの濃度でデシプラミン塩酸塩を準備し、10ミリリットル/ kgで動物に投与する。化合物の塩成分の重量は、正しい濃度が達成されるように考慮する必要があります。の重量の補正デシプラミン塩酸の分子量(MW):302.84 MW塩酸:遊離塩基の36.46 MW:266.38補正係数:302.84 / 266.38 = 1.137溶液10mlについて:= 2.5mg/mlデシプラミンX 10.0ミリリットルXデシプラミン塩酸塩の塩酸塩補正係数デシプラミン塩酸塩= 2.5mg/ml X 10.0ミリリットルX 1.137 = 28.43mg
- その日に手術を受けた動物の数を5mg/kgを、各マウスを供給するパージリン塩酸の適切な量を量る。上記のような化合物の塩成分を補正する。マウスの低体重は、それが正確に少量を提供することは困難になり、したがっては0.5 mg / mlの濃度でパージリン塩酸塩を準備し、10ミリリットル/ kgで動物に投与する。
パージリン塩酸塩の塩酸塩の重量を修正します。
パージリン塩酸MW:195.69 MWのHCl:36.46
遊離塩基の分子量:159.23補正係数:195.69 / 159.23 = 1.229
溶液10mlに対してより重量:<BR /> = 0.5 mg / mlのパージリンX 10.0ミリリットルxの補正係数
= 0.5 mg / mlのX 10.0ミリリットルX 1.229
パージリン塩酸= 6.15mg - 10mlのガラスに28.43mgデシプラミンHClおよび6.15mgパージリン塩酸を組み合わせるシリンダー、8 mlの滅菌生理食塩水(0.9%)を追加します。 45渦と熱°C混合物が溶解するまで。溶液のpHは尿および消化管機能を伴う不快感や術後の合併症を引き起こすかどうマウスに投与され、3時ごろになります。 pHが7.4になるまでのNaOH(1M)の滴を追加します。滅菌生理食塩水(0.9%)、ボルテックスで10ミリリットルまで音量を上げてトップ。 〜80℃でラベル、日付、凍結パルギリンHClを室温で生理食塩水に溶解しないことを考えれば、手術期間中、°C手術室で37に加熱した水浴中で投薬混合物を保管してください。
- 6-OHDAのソリューションは、すぐに手術前に準備する必要があります。 6-OHDA臭化水素酸塩(6を溶解するために使用される車両-OHDA.Br)ソリューションは、滅菌生理食塩水(0.9%)を含む溶液アスコルビン酸(0.2%)である。それが非アクティブなフォームに、6 OHDA.Brの酸化を防止するため、アスコルビン酸、6 - OHDA.Brを安定させるために必要とされる。空の1 Lに追加し、アスコルビン酸の0.2グラムを量り、メスシリンダー、滅菌生理食塩水で1 L(0.9%)までの上部とかき混ぜる。 〜80°Cでラベル、日付、および店舗必要になるまで。
- 3.0μgの各マウスを供給するために15.0 mg / mlの溶液を作るために6 OHDA.HBrの適切な量を量る。 6 OHDA.Brは、光と熱であるため、敏感な計量する前に氷の上で光、場所への暴露を避けることができます。
6 OHDA.HBrでHBr塩の重量を修正します。
6 OHDA.HBrのMW:250.09 MWのHBr:遊離塩基の79.9 MW:170.19
補正係数:250.09 / 170.19 = 1.47
溶液0.5mlが出量る場合:
= 15.0 mg / mlの6-OHDA×0.5 ml用×補正係数
= 15.0 mg / mlの6-OHDA×0.5 ml用×1.47
6 OHDA.HBrの= 11.03 mgの - (pH7.4の0.02%滅菌生理食塩水(0.9%)、アスコルビン酸)、アルミ箔で覆われ、滅菌1.0mlのチューブに6 OHDA.HBrを量り、0.5 mlの車両を追加します。渦混合物が溶解するまで、ラベル、およびすぐに使用するまで氷上に静置。 6-OHDA溶液は調製後約6時間以内に使用しなければならないことに注意してください。ソリューションが直接準備した後、または手術中にどちらかの暗褐色になった場合、これは6-OHDA.HBrは酸化となっていることを示し、もはや効果的な神経毒ではないので、破棄され、再度準備する必要があります。
- 偽手術動物のために、車両と同等の容積(滅菌生理食塩水(0.9%)、アスコルビン酸0.02%pH 7.4)に6-OHDA-病変の動物が受け取るものにを構成し、包まれた1.0ミリリットル滅菌チューブ内の場所スズ箔、ラベルと場所ですぐに使用するまで氷の上。
3。外科手術装置を設定する
手術器具は、オートクレーブの前にtを用いて滅菌する必要がありますoの手術。各操作の間に、手術器具は250に加熱し、続いて95%エタノールで滅菌しなければならない2分間°C。全ての実験は、所属機関、国の適切な動物ケア委員会のガイドラインに従って実行する必要があります。
- 前の機器の設定にイソプロピルアルコールを持つすべての表面や機器を清掃します。きれいな手術機器を取り扱う際には滅菌手袋を着用してください。
- ベース上にペーパータオルでマウス·リカバリ·ケージを設定します。加熱ランプの下または加熱されたパッドの上に置きます。
- 酸素流入が接続され、オープンされていることを確認、麻酔トロリーを設定し、イソフルラン貯水池が完全にいっぱいです。 1 L /分、2から4パーセントにイソフルランに酸素流量を設定します。理想的には動物が定位フレームにある間に誘導室にだけでなく、メンテナンスのために酸素イソフルラン混合物を提供するために麻酔のマシンから2流出ポートが存在します。
- 共同注入装置のアセンブリは、成功した病変を確保するために重要である閉じ込められた空気またはブロックされた針のように病変部位に注入された6-OHDAの量を減らしrrect。図1に示すように注入装置を組み立てる。 PEEKチューブの一方の側へスレッド1 RN金属ナット(RN圧縮キット(フィッティング1/16インチ ))の場合、PEEKカップフェルール、標準的なPFAフェルールが続く。オリエント正規PFAフェルール上にコーンはPEEKカップは、フェルールの接合部にスリップするように、フェルール。接続を確保するデュアル小さなハブRNカプラー(#1)に場所がきついです。デュアル小型のハブRNカプラのもう一方の端に33ゲージの注射針を挿入します。 RN金属ナット締めのいずれかを介して針に糸を通す。 33ゲージの針は、デュアル小さなハブRNカプラー(#1)〜180°の角度であることを確認します。 PEEKチューブのもう一方の端では、RNの金属ナットのスレッド1は、PFAフェルールその後、PEEK製のフェルールが続く。金属製のナットを挿入します。ndは2つ目のデュアル小さなハブRNカプラーにアセンブリをフェルールとの接続を締めます。第二小デュアルRNハブカプラ(#2)のもう一方の端にある小さなハブRNアダプタ(ルアーアダプタ)にルアーを挿入し、接続を締めます。
- 次の注入装置は、(図1を参照)プライミングする必要があります。に気泡がないことを確認、250μlの滅菌水1.0μLハミルトンシリンジを満たします。ルアーアダプタに250μlのシリンジを取り付け、水がチューブのもう一方の端に33ゲージの注射針を介して放出されるよう250μlのシリンジのプランジャーを押し下げる。ルアーアダプターの端にビーズの小さな水を残して、ルアーアダプタ250μlのシリンジを引き出しながら、システムを介して水を押し続けます。小さな水のビーズが排出されるまで、1.0μLシリンジのプランジャーを押し下げます。慎重にルアーアダプタに1.0μLシリンジを挿入して、1.0μLシリンジでビーズ水がビーズ現在のOに接続していることを確認してくださいnのルアーアダプタ、および完全にルアーアダプタに1.0μLシリンジを挿入します。小さな二重のRNハブカプラには気泡がないことを確認します。
- 今すぐシステムをプライミングされていることを、灌流装置は、定位フレームと輸液ポンプに固定することができます。定位フレームのマニピュレータアームに取り付けられた33ゲージの注射針で小さなデュアルRNハブカプラーをクランプし、灌流ポンプ〜1.0μLシリンジを固定し、シリンジクランプに押し付けられるような血流ポンプの開始時にすることとすることはできません移動します。プログラム輸液ポンプを0.1μL/ minの注入速度を可能にする。
4。片側6-OHDA病変の手術
- 操作の前に三十分は、各動物の重さと重量を記録します。全身1マウスに腹腔内注射で10 ml / kgの(IP)でデシプラミン塩酸塩(2.5 mg / mlの、シグマアルドリッチ社)とパージリン塩酸塩(0.5 mg / mlと、シグマアルドリッチ)(0.9%滅菌生理食塩水、pH7.4)を管理1ミリリットル注射器に接続されている27グラムの針を使用します。たとえば、30.0グラムのマウスには、前投薬の300μlを受け取ることになります。加熱ディスクをウォームアップと耳と歯バーの下にこれを配置します。加熱ディスクは、手術中に動物の温度を維持し、定位フレームの耳と歯のバーに合わせて理想的な高さで動物を維持するのに役立ちます。
- デシプラミン塩酸とパージリンHCl溶液の投与後十五分、閉鎖麻酔チャンバー内にマウスを置くと、イソフルラン吸入(O 2 2-3%)を用いて動物をanesthetise。それは後肢のピンチとブリンクなし反射への応答を示していないときに動物が十分にanesthetisedです。
- マウスの頭の上を剃る、綿ウールを使用して、皮膚に直接リドカイン局所鎮痛剤を適用します。リドカインアプリケーションの次の5つの分、betadineソリューションと動物の頭を滅菌する。
- マウスに適合した定位フレームに動物を配置。動物の顔の上に置か麻酔マスクを使用して:第一門歯バー(-3.0〜2.0ミリメートル切歯バーの設定)に動物を配置します。 1 L /分、百分の1.5から2にイソフルランに酸素流量を調整します。切歯バーは頭蓋骨のトップレベルであるようにイヤーカップとの相対レベルであるべきである。イヤーカップ(直径5.0ミリメートル)を挿入します。イヤーカップは、ヘッドが完全に平坦であるときに正しく挿入されており、どちらの方向に移動することはできません。
- 手術用メスの刃を使用して、マウスの頭の上に皮膚の正中線に沿って切断し、皮膚を撤回。ガーゼを使用して、頭蓋骨の表面を乾燥させます。
- 1.0μLシリンジのプランジャーを押し下げ、および6-OHDA溶液(15 mg / ml)を含むスズ箔で覆われた1 mlのチューブに33ゲージの注射針を配置します。 6-OHDA溶液(15 mg / ml)を浸漬し33ゲージの注射針を維持しながら、1.0μLシリンジのプランジャーをゆっくりと後ろに引く。
- 中旬に沿って1cmの切開を作成します。頭蓋骨のライン。ブレグマに向かって注射針の先端を進める、小さなビーズを形成するために、33ゲージの注射針から6-OHDA溶液の少量を分注する。ゆっくりブレグマに注射針の先端を下げたときにビーズタッチはブレグマは、針の先端を進んで停止し、これらの座標を記録します。背側方向に注射針2ミリメートルを撤回し、ラムダに向かって吻側尾側方向に矢状縫合に沿って移動します。小さなビーズを形成するために、33ゲージの注射針から6-OHDA溶液の少量を進めています。ゆっくりビーズコンタクトラムダは針の先端を進めて停止し、これらの座標を記録ラムダへの注射針の先端を下げます。それらがない場合は、内側(ML)側面と、背腹(DV)座標は、ブレグマとラムダのために同一である必要があり、APの座標、およびML座標の耳バーのためにそれに応じて切歯バーを調整します。座標APに針を移動させる:-1.2ミリメートル、ML:BREG相対-1.1ミリメートル定位座標25のマウスの脳アトラスによればミリアンペア。針を撤回し、バリ25ゲージ針を用いて頭蓋骨に穴。
- 座標上に注射針を返し、DVに針を挿入し、5ミリメートル。 0.1μL/分(3μgの合計)の速度で一方的に内側前脳束に6-OHDAまたは車両の0.2μlを注入する。 6-OHDAまたはビヒクルの投与が完了すると、離れて注射部位からの拡散を可能にするために、さらに5分間の場所に針を残します。
- 徐々に針を撤回。
- 3縫合糸を使用して頭皮に切開を閉じて、皮下(sc)乳酸リンゲル液の1ミリリットルを提供します。
- 意識が回復するまで回復ケージの定位フレーム、場所から動物を削除します。
5。 6-OHDA-病変動物の術後ケア
- 場所ケージ内の動物(3匹/ケージ)および飲食sugareへの無料アクセスを許可するdの水(10 mM)を。食欲と消化管運動を促進するためのケージの床の上に食品容器でニュートラ - ゲル法とKMR(子猫ミルクの交換)を提供します。
- 2週間24手術後、毎日マウスを検査します。各検査に特別な注意がケージ内を移動する動物の能力を評価することによって、動物の警戒を払うべきである。最後の観察期間と同様に、糞便の存在との整合性からの食糧や水の摂取量も観察する必要があります。一般的な術後合併症は、これが皮膚の次のスキンピンチの遅い収縮によって明白である脱水です。これが観察されている場合は1週間乳酸リンゲル液SCの1ミリリットルを配信したり、症状が改善するまで。雄動物の場合には、性器は慎重にペニスの赤みによって識別された陰茎の脱出を観察する必要があります。この問題が発生した場合、影響を受けた動物の陰茎にmucolゲルを適用し、1週間乳酸リンゲル液SCの1ミリリットルを提供または症状まで改善されます。
- 体重の変化を監視するために毎日の動物の重量を量る。
- 腹腔内注射は、消化器系の小さな涙の原因となった場合には、腹部の感染が発生する可能性があります。したがって、腫れて膨らんだ腹部によって明らかに腹部の感染prsenceのために評価する。 3-4日のためにdrining水のバイトリルを投与することによって、治療したり、症状が改善するまで。
6。パーキンソン病の評価
病変の程度を推定するために、行動の評価は、ドーパミン枯渇量は26、最大と安定しているとき、6-OHDA病変手術後14-21日行われた。
- 0.01ミリリットル/ gの0.9パーセント滅菌生理食塩水の腹腔内注射後、場所のガラスシリンダーのマウス(11センチメートル×9.5 cm)とは、ビデオカメラ(CG9、三洋)を使用して、彼らの活動を記録します。
- ビデオを見て、ipsiversiveとcontrav両方で行われた完全な360°の回転数を数える病変の相対ersive方向。
- ipsiversive回転に向かって大きなバイアス、より多くのパーキンソン病の動物は、こうしてネット(contraversiveとipsiversive)の回転動作のパーセンテージとしてipsiversive回転の割合を計算します。
7。 HPLCによる線条体ドーパミン含有量の測定
- 6-OHDA病変の手術後少なくとも21日、行動研究の完了時に、麻酔の過剰投与により、マウスを犠牲にし、慎重に脳を削除します。各マウスの各半球から線条体の1つのスライス(230μm)を保持し、-80℃で切片と店舗°Cを線条体試料の調製まで、直後にフリーズをはめ込みます。
- HPLCサンプルバッファー(2 mMのグルタチオンと0.1 M PCA)はブレークダウンから線条体サンプルから抽出されたドーパミンを防ぐことができます。
サンプル緩衝液を100mlの場合:
= 100ミリリットルHPLCグレードH 2 O
= 0.862ミリリットルPCA(70%)(SIGM1)
= 61.5 mgのグルタチオン(還元)
HPLCグレードH 2 Oを測定し、PCAを追加し、溶液中のグルタチオンを溶解し、よく、フィルタ混ぜる。サンプルバッファーは、最大1ヶ月に4℃で保存することができます。 - 氷の上に線条体スライスを解凍し、超音波細胞破砕機(フィッシャーソニック、米国)を使用して、200μlのサンプル緩衝液中で均質化。すべての回で氷の上に試料を保持し、10秒ごとにサンプルが均質化期間の間冷却するために許可されていることを確保するため、各サンプルを三回均質化。
- タンパク質アッセイのための各均質化したサンプルの20μl(-80℃保存)を脇に置きます。
- サンプルを遠心分離(20800×gで20分間(4℃、エッペンドルフ58 - 04R、米国))の場合、0.2μmのPVDF膜(ポール、カタログ番号:1935-28143-310)を介して上清とフィルタを削除し、で凍結HPLC分析に供するまで-80°C。バックアップタンパク質アッセイと同様にタンパク質ペレットを保持します。
- THRを実行するためのHPLC用移動相の調製HPLCカラムウワーッ。
移動相1Lの場合:
60mMののNaH 2 PO 4·H 2 O(塩基性)= 8.27グラム
30mMのクエン酸= 5.7グラム
0.13 mMのエチレンジアミン四酢酸(EDTA)二ナトリウム塩= 48 mgを脱水
0.16 mMのドデシル硫酸ナトリウム(SDS)= 45 mgの
850ミリリットルHPLCグレードの水(カレドン、カタログ番号:8801から7まで)
15%v / vのアセトニトリル-190液(pH 3.35)= 150ミリリットルHPLCグレード(カレドン、カタログ番号:1401から7まで)
10 M NaOHを〜2μL(HPLCグレード水)で
すべての試薬は、可能な限り≥99.0%純粋およびHPLCグレードの必要があります。水とアセトニトリルはHPLCグレードでなければなりません。移動相は、準備の一週間以内に使用する必要があります。専用の、きれいなガラス製品を持っており、もっぱら移動相(1リットルのガラスメスシリンダーと、少なくとも2 1リットルのガラスフラスコ)の調製のための棒をかき混ぜる。移動相を準備する前に濾過し、degassi中にそれを転送する準備を2つのクリーンな1 Lフラスコに溶液を作るための1および1を持っているNG。移動相は一晩HPLCを介して循環し、ベースラインを使用する前にフラットであることを確認することができます。 - ガラスメスシリンダーにHPLCグレードの水700ミリリットルを測定するとのNaH 2 PO 4を溶解させる。その中にH 2 O、クエン酸、EDTAおよびSDS。 850ミリリットルに水を補充。
- 10 M NaOHを用いて3.35にpHを調整し、アセトニトリルを追加し、テフロン被覆攪拌棒を使用してソリューションを混ぜる。
- (カタログ番号:SLGP033RS秒)きれいで、空の1Lフラスコと真空0.22μmのHVLPミリポアフィルターを介してそこに移動相をフィルタリングするに攪拌棒を入れてください。ろ過する前に、85:15 H 2 O / ACNでフィルターを濡らす。かつて携帯電話は完全に脱気は、少なくとも10分間、真空下で攪拌することにより、移動相フィルタ処理されます。
- 線条体サンプルのドーパミン濃度が測定される対象となる基準を準備します。基準は、線条体サンプルの各バッチの開始時と終了時にHPLCを介して実行されています。 1ドーパミンのmg / mlのストック溶液を、事前に行われ、-80℃で20μlのアリコートに格納することができ℃のストック溶液を調製するために、5 mlのサンプルバッファーで5 mgのドーパミンを溶解する(上記参照)と徹底的にそれを混ぜる。 2.5mlのサンプルバッファーに追加し、2μg/ mlのドーパミン溶液を得るために徹底的にそれを混合し、1 mg / mlストック溶液5μlを取ることによって、基準の準備を開始。
- 四基準は濃度曲線を生成するためにHPLCを介して実行されています。ドーパミンの濃度は100 ng / mlで、50 ng / mlの25 ng / mlで、12.5 ng / mlの。生成するために、ドーパミンのこれらの4つの濃度は7.10で製造した2μg/ mlのドーパミン溶液)10μlを取る。とあなたに100 ng / mlのドーパミン溶液を得たサンプルバッファー190μlにそれを追加します。この次のサンプルバッファーで100 ng / mlのドーパミン溶液を1:1の段階希釈を行います。単純に100 ng / mlのドーパミンの100μlを取り、50 ng / mlのドーパミンを生成するためにサンプルバッファーと混合液100μlを追加し、100を取る50 ng / mlのドーパミンおよび25 ng / mlのドーパミンなどを生産するためにサンプルバッファーと混合液100μlを追加μlの。
- HPLCシステム(Waters社1525μバイナリポンプ、717plusオートサンプラ、対称C-18逆相カラム(15センチ×内径4.6 mm、5μmの粒子サイズ)(30°C)を調製し、電気化学検出器(ESA Coulochem III)が装備デュアル電極分析セル(ESA 5011A)とし、Breezeのソフトウェア(ウォーターズ))最初のパージコンピュータソフトウェアのパージプロトコルを選択するか、製造元の指示に従って、移動相を備えたシステムによって制御されます。新鮮な移動相でのHPLCシステムでは、この交流は、以前のすべてのソリューションを提供します。
- 400 mVの、それぞれ第1および第2の電極のために-300 mVで電気化学ポテンシャルを設定します。この後、少なくとも2時間のためにそれを実行し、1ml /分の流量で移動相を持つ理想的には一晩でシステムを平衡化します。平衡中の細胞がオンになっていて、ベースラインの再なければならない読書は、システムが使用する準備ができ安定した時、監視ading。平衡の最初の時間に終了し、システムがこれは移動相が移動相のフラスコに入れ、出口ホースを置くことによって、HPLCシステムを介して循環させることができます以下、無駄コンテナに入ることを、移動相はしましょう。
- 氷の上で線条体のサンプルを解凍し、1ミリリットル/分で移動相の流速で平衡化したHPLCシステムに、各サンプルの2×20μlを、それぞれのドーパミン標準のさらに20μlのに続いて各ドーパミン標準液20μlを注入します。
- スタンダードとサンプルによって生成されたドーパミンピークの面積を分析するHPLCシステムソフトウェアを使用しています。標準のドーパミン濃度曲線に線条体試料中に存在するドーパミンピークの面積を比較すると、それぞれの線条体サンプルの20μlにおけるドーパミンの量を識別します。全体の線条体スライスの合計ドーパミンの存在を見つけるために、この図をスケールアップ。
- Pあなたは)7.4に保管しておいた線条体ホモジネートを20μlの上に標準的なタンパク質アッセイをerform。これはmg / mlの線条体試料中に存在するタンパク質の量を測定します。このことから、あなたは半球間とマウスの間にドーパミンの濃度を比較することができます/ NG MGの値として線条体サンプル中のドーパミンの量を計算します。
8。代表的な結果
神経毒によって引き起こされる細胞死の量はcompletion26に達した6-OHDA病変手術後に15〜21日、生理食塩水(IP)28の投与後に自発的な360°回転の測定は、6の成功を評価するために使用することができます(図2)-OHDA-病変。行動評価のこの方法は、簡単かつ迅速であり、そのようなアンフェタミンやアポモルフィンの課題として、ドーパミン作動薬によって引き起こされる潜在的なプライミング効果を回避することができます。さらに、自発的な回転の評価は、より良いprediです。前肢の足の配置テスト27に比べて<95%のドーパミンの枯渇を持つ動物のctor。各動物の自発ipsiversiveの回転の割合で線条体サンプル(HPLCを用いた行動研究の完了時に調製した)から線条体ドーパミンレベルを相関させることによって、我々は6-OHDAの病変に向かって70%以上ipsiversive回転を示す動物が失われたことを発見した> 95パーセント線条体ドーパミン(図3)27。自発的な回転を(40.91±8.01)(図2)測定時に内側前脳束の部分的な6-OHDA誘発性病変(59.44±17.20)(図3)に続いて、何回転バイアスipsiversive対contraversive側との間ではありませんでした。ラットにおけるMFBに6-OHDA投与後発見されたようにこのように、それはドーパミン作動性黒質 - 線条体ニューロンの深刻な損失を引き起こすことが可能であり、生理食塩水投与(IP)は6-OHの程度をスクリーニングするための正確な方法です。これらの動物におけるDAの病変。
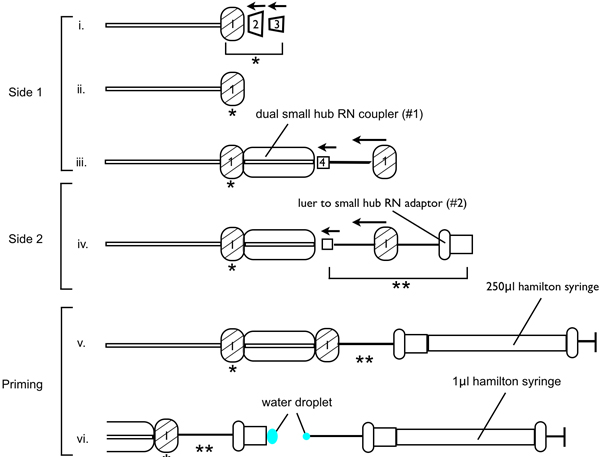
図1 6-OHDA病変手術のために注射針装置の組立を説明するための模式図。
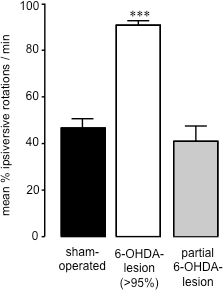
図2偽手術および6-OHDA病変マウスの回転動作の評価。偽手術および6-OHDA-病変マウスの自発的回転。データは平均パーセンテージipsiversive回転±ネットcontraversiveとipsiversive回転が100%であるSEM、として表示されます。オープンバー:偽手術動物;グレーバー:> 95%のドーパミンの損失と6-OHDA-病変動物、黒いバー:部分的に損傷された6-OHDA病変手術を受けた動物。 *** P <0.001偽手術動物に比べて。一方向ANOVAは、ダンの多重比較検定(sが続くハム·運営:N = 17、6-OHDA-病変(> 95%):N = 23;部分6-OHDA病変:n = 3)で。
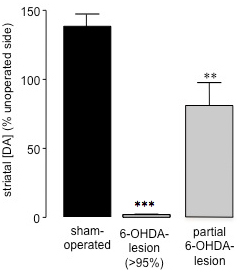
図3 HPLCを用いて偽手術における線条体ドーパミンのレベルと6-OHDA病変マウスの評価。線条体ドーパミンのコンテンツは、偽と6-OHDA-病変動物の作動と運転されていない半球で決定された。データは平均パーセンテージ±運転されていない線条体の線条体ドーパミンレベルのSEMとして表示されます。オープンバー:偽手術動物;グレーバー:> 95%のドーパミンの損失と6-OHDA-病変動物、黒いバー:部分的に損傷された6-OHDA病変手術を受けた動物。 *** P <0.001、** P <0.01偽手術動物に比べて。一方向ANOVAは、ダンの多重比較検定に続いて(偽手術:N = 17、6-OHDA-病変(> 95%):N = 23、部分的に6-OHDA病変:n = 3)で。
EAK ">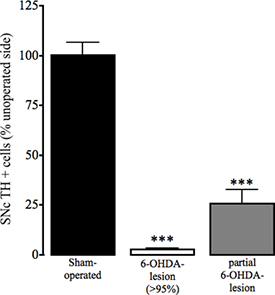
図4:偽手術および6-OHDA病変マウスのSNCにおけるチロシン水酸化酵素免疫反応性の評価。シールらで説明したようにドーパミン細胞の黒質緻密部(SNC)の損失、偽と6-OHDA-病変動物の作動と運転されていない半球におけるチロシン水酸化酵素の損失(TH)陽性immunohistochemistyのマーカーとして決定した。キーを押します。データは平均パーセンテージ±運転されていない線条体におけるTH陽性細胞のSEMとして表示されます。オープンバー:偽手術動物;グレーバー:> 95%のドーパミンの損失と6-OHDA-病変動物、黒いバー:部分的に損傷された6-OHDA病変手術を受けた動物。 *** P <0.001、** P <0.01偽手術動物に比べて。一方向ANOVAは、ダンの複数のCOMPA続くrison試験(偽手術:N = 17、6-OHDA-病変(> 95%):N = 23、部分的に6-OHDA病変:n = 3)で。
ディスカッション
このプロトコルは高い病変成功率、低死亡率で、非常に再現性があるパーキンソン病の安定した片側6-OHDA-病変マウスモデル生成のための方法を説明します。 6-OHDA病変の手術の成功は容易に病変線条体27の> 95%のドーパミンの枯渇を示す> 70%ipsiversive回転と自発的な回転動作を測定することにより推定することができます。それが線条体ドーパミンレベル28の直接測定を?...
開示事項
著者らは、開示することは何もありません。
謝辞
この作品は、外務国際貿易(カナダ政府)、トロント大学のコンノート·ファンド、イノベーション、NSERC、Krembil財団と硬化、パーキンソンの信頼のためのカナダの財団の部門によってサポートされていました。
資料
名前会社概要カタログ番号コメント(オプション) PEEKチューブ< (1/16 THインチ)
| Name | Company | Catalog Number | Comments |
| デシプラミン塩酸 | Sigma-Aldrichは、オークビル、ON、カナダ | D125 | 25mg/kg |
| パージリン塩酸 | Sigma-Aldrichは、オークビル、ON、カナダ | P8013 | 5mg/kgを |
| 6-OHDAのHBr | Sigma-Aldrichは、オークビル、ON、カナダ | H116 | 3mgの/マウス |
| 定位フレーム | Kopfは楽器、タハンガ、CA、アメリカ合衆国 | モデル900 | |
| マウスの耳カップ | Kopfは楽器、タハンガ、CA、アメリカ合衆国 | モデル921頬骨のイヤーカップ | |
| マウス切歯バー | Kopfは楽器、タハンガ、CA、アメリカ合衆国 | モデル923B | |
| マウス麻酔マスク | Kopfは楽器、タハンガ、CA、アメリカ合衆国 | モデル923B | |
| プライミングキット(250ミリリットル注射器を含む) | ハミルトン社、リノ、ネバダ州、アメリカ合衆国 | PRMKIT 81120 | |
| RN圧縮フィッティングキット(1ミリメートル) | ハミルトン社、リノ、ネバダ州、アメリカ合衆国 | 55750から01 | |
| ハミルトン社、リノ、ネバダ州、アメリカ合衆国 | 55751から01 | ||
| デュアル小さなハブRNカプラ | ハミルトン社、リノ、ネバダ州、アメリカ合衆国 | 55752から01 | |
| 小さなハブRNアダプタにルアー | ハミルトン社、リノ、ネバダ州、アメリカ合衆国 | 55753から01 | |
| 1ミリリットル25Sシリンジモデル7001KH | ハミルトン社、リノ、ネバダ州、アメリカ合衆国 | 80100 | |
| * 6の33Gニードル(RN)パック。 。 45 <°のベベルを使用してカスタム1インチ | ハミルトン社、リノ、ネバダ州、アメリカ合衆国 | 7803から05 | |
| はさみ | ファイン科学ツール、バンクーバー、BC、カナダ。 | 14084から08 | |
| メス | ファイン科学ツール、バンクーバー、BC、カナダ | 10003から12 | |
| メスの刃 | ファイン科学ツール、バンクーバー、BC、カナダ | 10035から20 | |
| Forcep | ファイン科学ツール、バンクーバー、BC、カナダ | 11608から15 | |
| Hemostats | ファイン科学ツール、バンクーバー、BC、カナダ。 | 13004から14 | |
| イソフルラン | アボット | 02241315 | 百分の2から3 |
| Suters(Vicryl 4.0) | Syneture | SS-683 | |
| 滅菌器 | ファイン科学ツール、バンクーバー、BC、カナダ | 18000から45 | |
| 輸液ポンプ | ハーバード装置 | 博士2000分の22 | |
| 針(27G) | ベクトン·ディッキンソン | 305109 | |
| 針(25G) | ベクトン·ディッキンソン | 305127 | |
| シリンジ(1ミリリットル) | BDシリンジ | 309692 | |
| 麻酔トロリー | LEI医療 | M2000 | |
| バイトリル | CDMV、セント·ヒヤシンス物語、QC | 102207 | |
| リドカイン | CDMV、セント·ヒヤシンス物語、QC | 3914 | |
| Betadineソリューション | CDMV、セント·ヒヤシンス物語、QC | 19955 |
参考文献
- Costall, B., Naylor, R. J., Pycock, C. Non-specific supersensitivity of striatal dopamine receptors after 6-hydroxydopamine lesion of the nigrostriatal pathway. Eur. J. Pharmacol. 35, 276-283 (1976).
- Maneuf, Y. P., Mitchell, I. J., Crossman, A. R., Brotchie, J. M. On the role of enkephalin cotransmission in the GABAergic striatal efferents to the globus pallidus. Exp. Neurol. 125, 65-71 (1994).
- Robertson, G. S., Robertson, H. A. Evidence that L-dopa-induced rotational behavior is dependent on both striatal and nigral mechanisms. J. Neurosci. 9, 3326-3331 (1989).
- Ungerstedt, U., Arbuthnott, G. W. Quantitative recording of rotational behavior in rats after 6-hydroxy-dopamine lesions of the nigrostriatal dopamine system. Brain Res. 24, 485-493 (1970).
- Brotchie, J. M. Novel approaches to the symptomatic treatment of parkinsonian syndromes: alternatives and adjuncts to dopamine-replacement. Curr. Opin. Neurol. 10, 340-345 (1997).
- Besson, M. J., Graybiel, A. M., Nastuk, M. A. [3H]SCH 23390 binding to D1 dopamine receptors in the basal ganglia of the cat and primate: delineation of striosomal compartments and pallidal and nigral subdivisions. Neuroscience. 26, 101-119 (1988).
- Gerfen, C. R. D1 and D2 dopamine receptor-regulated gene expression of striatonigral and striatopallidal neurons. Science. 250, 1429-1432 (1990).
- Schiffmann, S. N., Jacobs, O., Vanderhaeghen, J. J. Striatal restricted adenosine A2 receptor (RDC8) is expressed by enkephalin but not by substance P neurons: an in situ hybridization histochemistry study. J. Neurochem. 57, 1062-1067 (1991).
- Hutchison, W. D. Differential neuronal activity in segments of globus pallidus in Parkinson's disease patients. Neuroreport. 5, 1533-1537 (1994).
- Pan, H. S., Penney, J. B., Young, A. B. Gamma-aminobutyric acid and benzodiazepine receptor changes induced by unilateral 6-hydroxydopamine lesions of the medial forebrain bundle. J. Neurochem. 45, 1396-1404 (1985).
- Pan, H. S., Walters, J. R. Unilateral lesion of the nigrostriatal pathway decreases the firing rate and alters the firing pattern of globus pallidus neurons in the rat. Synapse. 2, 650-656 (1988).
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Kreitzer, A. C., Malenka, R. C. Endocannabinoid-mediated rescue of striatal LTD and motor deficits in Parkinson's disease models. Nature. 445, 643-647 (2007).
- Shen, W., Flajolet, M., Greengard, P., Surmeier, D. J. Dichotomous dopaminergic control of striatal synaptic plasticity. Science. 321, 848-851 (2008).
- Lundblad, M., Picconi, B., Lindgren, H., Cenci, M. A. A model of L-DOPA-induced dyskinesia in 6-hydroxydopamine lesioned mice: relation to motor and cellular parameters of nigrostriatal function. Neurobiol. Dis. 16, 110-123 (2004).
- Grealish, S., Mattsson, B., Draxler, P., Bjorklund, A. Characterisation of behavioural and neurodegenerative changes induced by intranigral 6-hydroxydopamine lesions in a mouse model of Parkinson's disease. Eur. J. Neurosci. 31, 2266-2278 (2010).
- Dauer, W., Przedborski, S. Parkinson's disease: mechanisms and models. Neuron. 39, 889-909 (2003).
- Francardo, V. Impact of the lesion procedure on the profiles of motor impairment and molecular responsiveness to L-DOPA in the 6-hydroxydopamine mouse model of Parkinson's disease. Neurobiol. Dis. 42, 327-340 (2011).
- Jakowec, M. W., Petzinger, G. M. 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-lesioned model of parkinson's disease, with emphasis on mice and nonhuman primates. Comp. Med. 54, 497-513 (2004).
- Visanji, N. P., Brotchie, J. M. MPTP-Induced Models of Parkinson's Disease in Mice and Non-Human Primates. Curr. Protoc. Pharmacol. Chapter 5, 42-42 (2005).
- Sedelis, M., Schwarting, R. K., Huston, J. P. Behavioral phenotyping of the MPTP mouse model of Parkinson's disease. Behav. Brain Res. 125, 109-125 (2001).
- Schallert, T., Fleming, S. M., Leasure, J. L., Tillerson, J. L., Bland, S. T. CNS plasticity and assessment of forelimb sensorimotor outcome in unilateral rat models of stroke, cortical ablation, parkinsonism and spinal cord injury. Neuropharmacology. 39, 777-787 (2000).
- Paul, M. L., Currie, R. W., Robertson, H. A. Priming of a D1 dopamine receptor behavioural response is dissociated from striatal immediate-early gene activity. Neuroscience. 66, 347-359 (1995).
- Breese, G. R., Traylor, T. D. Effect of 6-hydroxydopamine on brain norepinephrine and dopamine evidence for selective degeneration of catecholamine neurons. J. Pharmacol Exp. Ther. 174, 413-420 (1970).
- Breese, G. R., Chase, T. N., Kopin, I. J. Metabolism of tyramine-3H and octopamine-3H by rat brain. Biochem. Pharmacol. 18, 863-869 (1969).
- Frankin, K. B. J., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (2008).
- Cornell-Bell, A. H., Finkbeiner, S. M., Cooper, M. S., Smith, S. J. Glutamate induces calcium waves in cultured astrocytes: long-range glial signaling. Science. 247, 470-473 (1990).
- Iancu, R., Mohapel, P., Brundin, P., Paul, G. Behavioral characterization of a unilateral 6-OHDA-lesion model of Parkinson's disease in mice. Behav. Brain Res. 162, 1-10 (2005).
- Tan, Y., Williams, E. A., Lancia, A. J., Zahm, D. S. On the altered expression of tyrosine hydroxylase and calbindin-D 28kD immunoreactivities and viability of neurons in the ventral tegmental area of Tsai following injections of 6-hydroxydopamine in the medial forebrain bundle in the rat. Brain Res. 869, 56-68 (2000).
- Thiele, S. L. Generation of a model of L-DOPA-induced dyskinesia in two different mouse strains. J. Neurosci. Methods. 197, 193-208 (2011).
- Henry, B., Crossman, A. R., Brotchie, J. M. Characterization of a rodent model in which to investigate the molecular and cellular mechanisms underlying the pathophysiology of L-dopa-induced dyskinesia. Adv. Neurol. 78, 53-61 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved