È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sviluppo di un unilateralmente lesionata 6-OHDA modello murino della malattia di Parkinson
In questo articolo
Riepilogo
Un protocollo per l'esecuzione unilaterale 6-OHDA lesioni del fascio proencefalo mediale è descritto nei topi. Questo metodo ha un basso tasso di mortalità (13,3%) con l'89% degli animali sopravvissuti mostrano una perdita> 95% della dopamina striatale e di 90,63 ± -4,02% pregiudizi ipsiversive rotazione verso il lato della lesione.
Abstract
Il unilateralmente lesionata 6-hyroxydopamine (6-OHDA)-lesionato modello murino della malattia di Parkinson (PD) si è rivelato prezioso per avanzare la nostra comprensione dei meccanismi alla base dei sintomi parkinsoniani, poiché essa ricapitola i cambiamenti nei circuiti dei gangli della base e farmacologia osservata in pazienti parkinsoniani 1-4. Tuttavia, le modifiche precise cellulari e molecolari che si verificano a cortico-striatali sinapsi delle vie di uscita all'interno del corpo striato, che è la zona di ingresso principale dei gangli basali rimanere sfuggente, e questo è ritenuto sito dove alterazioni patologiche sottostanti presentano sintomi parkinsoniani 3 , 5.
Nel PD, la comprensione dei meccanismi alla base di cambiamenti nella degenerazione dei gangli basali circuito seguente del nigro-striatale è stata notevolmente migliorata con lo sviluppo del cromosoma batterico artificiale (BAC) in topi che esprimono proteine fluorescenti verdi guidati da promuovere8, consentendo loro di essere valutati singolarmente:;: specifico per le due vie di uscita striatali (eGFP-D2 e eGFP-A2a via indiretta EGFP-D1 diretta via) rs. Ad esempio, studi recenti hanno suggerito che ci sono cambiamenti patologici nella plasticità sinaptica in topi parkinsoniani 9,10. Tuttavia, questi studi hanno utilizzato topi giovani e modelli acuti di parkinsonismo. Non è chiaro se le modifiche descritte in ratti adulti con stabili 6-OHDA lesioni si verificano anche in questi modelli. Altri gruppi hanno tentato di generare una stabile lesionato unilateralmente-6-OHDA modello di topo adulto del PD da parte la lesione del fascio mediale del proencefalo (MFB), purtroppo, il tasso di mortalità in questo studio è estremamente elevata, con solo il 14% sopravvive l'intervento chirurgico per il 21 11 giorni o più. Studi più recenti hanno generato intra-nigral lesioni sia con un tasso di mortalità bassa perdita> 80% dei neuroni dopaminergici, ma espressione di L-DOPA discinesia indotta da 11,12,13,14 era variabilein questi studi. Un altro modello di topo ben definito del PD è l'MPTP-leso il mouse 15. Anche se questo modello si è dimostrato utile nella valutazione dei potenziali agenti neuroprotettivi 16, è meno adatto per la comprensione dei meccanismi alla base dei sintomi del morbo di Parkinson, in quanto questo modello spesso non riesce a indurre deficit motori, e mostra una grande variabilità nella misura di lesione 17, 18 .
Qui abbiamo sviluppato una stabile unilaterale 6-OHDA lesionato modello murino di PD mediante somministrazione diretta di 6-OHDA nella MFB, che causa la perdita costante> 95% della dopamina striatale (come misurato mediante HPLC), oltre a produrre il comportamento squilibri osservati nel ben caratterizzati unilaterale 6-OHDA-lesionato modello di ratto PD. Questo modello murino di recente sviluppo del PD si rivelerà un prezioso strumento per la comprensione dei meccanismi alla base della generazione dei sintomi parkinsoniani.
Protocollo
1. Housing e preparazione di topi
- Mantenere una colonia di cromosoma artificiale batterico (BAC) guidato topi transgenici 8 (Mutant mouse Regional Resource Center (MMRRC) FVB in una 12:12 h ciclo luce-buio con libero accesso a cibo e acqua. Questi topi sono topi FVB puri, e non è necessario attraversare questi topi con qualsiasi altro ceppo, sia ai fini della riproduzione, o per assicurare il successo del 6-OHDA procedura lesione.
- Al fine di generare un modello parkinsoniano, topi adulti di età compresa tra 31-42 giorni dopo la nascita (P31-42) sono necessari per interventi chirurgici 6-OHDA e sham-lesione.
- Per ridurre il rischio di infezione, somministrare Baytril (antibiotico) nell'acqua da bere per 24 ore prima dell'intervento.
2. Preparazione di farmaci per la chirurgia
Una premedicazione di desipramina e pargilina è generalmente somministrato a roditori prima dell'iniezione di 6-idrossidopamina (6-OHDA) per aumentare la selettività e efficacy di 6-OHDA lesioni indotte. La noradrenalina / 5HT inibitore della captazione, desipramina diminuisce 6-OHDA indotta da noradrenalina e della 5HT esaurimento 22, mentre l'inibitore della monoamino ossidasi, pargilina aumenta la sensibilità dei terminali dopaminergici a 6-OHDA, riduce la distruzione extrasinaptica di 6-idrossidopamina 31.
- La premedicazione (desipramina cloridrato (HCl) e pargilina HCl) può essere effettuato in grandi volumi e conservati a -80 ° C fino all'utilizzo. Pesare la quantità appropriata di desipramina HCl fornire ciascun topo con 25 mg / kg per il numero di animali che riceverà la chirurgia in quel giorno. Il basso peso del mouse rende difficile fornire piccoli volumi accuratamente, quindi preparare desipramina cloridrato ad una concentrazione di 2,5 mg / ml e somministrato all'animale a 10 ml / kg. Il peso del componente sale del composto deve essere rappresentato in modo tale che la corretta concentrazione si ottiene. Correzione per il peso delSale HCl in desipramina cloridrato: peso molecolare (MW) di desipramina HCl: 302,84 MW HCl: 36,46 MW di base libera: 266,38 Fattore di correzione: 302,84 / 266,38 = 1,137 per 10 ml di soluzione: x = 2.5mg/ml desipramina x 10.0ml Fattore di correzione = 2.5mg/ml x 10.0ml x 1,137 = 28.43mg di cloridrato di desipramina
- Pesare la quantità appropriata di pargilina HCl fornire ciascun topo con 5mg/kg per il numero di animali ricevere chirurgia quel giorno. Corretta per il componente sale del composto come descritto sopra. Il basso peso del mouse rende difficile fornire piccoli volumi accuratamente, quindi preparare cloridrato pargilina ad una concentrazione di 0,5 mg / ml e somministrare all'animale a 10 ml / kg.
Per correggere il peso del sale di HCl in cloridrato pargilina:
MW di pargilina HCl: MW 195,69 HCl: 36,46
MW di base libera: 159,23 Fattore di correzione: 195,69 / 159,23 = 1,229
Per 10 ml di soluzione, pesare:
= 0,5 mg / ml pargilina x 10,0 ml x Fattore di correzione
= 0,5 mg / ml x 10,0 ml x 1,229
= 6.15mg di cloridrato di pargilina - Combina 28.43mg desipramina HCl e 6.15mg pargilina HCl in un bicchiere da 10 ml cilindro graduato e aggiungere 8 ml di soluzione salina sterile (0,9%). Vortex e calore a 45 ° C fino a quando la miscela viene disciolta. Il pH della soluzione sarà ora a circa il 3, che se somministrato per i topi provocare fastidio e complicazioni post-operatorie coinvolge funzione del tratto urinario e gastrointestinale. Aggiungere gocce di NaOH (1M) fino a quando il pH è 7,4. Rabboccare il volume a 10 ml con soluzione salina sterile (0,9%), e il vortice. Label, data e congelare a ~ 80 ° C. Dato che pargilina HCl non è solubile in soluzione fisiologica a temperatura ambiente, tutto il periodo chirurgico, conservare la miscela premedicazione in un bagno d'acqua riscaldata a 37 ° C in sala operatoria.
- Soluzioni di 6-OHDA deve essere preparata immediatamente prima di interventi chirurgici. Il veicolo usato per sciogliere 6-OHDA bromidrato (6-OHDA.Br) soluzione salina sterile (0,9%) di acido ascorbico soluzione contenente (0,2%). L'acido ascorbico è necessario stabilizzare 6-OHDA.Br, in quanto impedisce l'ossidazione di 6-OHDA.Br in una forma inattiva. Pesare 0,2 g di acido ascorbico, quindi aggiungere ad un vuoto 1 L cilindro graduato, alto fino a 1 L con soluzione salina sterile (0,9%) e mescolare. Label, la data, e conservare a ~ 80 ° C fino al momento.
- Pesare la quantità appropriata di 6-OHDA.HBr per fare un 15,0 mg / ml soluzione per fornire ciascun topo con 3,0 pg. Dal 6-OHDA.Br è leggera e sensibile al calore evitare l'esposizione alla luce, e il luogo in ghiaccio prima della pesatura.
Per correggere il peso del sale HBr in 6-OHDA.HBr:
MW di 6-OHDA.HBr: HBr 250,09 MW: 79,9 MW di base libera: 170,19
Fattore di correzione: 250,09 / 170,19 = 1,47
Per 0,5 ml di soluzione pesare:
= 15,0 mg / ml 6-OHDA x 0,5 ml x Fattore di correzione
= 15,0 mg / ml 6-OHDA x 0,5 x 1,47 ml
= 11,03 mg di 6-OHDA.HBr - Pesare 6-OHDA.HBr in una provetta sterile 1,0 ml ricoperto di carta stagnola, e aggiungere 0,5 ml del veicolo (soluzione salina sterile (0,9%), acido ascorbico 0,02% pH 7,4). Vortex finché il composto è sciolto, etichetta, e posto immediatamente in ghiaccio fino al momento dell'uso. Si noti che il 6-OHDA soluzione deve essere utilizzata entro circa 6 ore dopo la preparazione. Se la soluzione diventa marrone scuro o direttamente dopo la preparazione, o durante l'intervento, questo indica che 6-OHDA.HBr è diventata ossidato, e non è più efficace una neurotossina, quindi deve essere eliminato e preparati nuovamente.
- Per sham-operati animali, costituiscono un volume equivalente di veicolo (soluzione salina sterile (0,9%), acido ascorbico 0,02% pH 7,4) a quello che i 6-OHDA-lesionati animali riceveranno, e posto in una provetta sterile 1,0 ml avvolto nella carta stagnola, etichetta e posto immediatamente in ghiaccio fino al momento dell'uso.
3. Impostare l'apparecchio chirurgico
Strumenti chirurgici devono essere sterilizzati in autoclave utilizzando un t primao chirurgia. Tra ogni operazione, strumenti chirurgici devono essere sterilizzati in etanolo al 95% seguita da riscaldamento a 250 ° C per 2 minuti. Tutti gli esperimenti devono essere eseguiti in conformità con le linee guida delle Commissioni competenti la cura degli animali dell'istituto affiliato e il paese.
- Pulire tutte le superfici e le attrezzature con alcool isopropilico prima di impostare l'apparecchiatura. Indossare guanti sterili quando si maneggiano pulito attrezzature chirurgiche.
- Set-up una gabbia del mouse di recupero con i tovaglioli di carta sulla base. Posizionare sotto una lampada di riscaldamento o sopra un tampone riscaldato.
- Impostare il carrello anestesia, assicurando che l'afflusso di ossigeno è collegato e aperto, e il serbatoio isoflurano è completamente pieno. Impostare il flusso di ossigeno a 1 L / min, e la isoflurano al 2-4%. Idealmente vi saranno due porte di efflusso dalla macchina anestetico per fornire la miscela isoflurano ossigeno ad una camera di induzione, come pure per la manutenzione, mentre l'animale è nel telaio stereotassico.
- CorRect assemblaggio dell'apparecchiatura per infusione è fondamentale per garantire lesioni successo, come l'aria intrappolata o aghi bloccati diminuisce il volume di 6-OHDA infuso nel sito della lesione. Montare l'apparecchiatura per infusione, come mostrato in figura 1. Discussione un dado metallico RN su un lato del tubo PEEK (RN compressione kit (raccordo 1/16 pollici th)), seguita dalla coppa PEEK ghiera, quindi la ghiera canonica PFA. Orientare le boccole in modo che il cono sulla canonica PFA ghiera scivolerà nella parte accoppiamento della coppa PEEK ghiera. Luogo in dual piccolo hub RN accoppiatore (# 1), garantendo la connessione è stretta. Sull'altra estremità della doppia piccolo mozzo RN accoppiatore inserire l'ago di iniezione 33 gauge. Infilare l'ago attraverso uno dei dadi metallici RN e stringerle. Assicurarsi che il 33 gauge è ad un angolo di 180 ° per doppio piccolo mozzo RN accoppiatore (# 1). Sull'altra estremità del tubo PEEK, uno dei dadi filo metallico RN seguita da una boccola PEEK, quindi la ghiera PFA. Inserire il dado in metallo unond ghiera di montaggio in un secondo dual piccolo hub RN accoppiatore e serrare la connessione. All'altra estremità di un secondo piccolo dual RN hub accoppiatore (# 2) inserire l'adattatore luer alle piccole hub RN (adattatore luer), e stringere la connessione.
- Successivamente il dispositivo di infusione deve essere caricato (vedi Figura 1). Riempire il 250 pl e 1,0 pl siringhe Hamilton con acqua sterile, garantendo che non vi siano bolle d'aria. Fissare la siringa 250 microlitri all'adattatore luer e lo stantuffo della siringa 250 microlitri tale che l'acqua viene rilasciata attraverso l'ago di iniezione 33 gauge sull'altra estremità del tubo. Continuare a spingere l'acqua attraverso il sistema tirando la siringa 250 microlitri dal luer, lasciando un piccolo acqua tallone sul fondo del luer. Premere lo stantuffo della siringa 1,0 microlitri fino a quando un piccolo tallone d'acqua viene espulso. Inserire con cautela il 1,0 microlitri siringa all'adattatore luer, assicurarsi che l'acqua tallone sulla siringa 1,0 microlitri si collega con l'acqua tallone presente on l'adattatore luer, e completamente inserire la siringa 1,0 microlitri all'adattatore luer. Assicurarsi che nessun bolle nel piccolo dual accoppiatore RN hub.
- Ora che il sistema è innescato, l'apparato di perfusione può essere fissato al telaio stereotassico e pompa per infusione. Fissare la piccola duplice RN accoppiatore mozzo con l'ago 33 gauge iniezione attaccato al braccio manipolatore del telaio stereotassico, quindi bloccare il 1,0 siringa microlitri alla pompa di perfusione, tale che quando la pompa di perfusione inizia la siringa viene premuto contro la pinza e non può muoversi. Programma la pompa di infusione per consentire una velocità di infusione di 0,1 microlitri / min.
4. Unilaterale 6-OHDA lesione chirurgia
- Trenta minuti prima alle operazioni, pesare ogni animale e registrare il peso. Sistemica somministrare desipramina cloridrato (2,5 mg / ml, Sigma Aldrich) e pargilina cloridrato (0,5 mg / ml, Sigma Aldrich) (0,9% soluzione salina sterile, pH 7,4) a 10 ml / kg per iniezione intraperitoneale (ip) in un topoutilizzando un ago 27g attaccato ad una siringa da 1 ml. Per esempio, un topo 30,0 g riceverebbe 300 pl di premedicazione. Riscaldare il disco riscaldamento e collocare questo sotto l'orecchio e incisivo bar. Il disco riscaldamento aiuta a mantenere la temperatura del animale durante l'intervento chirurgico e tenere l'animale ad un'altezza ideale per adattarsi alle barre auricolari e incisivo del telaio stereotassico.
- Quindici minuti dopo la somministrazione della desipramina HCl e pargilina soluzione di HCl, posizionare il mouse in una camera chiusa anestesia, e anestetizzare l'animale mediante inalazione isoflurano (2-3% in O 2). L'animale è sufficientemente anestetizzati, quando non mostra alcuna risposta a pizzico zampa posteriore e nessun riflesso corneale.
- Shave parte superiore della testa del topo, e applicare l'analgesico topico lidocaina direttamente sulla pelle utilizzando cotone idrofilo. Cinque minuti dopo l 'applicazione lidocaina, sterilizzare la testa dell'animale con betadine.
- Mettete l'animale in una cornice stereotassico adattato per i topi. In primo luogo porre l'animale in bar incisivo (impostazione bar incisivo: -3,0 a +2,0 mm) con la maschera di anestesia posto sopra il volto dell'animale. Regolare il flusso di ossigeno a 1 L / min, e il 1,5-2% di isoflurano. La barra incisivi dovrebbe essere ad un livello relativamente alle coppe tali che la parte superiore del cranio è livello. Inserire le cuffie (diametro 5,0 mm). Le coppe sono state inserite correttamente quando la testa è completamente piatto, e non può essere spostato in entrambe le direzioni.
- Tagliare lungo la linea mediana della pelle sulla parte superiore della testa del topo con un bisturi, e ritrarre la pelle. Essiccare la superficie del cranio con garza.
- Premere stantuffo della siringa 1,0 microlitri, e posizionare il calibro 33 ago di iniezione nel tubo 1 ml rivestita in stagnola contenente 6-OHDA soluzione (15 mg / ml). Tirare lentamente lo stantuffo della siringa 1,0 microlitri mantenendo il 33 ago per iniezioni gauge immerso nella soluzione di 6-OHDA (15 mg / ml).
- Creazione di un 1 centimetro incisione lungo la metàlinea del cranio. Avanzare la punta dell'ago iniezione verso Bregma, erogare una piccola quantità di 6-OHDA soluzione dall'ago 33 gauge iniezione per formare una piccola tallone. Lentamente abbassare la punta dell'ago per iniezione Bregma, quando il tallone tocca Bregma arrestare avanzare la punta dell'ago e registrare queste coordinate. Ritrarre l'ago di iniezione 2 mm in direzione dorsale, e si muovono lungo la sutura sagittale in una direzione rostrale caudale verso lambda. Avanzare una piccola quantità di 6-OHDA soluzione dall'ago 33 gauge iniezione per formare una piccola tallone. Lentamente abbassare la punta dell'ago per iniezione Lambda, quando il tallone contatti Lambda arrestare avanzare la punta dell'ago e registrare queste coordinate. Il laterale mediale (ML), ventrali e dorsali (DV) coordinate dovrebbero essere identiche per Bregma e Lambda, se non lo sono, regolare la barra incisivo di conseguenza per le coordinate AP, e le barre di auricolari per le coordinate ML. Spostare l'ago coordinate AP: -1,2 mm, ML: -1,1 mm rispetto alla Bregma secondo l'Atlante cervello di topo in stereotassico Coordinate 25. Ritrarre l'ago, e radica un foro nel cranio con un ago calibro 25.
- Riportare l'ago per iniezioni a quanto sopra coordinate, e inserire l'ago DV:-5mm. Infondere 0,2 pl di 6-OHDA o veicolo unilateralmente nel fascio proencefalo mediana ad una velocità di 0,1 pl / min (3 totale pg). Al termine della somministrazione di 6-OHDA o di un veicolo, lasciare l'ago in vigore per altri cinque minuti per permettere la diffusione di distanza dal sito di iniezione.
- Lentamente ritirare l'ago.
- Chiudere l 'incisione sul cuoio capelluto con tre punti di sutura, e fornire 1 ml di soluzione di Ringer lattato di via sottocutanea (sc).
- Rimuovere l'animale dal telaio stereotassico, e posto nella gabbia di recupero fino a quando la coscienza è recuperato.
5. Assistenza post-operatoria di 6-OHDA-lesionati animali
- Mettere gli animali in gabbia (3 topi / gabbia) e consentire il libero accesso al cibo e sugared acqua (10 mM). Fornire Nutra-gel e KMR (sostituzione del latte kitten) in contenitori di cibo sul pavimento della gabbia per stimolare l'appetito e la motilità gastrointestinale.
- Ispezionare topi quotidiani post-intervento chirurgico per 2 settimane 24. Ad ogni controllo si dovrebbe prestare particolare attenzione alla vigilanza di sottoprodotti di origine animale valutare la capacità degli animali di muoversi intorno alla gabbia. Assunzione di cibo e acqua dal periodo di osservazione, così come la presenza e la consistenza delle feci Occorre inoltre osservare. Un comune complicanza postoperatoria è la disidratazione questo è evidente dalla retrazione lento del pinch seguenti pelle pelle. Se questo si osserva fornire 1 ml di soluzione di Ringer lattato sc per 1 settimana o fino a quando i sintomi migliorano. In caso di animali di sesso maschile, i genitali devono essere attentamente osservati per prolasso del pene identificato da arrossamento del pene. In questo caso applicare il gel mucol al pene dell'animale infetto, e fornire 1 ml di soluzione di Ringer lattato sc per 1 settimanao fino a quando i sintomi migliorano.
- Pesare gli animali al giorno per monitorare i cambiamenti del peso corporeo.
- Nel caso in cui l'iniezione ip ha causato una piccola rottura nel sistema gastrointestinale, infezione addominale può comportare. Pertanto, valutare per l'prsence di infezione dell'addome, gonfiore evidente distensione addominale. Trattare con la somministrazione di Baytril drining in acqua per 3-4 giorni o fino a quando i sintomi migliorano.
6. Parkinsoniana valutazione
Per stimare l'entità della lesione, la valutazione comportamentale è stata effettuata 14-21 giorni dopo l'intervento 6-OHDA-lesione, quando la quantità di deplezione di dopamina è massimo e stabile 26.
- Dopo l'iniezione ip di 0,01 ml / g di soluzione salina allo 0,9% sterile, topi posto in cilindri di vetro (11 cm x 9,5 cm) e registrare la loro attività utilizzando una videocamera (CG9, Sanyo).
- Guardando il video, contare il numero di rotazioni complete a 360 ° fatte sia nel ipsiversive e contraversive direzione rispetto alla lesione.
- Quanto maggiore è la tendenza verso rotazioni ipsiversive, più parkinsoniano l'animale, in modo da calcolare la percentuale di rotazioni ipsiversive come percentuale di rete (contraversive e ipsiversive) comportamento a rotazione.
7. Determinazione del contenuto di dopamina striatale mediante HPLC
- Almeno 21 giorni dopo la 6-OHDA chirurgia della lesione, e al termine degli studi comportamentali, sacrificare i topi da un eccesso di dose di anestesia, e rimuovere con cura il cervello. Conservare una fetta di striato (230 micron) da ciascun emisfero in ogni mouse, e far scattare freeze subito dopo il sezionamento e conservare a -80 ° C fino alla preparazione dei campioni striatali.
- Il tampone campione HPLC (0,1 M PCA con 2 mM glutatione) impedisce la dopamina estratto dai campioni striatali da abbattere.
Per 100 ml di tampone campione:
= 100 ml HPLC H 2 O
= 0,862 ml PCA (70%) (SIGMa)
= 61,5 mg di glutatione (ridotto)
Misurare il grado HPLC H 2 O, aggiungere il PCA, sciogliere il glutatione nella soluzione, mescolare bene e filtrare. Il tampone campione può essere conservato a 4 ° C per 1 mese. - Scongelare fettine striatali sul ghiaccio, poi omogeneizzare in 200 microlitri tampone campione utilizzando un distruttore delle cellule ad ultrasuoni (Fisher Sonic, USA). I campioni in ghiaccio in ogni momento e omogeneizzare ogni campione tre volte per 10 secondi ciascuna garantire che i campioni sono autorizzati a raffreddare tra i periodi di omogeneizzazione.
- Mettere da parte 20 microlitri di ciascun campione omogeneizzato (conservare a -80 ° C) per un saggio di proteine.
- Centrifugare i campioni (20.800 xg, 20 min (4 ° C, Eppendorf 58 - 04R, USA)), quindi rimuovere il surnatante e filtrare attraverso un 0,2 micron membrana PVDF (Pall, Cat #: 1935-28143-310) e congelare a -80 ° C fino all'analisi HPLC. Conservare la proteina pellet come back-up per il dosaggio di proteine.
- Preparazione della fase mobile per HPLC eseguire through la colonna HPLC.
Per 1 L di fase mobile:
60 mM NaH 2 PO 4. H 2 O (monobasico) = 8,27 g
30 mM di acido citrico = 5,7 g
0,13 mM di acido etilendiamminotetraacetico (EDTA) sale disodico disidratano = 48 mg
0,16 mm dodecil solfato di sodio (SDS) = 45 mg
850 ml di acqua per HPLC (Caledon, Cat #: 8801-7)
15% v / v Acetonitrile-190 (pH 3,35) = 150 ml HPLC (Caledon, Cat #: 1401-7)
~ 2 microlitri di NaOH 10 M (in HPLC H2O)
Tutti i reagenti devono essere ≥ 99,0% puro e di qualità HPLC, ovunque sia possibile. L'acqua e acetonitrile deve essere qualità HPLC. Fase mobile deve essere utilizzato entro una settimana di preparazione. Hanno dedicato, vetro pulito e agitare barre unicamente per la preparazione della fase mobile (un cilindro di vetro 1 L di misura e almeno 2 1 flaconi di vetro L). Prima di preparare la fase mobile hanno due pulita 1 fiaschi L disposta, uno per rendere la soluzione in uno e per trasferire in durante la filtrazione e degassing. Lasciare la fase mobile di circolare attraverso il HPLC notte e verificare che la linea di base è piatto prima dell'uso. - Misurare 700 ml di acqua per HPLC in un cilindro di vetro di misurazione e sciogliere il NaH 2 PO 4. H 2 O, acido citrico, EDTA e SDS in esso. Rabboccare l'acqua a 850 ml.
- Regolare il pH a 3,35 con 10 M NaOH, quindi aggiungere il acetonitrile e mescolare la soluzione con un ancoretta rivestita in Teflon.
- Mettere una barra di agitazione nel secondo parziale, svuotare pallone tarato da 1 L e vuoto filtrare la fase mobile in esso attraverso una HVLP Millipore 0,22 micron filter: (Cat #: SLGP033RS). Bagnare il filtro 85:15 in H 2 O / ACN prima della filtrazione. Una volta che il mobile è completamente filtrati, degassare la fase mobile agitando sotto vuoto per almeno 10 min.
- Preparare le norme contro il quale la concentrazione di dopamina dei campioni striatali verranno misurati. Standards vengono eseguiti attraverso la HPLC all'inizio e alla fine di ogni lotto di campioni striatali. A 1mg / ml soluzione stock di dopamina possono essere realizzati in anticipo e conservato in aliquote di 20 pl a -80 ° C. Per preparare la soluzione madre dopamina sciogliere 5 mg in 5 ml di tampone campione (vedi sopra) e mescolare accuratamente. Iniziare la preparazione degli standard prendendo 5 microlitri di 1 mg / ml di soluzione concentrata, aggiungendolo a 2,5 ml di tampone campione e miscelare accuratamente per ottenere un 2 pg / ml soluzione dopamina.
- Quattro gli standard vengono eseguiti attraverso l'HPLC per produrre una curva di concentrazione. Per le concentrazioni di dopamina sono: 100 ng / ml, 50 ng / ml, 25 ng / ml, e 12,5 ng / ml. Per generare questi quattro concentrazioni di dopamina tener 10 pl del 2 ug / ml soluzione preparata in dopamina 7,10). e aggiungerlo a 190 microlitri di tampone campione per darvi un 100 ng / ml soluzione di dopamina. In seguito a questo esegue una diluizione 1:1 di serie del 100 ng / ml soluzione di dopamina con il tampone del campione. Basta prendere 100 microlitri di 100 ng / ml dopamina e aggiungere 100 microlitri di tampone campione e mix per la produzione di 50 ng / ml dopamina, poi prendere 100pl di 50 ng / ml dopamina e aggiungere 100 pl di tampone campione e mescolare per produrre 25 ng / ml dopamina e così via.
- Per preparare il sistema HPLC, (Binary Waters 1525μ pompa, autocampionatore 717plus, Symmetry C-18 colonna a fase inversa (15 cm x 4,6 mm id, 5 pm dimensione particellare) (30 ° C), rivelatore elettrochimico (SEC Coulochem III) dotato con una cella a doppio elettrodo analitica (ESA 5011A) e controllato da software Breeze (Waters)) prima di spurgo del sistema con la fase mobile selezionando il protocollo di spurgo nel software oppure seguendo le istruzioni del produttore. Questo scambio di tutte le soluzioni precedenti nel sistema HPLC fresca fase mobile.
- Impostare il potenziale elettrochimico a 400 mV e -300 mV per i primi e secondi elettrodi, rispettivamente. Successivamente, equilibrare il sistema di funzionamento a vuoto per almeno 2 ore e preferibilmente per tutta la notte con la fase mobile ad una portata di 1 ml / min. Durante equilibramento delle cellule deve essere acceso e il re basaleading monitorati, quando la lettura diventa stabile il sistema è pronto per essere utilizzato. Per la prima ora di equilibrazione lasciare che la fase mobile che esce dal sistema di entrare in un contenitore waster, seguendo questo è possibile consentire la fase mobile attraverso il sistema di ricircolo HPLC mettendo il tubo di mandata nel pallone fase mobile.
- Scongelare campioni striatali su ghiaccio, poi iniettare 20 pl di ciascuno standard dopamina seguita da 2 x 20 microlitri di ciascun campione e di un ulteriore 20 pl di ciascuna norma di dopamina nel sistema HPLC equilibrata con la tariffa mobile flusso della fase a 1 ml / min.
- Utilizzare il software di sistema HPLC per analizzare l'area dei picchi dopamina prodotti dai campioni e standard. Confrontando l'area dei picchi dopamina presenti nei campioni striatali della curva standard concentrazione dopamina identificare la quantità di dopamina presente in 20 pl di ciascun campione striatale. Scalare questa cifra fino a trovare il totale presente dopamina in tutta la fetta striatale.
- Perform un test standard di proteina presente sulla pl 20 di omogenato striatale che mettere da parte in 7.4). Questo misurare la quantità di proteine presenti nei campioni striatali in mg / ml. Da questo calcolare la quantità di dopamina nei campioni striatali come un valore in ng / mg che consente di confrontare le concentrazioni di dopamina tra emisferi e tra i topi.
8. Risultati rappresentativi
Quindici a ventuno giorni dopo l'intervento 6-OHDA-lesione, quando la quantità di morte cellulare causata dalla neurotossina ha raggiunto completion26, misurazione di 360 ° rotazioni spontanee seguito della somministrazione di soluzione fisiologica (ip) 28 può essere utilizzato per valutare il successo di 6 -OHDA-lesionata (Figura 2). Questo metodo di valutazione comportamentale è semplice e veloce, ed evita gli effetti di priming potenziali causati da sostanze dopaminergiche come l'anfetamina o sfide apomorfina. Inoltre, la valutazione rotazione spontanea è un predicato migliorector di animali con 27. Correlando livelli di dopamina striatali da campioni striatali (preparato al termine degli studi comportamentali mediante HPLC) con percentuale di rotazioni spontanee ipsiversive in ciascun animale, abbiamo trovato che gli animali che presentano 70% o più rotazioni ipsiversive verso il 6-OHDA lesione hanno perso> 95% dopamina striatale (Figura 3) 27. Dopo parziali 6-OHDA lesioni indotte (59,44 ± 17,20) (Figura 3) del fascio proencefalo mediale, non vi era alcuna polarizzazione rotazione tra ipsiversive rispetto lati contraversive quando si misura rotazioni spontanee (40,91 ± 8,01) (Figura 2). Così, come è stato trovato in seguito 6-OHDA somministrazione al MFB nei ratti, è possibile causare una perdita profonda di dopaminergici nigro-striatali neuroni, e soluzione salina somministrazione (ip) è un metodo accurato per lo screening della portata di 6-OHDA lesione in questi animali.
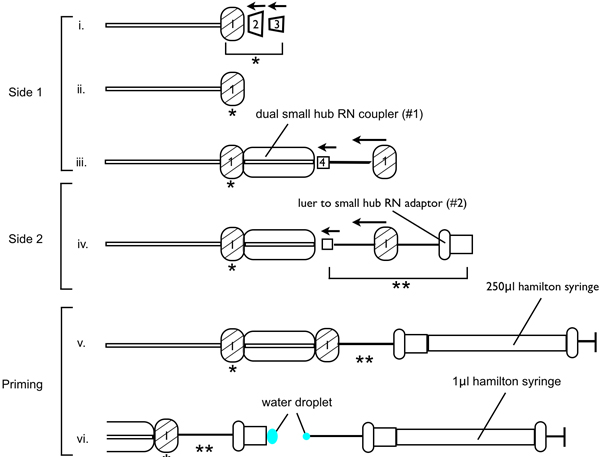
Figura 1. Schema di dimostrare assemblaggio dell'apparecchiatura ago per iniezione per 6-OHDA lesione interventi chirurgici.
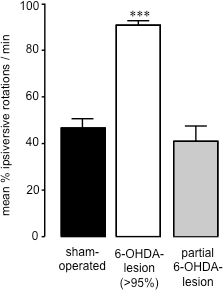
Figura 2. Valutazione del comportamento rotazionale in sham-operati e 6-OHDA topi lesionati. Rotazioni spontanee nei topi sham-operati e 6-OHDA-leso. I dati sono presentati come rotazioni medi percentuali ipsiversive ± SEM, dove netto contraversive e rotazioni ipsiversive sono 100%. Bar aperti: sham-operati animali; bar grigio: 6-OHDA-lesionati animali con> perdita di dopamina 95%; barre nere: animali sottoposti a chirurgia 6-OHDA-lesione che sono stati parzialmente lesionata. *** P <0.001 rispetto a sham-operati animali. One-way ANOVA seguita dal test di confronto multiplo Dunn (s prosciutto a comando: n = 17; 6-OHDA-lesionato (> 95%): n = 23; parziale 6-OHDA della lesione: n = 3).
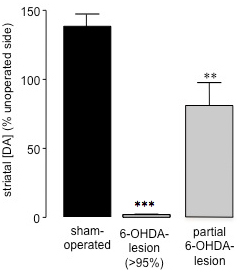
Figura 3. Valutazione dei livelli di dopamina striatale in sham-operati e 6-OHDA topi lesionati mediante HPLC. Contenuto di dopamina striatale è stato determinato nell'emisfero operato e non operato di Sham e 6-OHDA-lesionati animali. I dati sono presentati come media ± SEM percentuale dei livelli di dopamina nel corpo striato striatali non operato. Bar aperti: sham-operati animali; bar grigio: 6-OHDA-lesionati animali con> perdita di dopamina 95%; barre nere: animali sottoposti a chirurgia 6-OHDA-lesione che sono stati parzialmente lesionata. *** P <0.001, ** P <0.01 rispetto al sham-operati animali. One-way ANOVA seguita dal test di confronto multiplo di Dunn (sham-operati: n = 17, 6-OHDA-lesionato (> 95%): n = 23, 6-OHDA parziale della lesione: n = 3).
Eak ">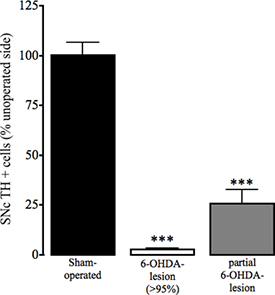
Figura 4. Valutazione della immunoreattività tirosina idrossilasi nel SNC in sham-operati e 6-OHDA topi lesionati. Come un marker di perdita di cellule della dopamina nella substantia nigra pars compacta (SNC), perdita di tirosina idrossilasi (TH) immunohistochemisty positiva nell'emisfero operato e non operato di Sham e 6-OHDA-lesionati animali è stata determinata come descritto in Thiele et al. In Press. I dati sono presentati come media ± SEM percentuale di cellule positive TH nello striato operati. Bar aperti: sham-operati animali; bar grigio: 6-OHDA-lesionati animali con> perdita di dopamina 95%; barre nere: animali sottoposti a chirurgia 6-OHDA-lesione che sono stati parzialmente lesionata. *** P <0.001, ** P <0.01 rispetto al sham-operati animali. One-way ANOVA seguita da Dunn più aziendeRison test (sham-operati: n = 17, 6-OHDA-lesionato (> 95%): n = 23, 6-OHDA parziale della lesione: n = 3).
Discussione
Questo protocollo descrive un metodo per la generazione di uno stabile unilaterale 6-OHDA lesionato modello murino della malattia di Parkinson, che è estremamente riproducibile, con un'elevata percentuale di successo lesione, e un tasso di mortalità basso. Il successo di 6-OHDA chirurgia lesione può essere facilmente stimata misurando spontaneo comportamento a rotazione con rotazioni ipsiversive> 70 sulla indicativi di> deplezione dopamina 95% in lesionato striato 27. Quantificazione dei livelli ...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal Ministero degli Affari Esteri e del Commercio internazionale (Governo del Canada), University of Toronto Connaught Fondo, la Fondazione canadese per l'innovazione, NSERC, la Fondazione Krembil and Trust di Parkinson Cure.
Materiali
del reagente Azienda Numero di catalogo Commenti (opzionale)
| Name | Company | Catalog Number | Comments |
| Desipramina HCl | Sigma-Aldrich, Oakville, ON, Canada | D125 | 25mg/kg |
| Pargilina HCl | Sigma-Aldrich, Oakville, ON, Canada | P8013 | 5mg/kg |
| 6-OHDA HBr | Sigma-Aldrich, Oakville, ON, Canada | H116 | 3 mg / mouse |
| Frame stereotassico | Kopf Instruments, Tujunga, CA, USA | Modello 900 | |
| Il mouse orecchio tazze | Kopf Instruments, Tujunga, CA, USA | Modello 921 coppe Zygoma | |
| Il mouse incisivo bar | Kopf Instruments, Tujunga, CA, USA | Modello 923B | |
| Il mouse anestesia maschera | Kopf Instruments, Tujunga, CA, USA | Modello 923B | |
| Kit di adescamento (siringa contenente 250 ml) | Hamilton Company, Reno, NV, USA | PRMKIT 81120 | |
| RN raccordo a compressione kit (1 mm) | Hamilton Company, Reno, NV, USA | 55750-01 | |
| Tubi PEEK dalla RN kit raccordo a compressione< (1/16 ° Pollici) | Hamilton Company, Reno, NV, USA | 55751-01 | |
| Dual piccolo hub RN Coupler | Hamilton Company, Reno, NV, USA | 55752-01 | |
| Luer ai piccoli hub RN adattatore | Hamilton Company, Reno, NV, USA | 55753-01 | |
| 1 ml siringa modello 25S 7001KH | Hamilton Company, Reno, NV, USA | 80.100 | |
| * 33G ago fisso (RN) confezione da 6. . Custom 1 pollice con 45 <° smusso | Hamilton Company, Reno, NV, USA | 7803-05 | |
| Forbici | Strumenti Scienza Belle, Vancouver, BC, Canada. | 14084-08 | |
| Scalpel | Strumenti Scienza Arti, Vancouver, BC, Canada | 10003-12 | |
| Lame di bisturi | Strumenti Scienza Arti, Vancouver, BC, Canada | 10035-20 | |
| Pinza | Strumenti Scienza Arti, Vancouver, BC, Canada | 11608-15 | |
| Hemostats | Strumenti Scienza Belle, Vancouver, BC, Canada. | 13004-14 | |
| Isoflurano | Abbot | 02241315 | 2-3% |
| Suters (Vicryl 4,0) | Syneture | SS-683 | |
| Sterilizzatore | Strumenti Scienza Arti, Vancouver, BC, Canada | 18000-45 | |
| Infusion Pump | Harvard Apparatus | Dottorato di Ricerca 22/2000 | |
| Aghi (27G) | Becton Dickinson | 305.109 | |
| Aghi (25G) | Becton Dickinson | 305.127 | |
| Siringhe (1 ml) | BD siringa | 309.692 | |
| Anestesia Carrello | LEI medica | M2000 | |
| Baytril | CDMV, St. Hyacinthe, QC | 102.207 | |
| Lidocaina | CDMV, St. Hyacinthe, QC | 3914 | |
| Betadine soluzione | CDMV, St. Hyacinthe, QC | 19.955 |
Riferimenti
- Costall, B., Naylor, R. J., Pycock, C. Non-specific supersensitivity of striatal dopamine receptors after 6-hydroxydopamine lesion of the nigrostriatal pathway. Eur. J. Pharmacol. 35, 276-283 (1976).
- Maneuf, Y. P., Mitchell, I. J., Crossman, A. R., Brotchie, J. M. On the role of enkephalin cotransmission in the GABAergic striatal efferents to the globus pallidus. Exp. Neurol. 125, 65-71 (1994).
- Robertson, G. S., Robertson, H. A. Evidence that L-dopa-induced rotational behavior is dependent on both striatal and nigral mechanisms. J. Neurosci. 9, 3326-3331 (1989).
- Ungerstedt, U., Arbuthnott, G. W. Quantitative recording of rotational behavior in rats after 6-hydroxy-dopamine lesions of the nigrostriatal dopamine system. Brain Res. 24, 485-493 (1970).
- Brotchie, J. M. Novel approaches to the symptomatic treatment of parkinsonian syndromes: alternatives and adjuncts to dopamine-replacement. Curr. Opin. Neurol. 10, 340-345 (1997).
- Besson, M. J., Graybiel, A. M., Nastuk, M. A. [3H]SCH 23390 binding to D1 dopamine receptors in the basal ganglia of the cat and primate: delineation of striosomal compartments and pallidal and nigral subdivisions. Neuroscience. 26, 101-119 (1988).
- Gerfen, C. R. D1 and D2 dopamine receptor-regulated gene expression of striatonigral and striatopallidal neurons. Science. 250, 1429-1432 (1990).
- Schiffmann, S. N., Jacobs, O., Vanderhaeghen, J. J. Striatal restricted adenosine A2 receptor (RDC8) is expressed by enkephalin but not by substance P neurons: an in situ hybridization histochemistry study. J. Neurochem. 57, 1062-1067 (1991).
- Hutchison, W. D. Differential neuronal activity in segments of globus pallidus in Parkinson's disease patients. Neuroreport. 5, 1533-1537 (1994).
- Pan, H. S., Penney, J. B., Young, A. B. Gamma-aminobutyric acid and benzodiazepine receptor changes induced by unilateral 6-hydroxydopamine lesions of the medial forebrain bundle. J. Neurochem. 45, 1396-1404 (1985).
- Pan, H. S., Walters, J. R. Unilateral lesion of the nigrostriatal pathway decreases the firing rate and alters the firing pattern of globus pallidus neurons in the rat. Synapse. 2, 650-656 (1988).
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Kreitzer, A. C., Malenka, R. C. Endocannabinoid-mediated rescue of striatal LTD and motor deficits in Parkinson's disease models. Nature. 445, 643-647 (2007).
- Shen, W., Flajolet, M., Greengard, P., Surmeier, D. J. Dichotomous dopaminergic control of striatal synaptic plasticity. Science. 321, 848-851 (2008).
- Lundblad, M., Picconi, B., Lindgren, H., Cenci, M. A. A model of L-DOPA-induced dyskinesia in 6-hydroxydopamine lesioned mice: relation to motor and cellular parameters of nigrostriatal function. Neurobiol. Dis. 16, 110-123 (2004).
- Grealish, S., Mattsson, B., Draxler, P., Bjorklund, A. Characterisation of behavioural and neurodegenerative changes induced by intranigral 6-hydroxydopamine lesions in a mouse model of Parkinson's disease. Eur. J. Neurosci. 31, 2266-2278 (2010).
- Dauer, W., Przedborski, S. Parkinson's disease: mechanisms and models. Neuron. 39, 889-909 (2003).
- Francardo, V. Impact of the lesion procedure on the profiles of motor impairment and molecular responsiveness to L-DOPA in the 6-hydroxydopamine mouse model of Parkinson's disease. Neurobiol. Dis. 42, 327-340 (2011).
- Jakowec, M. W., Petzinger, G. M. 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-lesioned model of parkinson's disease, with emphasis on mice and nonhuman primates. Comp. Med. 54, 497-513 (2004).
- Visanji, N. P., Brotchie, J. M. MPTP-Induced Models of Parkinson's Disease in Mice and Non-Human Primates. Curr. Protoc. Pharmacol. Chapter 5, 42-42 (2005).
- Sedelis, M., Schwarting, R. K., Huston, J. P. Behavioral phenotyping of the MPTP mouse model of Parkinson's disease. Behav. Brain Res. 125, 109-125 (2001).
- Schallert, T., Fleming, S. M., Leasure, J. L., Tillerson, J. L., Bland, S. T. CNS plasticity and assessment of forelimb sensorimotor outcome in unilateral rat models of stroke, cortical ablation, parkinsonism and spinal cord injury. Neuropharmacology. 39, 777-787 (2000).
- Paul, M. L., Currie, R. W., Robertson, H. A. Priming of a D1 dopamine receptor behavioural response is dissociated from striatal immediate-early gene activity. Neuroscience. 66, 347-359 (1995).
- Breese, G. R., Traylor, T. D. Effect of 6-hydroxydopamine on brain norepinephrine and dopamine evidence for selective degeneration of catecholamine neurons. J. Pharmacol Exp. Ther. 174, 413-420 (1970).
- Breese, G. R., Chase, T. N., Kopin, I. J. Metabolism of tyramine-3H and octopamine-3H by rat brain. Biochem. Pharmacol. 18, 863-869 (1969).
- Frankin, K. B. J., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (2008).
- Cornell-Bell, A. H., Finkbeiner, S. M., Cooper, M. S., Smith, S. J. Glutamate induces calcium waves in cultured astrocytes: long-range glial signaling. Science. 247, 470-473 (1990).
- Iancu, R., Mohapel, P., Brundin, P., Paul, G. Behavioral characterization of a unilateral 6-OHDA-lesion model of Parkinson's disease in mice. Behav. Brain Res. 162, 1-10 (2005).
- Tan, Y., Williams, E. A., Lancia, A. J., Zahm, D. S. On the altered expression of tyrosine hydroxylase and calbindin-D 28kD immunoreactivities and viability of neurons in the ventral tegmental area of Tsai following injections of 6-hydroxydopamine in the medial forebrain bundle in the rat. Brain Res. 869, 56-68 (2000).
- Thiele, S. L. Generation of a model of L-DOPA-induced dyskinesia in two different mouse strains. J. Neurosci. Methods. 197, 193-208 (2011).
- Henry, B., Crossman, A. R., Brotchie, J. M. Characterization of a rodent model in which to investigate the molecular and cellular mechanisms underlying the pathophysiology of L-dopa-induced dyskinesia. Adv. Neurol. 78, 53-61 (1998).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon