Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Développement d'une manière unilatérale-lésés 6-OHDA modèle murin de la maladie de Parkinson
Dans cet article
Résumé
Un protocole pour effectuer unilatérales de 6-OHDA lésions du faisceau médian du cerveau antérieur chez la souris est décrite. Cette méthode a un faible taux de mortalité (13,3%) avec 89% des animaux qui ont survécu montrant la perte de> 95% de la dopamine striatale et 90,63 ± -4,02% biais ipsiversive rotation vers le côté de la lésion.
Résumé
Le unilatéralement lésée 6-hyroxydopamine (6-OHDA)-lésé modèle de rat de la maladie de Parkinson (PD) s'est avérée précieuse pour faire progresser notre compréhension des mécanismes sous-jacents des symptômes parkinsoniens, car elle récapitule les changements dans les circuits des noyaux gris centraux et de la pharmacologie observée dans patients parkinsoniens 1-4. Toutefois, les changements précis cellulaires et moléculaires qui se produisent au niveau des synapses cortico-striatales des voies de sortie dans le striatum, qui est la région d'entrée majeure de ganglions de la base restent insaisissables, et ceci est considéré comme site où des anomalies pathologiques sous-jacents symptômes parkinsoniens se posent 3 , 5.
Dans la MP, la compréhension des mécanismes sous-jacents des changements dans la dégénérescence des ganglions circuits de base suivante de la voie nigro-striatale a été grandement améliorée grâce au développement des chromosomes bactériens artificiels (BAC) au cours des souris exprimant des protéines fluorescentes vertes entraînées par la promotion8, leur permettant d'être étudié de manière isolée:;: spécifique pour les deux voies de sortie du striatum (EGFP-D2 et eGFP-A2a voie indirecte EGFP-D1 voie directe) rs. Par exemple, des études récentes ont suggéré que des changements pathologiques dans la plasticité synaptique chez la souris parkinsoniens 9,10. Cependant, ces études utilisées chez les souriceaux et des modèles aigus de parkinsonisme. Il est difficile de savoir si les changements décrits chez des rats adultes avec stables 6-OHDA lésions se produisent également dans ces modèles. D'autres groupes ont tenté de générer une écurie unilatéralement lésée 6-OHDA modèle de souris adulte de PD par lesioning le faisceau médian du cerveau antérieur (MFB), malheureusement, le taux de mortalité dans cette étude était extrêmement élevé, avec seulement 14% survivent la chirurgie pour le 21 jours ou plus 11. Des études plus récentes ont généré des lésions intra-nigrales à la fois avec un taux de mortalité faible perte> 80% des neurones dopaminergiques, mais l'expression de la L-DOPA dyskinésie induite par 11,12,13,14 était variabledans ces études. Un autre modèle de souris bien établi de maladie de Parkinson est la souris MPTP lésé 15. Alors que ce modèle s'est avéré utile dans l'évaluation des potentiels agents neuroprotecteurs 16, il est moins approprié pour comprendre les symptômes mécanismes sous-jacents de PD, comme ce modèle échoue souvent à induire des déficits moteurs, et montre une grande variabilité de l'étendue de la lésion 17, 18 .
Ici, nous avons développé un modèle de stabilité unilatérale de la souris 6-OHDA-lésé de PD par l'administration directe de la 6-OHDA dans le MFB, ce qui provoque toujours une perte> 95% de la dopamine striatale (tel que mesuré par HPLC), ainsi que la production du comportement déséquilibres observés dans le modèle bien caractérisé chez le rat unilatérale de 6-OHDA-lésé de PD. Ce modèle de souris nouvellement développé du PD se révélera un outil précieux dans la compréhension des mécanismes sous-jacents génération des symptômes parkinsoniens.
Protocole
1. Logement et la préparation de souris
- Maintenir une colonie de chromosomes bactériens artificiels (BAC) entraîné des souris transgéniques 8 (souris mutante de ressources du Centre régional (MMRRC) FVB dans une 12:12 h cycle lumière-obscurité avec un accès libre à la nourriture et l'eau. Ces souris sont des souris FVB pure, et il n'est pas nécessaire de traverser ces souris avec une autre souche, soit pour des fins de reproduction, ou pour assurer le succès de la procédure de lésion 6-OHDA.
- Afin de générer un modèle parkinsonien, les souris adultes âgés de 31 à 42 jours après la naissance (P31-42) sont nécessaires pour les chirurgies de 6-OHDA-lésion et imposture.
- Pour réduire le risque d'infection, administrer Baytril (antibiotique) dans l'eau potable pendant 24 heures avant la chirurgie.
2. Préparation de médicaments pour la chirurgie
Une prémédication de la désipramine et la pargyline est habituellement administré à des rongeurs avant l'injection de 6-hydroxydopamine (6-OHDA) pour augmenter la sélectivité et efficacy de 6-OHDA lésions induites. L'inhibiteur de recapture de la noradrénaline / 5HT, désipramine diminue de 6-OHDA induite par la noradrénaline et la 5HT appauvrissement de la couche 22, alors que l'inhibiteur de la monoamine oxydase, pargyline améliore la sensibilité des terminaisons dopaminergiques de la 6-OHDA, en réduisant la destruction extrasynaptique de 6-hydroxydopamine 31.
- La prémédication (chlorhydrate de désipramine (HCl) et de pargyline HCl) peut être faite en grandes quantités et conservés à -80 ° C jusqu'à son utilisation. Peser la quantité appropriée de la désipramine HCl de fournir à chaque souris avec 25 mg / kg pour le nombre d'animaux qui recevra la chirurgie ce jour-là. Le faible poids de la souris, il est difficile de fournir des volumes de petites précision; donc préparer le chlorhydrate de désipramine à une concentration de 2,5 mg / ml et administré à l'animal à 10 ml / kg. Le poids du composant du sel du composé doit être représenté de façon que la concentration appropriée est obtenue. De correction pour le poids de laSel HCl dans la désipramine chlorhydrate: poids moléculaire (MW) de la désipramine HCl: 302,84 MW HCl: 36.46 MW de base libre: 266,38 Facteur de correction: 302,84 / 266,38 = 1,137 pour 10 ml de la solution: = 2.5mg/ml désipramine x x 10.0ml = facteur de correction 2.5mg/ml x x 1,137 = 10.0ml de chlorhydrate de désipramine 28.43mg
- Peser la quantité appropriée de HCl pargyline de fournir à chaque souris avec 5mg/kg pour le nombre d'animaux recevant la chirurgie ce jour-là. Corriger la composante sel du composé tel que décrit ci-dessus. Le faible poids de la souris, il est difficile de fournir des volumes de petites précision; donc préparer le chlorhydrate de pargyline à une concentration de 0,5 mg / ml et administrer à l'animal à 10 ml / kg.
Corriger le poids du sel de HCl dans chlorhydrate de pargyline:
MW de pargyline HCl: 195,69 MW HCl: 36.46
MW de base libre: 159,23 Facteur de correction: 195,69 / 159,23 = 1,229
Pour 10 ml de solution peser:
= 0,5 mg / ml x 10,0 ml pargyline facteur de correction x
= 0,5 mg / ml x 10,0 ml x 1,229
= 6.15mg de chlorhydrate de pargyline - Combinez la désipramine 28.43mg HCl et 6.15mg pargyline HCl dans un verre de 10 ml cylindre gradué, et ajouter 8 ml de solution saline stérile (0,9%). Vortex et de la chaleur à 45 ° C jusqu'à ce que le mélange est dissous. Le pH de la solution sera désormais autour de 3, qui s'il est administré à des souris causer de l'inconfort et complications post-opératoires impliquant la fonction des voies urinaires et digestives. Ajouter gouttes de NaOH (1M) jusqu'à ce que le pH est 7,4. Compléter le volume à 10 ml avec une solution saline stérile (0,9%), et le vortex. Label, la date et le gel à ~ 80 ° C. Étant donné que pargyline HCl n'est pas soluble dans une solution saline à la température ambiante, pendant toute la période péri-opératoire, stocker le mélange prémédication au bain-marie chauffé à 37 ° C dans la salle d'opération.
- Solutions de 6-OHDA doit être préparé juste avant la chirurgie. Le véhicule utilisé pour dissoudre la 6-OHDA bromhydrate (6-OHDA.Br) solution est une solution saline stérile (0,9%) d'acide ascorbique solution contenant (0,2%). L'acide ascorbique est nécessaire pour stabiliser 6-OHDA.Br, car elle empêche l'oxydation de la 6-OHDA.Br à une forme inactive. Peser 0,2 g d'acide ascorbique, puis ajouter à un vide de 1 L éprouvette graduée, compléter à 1 L avec une solution saline stérile (0,9%) et remuer. Étiquette, la date, et les conserver à ~ 80 ° C jusqu'à ce que nécessaire.
- Peser la quantité appropriée de 6-OHDA.HBr de faire un 15,0 mg / ml solution à fournir à chaque souris avec 3,0 mg. Depuis le 6-OHDA.Br est léger et sensible à la chaleur d'éviter l'exposition à la lumière, et le lieu sur la glace avant la pesée.
Corriger le poids du sel de HBr en 6-OHDA.HBr:
MW de 6-OHDA.HBr: 250,09 MW HBr: 79,9 MW de base libre: 170,19
Facteur de correction: 250,09 / 170,19 = 1,47
Pour 0,5 ml de solution peser:
= 15,0 mg / ml 6-OHDA x 0,5 ml de facteur de correction x
= 15,0 mg / ml 6-OHDA x 0,5 ml x 1,47
= 11,03 mg de 6-OHDA.HBr - Peser 6-OHDA.HBr dans un tube de 1,0 ml stérile recouverte de papier d'aluminium, et ajoutez 0,5 ml de véhicule (une solution saline stérile (0,9%), l'acide ascorbique 0,02% pH 7,4). Vortex jusqu'à ce que le mélange est dissous, l'étiquette, et le lieu immédiatement sur la glace jusqu'à utilisation. Notez que la solution de 6-OHDA doit être utilisé dans environ 6 heures après la préparation. Si la solution vire au brun foncé, soit directement après la préparation, ou pendant la chirurgie, ce qui indique que la 6-OHDA.HBr a s'oxyder, et n'est plus une neurotoxine efficace, elle doit donc être mis au rebut et préparé une fois de plus.
- Pour les animaux opérés de manière fictive, forment un volume équivalent de véhicule (une solution saline stérile (0,9%), l'acide ascorbique 0,02% pH 7,4) à celui qui les animaux de 6-OHDA-lésés recevront, et le placer dans un tube de 1,0 ml stérile enveloppé dans une feuille d'étain, l'étiquette et le lieu immédiatement sur la glace jusqu'à utilisation.
3. Installation de l'appareil chirurgical
Outils chirurgicaux doivent être stérilisés en utilisant un t autoclave avantchirurgie o. Entre chaque opération, des outils chirurgicaux doit être stérilisé dans l'éthanol à 95% suivi d'un chauffage à 250 ° C pendant 2 minutes. Toutes les expériences doivent être réalisées conformément aux lignes directrices des comités appropriés de protection des animaux de l'institution d'affiliation et le pays.
- Nettoyez toutes les surfaces et l'équipement avec de l'alcool isopropylique avant la mise en place de l'équipement. Porter des gants stériles lors de la manipulation propre matériel chirurgical.
- Set-up d'une cage de récupération de la souris avec des serviettes en papier sur la base. Placer sous une lampe chauffante ou sur le dessus d'un coussin chauffant.
- Mettre en place le chariot d'anesthésie, en sorte que le flux d'oxygène est relié et ouverte, l'isoflurane et le réservoir est rempli de fluide. Régler le débit d'oxygène à 1 L / min, et l'isoflurane à 2-4%. Idéalement il y aura deux orifices de sortie de la machine pour fournir l'anesthésique au mélange d'oxygène isoflurane à une chambre d'induction, ainsi que pour l'entretien alors que l'animal est dans le cadre stéréotaxique.
- Correct assemblage de l'appareil de perfusion est essentielle pour assurer des lésions succès, car l'air piégé ou des aiguilles bloquées diminue le volume de 6-OHDA infusé au site de lésion. Assembler l'appareil de perfusion comme illustré dans la figure 1. Fil métallique, un écrou RN sur un côté de la tubulure PEEK (RN compression Kit (raccord 1/16 pouce e)), suivie par la virole PEEK coupelle, puis le PFA canonique virole. Orienter les embouts de telle sorte que le cône sur la virole canonique PFA se glisse dans la pièce d'accouplement de la coupe du PEEK virole. Placer dans la double petite coupleur hub RN (# 1), assurant la liaison est serré. Sur l'autre extrémité de la double petite coupleur moyeu RN insérer l'aiguille de calibre 33 injection. Enfilez l'aiguille à travers l'un des écrous métalliques RN et serrer. Assurez-vous l'aiguille 33 jauge est à un angle de 180 ° par rapport à la double petite plaque tournante RN coupleur (# 1). Sur l'autre extrémité de la tubulure PEEK, du fil un des écrous métalliques RN suivie d'une virole PEEK, le PFA virole. Insérez l 'écrou métallique d'une bague de montage dans un second double petite coupleur hub RN et serrer le raccord. À l'autre extrémité d'une petite seconde à double coupleur RN hub (# 2) insérer l'embout luer à petit hub RN (adaptateur Luer), et serrer le raccord.
- Suivant l'appareil de perfusion doit être amorcée (voir Figure 1). Remplissez le pl 250 et 1.0 pi seringues Hamilton avec de l'eau stérile, assurant qu'il n'ya pas de bulles d'air. Fixer la seringue 250 pi à l'adaptateur Luer et enfoncer le piston de la seringue 250 pi de telle sorte que l'eau est libérée à travers l'aiguille de calibre 33 injection sur l'autre extrémité de la tubulure. Continuer à pousser l'eau à travers le système, tout en tirant la seringue 250 pi de l'adaptateur Luer, laissant une petite bille de l'eau sur l'extrémité de l'adaptateur Luer. Enfoncer le piston de la seringue 1,0 pi jusqu'à une petite bille de l'eau est éjectée. Insérez soigneusement la seringue 1,0 ul dans l'adaptateur Luer, assurez-vous que l'eau perle sur la seringue 1,0 pi connecte avec le o perler l'eau présenten l'adaptateur luer, et insérer complètement la seringue 1,0 ul dans l'adaptateur luer. Assurez-vous pas de bulles dans le coupleur petite double RN moyeu.
- Maintenant ce que le système est amorcée, le dispositif de perfusion peuvent être fixée au cadre stéréotaxique et la pompe de perfusion. Serrer le petit double RN moyeu coupleur avec l'aiguille 33 jauge d'injection fixé sur le bras manipulateur du cadre stéréotaxique, puis serrer la seringue 1,0 pi à la pompe de perfusion, de telle sorte que lorsque la pompe de perfusion commence la seringue est pressée contre la pince et peut pas déplacer. Programme de la pompe à perfusion afin de permettre un débit de perfusion de 0,1 l / min.
4. Unilatérale la chirurgie lésion 6-OHDA
- Trente minutes avant les opérations, peser chaque animal et enregistrer le poids. Systémique d'administrer le chlorhydrate de désipramine (2,5 mg / ml, Sigma Aldrich) et du chlorhydrate de pargyline (0,5 mg / ml, Sigma Aldrich) (0,9% de solution saline stérile, pH 7,4) à 10 ml / kg par injection intra-péritonéale (ip) pour une sourisen utilisant une aiguille 27g montée sur une seringue de 1 ml. Par exemple, une souris 30,0 g recevrait 300 pl de la prémédication. Faire chauffer le disque chauffant et placez ce sous l'oreille et incisive bar. Le disque de chauffage contribuera à maintenir la température de l'animal pendant la chirurgie et de garder l'animal à une hauteur idéale pour répondre aux barres d'oreilles et incisive du cadre stéréotaxique.
- Quinze minutes après l'administration de la désipramine et HCl pargyline une solution de HCl, placez la souris dans une chambre fermée anesthésie, et anesthésier l'animal à l'aide d'inhalation d'isoflurane (2-3% en O 2). L'animal est suffisamment anesthésié quand il montre pas de réponse à pincée patte arrière et pas de réflexe de clignement.
- Rasage sommet de la tête de la souris, et d'appliquer la analgésique topique de lidocaïne directement sur la peau avec de la laine de coton. Cinq minutes après l'application lidocaïne, stériliser la tête de l'animal avec une solution de Bétadine.
- Placez l'animal dans un cadre stéréotaxique adaptée pour les souris. Tout d'abord placer l'animal dans la barres des incisives (réglage de la barre incisive: -3,0 à 2,0 mm) avec le masque d'anesthésie placé sur la face de l'animal. Régler le débit d'oxygène à 1 L / min, et l'isoflurane à 1,5-2%. La barre d 'incisives doivent être à un niveau par rapport aux oreillettes telles que le sommet du crâne est de niveau. Insérez les oreillettes (diamètre 5,0 mm). Les oreillettes ont été insérées correctement lorsque la tête est complètement à plat, et ne peut pas être déplacé dans les deux sens.
- Couper le long de la ligne médiane de la peau au-dessus de la tête de la souris en utilisant une lame de scalpel, et rétracter la peau. Sécher la surface du crâne à l'aide de gaze.
- Poussez sur le piston de la seringue 1,0 pi, et placez l'aiguille du manomètre 33 d'injection dans le tube 1 ml recouvert de feuille d'étain contenant 6-OHDA solution (15 mg / ml). Tirez lentement sur le piston de la seringue 1,0 pi tout en gardant l'aiguille 33 d'injection jauge immergée dans la solution de 6-OHDA (15 mg / ml).
- Créer une incision de 1 cm le long de la mila ligne du crâne. Faire avancer la pointe de l'aiguille d'injection vers Bregma, distribuer une petite quantité de solution de 6-OHDA de l'aiguille de calibre 33 injection pour former une petite bille. Abaisser lentement la pointe de l'aiguille d'injection à Bregma, lorsque le bourrelet touche Bregma arrêter l'avancement de la pointe de l'aiguille et enregistrer ces coordonnées. Rétracter l'aiguille d'injection 2 mm dans la direction dorsale, et se déplacent le long du fil de suture dans une direction sagittale rostrale caudale vers lambda. Faire avancer une petite quantité de solution de 6-OHDA de l'aiguille de calibre 33 injection pour former une petite bille. Abaisser lentement la pointe de l'aiguille d'injection à Lambda, lorsque le bourrelet de contacts Lambda arrêter l'avancement de la pointe de l'aiguille et enregistrer ces coordonnées. Le latérales médiale (ML), et dorsale ventrales (DV) les coordonnées devraient être identiques pour Bregma et Lambda, si elles ne sont pas, ajuster la barre d 'incisives en conséquence pour les coordonnées AP, et les barres d'oreilles pour les coordonnées ML. Déplacer l'aiguille coordonne AP: -1,2 mm, ML: -1,1 mm par rapport à Bregma fonction de l'Atlas du cerveau de la souris dans stéréotaxique Coordonnées 25. Retrait de l'aiguille, et sans bavures un trou dans le crâne à l'aide d'une aiguille de calibre 25.
- Retour à l'aiguille d'injection ce qui précède coordonnées, et insérer l'aiguille à DV:-5mm. Infuser 0,2 ul de 6-OHDA ou d'un véhicule de façon unilatérale dans le faisceau du cerveau antérieur médian à un taux de 0,1 pi / min (3 au total ug). À la fin de l'administration de 6-OHDA ou d'un véhicule, laisser l'aiguille en place pour cinq minutes supplémentaires pour permettre la diffusion en dehors du site d'injection.
- Lentement retirer l'aiguille.
- Fermer l'incision du cuir chevelu à l'aide de trois points de suture, et de livrer 1ml de solution de Ringer lactate de voie sous-cutanée (sc).
- Retirer l'animal de cadre stéréotaxique, et sa place dans la cage de récupération jusqu'à la conscience est retrouvé.
5. Soins post-opératoires de la 6-OHDA-lésés animaux
- Place des animaux dans des cages (3 souris par cage) et permettent le libre accès à la nourriture et sugarel'eau j (10 mM). Fournir Nutra-gel et KMR (remplacement du lait chaton) dans les contenants alimentaires sur le plancher de la cage pour stimuler l'appétit et de la motilité gastro-intestinale.
- Inspectez souris quotidiens post-opératoire pendant 2 semaines 24. À chaque inspection attention particulière devrait être accordée à la vigilance de l'animal en évaluant la capacité de l'animal de se déplacer autour de la cage. L'alimentation et l'apport d'eau de la dernière période d'observation, ainsi que la présence et la cohérence de la matière fécale doivent également être respectées. Une commune complication post-opératoire est la déshydratation ce qui est évident par la rétraction lente de la peau pincée la peau suivant. Si ceci est observé offrir 1ml de solution de Ringer lactate sc pour 1 semaine ou jusqu'à ce que les symptômes s'améliorent. Dans le cas d'animaux mâles, les organes génitaux doivent être soigneusement observés pour un prolapsus du pénis identifiée par une rougeur du pénis. Si cela se produit appliquer le gel mucol vers le pénis de l'animal infecté, et de livrer 1 ml de solution de Ringer lactate sc pour 1 semaineou jusqu'à ce que les symptômes s'améliorent.
- Peser les animaux tous les jours pour surveiller les changements dans le poids corporel.
- Dans le cas où l'injection ip a provoqué une petite déchirure dans le système gastro-intestinal, infection abdominale peut entraîner. Par conséquent, d'évaluer pour la prsence de l'infection de l'abdomen, en évidence par l'abdomen distendu enflée. Traiter par l'administration de Baytril dans l'eau pendant 3-4 jours drining ou jusqu'à ce que les symptômes s'améliorent.
6. Parkinsonien évaluation
Pour estimer l'ampleur de la lésion, l'évaluation comportementale a été réalisée 14-21 jours après la chirurgie 6-OHDA-lésion, lorsque le montant de l'appauvrissement de la dopamine est maximale et stable 26.
- Après une injection ip de 0,01 ml / g solution saline stérile à 0,9%, les souris les placer dans des cylindres de verre (11 cm x 9,5 cm) et d'enregistrer leur activité en utilisant une caméra vidéo (CG9, Sanyo).
- Regarder la vidéo, compter le nombre de rotations complètes de 360 ° faites à la fois dans l'ipsiversive et contraversive direction par rapport à la lésion.
- Plus la tendance est vers des rotations ipsiversive, plus parkinsonien l'animal, ainsi calculer la proportion de rotations ipsiversive comme un pourcentage du bénéfice net (contraversive et ipsiversive) le comportement de rotation.
7. Détermination de la teneur dopamine striatale par HPLC
- Au moins 21 jours suivant la chirurgie lésion 6-OHDA, et à l'achèvement des études comportementales, sacrifier les souris par une sur-dose d'anesthésie, et retirez soigneusement le cerveau. Conserver une tranche de striatum (230 um) à partir de chaque hémisphère dans chaque souris, et enclenchez le gel immédiatement après la coupe et conserver à -80 ° C jusqu'à ce que la préparation des échantillons du striatum.
- Le tampon d'échantillon HPLC (0,1 M APC avec 2 mM de glutathion) empêche la dopamine extrait à partir des échantillons du striatum de tomber en panne.
Pour 100 ml de tampon d'échantillon:
= 100 ml de qualité HPLC H 2 O
= 0,862 ml PCA (70%) (SIGMa)
= 61,5 mg de glutathion (réduit)
Mesurer la qualité HPLC H 2 O, ajoutez l'APC, de dissoudre le glutathion dans la solution, bien mélanger et filtrer. Le tampon d'échantillon peut être conservé à 4 ° C pour un maximum de 1 mois. - Décongeler tranches striatales sur la glace, puis homogénéiser dans 200 ul du tampon d'échantillon en utilisant un perturbateur cellules ultrasons (Fisher Sonic, Etats-Unis). Conserver les échantillons sur la glace en tout temps et homogénéiser chaque échantillon trois fois pour 10 secondes chacun veillant à ce que les échantillons sont autorisés à se refroidir entre les périodes d'homogénéisation.
- Mettre de côté 20 ul de chaque échantillon homogénéisé (conserver à -80 ° C) pour un dosage de protéines.
- Centrifuger les échantillons (20 800 xg, 20 min (4 ° C, Eppendorf 58 - 04R, États-Unis)), puis éliminer le surnageant et filtrer à travers un 0,2 um membrane de PVDF (Pall, Cat #: 1935-28143-310) et congeler à -80 ° C jusqu'à l'analyse HPLC. Conserver le culot de protéines comme pour les back-up le dosage des protéines.
- Préparation de la phase mobile pour HPLC afin de fonctionner through la colonne HPLC.
Pour 1 L de la phase mobile:
60 mM NaH 2 PO 4. H 2 O (monobasique) = 8,27 g
30 mM d'acide citrique = 5,7 g
0,13 mM d'acide éthylènediaminetétraacétique (EDTA) sel disodique déshydrater = 48 mg
0,16 mM de dodécylsulfate de sodium (SDS) = 45 mg
850 ml d'eau de qualité HPLC (Caledon, Cat #: 8801-7)
15% v / v d'acétonitrile-190 (pH 3,35) = 150 ml de qualité HPLC (Caledon, Cat #: 1401-7)
~ 2 pi de NaOH 10 M (en qualité CLHP H2O)
Tous les réactifs doivent être ≥ 99,0% pur et de qualité CLHP la mesure du possible. L'eau et l'acétonitrile doit être de qualité HPLC. La phase mobile doit être utilisé dans une semaine de préparation. Ont consacré, de la verrerie propre et remuer bars uniquement pour la préparation de la phase mobile (un cylindre de 1 L à mesurer en verre et au moins 2 1 flacons en verre L). Avant de préparer la phase mobile ont deux propres flacons de 1 L préparées, l'une pour rendre la solution dans et l'autre pour le transférer dans lors de la filtration et degassing. Autoriser la phase mobile de circuler à travers l'HPLC nuit et vérifiez que la ligne de base est plat avant de l'utiliser. - Mesurer 700 ml d'eau de qualité CLHP dans un cylindre de verre de mesure et de dissoudre le. NaH 2 PO 4. H 2 O, acide citrique, l'EDTA et SDS en elle Compléter l'eau à 850 ml.
- Ajuster le pH à 3,35 avec 10 M de NaOH, puis ajouter de l'acétonitrile et mélanger la solution en utilisant une barre en téflon agitation revêtu.
- Mettre un barreau aimanté dans la seconde propre, vide 1 flacon L et le vide filtrer la phase mobile en elle à travers un filtre de 0,22 um HVLP Millipore: (Cat #: SLGP033RS). Mouiller le filtre dans 85:15 H 2 O / ACN avant la filtration. Une fois que le mobile est entièrement filtrée, dégazer la phase mobile par l'agitation sous vide pendant au moins 10 min.
- Préparer les normes par rapport auxquelles la concentration de dopamine des échantillons striataux seront mesurés. Normes sont gérés par l'HPLC au début et la fin de chaque lot d'échantillons du striatum. Un unemg / ml, solution stock de dopamine peut être faite à l'avance et stocké dans 20 aliquotes à -80 ° C. Pour préparer la solution stock de dissoudre 5 dopamine mg dans 5 ml du tampon d'échantillon (voir ci-dessus) et mélanger soigneusement. Commencer à préparer les normes en prenant 5 pi de 1 mg / ml de solution mère, en l'ajoutant à 2,5 ml du tampon d'échantillon et bien mélanger pour obtenir une pg 2 / solution dopamine ml.
- Quatre normes sont gérées par la HPLC pour produire une courbe de concentration. Pour les concentrations de dopamine sont les suivants: 100 ng / ml, 50 ng / ml, 25 ng / ml, et 12,5 ng / ml. Afin de générer ces quatre concentrations de dopamine prendre 10 pl de la solution la dopamine 2 ug / ml préparée dans 7.10). et l'ajouter à 190 pi de tampon d'échantillon pour vous donner une 100 ng / ml solution la dopamine. Suite à cette effectuer une dilution 1:1 de série de la 100 ng / ml solution la dopamine avec un tampon d'échantillon. Il suffit de prendre 100 ul de 100 ng / ml dopamine et ajouter 100 ul de tampon d'échantillon et mélanger pour produire 50 ng / ml dopamine, puis prendre 100ul de 50 ng / ml de la dopamine et ajouter 100 ul de tampon d'échantillon et mélanger pour produire 25 ng / ml dopamine et ainsi de suite.
- Pour préparer le système HPLC, (pompe Waters binaire 1525μ, 717plus échantillonneur automatique, Symétrie C-18 en phase inverse sur colonne (15 cm x 4,6 mm de diamètre, la taille des particules 5 um) (30 ° C), électrochimique détecteur (ESA Coulochem III) équipés avec une cellule à double électrode d'analyse (ESA 5011B) et contrôlé par le logiciel Breeze (Waters)) de purge d'abord le système avec la phase mobile en sélectionnant le protocole de purge dans le logiciel ou en suivant les instructions du fabricant. Cette échanges de solution précédente dans le système HPLC avec la phase mobile frais.
- Définir les potentiels électrochimiques à 400 mV et -300 mV pour les première et seconde électrodes respectivement. Suite à cela, équilibrer le système en l'exécutant au moins 2 heures et idéalement une nuit avec la phase mobile à un débit de 1 ml / min. Au cours de l'équilibration des cellules doit être activé et la re ligne de baseADing surveillé, lorsque la lecture devient stable le système est prêt à être utilisé. Pendant la première heure d'équilibration laisser la phase mobile qui sort du système aller dans un récipient usées, à la suite de cette on peut permettre à la phase mobile pour recirculer à travers le système CLHP en mettant le tuyau de sortie dans le ballon de la phase mobile.
- Faire dégeler les échantillons striataux sur la glace, puis injecter 20 ul de chaque norme dopamine suivie par 2 x 20 pi de chaque échantillon et un autre 20 ul de chaque norme de la dopamine dans le système HPLC équilibrée avec le débit de la phase mobile à 1 ml / min.
- Utilisez le logiciel système HPLC pour analyser la surface des pics de dopamine produite par les normes et les échantillons. En comparant la surface des pics de dopamine présents dans les échantillons du striatum à la courbe de la concentration de dopamine norme déterminera la quantité de dopamine présente dans 20 ul de chaque échantillon striatal. Scale ce chiffre à trouver le cadeau dopamine totale dans la tranche entière striatum.
- Perform un dosage de protéines standard sur le pl 20 de homogénat striatale que vous mettez de côté dans la version 7.4). Ce sera de mesurer la quantité de protéine présente dans les échantillons du striatum en mg / ml. A partir de ce calcul de la quantité de dopamine dans les échantillons du striatum comme une valeur en ng / mg vous permettant de comparer les concentrations de dopamine entre les hémisphères et entre les souris.
8. Les résultats représentatifs
Quinze à vingt et un jours après la chirurgie 6-OHDA-lésion, lorsque le montant de la mort cellulaire causée par la neurotoxine a atteint completion26 spontanée, la mesure de 360 ° rotations suivant l'administration de sérum physiologique (ip) 28 peut être utilisé pour évaluer le succès du 6 -OHDA-lésés (Figure 2). Cette méthode d'évaluation comportementale est simple et rapide, et évite les effets d'amorçage potentiels causés par les agents dopaminergiques telles que les amphétamines ou l'apomorphine défis. En outre, l'évaluation de rotation spontanée est une meilleure prédicatctor des animaux avec des 27. En corrélant les niveaux de dopamine du striatum à partir d'échantillons du striatum (préparé à la fin des études de comportement en utilisant HPLC) avec un pourcentage de rotations spontanées ipsiversive dans chaque animal, nous avons constaté que les animaux qui présentent 70% ou plus des rotations ipsiversive vers la lésion 6-OHDA ont perdu> 95% la dopamine striatale (Figure 3) 27. Après partielles 6-OHDA lésions induites (59,44 ± 17,20) (Figure 3) du faisceau médian du cerveau antérieur, il n'y avait pas de biais de rotation entre ipsiversive par rapport côtés contraversive lors de la mesure des rotations spontanées (40,91 ± 8,01) (Figure 2). Ainsi, comme cela a été constaté à l'issue de 6-OHDA l'administration de la MFB chez le rat, il est possible de provoquer une perte profonde de dopaminergiques nigro-striataux neurones, et de l'administration une solution saline (ip) est une méthode précise pour le criblage de l'étendue de la 6-OHLésion DA chez ces animaux.
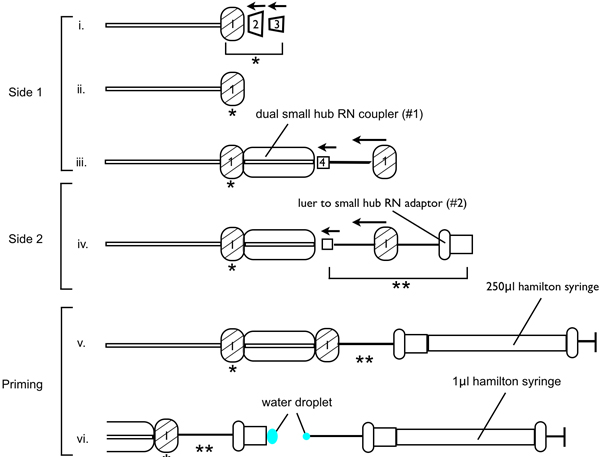
Figure 1. Schéma de démontrer l'assemblage de l'appareil aiguille d'injection pour la 6-OHDA-lésion chirurgies.
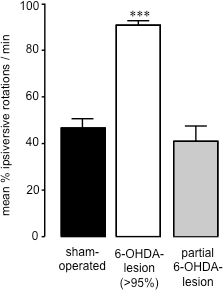
Figure 2. Évaluation du comportement de rotation dans opérés de manière fictive et la 6-OHDA souris lésés. Rotations spontanées chez la souris opérés de manière fictive et la 6-OHDA-lésé. Les données sont présentées comme moyennes rotations ipsiversive pourcentage ± SEM, où net contraversive et les rotations sont ipsiversive 100%. Bars ouverts: animaux opérés de manière fictive, les barres grises: 6-OHDA-lésés animaux avec> la perte de la dopamine de 95%, les barres noires: les animaux qui ont subi une chirurgie 6-OHDA-lésion qui ont été partiellement lésé. *** P <0,001 comparé au opérés de manière fictive les animaux. Une ANOVA suivie d'un test de comparaison multiple de Dunn (s jambon-exploité: n = 17; 6-OHDA-lésé (> 95%): n = 23; partielle 6-OHDA-lésion: n = 3).
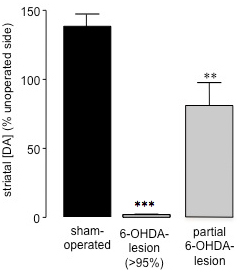
Figure 3. Évaluation des niveaux de dopamine du striatum dans opérés de manière fictive et la 6-OHDA souris lésés par HPLC. Contenu dopamine striatale a été déterminée dans l'hémisphère exploités et non opérée du trompe-l'œil et la 6-OHDA-lésés animaux. Les données sont présentées en pourcentage moyenne ± SEM de niveaux de dopamine du striatum dans le striatum non opérée. Bars ouverts: animaux opérés de manière fictive, les barres grises: 6-OHDA-lésés animaux avec> la perte de la dopamine de 95%, les barres noires: les animaux qui ont subi une chirurgie 6-OHDA-lésion qui ont été partiellement lésé. *** P <0,001, ** P <0,01 par rapport à des animaux opérés de manière fictive. Une ANOVA suivie d'un test de comparaison multiple de Dunn (opérés de manière fictive: n = 17, 6-OHDA-lésé (> 95%): n = 23, 6-OHDA partielle-lésion: n = 3).
EAK ">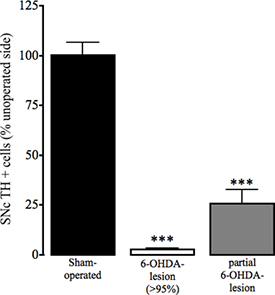
Figure 4. Évaluation de l'immunoréactivité de la tyrosine hydroxylase dans le SNC en opérés de manière fictive et la 6-OHDA souris lésés. En tant que marqueur de la perte de cellules dopaminergiques dans la substance noire pars compacta (SNC), la perte de la tyrosine hydroxylase (TH) immunohistochimie positive dans l'hémisphère exploités et non opérée du trompe-l'œil et la 6-OHDA-lésés animaux a été déterminée comme décrit dans Thiele et al. Dans la presse. Les données sont présentées en pourcentage moyenne ± SEM de TH cellules positives dans le striatum non opérée. Bars ouverts: animaux opérés de manière fictive, les barres grises: 6-OHDA-lésés animaux avec> la perte de la dopamine de 95%, les barres noires: les animaux qui ont subi une chirurgie 6-OHDA-lésion qui ont été partiellement lésé. *** P <0,001, ** P <0,01 par rapport à des animaux opérés de manière fictive. Une ANOVA suivie par plusieurs sociétés de DunnRison test (opérés de manière fictive: n = 17, 6-OHDA-lésé (> 95%): n = 23, 6-OHDA partielle-lésion: n = 3).
Discussion
Ce protocole décrit une méthode pour la génération d'un modèle stable de la souris unilatérale de 6-OHDA-lésé de la maladie de Parkinson, qui est extrêmement reproductible, avec un taux de réussite lésion de haut, et un faible taux de mortalité. Le succès de l'opération lésion 6-OHDA peut être facilement estimée par la mesure de comportement en rotation spontanée ayant plus de 70% des rotations ipsiversive indicatifs de> 95% appauvrissement dopamine dans le striatum lésé 27. Qua...
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ce travail a été soutenu par le ministère des Affaires étrangères et du Commerce international (Gouvernement du Canada), Université de Toronto Connaught Fonds, la Fondation canadienne pour l'innovation, le CRSNG, la Fondation Krembil et la confiance de la maladie de Parkinson Cure.
matériels
Nom du réactif Société Commentaires (optionnel) 900 (contenant une seringue 250ml) de la RN de compression kit de montage< (1/16 E Pouces)
| Name | Company | Catalog Number | Comments |
| Désipramine HCl | Sigma-Aldrich, Oakville, ON, Canada | D125 | 25mg/kg |
| Pargyline HCl | Sigma-Aldrich, Oakville, ON, Canada | P8013 | 5mg/kg |
| 6-OHDA HBr | Sigma-Aldrich, Oakville, ON, Canada | H116 | 3 mg / souris |
| Cadre stéréotaxique | Kopf Instruments, Tujunga, CA, Etats-Unis | ||
| La souris oreillettes | Kopf Instruments, Tujunga, CA, Etats-Unis | Modèle 921 oreillettes Zygoma | |
| La souris incisive bar | Kopf Instruments, Tujunga, CA, Etats-Unis | Modèle 923b | |
| La souris anesthésie masque | Kopf Instruments, Tujunga, CA, Etats-Unis | Modèle 923b | |
| Hamilton Company, Reno, NV, Etats-Unis | PRMKIT 81120 | ||
| RN raccord à compression kit (1 mm) | Hamilton Company, Reno, NV, Etats-Unis | 55750-01 | |
| Hamilton Company, Reno, NV, Etats-Unis | 55751-01 | ||
| Double petite plaque tournante RN coupleur | Hamilton Company, Reno, NV, Etats-Unis | 55752-01 | |
| Luer à petit hub RN adaptateur | Hamilton Company, Reno, NV, Etats-Unis | 55753-01 | |
| 1ml 25S modèle de seringue 7001KH | Hamilton Company, Reno, NV, Etats-Unis | 80100 | |
| * 33G amovible aiguille (RN) pack de 6. . Personnalisé 1 pouces avec 45 <° biseau | Hamilton Company, Reno, NV, Etats-Unis | 7803-05 | |
| Ciseaux | Outils belle science, Vancouver, BC, Canada. | 14084-08 | |
| Scalpel | Outils belle science, Vancouver, BC, Canada | 10003-12 | |
| Lames de bistouri | Outils belle science, Vancouver, BC, Canada | 10035-20 | |
| Pince | Outils belle science, Vancouver, BC, Canada | 11608-15 | |
| Hémostatiques | Outils belle science, Vancouver, BC, Canada. | 13004-14 | |
| L'isoflurane | Abbé | 02241315 | 2-3% |
| Suters (Vicryl 4.0) | Syneture | SS-683 | |
| Stérilisateur | Outils belle science, Vancouver, BC, Canada | 18000-45 | |
| Harvard Apparatus | Doctorat 22/2000 | ||
| Aiguilles (27G) | Becton Dickinson | 305109 | |
| Aiguilles (25G) | Becton Dickinson | 305127 | |
| Seringues (1ml) | BD seringue | 309692 | |
| Anesthésie chariot | LEI médicale | M2000 | |
| Baytril | CDMV, Saint-Hyacinthe, QC | 102207 | |
| La lidocaïne | CDMV, Saint-Hyacinthe, QC | 3914 | |
| CDMV, Saint-Hyacinthe, QC | 19955 |
Références
- Costall, B., Naylor, R. J., Pycock, C. Non-specific supersensitivity of striatal dopamine receptors after 6-hydroxydopamine lesion of the nigrostriatal pathway. Eur. J. Pharmacol. 35, 276-283 (1976).
- Maneuf, Y. P., Mitchell, I. J., Crossman, A. R., Brotchie, J. M. On the role of enkephalin cotransmission in the GABAergic striatal efferents to the globus pallidus. Exp. Neurol. 125, 65-71 (1994).
- Robertson, G. S., Robertson, H. A. Evidence that L-dopa-induced rotational behavior is dependent on both striatal and nigral mechanisms. J. Neurosci. 9, 3326-3331 (1989).
- Ungerstedt, U., Arbuthnott, G. W. Quantitative recording of rotational behavior in rats after 6-hydroxy-dopamine lesions of the nigrostriatal dopamine system. Brain Res. 24, 485-493 (1970).
- Brotchie, J. M. Novel approaches to the symptomatic treatment of parkinsonian syndromes: alternatives and adjuncts to dopamine-replacement. Curr. Opin. Neurol. 10, 340-345 (1997).
- Besson, M. J., Graybiel, A. M., Nastuk, M. A. [3H]SCH 23390 binding to D1 dopamine receptors in the basal ganglia of the cat and primate: delineation of striosomal compartments and pallidal and nigral subdivisions. Neuroscience. 26, 101-119 (1988).
- Gerfen, C. R. D1 and D2 dopamine receptor-regulated gene expression of striatonigral and striatopallidal neurons. Science. 250, 1429-1432 (1990).
- Schiffmann, S. N., Jacobs, O., Vanderhaeghen, J. J. Striatal restricted adenosine A2 receptor (RDC8) is expressed by enkephalin but not by substance P neurons: an in situ hybridization histochemistry study. J. Neurochem. 57, 1062-1067 (1991).
- Hutchison, W. D. Differential neuronal activity in segments of globus pallidus in Parkinson's disease patients. Neuroreport. 5, 1533-1537 (1994).
- Pan, H. S., Penney, J. B., Young, A. B. Gamma-aminobutyric acid and benzodiazepine receptor changes induced by unilateral 6-hydroxydopamine lesions of the medial forebrain bundle. J. Neurochem. 45, 1396-1404 (1985).
- Pan, H. S., Walters, J. R. Unilateral lesion of the nigrostriatal pathway decreases the firing rate and alters the firing pattern of globus pallidus neurons in the rat. Synapse. 2, 650-656 (1988).
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Kreitzer, A. C., Malenka, R. C. Endocannabinoid-mediated rescue of striatal LTD and motor deficits in Parkinson's disease models. Nature. 445, 643-647 (2007).
- Shen, W., Flajolet, M., Greengard, P., Surmeier, D. J. Dichotomous dopaminergic control of striatal synaptic plasticity. Science. 321, 848-851 (2008).
- Lundblad, M., Picconi, B., Lindgren, H., Cenci, M. A. A model of L-DOPA-induced dyskinesia in 6-hydroxydopamine lesioned mice: relation to motor and cellular parameters of nigrostriatal function. Neurobiol. Dis. 16, 110-123 (2004).
- Grealish, S., Mattsson, B., Draxler, P., Bjorklund, A. Characterisation of behavioural and neurodegenerative changes induced by intranigral 6-hydroxydopamine lesions in a mouse model of Parkinson's disease. Eur. J. Neurosci. 31, 2266-2278 (2010).
- Dauer, W., Przedborski, S. Parkinson's disease: mechanisms and models. Neuron. 39, 889-909 (2003).
- Francardo, V. Impact of the lesion procedure on the profiles of motor impairment and molecular responsiveness to L-DOPA in the 6-hydroxydopamine mouse model of Parkinson's disease. Neurobiol. Dis. 42, 327-340 (2011).
- Jakowec, M. W., Petzinger, G. M. 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-lesioned model of parkinson's disease, with emphasis on mice and nonhuman primates. Comp. Med. 54, 497-513 (2004).
- Visanji, N. P., Brotchie, J. M. MPTP-Induced Models of Parkinson's Disease in Mice and Non-Human Primates. Curr. Protoc. Pharmacol. Chapter 5, 42-42 (2005).
- Sedelis, M., Schwarting, R. K., Huston, J. P. Behavioral phenotyping of the MPTP mouse model of Parkinson's disease. Behav. Brain Res. 125, 109-125 (2001).
- Schallert, T., Fleming, S. M., Leasure, J. L., Tillerson, J. L., Bland, S. T. CNS plasticity and assessment of forelimb sensorimotor outcome in unilateral rat models of stroke, cortical ablation, parkinsonism and spinal cord injury. Neuropharmacology. 39, 777-787 (2000).
- Paul, M. L., Currie, R. W., Robertson, H. A. Priming of a D1 dopamine receptor behavioural response is dissociated from striatal immediate-early gene activity. Neuroscience. 66, 347-359 (1995).
- Breese, G. R., Traylor, T. D. Effect of 6-hydroxydopamine on brain norepinephrine and dopamine evidence for selective degeneration of catecholamine neurons. J. Pharmacol Exp. Ther. 174, 413-420 (1970).
- Breese, G. R., Chase, T. N., Kopin, I. J. Metabolism of tyramine-3H and octopamine-3H by rat brain. Biochem. Pharmacol. 18, 863-869 (1969).
- Frankin, K. B. J., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (2008).
- Cornell-Bell, A. H., Finkbeiner, S. M., Cooper, M. S., Smith, S. J. Glutamate induces calcium waves in cultured astrocytes: long-range glial signaling. Science. 247, 470-473 (1990).
- Iancu, R., Mohapel, P., Brundin, P., Paul, G. Behavioral characterization of a unilateral 6-OHDA-lesion model of Parkinson's disease in mice. Behav. Brain Res. 162, 1-10 (2005).
- Tan, Y., Williams, E. A., Lancia, A. J., Zahm, D. S. On the altered expression of tyrosine hydroxylase and calbindin-D 28kD immunoreactivities and viability of neurons in the ventral tegmental area of Tsai following injections of 6-hydroxydopamine in the medial forebrain bundle in the rat. Brain Res. 869, 56-68 (2000).
- Thiele, S. L. Generation of a model of L-DOPA-induced dyskinesia in two different mouse strains. J. Neurosci. Methods. 197, 193-208 (2011).
- Henry, B., Crossman, A. R., Brotchie, J. M. Characterization of a rodent model in which to investigate the molecular and cellular mechanisms underlying the pathophysiology of L-dopa-induced dyskinesia. Adv. Neurol. 78, 53-61 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon