Method Article
Mapeo óptico de potenciales de acción y transitorios de calcio en el corazón de ratón
En este artículo
Resumen
Este documento detalla el procedimiento de disección, la configuración instrumental y las condiciones experimentales durante el mapeo óptico del potencial de membrana (Vm) y el calcio intracelular transitoria (CAT) en Langendorff perfundidos aislados intactos los corazones de ratón.
Resumen
El corazón de ratón es un modelo popular para estudios cardiovasculares, debido a la existencia de tecnología de bajo costo para la ingeniería genética en esta especie. Fenotipo cardiovascular fisiológica del corazón del ratón se puede hacer fácilmente utilizando imágenes de fluorescencia utilizando varias sondas de potencial de membrana (V m), los transitorios de calcio (CAT), y otros parámetros. Acoplamiento excitación-contracción se caracteriza por la dinámica de la acción del calcio intracelular y el potencial, por lo tanto, es muy importante planificar tanto m V y CAT simultáneamente desde la misma ubicación en el centro 4.1. Mapeo simultáneo óptica de Langendorff perfundidos corazones de ratón tiene el potencial para dilucidar los mecanismos subyacentes insuficiencia cardíaca, arritmias, enfermedades metabólicas y otras enfermedades del corazón. La visualización de la activación, la velocidad de conducción, la duración del potencial de acción y otros parámetros en una gran variedad de sitios no se puede lograr de la investigación a nivel celular, pero está bien resuelto por mapeo óptico 1,5,6. En este trabajo se presenta la configuración de los instrumentos y las condiciones experimentales para el mapeo simultáneo óptica de V m y el gato en el corazón de ratón con alta resolución espacio-temporal con el estado de la técnica de la tecnología CMOS de imagen. Consistente grabaciones ópticas obtenidas con este método ponen de manifiesto que la cartografía óptica simultánea de los corazones de ratón Langendorff perfundidos es factible y fiable.
Protocolo
1. La preparación avanzada de soluciones de reserva
- Se preparan dos soluciones estándar de solución de Tyrode (16x) de antemano en agua desionizada y almacenarlas a 4 º C:
- Archivo I (119.872 g / L NaCl, 3,056 g / L de CaCl 2 (2H 2 O), 5,6 g / L KCl, 2,6274 g / L NaH 2 PO 4, 3,408 g / L MgCl 2 (6H 2 O), (Fisher Lawn científica, Feria, NJ));
- Archivo II (26,88 g / L NaHCO3, (Fisher Scientific, Fair Lawn, NJ)).
- Preparar soluciones madre de los tintes fluorescentes. Para evitar la congelación y descongelación repetida, que almacenan el 30 alícuotas de ambos colorantes a -20 ° C, lo cual es suficiente para un experimento:
- Sensibles al voltaje tinte RH237 (Invitrogen, Carlsbad, CA) solución de reserva, 1,25 mg / ml en dimetilsulfóxido (DMSO, Sigma, St. Louis, MO);
- Indicador de calcio Rhod-2AM (Invitrogen, Carlsbad, CA) de la solución madre, 1 mg / ml de solución de DMSO.
- Prepare la excitación-contracción blebbistatin desacoplador solución madre (Bioscience Tocris, St. Louis, MO, 2 mg / ml de solución en DMSO) con antelación y almacenar el blebbistatin disuelto a 4 ° C.
2. Preparar las soluciones de perfusión y la configuración experimental 7
- Recién preparar la solución de Tyrode de 2L (128.2mM NaCl, CaCl2 1,3 mm (2H 2 O), 4.7mm KCl, 1.05mM MgCl 2 (6H 2 O), 1.19mM NaH 2 PO 4, 20 mM NaHCO 3, 11,1 mm de D-glucosa en agua desionizada, pH = 7,35 ± 0,05). Si la solución madre se está utilizando para hacer 2 litros de solución de Tyrode (suficiente para un experimento) tomar 1750 ml de agua desionizada y mezclar con 125 ml de archivo I, 125 ml de archivo II, y 4 g de glucosa.
- Encienda las dos bombas de los sistemas de perfusión. Conjunto de la bomba peristáltica (Peri-Star, WPI, Sarasota, EE.UU.) que se utiliza para la perfusión retrógrada a 40 mL / min. Establecer la otra bomba peristáltica (Cole-Parmer Masterflex bomba Peristalic L / S, Cole-Parmer Instrument Company, Vernon Hills, Illinois) que se utiliza para superfusión y regresar a la perfusión de nuevo al depósito de la celebración de 80 mL / min.
- Lave el sistema de perfusión con el 70% de etanol durante 30 minutos y luego con agua desionizada 2L.
- Una vez que toda el agua desionizada es evacuado de la cámara, hacer circular la solución de Tyrode y pasarlo por un filtro de 5 micras (Millipore, Billerica, MA, EE.UU.). Caliente la perfusión a 37 ° C con una camisa de agua y recirculación (ThermoNESLAB EX7, Newtown, EE.UU.) y oxigenar la perfusión por burbujeo de O 2 / CO 2 (95% / 5%) de gas en la solución. Monitorear el pH de la solución con un pH-metro (Oakton Instruments, Vernon Hills, IL) y ajustar la velocidad de O 2 / CO 2 burbujas para mantener el pH a 7,35 ± 0,05. Continuar el seguimiento y la temperatura del pH durante el experimento.
- El aparato de doble mapeo óptico se compone de dos cámaras Ultima Micam-L CMOS (SciMedia, Costa Mesa, CA) que tienen alta resolución espacial (100x100 píxeles, 230 ± 20 m por píxel) y la resolución temporal (1000-3000 frames / seg). Fijar un filtro pasa-banda (590 ± 15 nm, Thorlabs, Newton, Nueva Jersey) frente a la cámara de imágenes de calcio designado, mientras que, un filtro de paso largo (> 700 nm, Thorlabs, Newton, Nueva Jersey), debe ser colocado en delante de la cámara de tensión imágenes designado. Las cámaras están dispuestos perpendicularmente entre sí por un titular, que contiene un espejo dicroico (635 nm de corte, Omega óptico, de Brattleboro, VT). Inmediatamente debajo del soporte de la cámara dual existe un objetivo (Nikon Nikkor 55 mm 1:1,4 235.052), que se centra la emisión de luz que viene del corazón en el espejo dicroico. La distancia de trabajo es de aproximadamente 3 cm.
La luz de excitación es generada por una lámpara halógena (Newport Oriel Instruments, Stratford, CT; SciMedia, Costa Mesa, CA) y se transmite a través de un filtro de calor, velocidad y filtro pasa banda (520 ± 45 nm). Una guía de luz flexible dirige la luz de paso de banda filtrada en la preparación, y una velocidad de obturación se utiliza para asegurar que la preparación se expone a la luz hasta la adquisición de imágenes para evitar photobleaching de los tintes. - Prepare Ag / AgCl 2 electrodos de estimulación y detección de antemano y los instala en la cámara antes de poner el corazón. Asegúrese de que los amplificadores y los filtros se ajustan a los niveles apropiados.
3. La cosecha del corazón de ratón, canular, y establecer la perfusión Langendorff
- Anestesiar el ratón con ketamina / xilacina (ketamina, 80mg/kg de peso corporal, la xilazina, 10 mg / kg de peso corporal) y heparina (100 unidades) por inyección intraperitoneal. Asegurar un nivel adecuado de anestesia por la falta de reflejo de dolor.
- Después de una incisión en la mitad del esternón, eliminar rápidamente el corazón y lavarlo en oxigenada (95% O 2, 5% CO 2), a temperatura constante (37 ± 1 ° C) de Tyrode solución.
- Utilizando un microscopio de disección, A identificar rápidamente la aorta y hacer un corte limpio a través de la aorta ascendente por debajo de la arteria subclavia derecha. Una breve sección de la aorta se conecta a un encargo de calibre 21 con una punta de la cánula quemado. 4-0 de negro trenzado sutura de seda (Corporación de Especialidades Quirúrgicas, Reading, PA) se utiliza para fijar el corazón en la cánula. Después de la canulación, el corazón es retrógrada y perfundidos superfused con Tyrode. La velocidad de perfusión retrógrada se ajusta en el rango de 5.2 mL / min para mantener la presión aórtica entre 60 y 80 mmHg (transductor de presión, World Precision Instruments Inc. (WPI), Sarasota, EE.UU.; puente Amplificador TBM4M, WPI, Sarasota, EE.UU.).
- Después de que el corazón se cánula, los pulmones, el timo y el tejido graso se diseca y se retira.
- El corazón aislado se fija (Herramientas Artes Ciencias) en el vértice de la parte inferior de la cámara de perfusión (recubierto Sylgard) para evitar que la corriente inducida por el movimiento. Los apéndices auriculares derecho e izquierdo también se extendía y se fija (Herramientas Artes Ciencia, Inc, Foster City, CA) a la parte inferior de la cámara, lo que proporciona un área máxima de medición óptica de las aurículas.
¡Muy importante! Un tubo de silicona que se introduce en el ventrículo izquierdo a través de las venas pulmonares y se fija con sutura de seda de tejido conectivo cerca. Esto evita la congestión y la acidificación de la solución de la perfusión atrapados en el ventrículo izquierdo, lo cual es especialmente importante después de la supresión de las contracciones ventriculares con un desacoplador de excitación-contracción (véase la Parte 4 el paso 19). - Un electrodo de encargo se coloca en la superficie del corazón para llevar a cabo la estimulación de estimulación, que se genera por el Maestro-8 (AMP Instruments Ltd, Jerusalén, Israel) o PowerLab 26T (AD Instruments, Sydney, Australia).
- Una cubierta de cristal pequeño se fija en la superficie de la solución sobre el corazón para reducir los artefactos de movimiento de la solución de vibración.
- Enfocar la luz de excitación en el corazón. Además, ajustar la distancia entre el aparato de doble cámara y el corazón para que la resolución máxima se obtendrá.
- Apague todas las luces en la sala y comenzar con las grabaciones eléctricas PowerLab 26T.
4. La tensión de carga y tintes sensibles al calcio y desacoplador de excitación-contracción
- De calentamiento de 0,6 ml blebbistatin. Mezclar 0,5 ml de la blebbistatin con la perfusión en el depósito de retención. Diluir el resto de 0,1 ml de blebbistatin en 1 ml de solución de Tyrode y lentamente se inyecta (en un periodo de 20 minutos) a través de un puerto de drogas cerca de la cánula. Observe como blebbistatin reduce gradualmente el artefacto de movimiento.
- Diluir 30 l de solución de la tensión de valores sensibles tinte RH237 en una solución de 1 ml de Tyrode e inyecte lentamente durante 5-7 minutos en el puerto de inyección misma blebbistatin.
- 30 l de calcio indicador de Rhod-2 1:01 AM es mezclado con Pluronic F127 (Invitrogen, Carlsbad, CA, solución al 20% en DMSO) y luego se diluyen en 1 ml de solución de Tyrode y poco a poco se aplica sobre 5-10 minutos a través del puerto de inyección misma .
- Esperar 5-10 minutos para blebbistatin y tintes para llegar a la membrana celular y el citosol. Continuar con el protocolo cuando el movimiento se suprime por completo.
- Un seguimiento continuo de ECG durante todo el procedimiento para asegurar el normal funcionamiento eléctrico del corazón.
- Comenzará grabaciones fluorescentes señal con el SciMedia de software a medida (SciMedia, Costa Mesa, CA).
5. Los resultados representativos:

Figura 1. Arreglo experimental para la perfusión, registros eléctricos y mapeo óptico.
EM = emisiones; Lp = paso largo
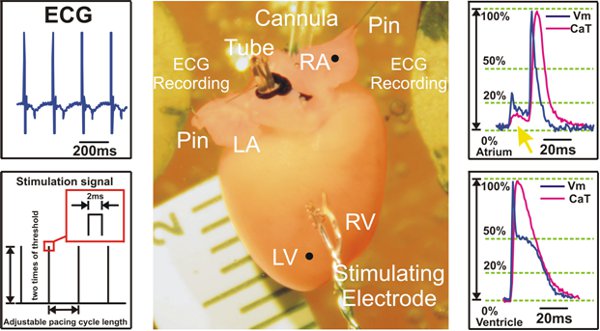
Figura 2. Preparación experimental y ejemplos de la señal registrada durante la estimulación ventricular. Izquierda: Las señales de ECG se obtienen de Ag / AgCl 2 electrodos de disco (Arriba) y un ejemplo de protocolo de estimulación S1S1 se muestra (abajo). Centro: ratón Langendorff preparación del corazón. A la derecha: Representante de los potenciales de acción óptica y señales de calcio transitorios de la aurícula (parte superior) y los ventrículos (parte inferior) se muestran. La flecha amarilla (Top) apunta a la dispersión de la señal fluorescente procedente de los ventrículos, que se ve en las grabaciones auricular.
LV = ventrículo izquierdo; RV = ventrículo derecho, LA = aurícula izquierda, RA = aurícula derecha
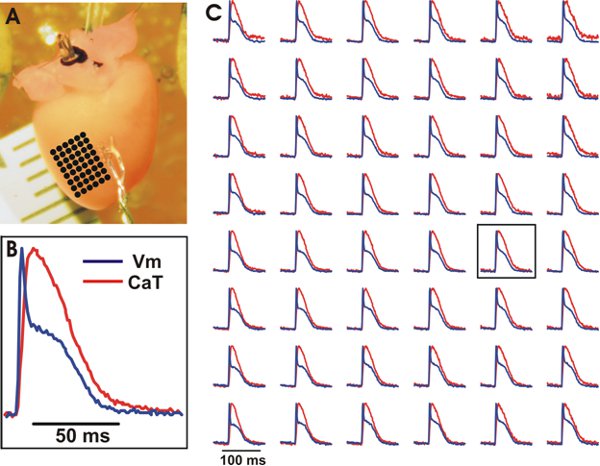
Figura 3. Representante grabaciones ópticas de V m y al gato de los ventrículos del corazón del tipo de ratón salvaje. A. La preparación experimental con una serie de puntos espaciados uniformemente marcados con puntos negro cuyas grabaciones ópticas se puede ver en (C). Ejemplo B. rastreo de V m y al gato de una ubicación central en la matriz (véase el recuadro in (C)). C. V m (azul) y CAT (rojo) de la matriz de puntos espaciados uniformemente. Las señales fueron agrupadas 3x3.
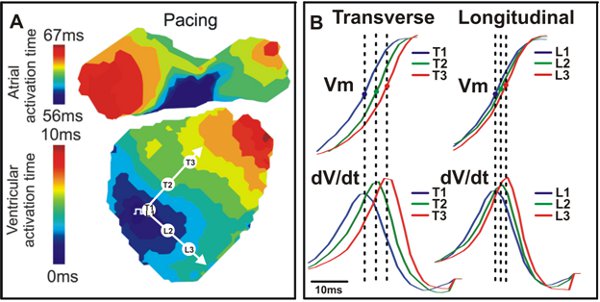
Figura 4. Mapa de activación y conducción. A. Un ejemplo de mapa de activación de un corazón tipo de ratón salvaje con transversal (T) y longitudinal (L) direcciones indicadas por las flechas blancas. B. V señales m (Arriba) y dV / dt (abajo) que corresponden a los tres puntos de vista en A (T1, T2, T3, L1, L2, L3).
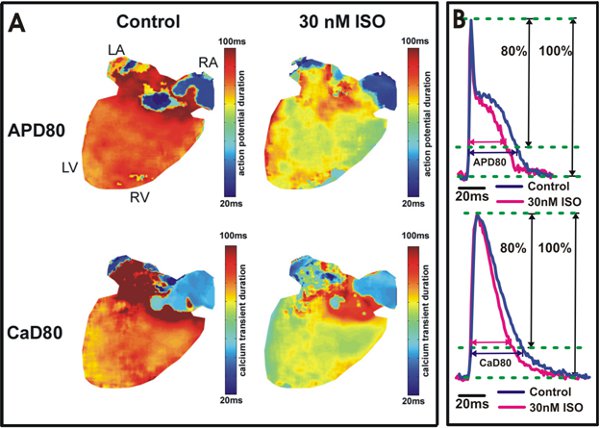
Figura 5. Potencial de acción y el análisis de calcio duración transitoria. A. duración potencial de acción en la repolarización del 80% (APD80) y la duración de calcio transitorio en la relajación del 80% (80 CAD) se muestran los mapas de un corazón en condiciones control (izquierda) y después de 30 aplicaciones isoproterenol nM (derecha). El color amarillo / verde en los ventrículos (derecha) indica isoproterenol acorta APD80 y 80 CAD. Ejemplo B. trazados de APD80 y 80 CAD de los ventrículos del ratón de tipo salvaje (Arriba) y en los atrios (abajo).
Discusión
En este experimento se modificó el método de perfusión Langendorff mediante la adición de un pequeño tubo de silicona, que es especialmente importante después de la supresión de las contracciones ventriculares con un desacoplador de excitación-contracción. El tubo de silicona se utiliza para evitar la congestión de solución, la acidificación de la solución de perfusión, y el desarrollo de la isquemia en el ventrículo izquierdo. El corazón de ratón es muy sensible a la hipotermia, por lo que las variaciones de temperatura a través del corazón hará que las diferencias artificiales en la duración potencial de acción. En consecuencia, un sistema de calefacción se llevó a cabo en la cámara de perfusión para mantener una temperatura constante de 37 ° C durante la totalidad del experimento 8. Desde un modelo de Langendorff no retiene la inervación del corazón, es necesario considerar la incorporación de los neurotransmisores a la perfusión con el fin de investigar el tono fisiológico simpático y parasimpático 9. Además de perfusión retrógrada, además de superfusión del corazón ayuda a mantener adecuados los parámetros ambientales tales como el pH y la temperatura. En este método, el corazón Langendorff perfundidos fue colocado en posición horizontal. Una configuración de la perfusión Langendorff verticales también se puede utilizar 10, pero puede resultar en la mecánica cardíaca ligeramente diferente 11. Además de las cámaras CMOS, detectores de alternativas también están disponibles y se pueden aplicar a mapa V m y el gato al mismo tiempo 12.
Aplicación de las cámaras CMOS de alta resolución espacio-temporal asegura la exactitud de las grabaciones, sin embargo, las señales ópticas de mapeo no son de una sola célula. Más bien, cada señal fluorescente proviene de cientos o miles de células, en función de magnificación óptica. La fluorescencia ventricular mucho más grande puede distorsionar las señales de dispersión óptica auricular, por lo tanto, una cuidadosa interpretación de las señales registradas ópticamente es necesario. Otra limitación de la preparación del ratón es la distorsión de la señal y el ruido inducido por la curvatura de la superficie debido al pequeño tamaño del corazón 13. Mediciones de velocidad de conducción puede ser alterada, no sólo de la curvatura del corazón del ratón, sino también de la polaridad del electrodo y los electrodos virtual. Para lograr la precisión de la velocidad de conducción, la anisotropía de la activación, y los mapas de la repolarización, enfoque correcto de la cámara en la superficie del corazón es esencial.
En este método, en tiempo real ECG puede complementar la investigación óptica de la electrofisiología cardiaca. Sensibles al voltaje medio de contraste (RH237) y el indicador de calcio (Rhod-2AM) son utilizados en el protocolo debido a su rápida respuesta, la excitación similar, y los espectros de emisión de 3,7 distinta. Hay combinaciones alternativas de tintes que se pueden utilizar para medir la V m y otro gato que RH237 y 3 Rhod-2AM. Una novela de tintes sensibles al voltaje, PGHI, con un gran cambio de Stoke (> 200 nm) fue encontrado para permitir una mejor m V y las señales de gato, porque la mayor separación de las longitudes de onda de emisión entre PGHI y 14 de Rhod-2AM. Mejoras en el futuro puede centrarse en la exploración de nuevas sondas fluorescentes, el desarrollo de detectores de imágenes nuevas y mejores programas informáticos de procesamiento de imágenes. Una resolución más alta y novedosa las técnicas de imagen óptico para el mapeo óptico 3D también son importantes las orientaciones futuras de mapeo óptico 5.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
NIH concede R01 HL085369.
Materiales
| Name | Company | Catalog Number | Comments |
| Químico | Empresa | Número de catálogo | |
| NaCl | Fisher Scientific, Fair Lawn, NJ | S271-1 | |
| CaCl2 (2H 2 O) | Fisher Scientific, Fair Lawn, NJ | C79-500 | |
| KCl | Fisher Scientific, Fair Lawn, NJ | S217-500 | |
| MgCl 2 (6H 2 O) | Fisher Scientific, Fair Lawn, NJ | M33-500 | |
| NaH 2 PO 4 (H 2 O) | Fisher Scientific, Fair Lawn, NJ | S369-500 | |
| NaHCO3 | Fisher Scientific, Fair Lawn, NJ | S233-3 | |
| D-glucosa | Fisher Scientific, Fair Lawn, NJ | D16-1 | |
| Blebbistatin | Bioscience Tocris, Ellisville, MO | 1760 | |
| RH237 | Invitrogen, Carlsbad, CA | S1109 | |
| Rhod-2AM | Invitrogen, Carlsbad, CA | R1244 | |
| Pluronic F127 | Invitrogen, Carlsbad, CA | P3000MP | |
| Dimetilsulfóxido (DMSO) | Sigma, St. Louis, MO | D2650 |
Referencias
- Efimov, I. R., Rendt, J. M., Salama, G. Optical maps of intracellular [Ca2+]i transients and action-potentials from the surface of perfused guinea-pig hearts. Circulation. 90, 1-1 (1994).
- Efimov, I. R. Optical mapping of repolarization and refractoriness from intact hearts. Circulation. 90, 1469-1480 (1994).
- Choi, B. R., Salama, G. Simultaneous maps of optical action potentials and calcium transients in guinea-pig hearts: mechanisms underlying concordant alternans. J Physiol. 529, 171-188 (2000).
- Pruvot, E. J. Role of calcium cycling versus restitution in the mechanism of repolarization alternans. Circ Res. 94, 1083-1090 (2004).
- Efimov, I. R., Nikolski, V. P., Salama, G. Optical imaging of the heart. Circ Res. 95, 21-33 (2004).
- Fast, V. G., Dhein, S., Delmoar, M. Recording action potential using voltage sensitive dyes. Practical methods in cardiovascular research. , 233-255 (2005).
- Glukhov, A. V. Differential K(ATP) channel pharmacology in intact mouse heart. J Mol Cell Cardiol. , (2009).
- Baker, L. C. Enhanced dispersion of repolarization and refractoriness in transgenic mouse hearts promotes reentrant ventricular tachycardia. Circ Res. 86, 396-407 (2000).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacol Res. 41, 613-627 (2000).
- Efimov, I. R. Virtual electrode polarization in the far field: implications for external defibrillation. Am J Physiol Heart Circ Physiol. 279, 1055-1070 (2000).
- Hammouda, M., Kinosita, R. The coronary circulation in the isolated heart. J Physiol. 61, 615-628 (1926).
- Salama, G., Hwang, S. M. Simultaneous optical mapping of intracellular free calcium and action potentials from Langendorff perfused hearts. Curr Protoc Cytom. 12, 17-17 (2009).
- Lou, Q. Quantitative panoramic imaging of epicardial electrical activity. Ann Biomed Eng. 36, 1649-1658 (2008).
- Salama, G. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. J Membr Biol. 208, 125-140 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados