Method Article
在小鼠心脏的动作电位和钙瞬变的光学测绘
摘要
本文详细解剖程序,工具设置,并在光学测绘跨膜电位(VM)和细胞内钙瞬变(CAT),在隔离的Langendorff完整的实验条件下灌注小鼠心脏。
摘要
鼠标心脏是一个流行的模式由于成本低,在这个物种的基因工程技术存在心血管研究。心血管鼠标心脏生理表型可以很容易地使用荧光成像技术,采用各种探头跨膜电位(V M),钙瞬变(CAT),以及其他参数。兴奋收缩偶联的特点是动作电位和细胞内钙离子的动态,因此,它是极其重要的映射 V M和CAT同时从同一位置上的心脏 1-4 。同时,从光映射的Langendorff灌注小鼠心脏有可能澄清心脏衰竭,心律失常,代谢性疾病,和其他心脏疾病的基本机制。可视化激活,传导速度减慢,动作电位时程,并在无数的网站的其他参数可以不实现从细胞水平调查, 但光学映射1,5,6解决。在本文中,我们目前的仪表安装和实验条件的同步光映射在小鼠心脏V M和CAT高时空决议,利用国家的最先进的CMOS成像技术。用这种方法得到一致的光录音说明的Langendorff灌注小鼠心脏,同时光的映射是可行和可靠的。
研究方案
1。股票方案的高级准备
- 准备提前在去离子水台氏液(16倍)的股票解决方案,它们存储在4 ° C时:
- 股票我(119.872克/ L的NaCl,3.056 g / L的氯化钙2(H 2 O),5.6 g / L的氯化钾,2.6274克/升的NaH 2 PO 4,3.408 g / L的氯化镁2(H 2 O),(费舍尔科学,公平的草坪,NJ));
- 证券交易所II(26.88 g / L的碳酸氢钠,(费舍尔科学,公平的草坪,新泽西州))。
- 准备荧光染料的股票解决方案。为了避免反复冻融,我们店30μL分装于-20 ° C,这是一个实验是足够了两种染料:
- 电压敏感染料RH237(Invitrogen公司,卡尔斯巴德,加利福尼亚州)原液,1.25 mg / ml的二甲基亚砜溶液(DMSO,Sigma公司,圣路易斯,密苏里州);
- 钙指标Rhod - 2AM(Invitrogen公司,卡尔斯巴德,加利福尼亚州)股票的解决方案,为1 mg / ml的溶液,在DMSO。
- 准备兴奋收缩解偶联剂blebbistatin原液(Tocris生物科学,圣路易斯,密苏里州,为2 mg / ml的溶液,在DMSO)提前溶解blebbistatin存储在4 ° C。
2。准备灌注的解决方案和实验装置7
- 刚准备2L台氏液(128.2mM氯化钠,氯化钙为1.3mm 2(H 2 O),4.7毫米氯化钾,氯化镁1.05mM 2(H 2 O),1.19mM的NaH 2 PO 4,20MM 11.1mM碳酸氢钠3,D -葡萄糖在去离子水,pH值= 7.35 ± 0.05)。如果正在使用原液,使台氏液(足够一个实验)在我的股票,证券交易所二125毫升125毫升1750毫升的去离子水和混合,和4G的葡萄糖2L。
- 打开两个泵灌注系统。设置蠕动泵(围之星,WPI的,萨拉索塔,美国)是逆行灌注40毫升/分钟。设置其他蠕动泵(科尔 - 帕默的Masterflex Peristalic泵升/秒,科尔 - 帕默仪器公司,伊利诺伊州弗农山,)使用灌流和返回灌流控股水库至80毫升/分钟。
- 2L去离子水30分钟,然后用70%乙醇的清洗灌注系统。
- 一旦所有的去离子水是从室疏散,分发台氏液,并通过5微米过滤器(Millipore公司,比尔里卡,MA,USA)。灌流预热至37 °与水套循环(ThermoNESLAB EX7,现代城,美国)和冒泡到解决方案中的 O 2 / CO 2(95%/ 5%)气体氧气灌流。监测pH计(Oakton仪器,弗农山,IL)溶液的pH值和调整的O 2 / CO 2冒泡率保持在7.35 ± 0.05 pH值。继续监测实验过程中的pH值和温度。
- 双光学测绘仪器由两个MiCAM终极- L的CMOS摄像头(SciMedia,科斯塔梅萨,CA),有较高的空间(100x100像素,每个像素的230 ± 20微米)和时间(1,000-3,000帧/秒)的分辨率。修正一个带通滤波器(590 ± 15纳米,Thorlabs,牛顿,新泽西州)在指定的钙成像相机面前;同时,长通滤波器(> 700纳米,Thorlabs,牛顿,新泽西州)需要被定位在前面指定的电压成像相机。该相机是垂直排列的持有人,其中包含了分色镜(伯瑞特波罗(Brattleboro),欧米茄光,635 nm的截止,VT)。持有的双摄像头下方有一个镜头(尼康尼克尔55毫米1:1.4 235052),其重点是从心脏到分色镜发射光。工作距离大约是3厘米。
激发光所产生的卤素灯(新港奥丽尔仪器,斯特拉特福,CT; SciMedia,科斯塔梅萨,加利福尼亚),并通过热过滤器,快门,和带通滤波器(520 ± 45纳米)通过。一个灵活的导光引导到准备带通滤波的光,快门是用来确保该制剂是暴露在光线下图像采集期间,才避免了染料的漂白。 - 准备提前起搏和传感2银/氯化银电极放在心脏前室安装。确保放大器和滤波器调整到适当水平。
3。收获的小鼠心脏,cannulate,并成立了Langendorff灌流
- 鼠标麻醉与氯胺酮/甲苯噻嗪(氯胺酮,80mg/kg体重;甲苯噻嗪,10毫克/公斤体重)和腹腔注射肝素(100单位)。保证适当的麻醉水平,缺乏痛觉反射。
- 中旬胸骨正中切口后,迅速 取出心脏和洗中含氧(95%O2,5%的CO 2),恒温(37 ± 1 ° C)台氏液。
- 使用解剖显微镜迅速查明整个下面的右锁骨下动脉升主动脉主动脉和一个干净的切割。短款的主动脉,然后连接到一个自定义与燃烧尖21号套管。 4-0黑色编织丝线缝合(外科专业公司,读,PA)是用于固定到套管的心脏。后插管,心脏逆行灌注,并与台氏液灌流。逆行灌注率调整在2-5毫升/分钟,以保持动脉压60至80毫米汞柱(压力传感器,世界精密仪器公司(WPI),萨拉索塔,美国的范围;桥式放大器TBM4M,WPI,萨拉索塔美国)。
- 是空心的心脏后,肺,胸腺和脂肪组织,然后解剖和删除。
- 离体心脏灌注室底部的顶点(Sylgard涂层),以防止流诱导运动是固定的(精细科学的工具)。左,右心耳也拉伸和固定(精细的Foster City,CA公司,科学工具)腔的底部,它提供了心房的光学测量的最大表面面积。
很重要的!一个小的硅管插入左心室,通过肺静脉和丝线缝合固定在附近的结缔组织。这防止拥堵被困在左心室,这是抑制与兴奋收缩解偶联剂的室性早搏后显得尤为重要(见第4部分第19步)灌流和酸化的解决方案。 - 自定义的电极放置在心脏表面进行起搏刺激,这是由主8“(AMP仪器有限公司,耶路撒冷,以色列)或PowerLab系统26T(公元仪器,悉尼,澳大利亚)。
- 一个小玻璃盖是固定的解决方案,在振动的解决方案,以减少运动伪影的心脏表面上。
- 重点对心脏的激发光。此外,调整双摄像头设备,使最高分辨率将获得心脏之间的距离。
- 在房间里所有的灯关闭,并开始使用PowerLab系统26T的电气录音。
4。负载电压和钙敏感染料和兴奋收缩解偶联剂
- 热身0.6毫升blebbistatin。混合控股水库灌流blebbistatin 0.5毫升。台氏液,在1毫升稀释blebbistatin余下0.1毫升,慢慢注入通过套管附近的药物端口(超过20分钟的时间内)。观察作为blebbistatin逐渐减少了运动伪影。
- 电压敏感染料RH237台氏液1毫升的原液稀释30微升,超过5-7分钟,慢慢注入相同的进样口作为blebbistatin。
- 30μL,钙指标Rhod凌晨2点是聚醚F127(Invitrogen公司,卡尔斯巴德,加利福尼亚,20%DMSO溶液)混合,然后在台氏液1毫升稀释,慢慢地通过相同的进样口的应用在5-10分钟1:1 。
- 等待5-10分钟blebbistatin和染料达到细胞膜和细胞质。继续与运动时是完全压制的协议。
- 连续监测心电图在整个过程的录音,以确保正常心脏的电气功能。
- 开始使用SciMedia定制软件(SciMedia,科斯塔梅萨,CA)的荧光信号录音。
5。代表性的成果:

图1实验装置灌注,电气录音和光学测绘。
EM =排放; LP =长通
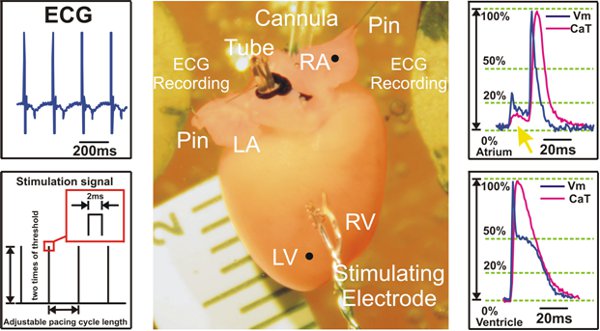
图2。心室起搏期间录得的实验准备和信号的例子。左:心电图信号从Ag / AgCl电极圆盘电极(顶部)和S1S1刺激协议的一个例子是显示(底部)收集。中心的Langendorff小鼠心脏的准备。右:代表光的动作电位和钙瞬变信号,从心房(顶)和心室(下)所示。黄色箭头(上)点的荧光信号散射来自心室,这是在心房录音。
LV =左心室; RV =右心室; LA =左心房; RA =右心房
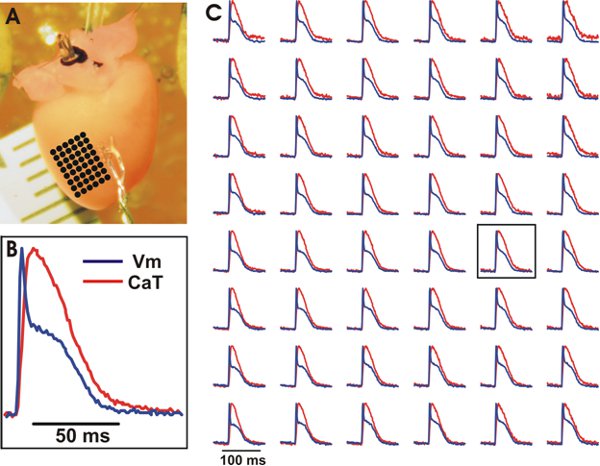
图3。V M和猫从野生型小鼠心脏心室代表的光录音。 A.一个均匀分布的黑点标记,(c)中可以看出,其光学录音地点数组的实验准备。 B.范例跟踪从一个阵列上的中央位置(见方框 V M和CAT我N(C))。 C. V M(蓝色)和CAT(红色)从均匀分布的位置阵列。信号进行分级的3x3。
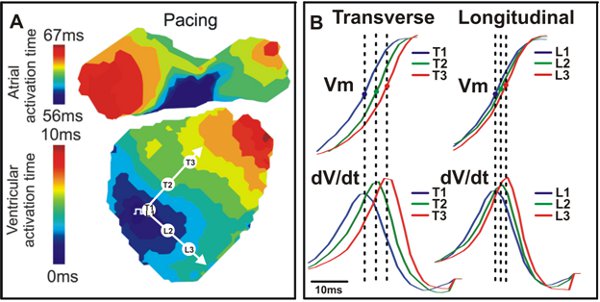
图4。激活地图和传导。答:例如,从横向(T)和纵向(L)的白色箭头指示的方向与野生型小鼠心脏激活的地图。 B. V M信号(上)和对应的dV / dt(下)看到这三个点(T1,T2,T3,L1,L2,L3)。
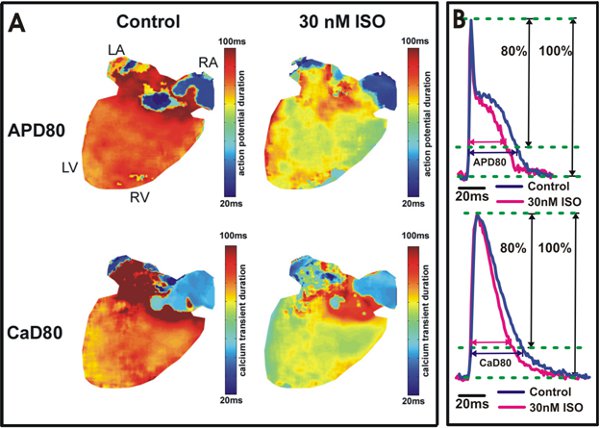
图5。动作电位和钙瞬变的持续时间分析。 A.行动在80%复极(APD80)和80%放宽(CaD80)的钙瞬变持续时间可能持续的时间地图显示从控制条件下的心脏(左)和30纳米异丙应用程序(右)后。在心室的黄/绿颜色(右)表示,异丙肾上腺素缩短APD80和CaD80。 B. APD80和CaD80例描从野生型小鼠心室(顶部)和心房(下)。
讨论
在这个实验中,我们修改了加入一个小的硅管,这是特别重要的室性早搏抑制与兴奋收缩解偶联剂后Langendorff灌流方法。硅管是用来防止解充血,灌注液酸化,并在左心室缺血的发展。鼠标心脏是,以低温非常敏感,因此,整个心脏的温度变化会导致动作电位持续时间的人为差异。因此,灌注室加热系统实施,以保持一个温度恒定在37 ° C,在整个实验的 8 。的Langendorff模型由于不保留神经支配的心脏,需要考虑增加神经递质的灌流,以探讨生理和副交感神经的语气 9 。除了逆行灌注,灌流的心脏除了有助于保持适宜的环境参数,如pH值和温度。在此方法中的Langendorff灌流心脏水平放置。一个垂直Langendorff灌流设置,也可以用 10,但可能会导致在略有不同心脏力学11。除了CMOS摄像头,其他探测器也可,并可以应用到地图 V M和CAT 同时 12 。
高时空分辨率的CMOS摄像头的应用,保证了录音的准确性,但是,光的映射信号不是从一个单细胞。相反,每个荧光信号来自数百或数千个细胞,视光学倍率。心室荧光大得多,可以扭曲心房光散射信号;因此,细致的解释是需要的光学记录的信号。鼠标准备的另一个限制是由表面的曲率,由于体积小的心脏13引起的信号失真和噪声。不仅从鼠标心脏的曲率,但也可以从电极的极性和虚拟电极传导速度的测量,可以改变。为了实现传导速度,激活各向异性,和复极地图的准确性,正确的相机的聚焦在心脏表面是必不可少的。
在此方法中,实时心电图记录可以补充的心脏电生理光学调查。电压敏感染料(RH237)和钙(Rhod - 2AM)使用的协议,因为他们的反应速度快,类似的激励,和不同的发射光谱3,7。有替代染料,可用于测量V M和CAT比RH237和Rhod - 2AM 3组合。一种新型电压敏感染料,PGHI斯托克的一个大转变(> 200nm的),被发现,以便更好的 V M和猫,因为更大的分离PGHI和Rhod上午02时14之间的发射波长信号。今后的改进重点放在探索新型的荧光探针,开发新的成像探测器,和改进的图像处理软件。较高的分辨率和光学成像方式,新型三维光映射也是重要的未来发展方向的光的映射5。
披露声明
没有利益冲突的声明。
致谢
国立卫生研究院拨款R01 HL085369。
材料
| Name | Company | Catalog Number | Comments |
| 化学 | 公司 | 产品编号 | |
| 氯化钠 | 费舍尔科学,公平的草坪,新泽西州 | S271 - 1 | |
| 氯化钙2(H 2 O) | 费舍尔科学,公平的草坪,新泽西州 | C79 - 500 | |
| 氯化钾 | 费舍尔科学,公平的草坪,新泽西州 | S217 - 500 | |
| 氯化镁2(H 2 O) | 费舍尔科学,公平的草坪,新泽西州 | M33 - 500 | |
| 的NaH 2 PO 4(H 2 O) | 费舍尔科学,公平的草坪,新泽西州 | S369 - 500 | |
| 碳酸氢钠3 | 费舍尔科学,公平的草坪,新泽西州 | S233 - 3 | |
| D -葡萄糖 | 费舍尔科学,公平的草坪,新泽西州 | D16 - 1 | |
| Blebbistatin | Tocris生物科学,Ellisville,莫 | 1760 | |
| RH237 | Invitrogen公司,卡尔斯巴德,CA | S1109 | |
| Rhod - 2AM | Invitrogen公司,卡尔斯巴德,CA | R1244 | |
| 聚醚F127 | Invitrogen公司,卡尔斯巴德,CA | P3000MP | |
| 二甲基亚砜(DMSO) | Sigma公司,圣路易斯,密苏里州 | D2650 |
参考文献
- Efimov, I. R., Rendt, J. M., Salama, G. Optical maps of intracellular [Ca2+]i transients and action-potentials from the surface of perfused guinea-pig hearts. Circulation. 90, 1-1 (1994).
- Efimov, I. R. Optical mapping of repolarization and refractoriness from intact hearts. Circulation. 90, 1469-1480 (1994).
- Choi, B. R., Salama, G. Simultaneous maps of optical action potentials and calcium transients in guinea-pig hearts: mechanisms underlying concordant alternans. J Physiol. 529, 171-188 (2000).
- Pruvot, E. J. Role of calcium cycling versus restitution in the mechanism of repolarization alternans. Circ Res. 94, 1083-1090 (2004).
- Efimov, I. R., Nikolski, V. P., Salama, G. Optical imaging of the heart. Circ Res. 95, 21-33 (2004).
- Fast, V. G., Dhein, S., Delmoar, M. Recording action potential using voltage sensitive dyes. Practical methods in cardiovascular research. , 233-255 (2005).
- Glukhov, A. V. Differential K(ATP) channel pharmacology in intact mouse heart. J Mol Cell Cardiol. , (2009).
- Baker, L. C. Enhanced dispersion of repolarization and refractoriness in transgenic mouse hearts promotes reentrant ventricular tachycardia. Circ Res. 86, 396-407 (2000).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacol Res. 41, 613-627 (2000).
- Efimov, I. R. Virtual electrode polarization in the far field: implications for external defibrillation. Am J Physiol Heart Circ Physiol. 279, 1055-1070 (2000).
- Hammouda, M., Kinosita, R. The coronary circulation in the isolated heart. J Physiol. 61, 615-628 (1926).
- Salama, G., Hwang, S. M. Simultaneous optical mapping of intracellular free calcium and action potentials from Langendorff perfused hearts. Curr Protoc Cytom. 12, 17-17 (2009).
- Lou, Q. Quantitative panoramic imaging of epicardial electrical activity. Ann Biomed Eng. 36, 1649-1658 (2008).
- Salama, G. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. J Membr Biol. 208, 125-140 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。