Method Article
マウスの心臓の活動電位およびカルシウムトランジェントの光学的マッピング
要約
そのまま孤立ランゲンドルフ灌流マウス心臓における本論文では詳細解剖の手順を、楽器のセットアップ、および実験条件膜電位の光学マッピング(VM)の間と細胞内カルシウムトランジェント(CAT)。
要約
マウスの心臓では、この種の遺伝子工学のための低コスト技術の存在に起因する心血管研究のための人気モデルです。マウスの心臓の心血管系の生理的な表現型解析は容易に膜電位(V M)、カルシウムトランジェント(CAT)、およびその他のパラメータのための様々なプローブを用いて蛍光イメージングを使用して行うことができます。興奮収縮連関は、活動電位と細胞内カルシウム動態によって特徴づけられるので、心1-4同じ場所から同時にV mとCATの両方をマッピングするために非常に重要である。ランゲンドルフから同時光学マッピングでは、マウスの心臓は心不全、不整脈、代謝性疾患、および他の心臓疾患のメカニズムを解明する可能性を秘めている灌流。活性化の可視化は、伝導速度、活動電位持続時間、およびサイトの無数にある他のパラメータは、細胞レベルの調査から達成することはできませんが、よく光学マッピング1,5,6によって解決されます。本稿では、最先端のCMOSイメージング技術を用いた高時空間分解能でマウスの心の中でV mとCATの同時光学マッピングのための計測のセットアップと、実験条件を示す。この方法で得られる一貫性のある光学式の録音は、ランゲンドルフ灌流マウス心臓のその同時光学マッピングが可能で信頼性の両方である示しています。
プロトコル
1。ストック溶液の高度な準備
- 脱イオン水で、事前にタイロード液(16倍)の二つのストック溶液を調製し、4℃に保存° C:
- 株式I(119.872グラム/ LのNaCl、3.056グラム/ LのCaCl 2(2H 2 O)、5.6 g / LのKClを、2.6274グラム/ LのNaH 2 PO 4、3.408グラム/ LのMgCl 2(6H 2 O)、(フィッシャー科学的な、フェアローン、ニュージャージー州));
- 株式II(26.88グラム/ L NaHCO3水溶液、(フィッシャーサイエンティフィック、フェアローン、ニュージャージー州))。
- 蛍光色素のストック溶液を準備します。繰り返し凍結融解を避けるために、我々は、-20℃、一つの実験のために十分である時、両方の染料の30μlのアリコートを格納します。
- 膜電位感受性色素RH237(Invitrogen社、カールスバッド、カリフォルニア州)ストック溶液、ジメチルスルホキシド、1.25 mg / mLの溶液(DMSO、Sigma社、セントルイス、MO);
- カルシウム指示薬rhodo -の異形2AM(Invitrogen社、カールスバッド、カリフォルニア州)ストック溶液、DMSOで1 mg / mL溶液。
- 事前に(バイオサイエンスTocris、セントルイス、MO、DMSOで2 mg / mLの溶液を)興奮収縮脱共役剤のblebbistatinのストック溶液を調製し、4℃で溶解blebbistatin℃にて保存してください。
2。灌流液と実験7を準備する
- たて2Lタイロード液(128.2mM NaClを、1.3mmの塩化カルシウム(2H 2 O)、4.7 mm使用のKCl、1.05mMのMgCl 2(6H 2 O)、1.19mMのNaH 2 PO 4、20mMのNaHCO 3を 、11.1mM D -グルコースを準備脱イオン水、pHの= 7.35 ± 0.05)。ストック溶液は、タイロード液(一つの実験のための十分な)証券私、証券II 125mlの125 mLの脱イオン水と混合の1750 mLを取り、グルコースの4グラムの2Lにするために使用されている場合。
- 灌流システムの2台のポンプをオンにします。 40ml /分の逆行性灌流のために使用される蠕動ポンプ(ペリスター、WPI、サラソタ、米国)を設定します。灌流のために使用され、80 mL / minに保持タンクに戻って灌流液を返すために他の蠕動ポンプ(コール - パーマーMasterflex PeristalicポンプL / S、コール - パーマーインスツルメント社、ヴァーノンヒルズ、イリノイ州)を設定します。
- 30分間70%エタノールとし、2L、脱イオン水で灌流系を洗ってください。
- 一度、すべての脱イオン水をチャンバーから排気され、タイロード液を循環し、5μmのフィルター(ミリポア、ビルリカ、MA、米国)に通すことになります。溶液中にO 2 / CO 2(95%/ 5%)ガスをバブリングすることにより37℃にウォータジャケットとサーキュレータとC(ThermoNESLAB EX7、ニュータウン、米国)と灌流液酸素を送り込むの灌流液を温める。 pHメーター(Oaktonインスツルメンツ、ヴァーノンヒルズ、イリノイ州)との溶液のpHを監視し、7.35 ± 0.05で、pHを保つためにO 2 / CO 2バブリングの速度を調整する。実験中のモニタのpHと温度を継続する。
- デュアル光学マッピング装置は、高い空間(100x100ピクセル、230 ±ピクセルあたり20ミクロン)と時間的(1000〜3000フレーム/秒)の分解能を持つ2つのMICAMアルティマ- L CMOSカメラ(SciMedia、コスタメサ、カリフォルニア)で構成されています。指定されたカルシウムイメージングカメラの前でバンドパスフィルター(590 ± 15nmの、Thorlabs、ニュートン、ニュージャージー州)を修正、一方、ロングパスフィルタは、(> 700nmの、Thorlabs、ニュートン、ニュージャージー州)に配置する必要があります指定された電圧のイメージングカメラの正面。カメラは、ダイクロイックミラー(635 nmのカットオフ、オメガオプティカル、ブラトルバロ、バーモント州)が含まれているホルダー、によって互いに垂直に配置されています。すぐにデュアルカメラホルダーの下にダイクロイックミラーの上に心臓からの放出光を焦点レンズ(ニコンニッコール55ミリメートル1:1.4 235052)、がある。ワーキングディスタンスは約3センチメートルです。
励起光は、ハロゲンランプ(ニューポートオリエインスツルメンツ、ストラットフォード、コネチカット州、SciMedia、コスタメサ、CA)によって生成され、熱のフィルター、シャッター、およびバンドパスフィルタ(520 ± 45 nm)を介して渡されます。フレキシブルライトガイドは、準備の上にバンドパスフィルタ処理されたライトを指示し、シャッターは準備が染料の退色を避けるために、画像取得時にのみ光にさらされることを保証するために使用されます。 - 事前にペーシングおよびセンシングのためのAg / AgCl電極2電極を準備し、心臓を配置する前にチャンバー内にインストールしてください。アンプとフィルタが適切なレベルに調整されていることを確認します。
3。 、マウスの心臓を収穫カニューレを挿入する、およびランゲンドルフ灌流を設定する
- と腹腔内注射によるヘパリン(100単位)、ケタミン/キシラジン(キシラジン、10 mg / kg体重ケタミン、体重を80mg/kg)でマウスを麻酔。痛みの反射の欠如によって麻酔の適切なレベルを確保する。
- 半ば胸骨切開後、すぐに心臓を削除し、(95%O 2、5%CO 2)酸素でそれを洗う、一定温度(37 ± 1℃)タイロード液。
- 解剖顕微鏡の使い方、急速に大動脈を識別し、右鎖骨下動脈下行大動脈を介してクリーンなカットを行います。大動脈の短いセクションは、フレアチップと21ゲージのカニューレをカスタムメイドに添付されます。 4から0黒編み絹縫合糸(手術スペシャリティー社、読書、PA)は、カニューレに心臓を修復するために使用されます。カニューレ挿入後、心臓が逆行性に灌流されると、タイロード液で灌流。ブリッジアンプTBM4M、WPI、サラソタ、、逆行性灌流率は60および80 mmHgの(圧力トランスデューサ、世界精密器械株式会社(WPI)、サラソタ、米国との間の大動脈圧を保つに2-5 mL / minの範囲で調整され米国)。
- 心臓がカニューレを挿入された後、肺、胸腺、および脂肪組織は、切開して削除されます。
- 単離心臓は、ストリーム誘発性運動を防ぐために、灌流チャンバーの底部(Sylgardのコート)に頂点に(ファイン科学ツール)固定されます。右と左心房の付属も延伸し、心房の光学測定のために最大の表面積を提供するチャンバーの底に(ファイン科学のツール、株式会社、フォスターシティー、CA)に固定されます。
非常に重要!小さなシリコンチューブは、肺静脈を通って左心室に挿入し、近くの結合組織に絹縫合糸で固定されています。これは、(パート4のステップ19を参照)興奮収縮脱共役剤による心室収縮の抑制後に特に重要である左心室の中に閉じ込め灌流液、の解の混雑と酸性化を防ぎます。 - カスタムメイドの電極は、マスター- 8(AMPインスツルメンツ株式会社、エルサレム、イスラエル)またはのPowerLab 26T(ADインスツルメンツ、シドニー、オーストラリア)によって生成されるペーシング刺激を、行うために心臓の表面に配置されます。
- 小さなカバーガラスが振動解からのモーションアーチファクトを減らすために、心臓上の解決策の表面に固定されています。
- 心臓の励起光の焦点を合わせる。さらに、デュアルカメラ装置と最大解像度が得られるように心臓の間の距離を調整する。
- 部屋ですべてのライトをオフにするとPowerLab 26Tを使用して、電気録音を開始する。
4。負荷電圧とカルシウム感受性色素と興奮収縮脱共役剤
- blebbistatinのウォームアップ0.6mlを。保持している貯水池の灌流液でblebbistatin 0.5 mLを混ぜる。タイロード溶液1mLにblebbistatinの残りの0.1mLを希釈し、ゆっくりカニューレの近くに位置する薬剤ポートを介して(20分かけ)、それを注入する。 blebbistatinが徐々に動きのアーチファクトを減少させると観察。
- 1 mLのタイロード溶液中で膜電位感受性色素RH237ストック溶液30μLを希釈し、ゆっくりblebbistatinと同じ射出ポートに5-7分にわたって注入する。
- 30μLカルシウムインジケーターrhodo -の異形2 AMは、1 mLのタイロード液で希釈し、ゆっくりと同一の注入ポートを通って5〜10分間にわたって適用しプルロニックF127(Invitrogen社、カールスバッド、カリフォルニア州、DMSOの20%溶液)と混合し、1:1である。
- blebbistatinと細胞膜と細胞質に到達するための染料のために5〜10分間待ちます。動きが完全に抑制されているプロトコルに進みます。
- 継続的に心臓の正常な電気的機能を確保するための手順全体にわたってECG記録を監視する。
- SciMediaカスタムソフトウェアを(SciMedia、コスタメサ、カリフォルニア)を使用して蛍光シグナルの録音を開始する。
5。代表的な結果:

図1。灌流のための実験装置、電気録音と光学マッピング。
EM =放出、LP =ロングパス
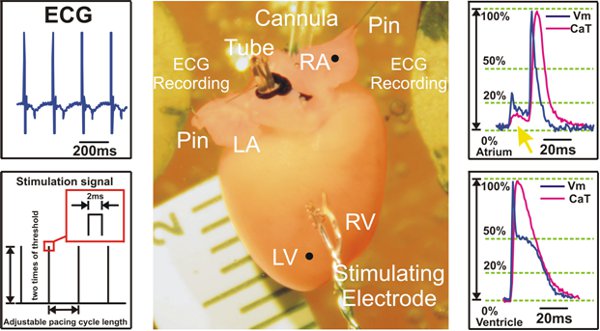
図2実験準備と心室ペーシング中に記録された信号の例。左:ECG信号は、Ag / AgCl電極2のディスク電極(トップ)とS1S1刺激プロトコルの例(下)に示されているから収集されます。センター:ランゲンドルフマウスの心臓の準備。右:代表的な光学活動電位と心房(上)と心室(下)からのカルシウムトランジェント信号が表示されます。黄色の矢印は、(トップ)心房レコーディングに見られる心室からの蛍光信号の散乱、を指します。
LV =左心室; =右心室RV、LA =左心房、RA =右心房
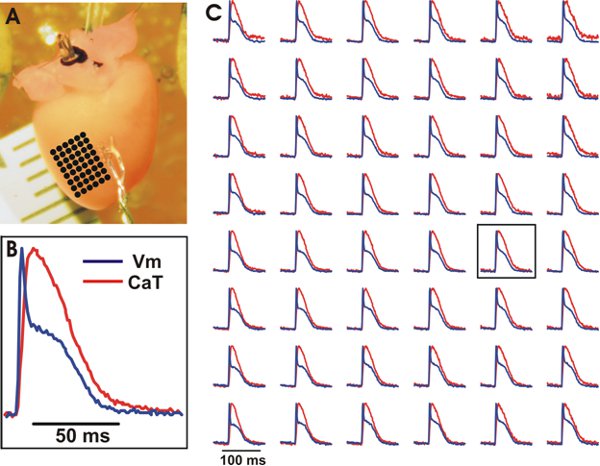
図3。野生型マウスの心臓の心室からV mとCATの代表的な光学録音。その光学録音(C)に見られる黒い点でマークされた等間隔の位置の配列を持つA.は、実験的な準備。アレイ上の中央の位置からV mと猫のトレースB.例(ボックスを参照してください私n個の(C))。等間隔の位置の配列からC V M(青)と猫(赤)。信号は、3x3ビニングされた。
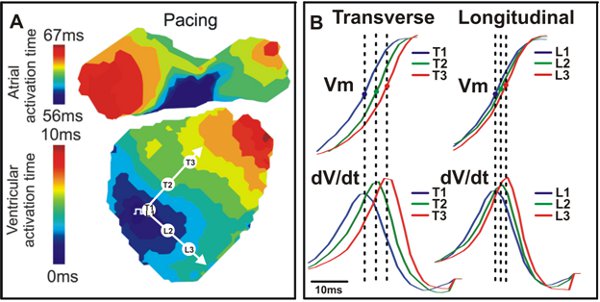
図4。アクティベーションマップと伝導。 A.は、横方向(T)と縦(L)方向と野生型マウスの心臓から例のアクティベーションマップは、白い矢印で示した。 B. V mの信号(上)とに見られる三点へのdV / dt(ボトム)に対応する(T1、T2、T3、L1、L2、L3)。
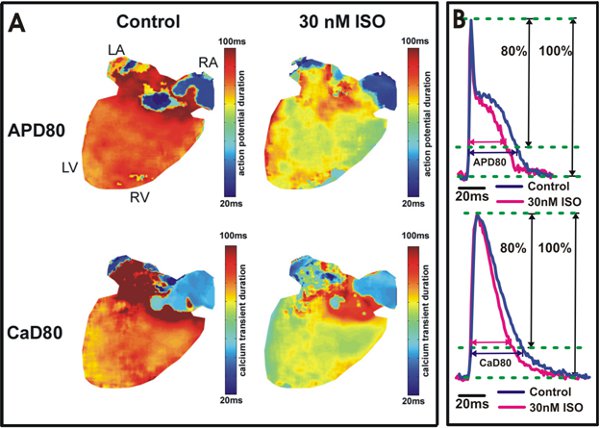
図5。活動電位およびカルシウム過渡期間の分析。 80%再分極(APD80)と80%の緩和(80カナダドル)マップでのカルシウム過渡期間におけるAの活動電位持続時間は、制御条件の下で心臓(左)から、30 nMのイソプロテレノールアプリケーション(右)の後に表示されます。心室の黄/緑の色は、(右)APD80と80カナダドルを短縮イソプロテレノールを示している。野生型マウスの心室(トップ)と心房(下)からAPD80と80カナダドルのB.の例では、トレーシング。
ディスカッション
この実験では、興奮収縮脱共役剤による心室収縮の抑制後に特に重要である小さなシリコンチューブを、追加することによって、ランゲンドルフ灌流法を変更。シリコンチューブは、ソリューションの混雑、灌流液の酸性化、および左心室の虚血の発症を予防するために使用されます。マウスの心臓では、低体温に非常に敏感であり、従って、心臓全体の温度変化が活動電位の持続時間で人工的な違いが発生します。その結果、加熱システムは、実験8の全体の間に37℃の一定温度を維持するために、灌流チャンバ内に実装されました。ランゲンドルフモデルは、心臓の神経支配を保持しないので、人は生理的交感神経と副交感神経トーン9を調べるために、潅流液に神経伝達物質の追加を検討する必要があります。逆行性灌流に加えて、心臓の灌流の加算は、pHや温度などの好適な環境パラメータを維持するのに役立ちます。この方法では、ランゲンドルフ灌流心臓を水平に置かれた。垂直ランゲンドルフ灌流のセットアップは、10を使用することもできますが、わずかに異なる心臓力学11になることがあります。 CMOSカメラのほかに、別の検出器も提供されており、マップV mと同時にCAT 12に適用することができます。
高い時空間解像度のCMOSカメラのアプリケーションは、録音の精度を保証しますが、光学マッピングの信号は、単一セルからではありません。むしろ、それぞれの蛍光シグナルは、光学倍率に応じて、細胞の数百または数千から来ている。はるかに大きな心室の蛍光は、光散乱による心房信号を歪めることができるので、光学的に記録した信号の慎重な解釈が必要です。マウスの準備のもう一つの制限は、心臓13の小さなサイズのため、表面の曲率によって誘導された信号の歪みとノイズです。伝導速度の測定のみならず、マウスの心臓の曲率からだけでなく、電極の極性と仮想電極から変更することができます。伝導速度、活性化の異方性、および再分極マップのために精度を達成するために、心臓の表面にカメラの焦点を修正することが不可欠です。
この方法では、リアルタイムでECG記録は、心臓電気生理学の光学的調査を補完することができます。膜電位感受性色素(RH237)とカルシウム指示薬(rhodo -の異形2AMが)ので、その高速応答のプロトコル、同じような励起、および別個の発光スペクトル3,7で使用されています。 V mとRH237とrhodo -の異形2AM 3以外の猫を測定するために使用できる染料の代替手段の組み合わせがあります。大きなストークのシフト(> 200nmの)を有する新規膜電位感受性色素、PGHIは、理由PGHIとrhodo -の異形2AM 14との間の発光波長の大きい分離の良いV mとCATの信号を許可することがわかった。今後の改善点は、新規な蛍光プローブ、新しいイメージング検出器の開発、および改良された画像処理ソフトウェアを探索に焦点を当てることができる。 3D光学マッピングのための高解像度と新しい光イメージングモダリティも光学マッピング5の将来の方向性が重要です。
開示事項
利害の衝突は宣言されません。
謝辞
NIHは、R01 HL085369を与えます。
資料
| Name | Company | Catalog Number | Comments |
| 化学 | 会社 | カタログ番号 | |
| NaClの | フィッシャーサイエンティフィック、フェアローン、ニュージャージー州 | S271 - 1 | |
| のCaCl 2(2H 2 O) | フィッシャーサイエンティフィック、フェアローン、ニュージャージー州 | C79 - 500 | |
| 塩化カリウム | フィッシャーサイエンティフィック、フェアローン、ニュージャージー州 | S217 - 500 | |
| のMgCl 2(6H 2 O) | フィッシャーサイエンティフィック、フェアローン、ニュージャージー州 | M33 - 500 | |
| のNaH 2 PO 4(H 2 O) | フィッシャーサイエンティフィック、フェアローン、ニュージャージー州 | S369 - 500 | |
| NaHCO 3の | フィッシャーサイエンティフィック、フェアローン、ニュージャージー州 | S233 - 3 | |
| D -グルコース | フィッシャーサイエンティフィック、フェアローン、ニュージャージー州 | D16 - 1 | |
| Blebbistatin | バイオサイエンスTocris、エリスヴィル、ミズーリ | 1760 | |
| RH237 | インビトロジェン、カールスバッド、カリフォルニア州 | S1109 | |
| rhodo -の異形2AM | インビトロジェン、カールスバッド、カリフォルニア州 | R1244 | |
| プルロニックF127 | インビトロジェン、カールスバッド、カリフォルニア州 | P3000MP | |
| ジメチルスルホキシド(DMSO) | シグマ、セントルイス、MO | D2650 |
参考文献
- Efimov, I. R., Rendt, J. M., Salama, G. Optical maps of intracellular [Ca2+]i transients and action-potentials from the surface of perfused guinea-pig hearts. Circulation. 90, 1-1 (1994).
- Efimov, I. R. Optical mapping of repolarization and refractoriness from intact hearts. Circulation. 90, 1469-1480 (1994).
- Choi, B. R., Salama, G. Simultaneous maps of optical action potentials and calcium transients in guinea-pig hearts: mechanisms underlying concordant alternans. J Physiol. 529, 171-188 (2000).
- Pruvot, E. J. Role of calcium cycling versus restitution in the mechanism of repolarization alternans. Circ Res. 94, 1083-1090 (2004).
- Efimov, I. R., Nikolski, V. P., Salama, G. Optical imaging of the heart. Circ Res. 95, 21-33 (2004).
- Fast, V. G., Dhein, S., Delmoar, M. Recording action potential using voltage sensitive dyes. Practical methods in cardiovascular research. , 233-255 (2005).
- Glukhov, A. V. Differential K(ATP) channel pharmacology in intact mouse heart. J Mol Cell Cardiol. , (2009).
- Baker, L. C. Enhanced dispersion of repolarization and refractoriness in transgenic mouse hearts promotes reentrant ventricular tachycardia. Circ Res. 86, 396-407 (2000).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacol Res. 41, 613-627 (2000).
- Efimov, I. R. Virtual electrode polarization in the far field: implications for external defibrillation. Am J Physiol Heart Circ Physiol. 279, 1055-1070 (2000).
- Hammouda, M., Kinosita, R. The coronary circulation in the isolated heart. J Physiol. 61, 615-628 (1926).
- Salama, G., Hwang, S. M. Simultaneous optical mapping of intracellular free calcium and action potentials from Langendorff perfused hearts. Curr Protoc Cytom. 12, 17-17 (2009).
- Lou, Q. Quantitative panoramic imaging of epicardial electrical activity. Ann Biomed Eng. 36, 1649-1658 (2008).
- Salama, G. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. J Membr Biol. 208, 125-140 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved