Method Article
Cartographie optique de potentiels d'action et les transitoires de calcium dans le cœur de la souris
Dans cet article
Résumé
Ce document détaille la procédure de dissection, la configuration instrumentale, et des conditions expérimentales lors de la cartographie optique de potentiel transmembranaire (Vm) et de calcium intracellulaire transitoire (CAT) dans Langendorff isolés perfusés intacte cœur de la souris.
Résumé
Le cœur de la souris est un modèle populaire pour les études cardiovasculaires en raison de l'existence d'une technologie à faible coût pour le génie génétique dans cette espèce. Phénotypage cardiovasculaire physiologique du cœur de souris peut être facilement fait en utilisant l'imagerie de fluorescence employant différentes sondes de potentiel transmembranaire (V m), les transitoires de calcium (CAT), et d'autres paramètres. Couplage excitation-contraction est caractérisée par une dynamique d'action du calcium intracellulaire potentiel et, par conséquent, il est extrêmement important de cartographier la fois V m et chat simultanément au même endroit sur le cœur 1-4. Simultanée de cartographie optique de Langendorff perfusé coeurs de souris a le potentiel pour élucider les mécanismes qui sous-tendent l'insuffisance cardiaque, les arythmies, les maladies métaboliques, et d'autres maladies cardiaques. Visualisation de l'activation, la vitesse de conduction, la durée du potentiel d'action, et d'autres paramètres à une myriade de sites ne peuvent pas être atteints de l'enquête au niveau cellulaire, mais est bien résolu par cartographie optique 1,5,6. Dans cet article nous présentons la configuration d'instrumentation et des conditions expérimentales pour la cartographie optique simultanée de V m et chat dans les cœurs de souris à haute résolution spatio-temporelle en utilisant l'état de l'art technologie d'imagerie CMOS. Conformément enregistrements optiques obtenus avec cette méthode montrent que la cartographie simultanée optique de coeurs perfusés de Langendorff la souris est à la fois réalisable et fiable.
Protocole
1. Préparation avancée des solutions de stock
- Préparer deux solutions de stock de solution de Tyrode (16x) à l'avance dans l'eau déminéralisée et de les stocker à 4 ° C:
- Stock I (119.872 g / L de NaCl, 3,056 g / L de CaCl 2 (2H 2 O), 5,6 g / L de KCl, 2,6274 g / L NaH 2 PO 4, 3,408 g / L MgCl 2 (6H 2 O), (Fisher scientifique, Fair Lawn, NJ));
- Stock II (26,88 g / l NaHCO3, (Fisher Scientific, Fair Lawn, NJ)).
- Préparer des solutions stock de colorants fluorescents. Pour éviter la congélation et décongélation répétées, nous stockons 30 aliquotes des deux colorants à -20 ° C, ce qui est suffisant pour une expérience:
- Sensibles au voltage solution stock de colorants RH237 (Invitrogen, Carlsbad, CA), 1,25 mg / ml solution dans le diméthylsulfoxyde (DMSO, Sigma, St. Louis, MO);
- Indicateur de calcium Rhod-deux heures solution stock (Invitrogen, Carlsbad, CA), 1 mg / ml solution dans le DMSO.
- Préparer excitation-contraction solution stock découplant blebbistatin (Bioscience Tocris, St. Louis, MO, 2 mg / ml solution dans le DMSO) à l'avance et de stocker les blebbistatin dissous à 4 ° C.
2. Préparer des solutions de perfusion et de l'installation expérimentale 7
- Fraîchement préparer la solution de Tyrode 2L de (128.2mM NaCl, CaCl 2 1,3 mm (2H 2 O), 4,7 KCl, MgCl 2 1,05 mm (6H 2 O), 1.19mM NaH 2 PO 4, 20mm de NaHCO 3, 11.1mm D-glucose dans l'eau, pH = 7,35 ± désionisée 0,05). Si la solution stock est utilisé pour faire des 2L solution de Tyrode (suffisant pour une expérience) de prendre 1750 ml d'eau déminéralisée et mélanger dans 125 ml de bouillon de I, 125 ml de bouillon de II, et 4g de glucose.
- Allumez les deux pompes du système de perfusion. Régler la pompe péristaltique (Peri-Star, WPI, Sarasota, Etats-Unis) qui est utilisé pour perfusion rétrograde à 40 mL / min. Réglez la pompe péristaltique d'autres (Cole-Parmer Masterflex Pompe Peristalic L / S, Instrument Company Cole-Parmer, Vernon Hills, Illinois) qui est utilisé pour surfusion et de revenir le perfusat de retour au réservoir tenant à 80 mL / min.
- Lavez le système de perfusion à l'éthanol 70% pendant 30 min puis à l'eau déminéralisée 2L.
- Une fois toute l'eau déminéralisée est évacué de la chambre, faire circuler la solution de Tyrode et le passer à travers un filtre de 5 um (Millipore, Billerica, MA, Etats-Unis). Chauffer le perfusat à 37 ° C avec une chemise d'eau et circulateur (ThermoNESLAB EX7, Newtown, Etats-Unis) et d'oxygéner le perfusat par barbotage d'O 2 / CO 2 (95% / 5%) de gaz dans la solution. Surveiller le pH de la solution avec un pH-mètre (Oakton Instruments, Vernon Hills, IL) et d'ajuster le taux d'O 2 / CO 2 bouillonnant à maintenir le pH à 7,35 ± 0,05. Poursuivre la surveillance du pH et de température pendant l'expérience.
- L'appareil de cartographie optique double composé de deux caméras MICAM Ultima-L CMOS (SciMedia, Costa Mesa, Californie) qui ont spatiale élevée (100x100 pixels, 230 ± 20 um par pixel) et temporelle (1000-3000 images / sec) de résolution. Correction d'un filtre passe-bande (590 ± 15 nm, Thorlabs, Newton, NJ), en face de la caméra d'imagerie calcique désigné, tandis que, d'un filtre passe-temps (> 700 nm, Thorlabs, Newton, NJ), doit être placé dans devant la caméra d'imagerie de tension désigné. Les caméras sont disposées perpendiculairement les uns aux autres par un porteur, qui contient un miroir dichroïque (635 nm de coupure, Omega Optical, Brattleboro, VT). Immédiatement au-dessous du support de caméra à double il ya un objectif (Nikon Nikkor 55 mm 1:1.4 235 052), qui focalise la lumière d'émission provenant du coeur sur le miroir dichroïque. Le travail à distance est d'environ 3cm.
La lumière d'excitation est produite par une lampe halogène (Newport Oriel Instruments, Stratford, CT; SciMedia, Costa Mesa, Californie) et est passé à travers un filtre de chaleur, d'obturation et filtre passe-bande (520 ± 45 nm). Un guide de lumière flexibles dirige la lumière filtrée passe-bande sur la préparation, et d'un obturateur est utilisée pour s'assurer que la préparation est exposé à la lumière que lors de l'acquisition d'image pour éviter photoblanchiment des colorants. - Préparer Ag / AgCl 2 électrodes de stimulation et de détection à l'avance et de les installer dans la chambre avant de placer au cœur. Assurez-vous que les amplificateurs et les filtres sont ajustés à des niveaux appropriés.
3. Récolte au cœur de la souris, cathétériser, et mettre en place une perfusion de Langendorff
- Anesthésier la souris avec la kétamine / xylazine (kétamine, 80mg/kg de poids corporel; xylazine, 10 mg / kg de poids corporel) et l'héparine (100 unités) par injection intrapéritonéale. Assurer le niveau approprié de l'anesthésie par le manque de réflexe de douleur.
- Après une incision médiane du sternum, enlever rapidement le cœur et le laver dans oxygénée (95% d'O 2, 5% CO 2), à température constante (37 ± 1 ° C) une solution de Tyrode.
- En utilisant un microscope à dissection, D'identifier rapidement l'aorte et de faire une coupe nette dans l'aorte ascendante dessous de l'artère sous-clavière droite. Une courte section de l'aorte est ensuite attaché à une coutume fait de calibre 21 canule avec un embout évasé. 4-0 suture de soie noire tressée (Surgical Corporation Spécialités, Reading, PA) est utilisé pour fixer le cœur sur la canule. Après canulation, le coeur est perfusé et rétrograde perfusées avec une solution de Tyrode. Le taux de perfusion rétrograde est ajusté dans la gamme de 2-5 mL / min pour maintenir la pression aortique entre 60 et 80 mmHg (capteur de pression, instruments de précision du Monde Inc (WPI), Sarasota, Etats-Unis; Pont Amplificateur TBM4M, WPI, Sarasota, Etats-Unis).
- Après le cœur est une canule, du poumon, du thymus et des tissus adipeux sont ensuite disséqués et enlevé.
- Le cœur isolé est épinglé (Outils Fine Science) à l'apex au fond de la chambre de perfusion (couché Sylgard) pour empêcher flux induits par le mouvement. Les appendices auriculaires droite et gauche sont également étirées et épinglé (Outils Fine Science, Inc, Foster City, CA) au fond de la chambre, qui donne la superficie maximale pour les mesures optiques de l'oreillette.
Très important! Un tube de silicium petite est inséré dans le ventricule gauche par les veines pulmonaires et fixé par une suture en soie au tissu conjonctif voisin. Cela évite la congestion solution et l'acidification de l'perfusat piégés dans le ventricule gauche, qui est particulièrement important après la suppression des contractions ventriculaires avec un découplant excitation-contraction (voir partie 4 étape 19). - Une électrode sur mesure est placé sur la surface du cœur de mener les stimulations rythme, qui est généré par le maître-8 (AMP Instruments Ltd, Jérusalem, Israël) ou PowerLab 26T (AD Instruments, Sydney, Australie).
- Un couvercle en verre petite est fixé sur la surface de la solution sur le cœur pour réduire artefacts de mouvement de la solution de vibration.
- Focaliser la lumière d'excitation sur le cœur. En outre, ajuster la distance entre l'appareil photo et le double cœur pour que la résolution maximale sera obtenue.
- Eteignez toutes les lumières dans la pièce et de commencer les enregistrements électriques utilisant PowerLab 26T.
4. Tension de charge et de colorants sensible au calcium et d'excitation-contraction découplant
- Warm-up 0,6 mL d'blebbistatin. Mélanger 0,5 mL de la blebbistatin avec le perfusat dans le réservoir de maintien. Diluer le reste 0,1 mL de blebbistatin dans 1 ml de solution de Tyrode et de l'injecter lentement (sur une période de 20 minutes) par un port de drogue situé près de la canule. Observez que blebbistatin réduit progressivement l'artefact de mouvement.
- Diluer 30 uL de la tension de la solution de teinture d'actions sensibles RH237 dans la solution 1 ml de Tyrode et injecter lentement au cours de 5-7 minutes dans le port d'injection même blebbistatin.
- 30 uL de calcium indicateur de Rhod-deux heures est de 1:1 mélangé avec Pluronic F127 (Invitrogen, Carlsbad, CA, solution à 20% dans le DMSO), puis dilué dans 1 mL de solution de Tyrode et lentement appliqué sur 5-10 min à travers le port même injection .
- Attendre 5-10 minutes pour blebbistatin et colorants pour atteindre la membrane cellulaire et le cytosol. Continuer avec le protocole lorsque le mouvement est complètement supprimée.
- Surveiller en permanence les enregistrements ECG au cours de la procédure entière pour assurer le fonctionnement normal électrique du cœur.
- Commencer enregistrements signal fluorescent en utilisant les logiciels personnalisés SciMedia (SciMedia, Costa Mesa, Californie).
5. Les résultats représentatifs:

Figure 1. Dispositif expérimental pour la perfusion, les enregistrements électriques et optiques de cartographie.
EM = émission; Lp = longpass
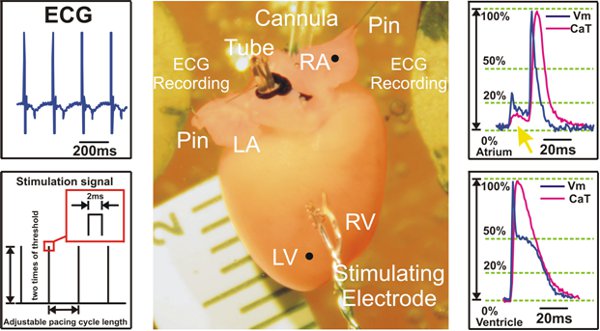
Figure 2. Préparation expérimentale et des exemples de signaux enregistrés pendant la stimulation ventriculaire. Gauche: Les signaux ECG sont recueillies auprès de Ag / AgCl 2 électrodes à disque (en haut) et un exemple de S1S1 protocole de stimulation est indiqué (en bas). Centre: préparation de Langendorff cœur de la souris. Droite: Représentant des potentiels d'action optiques et signaux calciques transitoires d'oreillettes (en haut) et les ventricules (bas) sont affichés. La flèche jaune (en haut) les points de la dispersion du signal fluorescent provenant des ventricules, ce qui est vu dans les enregistrements auriculaire.
LV = ventricule gauche; VD = ventricule droit; LA = oreillette gauche; RA = oreillette droite
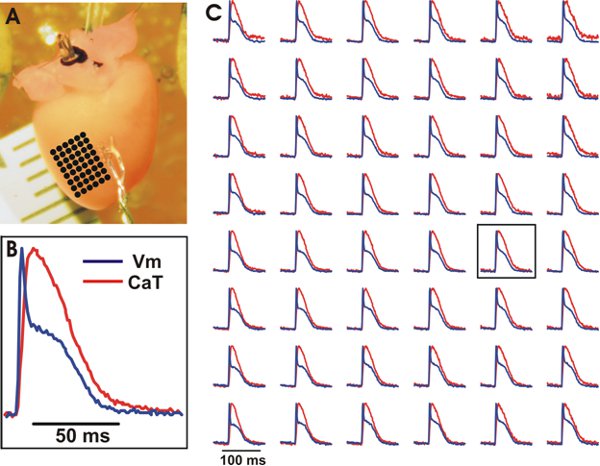
Figure 3. Représentant enregistrements optiques de V m et CAT des ventricules du cœur de souris de type sauvage. A. La préparation expérimentale avec un tableau de points uniformément répartis marquée par des points noirs dont les enregistrements optiques peut être vu dans (C). B. Exemple de traçage de V m et chat d'un emplacement central sur le tableau (voir encadré In (C)). C. V m (bleu) et Cat (rouge) à partir du tableau des emplacements régulièrement espacés. Les signaux ont été mis en cellule de 3x3.
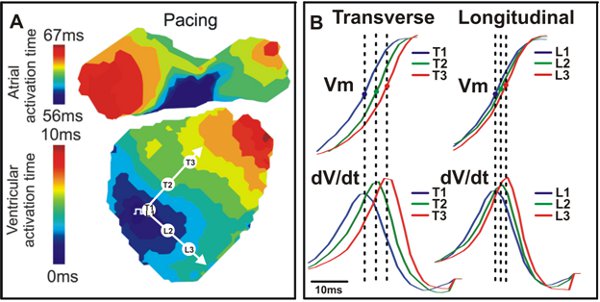
Figure 4. Carte d'activation et de conduction. A. Une carte d'activation par exemple d'un cœur de souris de type sauvage avec transversale (T) et longitudinale (L) directions indiquées par les flèches blanches. B. V signaux m (haut) et dV / dt (Bas), correspondant aux trois points de vue dans un (T1, T2, T3, L1, L2, L3).
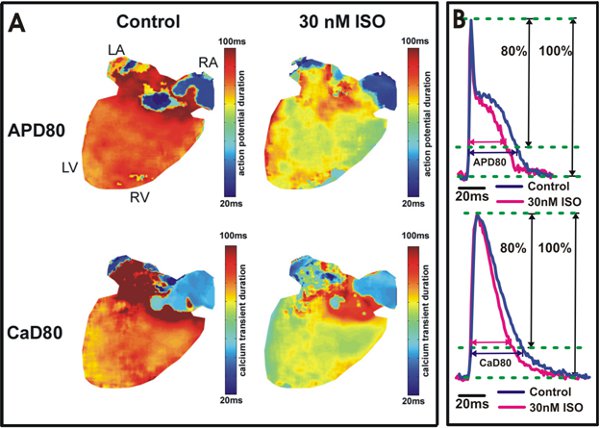
Figure 5. Potentiels d'action et analyse de la durée de calcium transitoire. A. Durée du potentiel d'action à 80% de repolarisation (APD80) et la durée de calcium transitoire à 80% détente (80 CAD) les cartes sont affichées à partir d'un coeur dans des conditions de contrôle (à gauche) et après application 30 nM isoprotérénol (à droite). La couleur jaune / vert dans les ventricules (à droite) indique l'isoprotérénol raccourcie APD80 et 80 CAD. B. Exemple de tracés et de 80 CAD APD80 des ventricules souris de type sauvage (haut) et oreillettes (bas).
Discussion
Dans cette expérience, nous avons modifié la méthode de perfusion de Langendorff en ajoutant un tube de silicium faible, ce qui est particulièrement crucial après la suppression des contractions ventriculaires avec un découplant excitation-contraction. Le tube de silicium est utilisé pour prévenir la congestion solution, l'acidification de la solution de perfusion, et le développement de l'ischémie dans le ventricule gauche. Le cœur de la souris est très sensible à l'hypothermie; ainsi, les variations de température à travers le cœur d'entraîner des variations artificielles dans la durée du potentiel d'action. Par conséquent, un système de chauffage a été mis en œuvre dans la chambre de perfusion afin de maintenir une température constante de 37 ° C pendant la totalité de l'expérience 8. Depuis un modèle de Langendorff ne conserve pas l'innervation du cœur, on doit envisager d'ajouter neurotransmetteurs pour le perfusat afin d'enquêter physiologiques du tonus sympathique et parasympathique 9. Outre une perfusion rétrograde, plus de surfusion du cœur aide à maintenir adaptée paramètres environnementaux tels que le pH et la température. Dans cette méthode, le coeur perfusé de Langendorff a été placée horizontalement. Une configuration de Langendorff verticales perfusion peut également être utilisé 10, mais peut entraîner un peu différent mécanique cardiaque 11. En plus de caméras CMOS, des détecteurs de rechange sont également disponibles et peuvent être appliquées à la carte V m et chat simultanément 12.
Application de caméras CMOS de haute résolution spatio-temporelle assure la précision des enregistrements, mais les signaux optiques ne sont pas la cartographie d'une seule cellule. Au contraire, chaque signal de fluorescence provient de centaines ou de milliers de cellules, en fonction de grossissement optique. La fluorescence du ventricule beaucoup plus grand peut fausser les signaux auriculaire par diffusion optique, par conséquent, une interprétation prudente des signaux enregistrés optiquement est nécessaire. Une autre limitation de la préparation de la souris est la distorsion du signal et le bruit induit par la courbure de la surface en raison de la petite taille du cœur 13. Mesures de vitesse de conduction peut être modifié non seulement par la courbure de la souris, mais aussi le cœur de la polarité des électrodes et des électrodes virtuel. Pour atteindre la précision pour la vitesse de conduction, l'anisotropie d'activation, et des cartes de repolarisation, de rectification et de focalisation de la caméra à la surface du cœur est essentielle.
Dans cette méthode, en temps réel les enregistrements ECG peuvent compléter la recherche optique de l'électrophysiologie cardiaque. Tension colorant sensible (RH237) et l'indicateur de calcium (Rhod-deux heures) sont utilisés dans le protocole en raison de leur réponse rapide, d'excitation semblables, et les spectres d'émission distincts 3,7. Il ya d'autres combinaisons de colorants qui peuvent être utilisés pour mesurer V m et CAT autres que RH237 et Rhod-2 heures 3. Un roman sensible au voltage colorant, PGHI, avec un grand déplacement de Stoke (> 200nm) a été trouvée pour permettre une meilleure m V et les signaux de chat car la plus grande séparation des longueurs d'onde d'émission entre PGHI et Rhod-2 heures 14. Les améliorations futures peuvent se concentrer sur l'exploration de nouvelles sondes fluorescentes, le développement de détecteurs d'imagerie, et l'amélioration des logiciels de traitement d'image. Une résolution et une nouvelle imagerie optique pour la cartographie 3D optique sont aussi importants les orientations futures de la cartographie optique 5.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
NIH subventions R01 HL085369.
matériels
| Name | Company | Catalog Number | Comments |
| Chimique | Société | Nombre de catalogue | |
| NaCl | Fisher Scientific, Fair Lawn, NJ | S271-1 | |
| CaCl 2 (2H 2 O) | Fisher Scientific, Fair Lawn, NJ | C79-500 | |
| KCl | Fisher Scientific, Fair Lawn, NJ | S217-500 | |
| MgCl 2 (6H 2 O) | Fisher Scientific, Fair Lawn, NJ | M33-500 | |
| NaH 2 PO 4 (H 2 O) | Fisher Scientific, Fair Lawn, NJ | S369-500 | |
| NaHCO 3 | Fisher Scientific, Fair Lawn, NJ | S233-3 | |
| D-glucose | Fisher Scientific, Fair Lawn, NJ | D16-1 | |
| Blebbistatin | Bioscience Tocris, Ellisville, MO | 1760 | |
| RH237 | Invitrogen, Carlsbad, CA | S1109 | |
| Rhod-deux heures | Invitrogen, Carlsbad, CA | R1244 | |
| Pluronic F127 | Invitrogen, Carlsbad, CA | P3000MP | |
| Diméthylsulfoxyde (DMSO) | Sigma, St. Louis, MO | D2650 |
Références
- Efimov, I. R., Rendt, J. M., Salama, G. Optical maps of intracellular [Ca2+]i transients and action-potentials from the surface of perfused guinea-pig hearts. Circulation. 90, 1-1 (1994).
- Efimov, I. R. Optical mapping of repolarization and refractoriness from intact hearts. Circulation. 90, 1469-1480 (1994).
- Choi, B. R., Salama, G. Simultaneous maps of optical action potentials and calcium transients in guinea-pig hearts: mechanisms underlying concordant alternans. J Physiol. 529, 171-188 (2000).
- Pruvot, E. J. Role of calcium cycling versus restitution in the mechanism of repolarization alternans. Circ Res. 94, 1083-1090 (2004).
- Efimov, I. R., Nikolski, V. P., Salama, G. Optical imaging of the heart. Circ Res. 95, 21-33 (2004).
- Fast, V. G., Dhein, S., Delmoar, M. Recording action potential using voltage sensitive dyes. Practical methods in cardiovascular research. , 233-255 (2005).
- Glukhov, A. V. Differential K(ATP) channel pharmacology in intact mouse heart. J Mol Cell Cardiol. , (2009).
- Baker, L. C. Enhanced dispersion of repolarization and refractoriness in transgenic mouse hearts promotes reentrant ventricular tachycardia. Circ Res. 86, 396-407 (2000).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacol Res. 41, 613-627 (2000).
- Efimov, I. R. Virtual electrode polarization in the far field: implications for external defibrillation. Am J Physiol Heart Circ Physiol. 279, 1055-1070 (2000).
- Hammouda, M., Kinosita, R. The coronary circulation in the isolated heart. J Physiol. 61, 615-628 (1926).
- Salama, G., Hwang, S. M. Simultaneous optical mapping of intracellular free calcium and action potentials from Langendorff perfused hearts. Curr Protoc Cytom. 12, 17-17 (2009).
- Lou, Q. Quantitative panoramic imaging of epicardial electrical activity. Ann Biomed Eng. 36, 1649-1658 (2008).
- Salama, G. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. J Membr Biol. 208, 125-140 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon