Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelado y de imagen de 3 dimensiones invasión celular colectiva
En este artículo
Resumen
Los modelos de la invasión de células tumorales en tres dimensiones de la matriz extracelular para reflejar mejor la En vivo Situación de los ensayos de la motilidad de dos dimensiones. Utilizando los ensayos de invasión de la matriz combinada con la imagen confocal de las células con fluorescencia etiquetado, información detallada sobre los modos de invasión y las diferentes contribuciones de los líderes frente a las siguientes células se pueden obtener.
Resumen
Una característica definitoria de la malignidad del cáncer es una invasión y metástasis. En algunos tipos de cáncer (e. g. Glioma 2), invasión local en el tejido sano circundante es la causa de la enfermedad y la muerte. Para otros tipos de cáncer (e. g. De mama, pulmón, etc.), Es el proceso de metástasis, en el que las células tumorales pasan de una masa tumoral primaria, colonizar los sitios distales y en última instancia, contribuir a la insuficiencia de órganos, que finalmente conduce a la morbilidad y la mortalidad a los 3. Se ha estimado que la invasión y las metástasis son responsables del 90% de las muertes por cáncer 4. Como resultado, ha habido un gran interés en la identificación de los procesos moleculares y mediadores críticos de proteínas de invasión y metástasis a los efectos de mejorar el diagnóstico y tratamiento 5.
Un reto para los científicos es desarrollar cáncer de ensayos de invasión que se asemejan bastante a la situación in vivo enpara permitir el modelado preciso enfermedad 6. Dos dimensiones ensayos motilidad celular son sólo informativos acerca de un aspecto de la invasión y no tienen en cuenta la remodelación de proteínas de matriz extracelular (ECM), que es también un elemento crítico. Recientemente, la investigación ha mejorado nuestra comprensión de la invasión de células tumorales, y reveló que las células individuales pueden moverse por los modos de forma alargada o redondeada 7. Además, ha habido un mayor reconocimiento de la contribución de la invasión colectiva, en la que las células invaden en filamentos, hojas y racimos, sobre todo en tumores altamente diferenciadas que mantienen las características del epitelio, a la propagación del cáncer 8.
Se presenta un método refinado 9 para examinar los aportes de proteínas candidatas a la invasión de colectivos 10. En particular, por las piscinas de ingeniería independiente de las células para expresar diferentes proteínas fluorescentes, es posible analizar molecularmente las actividades y proteinurians requerido en las células principales en comparación con los requeridos en las celdas siguientes. El uso de ARNi proporciona la herramienta molecular para desmontar experimentalmente los procesos involucrados en la invasión de células individuales, así como en diferentes posiciones de la invasión colectiva. En este procedimiento, las mezclas de las células con fluorescencia etiquetados se colocan en la parte inferior de un inserto de Transwell Matrigel previamente llena de proteínas ECM, luego se deja invadir "hacia arriba" a través del filtro y en el Matrigel. La reconstrucción de las pilas de la imagen de la serie Z, que se obtiene por la imagen confocal, en representaciones tridimensionales permite la visualización de forma colectiva hilos invadir y análisis de la representación de las células con fluorescencia marcado en la dirección frente a las siguientes posiciones.
Protocolo
1. Etiquetado retroviral de células con proteínas fluorescentes
- Células de la placa de embalaje retrovirales (por ejemplo, Phoenix) de un total de 0,25 x 10 6 células por pocillo de una 6-y plato fetal al 10% de suero bovino (FBS) / DMEM.
- Transfectar las células con el ADN retroviral 48 horas después, las células con Effectene de acuerdo a las instrucciones del fabricante.
- Enjuague pocillos dos veces con medio de 24 horas después, a continuación, agregar 1,5 ml de 10% de SFB / DMEM por pozo.
- Recoger virus en cultivo de tejidos empaquetados medio 48 horas más tarde con la pipeta y transferir a tubos de 2 ml microcentrífuga.
- Centrifugar a 1600 rpm durante 5 minutos para que sedimenten las células.
- Aspirar el sobrenadante a un tubo limpio y almacenar a -80 ° C.
- Las células que se retroviralmente transducidas se colocan fuera de 1,5 x 10 5 células por pocillo de una placa de 6 pocillos y se colocan en un incubador humidificado a 37 º C durante la noche.
- Al día siguiente, retire el papel de las células y add 1 ml de caldo de virus suplementado con 4 polibreno l (2 mg / mL) a cada pocillo. Vuelva a colocar las placas en la incubadora.
- Después de la incubación durante 5-6 horas, añadir 2 ml de 10% de SFB / DMEM a cada pocillo y las placas se sustituyen en 37 ° C durante la noche inbubator.
- Al día siguiente, reemplazar los medios de comunicación y permiten que las células 24 horas antes de la adición de medios selectivos apropiados.
- Cuando confluentes (que depende de la tasa de crecimiento de las células, y la eficiencia de la transducción retroviral, pero suele tardar entre 4-14 días), trypsinize células y tipo de células con fluorescencia no transducidas de referencia, recopilar y células de la piscina con fluorescencia mayor que los no-células transducidas y las alícuotas se congelan a -80 ° C para su uso futuro.
2. Inversa Matrigel ensayo de invasión
- Poco a poco descongelar una alícuota de Matrigel completa (es decir, que contienen factores de crecimiento) en el hielo (Figura 1A).
- Una vez descongelado, diluido 1:1 en Matrigel PBS enfriado con hielo (junto con otras adicionalestratamientos en la concentración de 2x en el PBS antes de la dilución; fig. 1B). Para que sea más fácil de manejar Matrigel antes de la polimerización, todos los recipientes de plástico (por ejemplo, consejos, tubos, etc) debe ser fría como el hielo.
- Inserte el mayor número 8 micras de poro 6,5 mm de diámetro sin revestimiento transwells como se requiere en los pocillos de una placa de 24 y cultivo de tejidos, luego cuidadosamente Pipetear 100 L de la Matrigel diluido en los pocillos y se deja incubar durante ~ 30 minutos a 37 ° C para solidificar (fig. 1C).
- Durante este tiempo, preparar uno o más fluorescente marcada con suspensiones celulares de entre 1 y 4 x 10 5 células por ml, en función de la línea celular, de cada estado de pre-tratamiento (e. g. SiRNA, el tratamiento de drogas) en su crecimiento normal medio (Figura 1D).
- Cuando el Matrigel se ha solidificado, invertir la transwells y Pipetear 100 L de la suspensión de células en la parte de abajo miran hacia arriba del filtro (Fig. 1E).
- Con cuidado, cubrir el transwells con la base de un tejido de 24 pocillosplaca de cultivo, toma de contacto con cada gota de suspensión celular (Figura 1 F).
- Se incuba la placa en el estado invertido durante 4 horas para permitir la unión de las células (Figura 1G).
- Después de este tiempo, a su vez las placas con el lado derecho hacia arriba y lavar cada Transwell secuencial por inmersión en medio de 2 x 1 ml de suero libre (Figura 2A).
- Deje el transwells en un tercer pozo que contiene alguna droga o tratamientos requeridos (Figura 2B).
- Suavemente Pipetear 100 L de 10% de SFB / DMEM más quimioatrayente (e. g. FEAG a 25 ng / ml) en el Transwell en la parte superior de la Matrigel solidificado / mezcla de PBS, coloque la tapa e incubar durante 3-5 días a 37 º C con CO2 al 5% (Fig. 2C).
3. Tinción y visualización
- Las células que expresan proteínas fluorescentes puede saltarse los pasos a continuación antes de la microscopía confocal
- A la imagen no fluorescentes las células invasoras Matrigel, transwells lugar en fresco 24 platos bien y pipeta de 1 ml de 4 MCalceína AM solución mancha en la parte superior de cada plug Matrigel, permitiendo que se derrame por los costados y las manchas de la parte superior e inferior. Calceína AM (éster acetoximetil de calceína) es un tinte de células vivas que las manchas de las células de todo el verde y no requiere la fijación.
- Incubar 1 hora a 37 ° C en 5% de CO2 atmósfera húmeda, en la que las células están totalmente manchados punto y listo para ser captado por microscopía confocal.
- Por otra parte, no fluorescente las células invasoras Matrigel se fijaron y se tiñeron como se describe en 3.5 a 3.9.
- Transferencia de cada Transwell a un nuevo máximo de 24 pocillos. Superposición de 1 ml de 4% para-formaldehyde/0.2% Triton X-100.
- Incube a temperatura ambiente durante 0,5 horas.
- Quitar fijador y lavar 3 veces con 1 ml de PBS.
- Quitar ARN citoplásmico con 30 min de tratamiento con RNasa 100 ug / ml RNasa. Lavar dos veces con PBS.
- Para la visualización de añadir 0,01 mg / ml de yoduro de propidio (PI) diluido en PBS y dejar a temperatura ambiente en el dark durante 0,5 horas. Lavar 3 veces con PBS. En esta etapa, PI manchas Transwell se puede mantener a temperatura ambiente en la oscuridad durante al menos 1 mes.
- Métodos precisos de imagen por microscopía confocal son dependientes de los recursos disponibles. Utilizando un microscopio invertido confocal, Transwell lugar con una pequeña cantidad de PBS residual en cubreobjetos grande (asegurarse de que no hay burbujas) sobre los no-inmersión 20 X objetivo y la captura de secciones ópticas de 10-15 m desde el fondo del enchufe matrigel. Individuales rebanadas de ópticas se pueden utilizar para cuantificar el grado de invasión (Figura 3) o en la construcción de objetos en 3 dimensiones usando el software apropiado, como Volocity (Figura 3B).
4. Resultados representante
Un ejemplo de un Z-serie de cortes ópticos se muestra en la Figura 3. En este caso, las células fueron teñidas con calceína AM y el número de células invasoras desde el filtro se puede ver que disminuyen con la distancia. Cuantificación de lavasion se puede hacer mediante el análisis de la relación de calceína AM píxeles positivos a negativos píxeles en cada intervalo, o utilizando el método de fijación / tinción se detalla más arriba y contando núcleos PI positiva en cada posición. Una de las ventajas de calceína AM tinción es que las reconstrucciones en 3 dimensiones de la invasión de células se puede montar utilizando software como Volocity, dando una representación visual de la modalidad de la invasión (Figura 3B). Si las células son etiquetados por la expresión de proteínas fluorescentes, entonces las posiciones de cada celda de color pueden ser visualizados en tres dimensiones reconstrucciones, ya sea visto desde un lado (Figura 3C) o haciendo cortes a través de la reconstrucción (Figura 3D).
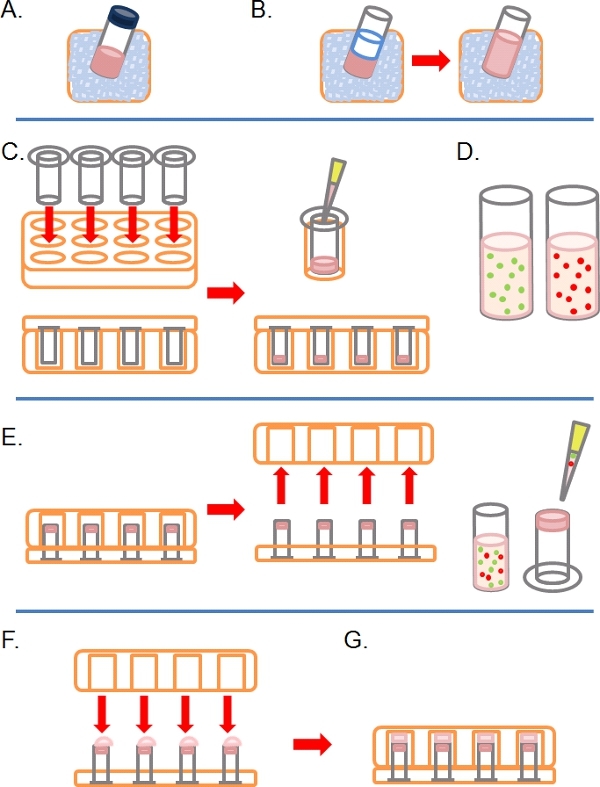
Figura 1. Esquema de los pasos involucrados en la creación de la invasión de ensayo inversa. A) Matrigel ECM descongeladas en hielo. B) Matrigel se diluye 1:1 con PBS que contenía los tratamientos de drogas en la concentración de dos veces al final. C) Inserciones Transwell se colocan en placas con pocillos múltiples, y Matrigel pipeta en cada uno. D) Las suspensiones celulares realizados en la concentración deseada. E) Una vez que el Matrigel se ha puesto, la placa se invierte y se retira, las células se colocan en el filtro inferior de las inserciones Transwell. F) En la posición invertida, la placa de paredes múltiples se coloca cuidadosamente sobre inserciones Transwell, haciendo contacto con la suspensión celular. G) Las células pueden adherirse al filtro durante 4 horas.
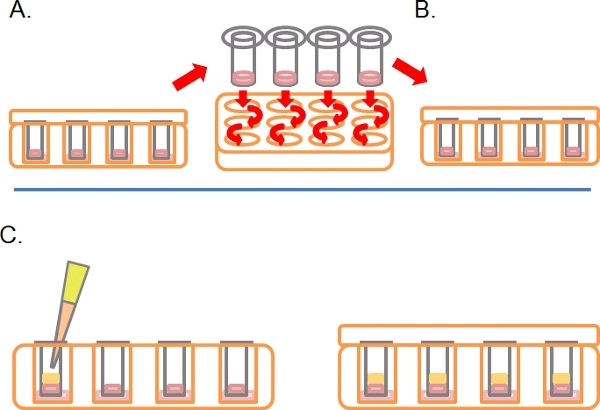
Figura 2. Continuación del esquema para el ensayo de invasión inversa. A) Una vez que las células se han adherido, sumerja cada Transwell en medio libre de suero dos veces para eliminar las células sueltas. B) Lugar lavado Transwell los medios de comunicación en un final bien contiene más tratamientos según sea necesario. C) los medios de comunicación que contiene quimioatrayente (por ejemplo, 10% de suero fetal bovino) con los tratamientos que requiere cuidado en capas en Matrigel.
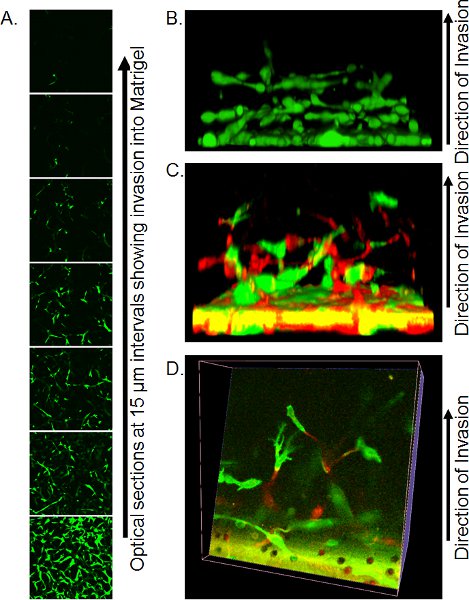
Figura 3. Imágenes representativas de los resultados del ensayo de invasión inversa. A) las secciones de óptica de las células teñidas con calceína AM invadir Matrigel, tomadas a intervalos de 15 micras por microscopía confocal. B) Reconstrucción de una reconstrucción en 3 dimensiones de la invasión de células de una pila de confocal de la serie Z imágenes, vista desde el lado. Reproducido de la referencia 10. C) La reconstrucción tridimensional de las células de las buenas prácticas agrarias y RFP etiqueta que invaden Matrigel visto desde un lado. D) corte óptico a través de la reconstrucción en 3 dimensiones de las células de las buenas prácticas agrarias y RFP etiquetados. Reproducido de la referencia 10.
Discusión
Los ensayos de invasión Matrigel tradicionalmente han sido establecidos con células colocadas sobre una capa de proteína de matriz extracelular con quimiotáctica inducida por la movilidad hacia ya través de un filtro en la parte inferior. La invasión se calificó como una función de cuántas células se podía contar en la parte inferior del filtro. Aunque en la práctica hay poca diferencia con el ensayo "inversa" invasión se ha descrito anteriormente, hay mucha más información sobre el proceso de i...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El financiamiento para esta investigación es de Cancer Research del Reino Unido.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
|---|---|---|---|
| DMEM (Dulbecco Modificado Medio Eagle) | GIBCO | 21969 | |
| El suero fetal bovino | PAA | A15-101 | |
| Penicilina-estreptomicina | GIBCO | 15140 | |
| 200 mM L-glutamina (100 veces) | GIBCO | 25050-032 | |
| Puromicina | Sigma-Aldrich | P8833 | |
| 0,05% de tripsina EDTA | GIBCO | 25300 | |
| Polybrene | Sigma-Aldrich | AL-118 | |
| Lipofectamine 2000 reactivo | Invitrogen | 11668019 | |
| Transwells 6,5 mm, 8,0 micras de tamaño de poro | Corning | 3422 | |
| Completar Matrigel | BD Biosciences | 354234 | |
| Calceína AM | Invitrogen | C1430 | |
| RNasa | Qiagen | 19101 | |
| Yoduro de propidio | Sigma-Aldrich | P4864 | |
| Confocal microcope | Leica | SP2MP |
Referencias
- Olson, M. F., Sahai, E. The actin cytoskeleton in cancer cell motility. Clin. Exp. Metastasis. 26, 273-287 (2008).
- Hoelzinger, D. B., Demuth, T., Berens, M. E. Autocrine factors that sustain glioma invasion and paracrine biology in the brain microenvironment. J. Natl. Cancer. Inst. 99, 1583-1593 (2007).
- Chaffer, C. L., Weinberg, R. A. A perspective on cancer cell metastasis. Science. 331, 1559-1564 (2011).
- Hanahan, D., Weinberg, R. A. The Hallmarks of Cancer. Cell. 100, 57-70 (2000).
- Francia, G., Cruz-Munoz, W., Man, S., Xu, P., Kerbel, R. S. Mouse models of advanced spontaneous metastasis for experimental therapeutics. Nat. Rev. Cancer. 11, 135-141 (2011).
- Hooper, S., Marshall, J. F., Sahai, E. Tumor cell migration in three dimensions. Methods. Enzymol. 406, 625-643 (2006).
- Croft, D. R., Olson, M. F. Regulating the conversion between rounded and elongated modes of cancer cell movement. Cancer Cell. 14, 349-351 (2008).
- Wolf, K. Multi-step pericellular proteolysis controls the transition from individual to collective cancer cell invasion. Nat. Cell. Biol. 9, 893-904 (2007).
- Hennigan, R. F., Hawker, K. L., Ozanne, B. W. Fos-transformation activates genes associated with invasion. Oncogene. 9, 3591-3600 (1994).
- Scott, R. W. LIM kinases are required for invasive path generation by tumor and tumor-associated stromal cells. J. Cell. Biol. 191, 169-185 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados