É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelagem e imagem 3-Dimensional Invasion cela coletiva
Neste Artigo
Resumo
Modelos de invasão das células tumorais em três dimensões da matriz extracelular melhor refletir a In vivo Situação do que os ensaios bidimensionais motilidade. Usando ensaios matriz invasão combinada com imagem confocal de células fluorescente-etiquetados, informações detalhadas sobre os modos de invasão e as contribuições distintas de líder contra seguintes células podem ser obtidas.
Resumo
A característica definidora de malignidade do câncer é a invasão e metástase 1. Em alguns tipos de câncer (e. g. Glioma 2), a invasão local para o tecido saudável é a principal causa de doença e morte. Para outros tipos de câncer (e. g. Pulmão, mama, etc.), É o processo de metástase, em que as células tumorais se mover de uma massa do tumor primário, colonizar locais distal e, finalmente, contribuir para a falência de órgãos, que eventualmente leva à morbidade e mortalidade 3. Estima-se que a invasão e metástases são responsáveis por 90% das mortes por câncer 4. Como resultado, tem havido grande interesse em identificar os processos moleculares e mediadores de proteína crítica de invasão e metástase para fins de diagnóstico e tratamento melhorando a 5.
Um desafio para os cientistas é o desenvolvimento de câncer de ensaios de invasão que se assemelham bastante a situação in vivo empara permitir a modelagem exata da doença 6. Bidimensional ensaios motilidade celular são apenas informativos sobre um aspecto da invasão e não levam em conta remodelação proteína de matriz extracelular (ECM), que também é um elemento crítico. Recentemente, pesquisas têm refinado a nossa compreensão de invasão das células tumorais e revelou que células individuais pode mover-se por modos alongadas ou arredondadas 7. Além disso, tem havido maior valorização da contribuição de invasão coletiva, na qual as células invadem em fios, chapas e aglomerados, principalmente em tumores altamente diferenciados que mantêm características epiteliais, para a propagação do câncer 8.
Nós apresentamos um método refinado 9 para examinar as contribuições de proteínas candidatas à invasão coletiva 10. Em particular, piscinas de engenharia separadas de células para expressar diferentes proteínas fluorescentes, é possível dissecar molecularmente as atividades e Proteins necessária em células líder versus aqueles exigidos nas células seguintes. O uso de RNAi fornece a ferramenta molecular para desmontar experimentalmente os processos envolvidos na invasão de células individuais, bem como em diferentes posições de invasão coletiva. Neste procedimento, as misturas de células fluorescente-etiquetados são banhados no fundo de uma inserção de Transwell previamente preenchido com Matrigel proteína ECM, então permissão para invadir "para cima" através do filtro e no Matrigel. Reconstrução de pilhas z-series imagem, obtida por imagem confocal, em representações tridimensionais permite a visualização de fios coletivamente invadindo e análise da representação das células fluorescente-etiquetadas na liderança contra seguintes posições.
Protocolo
1. Rotulagem retroviral de células com proteínas fluorescentes
- Células placa retroviral embalagem (por ex Phoenix) para fora em 0,25 x 10 6 células por poço de uma 6-bem prato em 10% soro fetal bovino (FBS) / DMEM.
- Transfecção de células com o DNA retroviral 48 horas depois células usando Effectene acordo com as instruções dos fabricantes.
- Enxágüe poços duas vezes com meio 24 horas depois, em seguida, adicione 1,5 ml de 10% FBS / DMEM por poço.
- Coletar vírus embalados em cultura de tecidos médio 48 horas mais tarde por pipetagem e transferência para 2 tubos de microcentrífuga mL.
- Centrifugar a 1600 rpm por 5 min para sedimentar as células.
- Remover o sobrenadante para um tubo limpo e armazenar a -80 ° C.
- Células a serem retrovirally transduzidas são banhados com menos 1,5 x 10 5 células por poço de um prato bem 6 e colocados em uma incubadora umidificada a 37 ° C durante a noite.
- No dia seguinte, remova a mídia a partir de células e add 1 ml do estoque de vírus suplementados com 4 polibrene mL (2 mg / mL) a cada poço. Substituir placas na incubadora.
- Após a incubação por 5-6 horas, adicionar 2 ml de 10% FBS / DMEM a cada poço e as placas são substituídas em 37 ° C inbubator durante a noite.
- No dia seguinte, troque a mídia e permitem que as células 24 horas antes de adicionar apropriados meios seletivos.
- Quando confluentes (que depende da taxa de crescimento das células, e eficiência da transdução retroviral, mas normalmente leva 4-14 dias), trypsinize células e de classificação para as células de fluorescência usando não transduzidas como referência, coletar e piscina com células fluorescência maior que os não-transduzidas células e alíquotas congelar a -80 ° C para uso futuro.
2. Ensaio de invasão inversa Matrigel
- Descongelar lentamente uma alíquota de Matrigel completa (ou seja, contendo fatores de crescimento) no gelo (Figura 1A).
- Uma vez descongelado, diluído 1:1 em Matrigel gelada PBS (juntamente com quaisquer outros adicionaistratamentos na concentração de 2x na PBS antes da diluição; Figura 1B). Para torná-lo mais fácil de manusear Matrigel antes de polimerização, todos os plasticware (por exemplo, pontas, tubos, etc) deve ser gelada.
- Inserir como muitos 8 micron dos poros de diâmetro 6,5 mm sem revestimento Transwells conforme exigido nos poços de uma placa de cultura de 24 poços de tecido, então, cuidadosamente pipeta 100 l do Matrigel diluída nos poços e deixe incubar por ~ 30 minutos a 37 ° C para solidificar (Figura 1C).
- Durante este tempo, prepare uma ou mais fluorescente marcado suspensões de células, entre 1-4 x 10 5 células por ml, dependendo da linha de células, a partir de cada condição pré-tratados (e. g. SiRNA tratamento de drogas), em seu crescimento normal médio (Figura 1D).
- Quando o Matrigel solidificou, inverter a Transwells e 100 mL de pipeta de suspensão de células para o lado de baixo para cima, de frente para o filtro (Figura 1E).
- Cuidadosamente cobrir o Transwells com a base de um tecido de 24 poçosplaca de cultura, fazer contato com cada gota de suspensão de células (Figura 1F).
- Incubar a placa no estado invertido por 4 horas para permitir a fixação das células (Figura 1G).
- Após este tempo, vire as placas com o lado direito para cima e lavar cada Transwell por seqüenciais de imersão em 2 x 1 ml meio isento de soro (Figura 2A).
- Deixe o Transwells em um terceiro poço contendo qualquer medicamentos ou tratamentos necessários (Figura 2B).
- Pipeta suavemente 100 l de 10% FBS / DMEM acrescido chemoattractant (e. g. EGF a 25 ng / ml) para a Transwell em cima do Matrigel solidificados / mistura PBS, recoloque a tampa e incubar durante 3-5 dias a 37 ° C com 5% de CO 2 (Figura 2C).
3. Coloração e visualização
- Células que expressam proteínas fluorescentes pode pular os passos abaixo antes de microscopia confocal
- A imagem não fluorescente células invasoras Transwells Matrigel, coloque em pratos frescos 24 ml Pipeta bem e 1 de 4 mMCalceína AM solução mancha no topo de cada ficha Matrigel, permitindo que ele derrame sobre os lados e mancha da parte superior e inferior. Calceína AM (éster acetoxymethyl de calceína) é um corante de células vivas que as células manchas verde inteira e não requer a fixação.
- Incubar 1 hora a 37 ° C em 5% de CO 2 atmosfera húmida, no qual as células ponto são totalmente manchado e pronta para ser fotografada por microscopia confocal.
- Alternativamente, não fluorescente células invasoras Matrigel podem ser fixadas e coradas como descrito abaixo em 3,5-3,9.
- Transfira cada Transwell a uma placa de 24 poços fresco. Sobreposição de 1 ml de 4% para-formaldehyde/0.2% Triton-X 100.
- Incubar à temperatura ambiente por 0,5 horas.
- Remover fixador e lavar 3 vezes com 1 ml de PBS.
- Remover RNA citoplasmático com 30 min de tratamento RNase usando 100 mg / ml RNase. Lavar duas vezes com PBS.
- Para visualização adicionar 0,01 iodeto de propídio mg / ml (PI) diluído em PBS e deixe em temperatura ambiente na dark para 0,5 horas. Lavar 3 vezes com PBS. Nesta fase, PI manchada transwell podem ser mantidos à temperatura ambiente no escuro por pelo menos 1 mês.
- Métodos de imagem precisa por microscopia confocal são dependentes de recursos disponíveis. Usando um microscópio invertido confocal, Transwell lugar com uma pequena quantidade de PBS residual em lamela grande (garantir que não haja bolhas de ar) sobre os não-imersão objetiva X 20 e captura de secções ópticas cada 10-15 M a partir do fundo do plug matrigel. Individuais fatias óptica pode ser utilizada para quantificar a extensão da invasão (Figura 3A) ou a construir em 3-dimensional objetos utilizando software apropriado, como Volocity (Figura 3B).
4. Resultados representante
Um exemplo de uma série de fatias Z-óptico é mostrado na Figura 3A. Neste caso, as células foram coradas com calceína AM e do número de células invasoras a partir do filtro pode ser vista a diminuir com a distância. Quantificação de novasion pode ser feito através da análise da proporção de calceína AM pixels positivo para negativo pixels em cada intervalo, ou usando o método de fixação / coloração detalhados acima e contando PI núcleos positivos em cada posição. Uma vantagem de calceína AM coloração é que as reconstruções 3-dimensional de invasão das células podem ser montados usando softwares como o Volocity, dando uma representação visual do modo de invasão (Figura 3B). Se as células são rotulados pela expressão de proteínas fluorescentes, então as posições de cada célula de cor pode ser visualizado em 3-dimensional reconstruções, tanto visto de lado (Figura 3C) ou fazendo fatias através da reconstrução (Figura 3D).
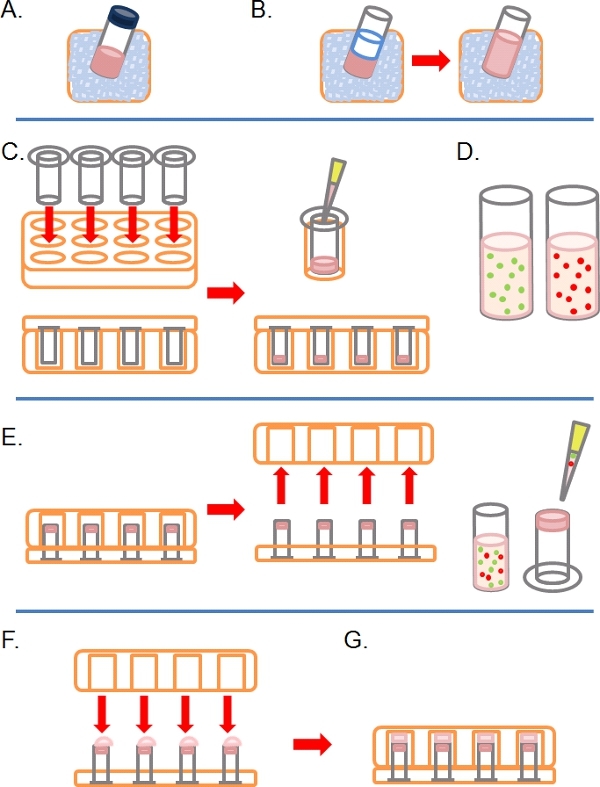
Figura 1. Diagrama esquemático das etapas envolvidas na configuração de ensaio de invasão inversa. A) Matrigel ECM descongeladas no gelo. B) Matrigel é diluído 1:1 com PBS contendo qualquer tratamentos com drogas duas vezes na concentração final. C) Insere Transwell são colocados em placas de vários poços, e Matrigel pipetados cada. D) suspensões celulares feitas na concentração desejada. E) Uma vez que o Matrigel definiu, a placa é invertido e removido, as células são banhados no filtro de baixo do Transwell insere. F) Na posição invertida, a placa multicamadas é cuidadosamente colocada sobre Transwell insere, fazendo contato com a suspensão de células. G) As células são autorizados a aderir ao filtro por 4 horas.
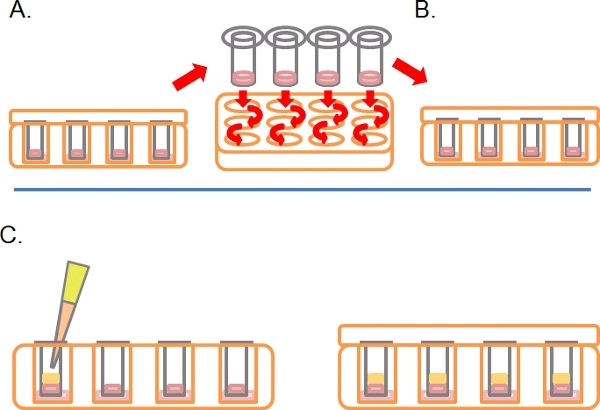
Figura 2. Continuação do diagrama esquemático para o ensaio de invasão inversa. A) Uma vez que as células aderiram, mergulhe cada Transwell em soro de mídia livre duas vezes para remover as células soltas. B) Coloque Transwell lavados em uma media final, contendo bem mais tratamentos, conforme necessário. C) Mídia contendo chemoattractant (por exemplo, 10% de soro fetal bovino) com os tratamentos, conforme exigido é cuidadosamente em camadas para Matrigel.
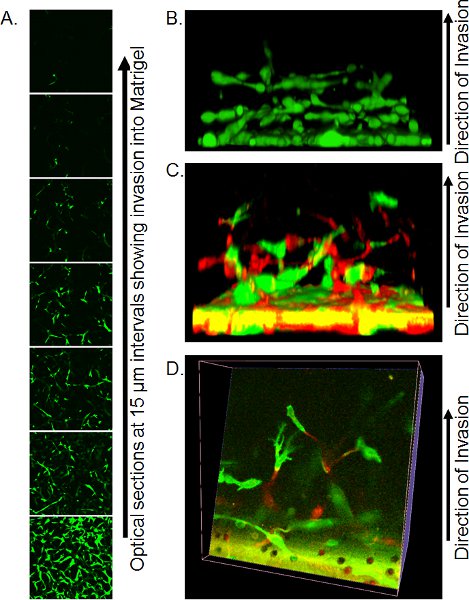
Figura 3. Imagens representativas dos resultados de ensaio de invasão inversa. A) seções óptico de células marcadas com calceína AM invadindo Matrigel, tomadas em intervalos de 15 mM por microscopia confocal. B) Reconstrução de uma reconstrução 3-dimensional de invasão de células de uma pilha de confocal Z-series imagens, visto de lado. Reproduzido da referência 10. C) reconstrução tridimensional da GFP e RFP marcado com células invasoras Matrigel visto de lado. D) fatia óptica através da reconstrução 3-dimensional de células GFP e RFP-rotulados. Reproduzido da referência 10.
Discussão
Ensaios de invasão Matrigel têm sido tradicionalmente criado com células colocado sobre uma camada de proteínas da matriz extracelular com chemoattractant induzida motilidade para e através de um filtro na parte inferior. Invasão foi classificada como uma função de quantas células podem ser contadas na parte inferior do filtro. Embora praticamente há pouca diferença com o ensaio de invasão "inversa" descrita acima, há consideravelmente mais informações sobre o processo de invasão que pode ser d...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Financiamento para esta pesquisa é do Cancer Research UK.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
|---|---|---|---|
| DMEM (Medium Modified Dulbecco Eagle) | GIBCO | 21969 | |
| Soro fetal bovino | PAA | A15-101 | |
| Estreptomicina penicilina | GIBCO | 15140 | |
| 200 mM L-Glutamina (100x) | GIBCO | 25050-032 | |
| Puromicina | Sigma-Aldrich | P8833 | |
| 0,05% Tripsina EDTA | GIBCO | 25300 | |
| Polibrene | Sigma-Aldrich | AL-118 | |
| Lipofectamine Reagente 2000 | Invitrogen | 11668019 | |
| Transwells 6,5 milímetros, 8,0 mM tamanho dos poros | Corning | 3422 | |
| Matrigel completo | BD Biosciences | 354234 | |
| Calceína AM | Invitrogen | C1430 | |
| RNase | Qiagen | 19101 | |
| Iodeto de propídio | Sigma-Aldrich | P4864 | |
| Confocal microcope | Leica | SP2MP |
Referências
- Olson, M. F., Sahai, E. The actin cytoskeleton in cancer cell motility. Clin. Exp. Metastasis. 26, 273-287 (2008).
- Hoelzinger, D. B., Demuth, T., Berens, M. E. Autocrine factors that sustain glioma invasion and paracrine biology in the brain microenvironment. J. Natl. Cancer. Inst. 99, 1583-1593 (2007).
- Chaffer, C. L., Weinberg, R. A. A perspective on cancer cell metastasis. Science. 331, 1559-1564 (2011).
- Hanahan, D., Weinberg, R. A. The Hallmarks of Cancer. Cell. 100, 57-70 (2000).
- Francia, G., Cruz-Munoz, W., Man, S., Xu, P., Kerbel, R. S. Mouse models of advanced spontaneous metastasis for experimental therapeutics. Nat. Rev. Cancer. 11, 135-141 (2011).
- Hooper, S., Marshall, J. F., Sahai, E. Tumor cell migration in three dimensions. Methods. Enzymol. 406, 625-643 (2006).
- Croft, D. R., Olson, M. F. Regulating the conversion between rounded and elongated modes of cancer cell movement. Cancer Cell. 14, 349-351 (2008).
- Wolf, K. Multi-step pericellular proteolysis controls the transition from individual to collective cancer cell invasion. Nat. Cell. Biol. 9, 893-904 (2007).
- Hennigan, R. F., Hawker, K. L., Ozanne, B. W. Fos-transformation activates genes associated with invasion. Oncogene. 9, 3591-3600 (1994).
- Scott, R. W. LIM kinases are required for invasive path generation by tumor and tumor-associated stromal cells. J. Cell. Biol. 191, 169-185 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados