È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modellazione e imaging 3-Dimensional Invasion cella Collettiva
In questo articolo
Riepilogo
Modelli di invasione delle cellule tumorali in tre dimensioni della matrice extracellulare meglio riflettere la In vivo quelli a due dimensioni saggi di motilità. Usando saggi invasione matrice combinata con l'imaging confocale di cellule fluorescenza-etichettato, informazioni dettagliate sulle modalità di invasione e il contributo distinto di leader rispetto ai seguenti cellule possono essere ottenuti.
Abstract
Una caratteristica distintiva della malignità del cancro è l'invasione e metastasi 1. In alcuni tipi di cancro (e. g. Glioma 2), invasione locale nel circostante tessuto sano è la causa principale di malattia e morte. Per altri tipi di tumore (e. g. Mammella, polmone, ecc.), È il processo di metastasi, in cui le cellule tumorali passare da una massa tumorale primaria, colonizzare siti distale e in ultima analisi, contribuire alla insufficienza d'organo, che alla fine porta a morbilità e mortalità 3. E 'stato stimato che l'invasione e le metastasi sono responsabili del 90% delle morti per cancro 4. Di conseguenza, vi è stato intenso interesse per individuare i processi molecolari e mediatori proteina critica di invasione e metastasi ai fini del miglioramento della diagnosi e del trattamento 5.
Una sfida per gli scienziati è quello di sviluppare il cancro test invasione che sufficientemente simile alla situazione in vivoper permettere la modellazione accurata della malattia 6. Bidimensionale saggi di motilità cellulare sono solo informativi circa un aspetto della invasione e non tengono conto della matrice extracellulare (ECM) rimodellamento proteina che è anche un elemento critico. Recentemente, la ricerca ha raffinato la nostra comprensione di invasione delle cellule tumorali e ha rivelato che le singole cellule possono spostare da modalità allungate o arrotondate 7. Inoltre, vi è stata maggiore apprezzamento per il contributo di invasione collettiva, in cui le cellule invadono in fili, fogli e dei cluster, in particolare nei tumori altamente differenziate che mantengono le caratteristiche epiteliali, per la diffusione del cancro 8.
Vi presentiamo un metodo raffinato 9 per esaminare il contributo delle proteine candidate per invasione collettiva 10. In particolare, le piscine di ingegneria separati di cellule di esprimere diverse proteine fluorescenti, è possibile sezionare molecolarmente le attività e PROTEIns richiesto nelle cellule principali rispetto a quelli richiesti nelle cellule seguito. L'uso di RNAi fornisce lo strumento molecolare di smontare sperimentalmente i processi coinvolti nell'invasione delle cellule individuali così come in diverse posizioni di invasione collettiva. In questa procedura, le miscele di cellule fluorescenza marcata sono placcati sul fondo di un inserto Transwell precedentemente riempiti con proteine Matrigel ECM, poi il permesso di invadere "verso l'alto" attraverso il filtro e nel Matrigel. Ricostruzione delle serie Z stack immagine, ottenuta da imaging confocale, in rappresentazioni tridimensionali permette la visualizzazione di collettivamente fili invadere e analisi della rappresentazione di cellule fluorescente-etichettato leader contro seguenti posizioni.
Protocollo
1. Etichettatura retrovirali di cellule con le proteine fluorescenti
- Piastra di cellule imballaggio retrovirali (ad esempio Phoenix) fuori a 0,25 x 10 6 cellule per pozzetto di un 6-bene piatto nel 10% siero fetale bovino (FBS) / DMEM.
- Trasfezione delle cellule con il DNA retrovirale 48 ore più tardi le cellule usando Effectene secondo le istruzioni dei produttori '.
- Sciacquare due volte con pozzi di media 24 ore più tardi, quindi aggiungere 1,5 ml di 10% FBS / DMEM per bene.
- Raccogliere virus confezionato in colture di tessuti di media dopo 48 ore pipettando e trasferendo ai tubi microcentrifuga da 2 ml.
- Centrifugare a 1600 rpm per 5 minuti per far sedimentare tutte le cellule.
- Rimuovere il supernatante in una provetta pulita e conservare a -80 ° C.
- Celle da retrovirally trasdotte sono placcati fuori a 1,5 x 10 5 cellule per pozzetto di un piatto ben 6 e posto in un incubatore umidificato a 37 ° C durante la notte.
- Il giorno successivo, rimuovere il supporto da parte delle cellule e add 1 ml di brodo virus integrato con 4 polibrene microlitri (2 mg / ml) in ciascun pozzetto. Sostituire le piastre in incubatrice.
- In seguito a incubazione per 5-6 ore, aggiungere 2 ml 10% FBS / DMEM in ciascun pozzetto e le piastre sono sostituiti in inbubator 37 ° C durante la notte.
- Il giorno successivo, sostituire i media e consentono alle cellule 24 ore prima di aggiungere appropriati terreni selettivi.
- Quando confluenti (che dipende dal tasso di crescita delle cellule, e l'efficienza della trasduzione retrovirale, ma richiede in genere 4-14 giorni), trypsinize cellule e di ordinamento per le celle a fluorescenza utilizzando non trasdotte come riferimento, raccogliere e cellule con piscina fluorescenza maggiore rispetto ai non-trasdotte aliquote e congelare a -80 ° C per uso futuro.
2. Inversa Matrigel invasione test
- Lentamente scongelare un'aliquota del Matrigel completa (cioè che contiene fattori di crescita) sul ghiaccio (Figura 1A).
- Una volta scongelato, diluire Matrigel ghiaccio 1:1 in PBS freddo (insieme a qualsiasi altra ulterioretrattamenti a concentrazione 2x nella PBS prima della diluizione; Figura 1B). Per rendere più facile da maneggiare Matrigel prima della polimerizzazione, tutti Plasticware (ad esempio punte, tubi, ecc) dovrebbe essere ghiacciato.
- Inserisci come molti pori di 8 micron 6,5 mm di diametro rivestito Transwells come richiesto nei pozzetti di una piastra ben 24 colture di tessuti, poi accuratamente pipetta 100 microlitri della Matrigel diluito nei pozzetti e lasciare incubare per circa 30 minuti a 37 ° C a solidificare (Figura 1C).
- Durante questo tempo, preparare uno o più fluorescenza marcata con sospensioni cellulari tra 1 a 4 x 10 5 cellule per ml, a seconda della linea cellulare, da ogni pre-trattati condizione (e. g. SiRNA, trattamento farmacologico) nella loro crescita normale medio (Figura 1D).
- Quando il Matrigel si è solidificato, invertire la Transwells e pipettare 100 l di sospensione cellulare sul lato inferiore rivolta verso l'alto del filtro (Figura 1E).
- Coprire attentamente la Transwells con la base di un tessuto ben 24piastra di coltura, prendere contatto con ogni goccia di sospensione cellulare (Figura 1F).
- Incubare la piastra in stato invertito per 4 ore per consentire l'attacco delle cellule (Figura 1G).
- In seguito a questo punto, girare i piatti destra-up e lavare ogni Transwell per immersione sequenziale in 2 x 1 ml di mezzo di siero libero (Figura 2A).
- Lasciare il Transwells in un terzo pozzo contenente farmaci o trattamenti necessari (Figura 2B).
- Delicatamente pipetta 100 l di 10% FBS / DMEM più chemiotattico (e. g. FEG a 25 ng / ml) nel Transwell in cima alla Matrigel solidificato / miscela PBS, sostituire il coperchio e incubare per 3-5 giorni a 37 ° C con il 5% di CO 2 (Figura 2C).
3. Colorazione e la visualizzazione
- Cellule che esprimono proteine fluorescenti possono saltare i passaggi riportati di seguito prima di microscopia confocale
- Per l'immagine non fluorescenti le cellule invadono Matrigel, Transwells luogo fresco in 24 piatti bene e pipettare 1 ml di 4 mMCalceina AM soluzione macchia sulla parte superiore di ogni spina Matrigel, permettendo così di versare sopra i lati e macchia dalla parte superiore e inferiore. Calceina AM (estere acetossimetil di calceina) è un colorante cellule vive che macchia le cellule intera verde e non richiede fissazione.
- Incubare per 1 ora a 37 ° C in 5% CO 2 atmosfera umidificata, in cui le cellule punto sono completamente colorati e pronti per essere ripreso al microscopio confocale.
- In alternativa, non fluorescenti le cellule invadono Matrigel possono essere fissate e colorate come descritto di seguito in 3,5-3,9.
- Trasferimento di ogni Transwell a un nuovo 24-pozzetti. Sovrapposizione 1 ml del 4% para-formaldehyde/0.2% Triton X-100.
- Incubare a temperatura ambiente per 0,5 ore.
- Rimuovere il fissativo e lavare 3 volte con 1 ml di PBS.
- Rimuovere RNA citoplasmatici con 30 minuti di trattamento RNasi con 100 mcg / ml RNasi. Lavare 2 volte con PBS.
- Per la visualizzazione aggiungere 0,01 mg / ml di ioduro di propidio (PI) diluito in PBS e lasciare a temperatura ambiente in dark per 0,5 ore. Lavare 3 volte con PBS. In questa fase, PI macchiato transwell possono essere conservati a temperatura ambiente al buio per almeno 1 mese.
- Metodi di imaging preciso mediante microscopia confocale sono dipendenti dalle risorse disponibili. Utilizzando un microscopio invertito confocale, Transwell luogo con una piccola quantità di residuo PBS su largo coprioggetti (garantire l'assenza di bolle sono presenti) per il mancato obiettivo immersione 20 X e catturare sezioni ottiche ogni 10-15 micron dalla parte inferiore della spina matrigel. Singoli fette ottico può essere utilizzato per quantificare l'entità di invasione (Figura 3A) o di costruire in 3-oggetti tridimensionali utilizzando un software appropriato, come Volocity (Figura 3B).
4. Rappresentante Risultati
Un esempio di serie Z di fette ottica è mostrata in figura 3a. In questo caso, le cellule sono state colorate con calceina AM e il numero di cellule invasori fino dal filtro può essere visto a diminuire con la distanza. Quantificazione dellevasion può essere fatto analizzando il rapporto di calceina AM pixel per pixel positivo negativo ad ogni intervallo, oppure utilizzando la fissazione / colorazione metodo sopra descritto e il conteggio dei nuclei PI positivo in ogni posizione. Un vantaggio di calceina AM colorazione è che il 3-dimensionale ricostruzioni di invasione delle cellule possono essere assemblati utilizzando software come Volocity, dando una descrizione visiva del modo di invasione (Figura 3B). Se le cellule sono etichettati con l'espressione di proteine fluorescenti, poi le posizioni di ogni cella del colore possono essere visualizzati in 3-dimensionale ricostruzioni, sia visti di lato (Figura 3C) o facendo fette attraverso la ricostruzione (Figura 3D).
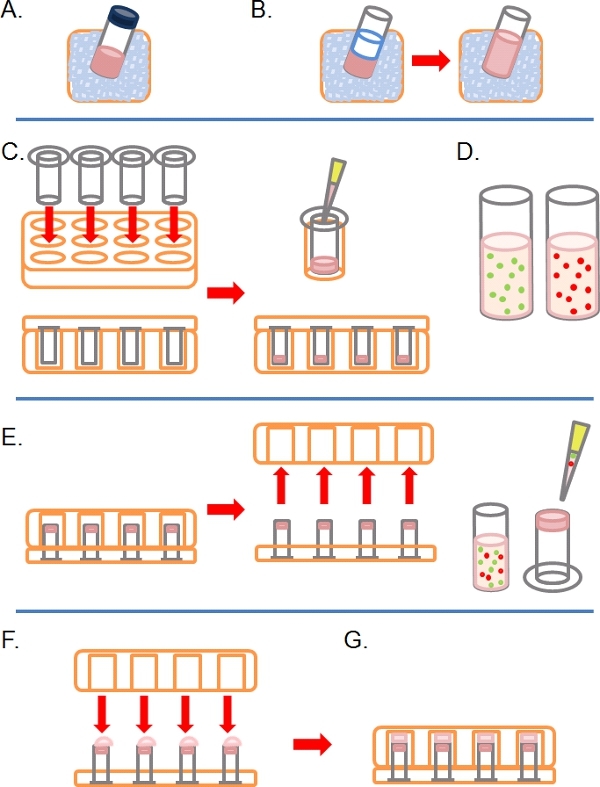
Figura 1. Schema delle tappe per la creazione di test inverso invasione. A) Matrigel ECM scongelati sul ghiaccio. B) Matrigel viene diluito 1:1 con PBS contenente eventuali trattamenti farmaco ad una concentrazione finale due volte. C) Inserti Transwell sono posti in piastre a pozzetti multipli, e in ogni Matrigel pipettati. D) le sospensioni cellulare fatto a concentrazione desiderata. E) Una volta che il Matrigel ha fissato, il piatto è invertito e rimosso, le cellule sono placcati sul filtro inferiore del inserti Transwell. F) in posizione capovolta, la lastra alveolare viene accuratamente posizionato sopra inserti Transwell, prendere contatto con la sospensione cellulare. G) Le cellule possono aderire al filtro per 4 ore.
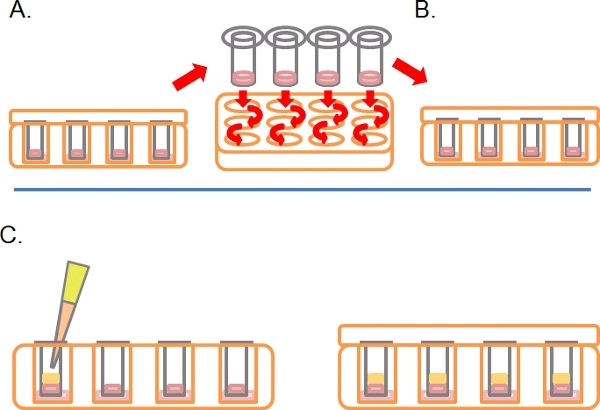
Figura 2. Proseguimento dello schema per il saggio invasione inverso. A) Una volta che le cellule hanno aderito, ciascuno Transwell tuffo in serum-free dei media due volte per rimuovere le cellule sciolto. B) Luogo lavati Transwell in un media finale contenente ben più trattamenti come richiesto. C) Media contenente chemiotattico (es. 10% di siero fetale bovino) con trattamenti come richiesto viene accuratamente a strati su Matrigel.
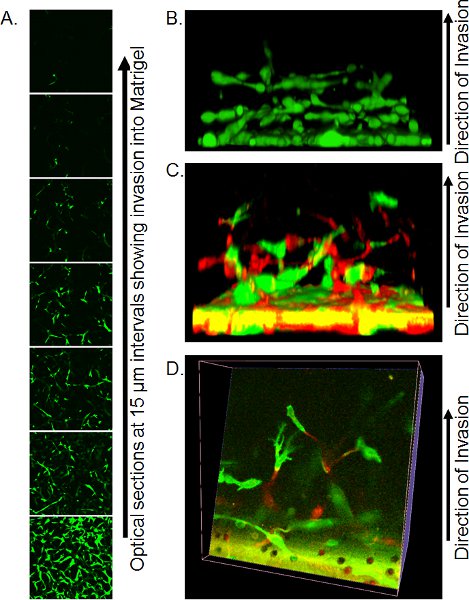
Figura 3. Immagini rappresentative dei risultati del test invasione inversa. A) sezioni ottiche di cellule colorate con calceina AM invasori Matrigel, prese a intervalli di 15 micron al microscopio confocale. B) Ricostruzione di una 3-dimensionale ricostruzione di invasione delle cellule da una pila di confocale serie Z immagini, viste dal lato. Ristampato da riferimento 10. C) Ricostruzione tridimensionale di cellule GFP e RFP-etichettati invasori Matrigel visto di lato. D) fetta ottico attraverso la 3-dimensionale ricostruzione delle cellule GFP e RFP-etichettati. Ristampato da riferimento 10.
Discussione
Saggi di invasione Matrigel sono tradizionalmente stati istituiti con le cellule posto su uno strato di proteine della matrice extracellulare con chemoattractant indotta motilità verso e attraverso un filtro in basso. L'invasività è stata valutata in funzione del numero di cellule potevano contare sulla parte inferiore del filtro. Anche se in pratica vi è poca differenza con il saggio "inversa" invasione di cui sopra, ci sono informazioni molto più sul processo di invasione che può essere deter...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Il finanziamento per questa ricerca è da Cancer Research UK.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
|---|---|---|---|
| DMEM (Medium Dulbecco Modified Eagle) | GIBCO | 21969 | |
| Siero bovino fetale | PAA | A15-101 | |
| Penicillina Streptomicina | GIBCO | 15140 | |
| 200 mM L-glutammina (100x) | GIBCO | 25050-032 | |
| Puromicina | Sigma-Aldrich | P8833 | |
| 0,05% tripsina EDTA | GIBCO | 25300 | |
| Polibrene | Sigma-Aldrich | AL-118 | |
| Lipofectamine 2000 reagente | Invitrogen | 11668019 | |
| Transwells 6.5mm, 8,0 micron diametro dei pori | Corning | 3422 | |
| Completa Matrigel | BD Biosciences | 354234 | |
| Calceina AM | Invitrogen | C1430 | |
| RNasi | Qiagen | 19101 | |
| Propidio ioduro | Sigma-Aldrich | P4864 | |
| Confocale microcope | Leica | SP2MP |
Riferimenti
- Olson, M. F., Sahai, E. The actin cytoskeleton in cancer cell motility. Clin. Exp. Metastasis. 26, 273-287 (2008).
- Hoelzinger, D. B., Demuth, T., Berens, M. E. Autocrine factors that sustain glioma invasion and paracrine biology in the brain microenvironment. J. Natl. Cancer. Inst. 99, 1583-1593 (2007).
- Chaffer, C. L., Weinberg, R. A. A perspective on cancer cell metastasis. Science. 331, 1559-1564 (2011).
- Hanahan, D., Weinberg, R. A. The Hallmarks of Cancer. Cell. 100, 57-70 (2000).
- Francia, G., Cruz-Munoz, W., Man, S., Xu, P., Kerbel, R. S. Mouse models of advanced spontaneous metastasis for experimental therapeutics. Nat. Rev. Cancer. 11, 135-141 (2011).
- Hooper, S., Marshall, J. F., Sahai, E. Tumor cell migration in three dimensions. Methods. Enzymol. 406, 625-643 (2006).
- Croft, D. R., Olson, M. F. Regulating the conversion between rounded and elongated modes of cancer cell movement. Cancer Cell. 14, 349-351 (2008).
- Wolf, K. Multi-step pericellular proteolysis controls the transition from individual to collective cancer cell invasion. Nat. Cell. Biol. 9, 893-904 (2007).
- Hennigan, R. F., Hawker, K. L., Ozanne, B. W. Fos-transformation activates genes associated with invasion. Oncogene. 9, 3591-3600 (1994).
- Scott, R. W. LIM kinases are required for invasive path generation by tumor and tumor-associated stromal cells. J. Cell. Biol. 191, 169-185 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon