Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Modélisation et Imagerie en 3 dimensions l'invasion des cellules collectives
Dans cet article
Résumé
Modèles de l'invasion des cellules tumorales en trois dimensions de la matrice extracellulaire de mieux refléter la In vivo La situation de tests de motilité en deux dimensions. En utilisant des tests d'invasion matrice combinée avec l'imagerie confocale de cellules marqué par fluorescence, des informations détaillées sur les modes d'invasion et les contributions distinctes de leader par rapport suivants cellules peuvent être obtenues.
Résumé
Une caractéristique de la malignité du cancer est une invasion et la métastase. Dans certains cancers (e. g. Gliome 2), invasion locale dans les tissus environnants sains est à l'origine de la maladie et la mort. Pour d'autres cancers (e. g. Sein, poumon, etc.), C'est le processus de métastase, dans lequel les cellules tumorales de passer d'une masse tumorale primaire, colonisent les sites distale et finalement contribuer à une défaillance organique, qui mène éventuellement à la morbidité et la de mortalité 3. Il a été estimé que l'invasion et les métastases sont responsables de 90% des décès par cancer 4. En conséquence, il a été un vif intérêt dans l'identification des processus moléculaires et les médiateurs protéiques critique de l'invasion et les métastases à des fins d'améliorer le diagnostic et le traitement 5.
Un défi pour les scientifiques est de développer un cancer des dosages invasion qui ressemble plus suffisamment à la situation in vivopour permettre la modélisation des maladies précises 6. Deux dimensions tests de motilité des cellules sont seulement informatifs sur un aspect de l'invasion et ne prennent pas en compte remodelage matriciel protéine extracellulaire (ECM) qui est aussi un élément critique. Récemment, la recherche a affiné notre compréhension de l'invasion des cellules tumorales et des cellules individuelles a révélé que peuvent se déplacer par des modes allongés ou arrondis 7. En outre, il a été plus grande appréciation de la contribution de l'invasion collective, dans laquelle les cellules envahir en brins, les feuilles et les grappes, en particulier dans les tumeurs hautement différenciées qui maintiennent des caractéristiques épithéliales, à la propagation du cancer 8.
Nous présentons une méthode raffinée 9 pour examiner les contributions des protéines candidates à l'invasion collective 10. En particulier, par des pools d'ingénierie séparées des cellules d'exprimer différentes protéines fluorescentes, il est possible de disséquer moléculairement les activités et Proteins nécessaires dans les cellules de leader par rapport à ceux requis dans les cellules suivantes. L'utilisation de l'ARNi constitue l'outil moléculaire pour démonter expérimentalement les processus impliqués dans l'invasion des cellules individuelles ainsi que dans différentes positions d'invasion collective. Dans cette procédure, des mélanges de cellules marqué par fluorescence sont plaquées sur le fond d'un insert Transwell préalablement rempli par Matrigel ECM protéines, a ensuite permis d'envahir "par le haut» à travers le filtre et dans le Matrigel. Reconstruction des piles d'images de la série Z, obtenue par imagerie confocale, en trois dimensions des représentations permet de visualiser collectivement brins d'invasion et d'analyse de la représentation de cellules marqué par fluorescence dans les principaux postes suivants par rapport.
Protocole
1. Étiquetage rétrovirale de cellules avec des protéines fluorescentes
- Cellules de la plaque d'encapsidation rétrovirale (ex Phoenix) à à 0,25 x 10 6 cellules par puits d'une 6-même plat dans 10% sérum de veau fœtal (FBS) / DMEM.
- Cellules avec un ADN rétroviral Transfecter 48 heures plus tard les cellules en utilisant Effectene conformément aux instructions du fabricant.
- Rincer les puits deux fois avec support 24 heures plus tard, puis ajouter 1,5 ml de 10% de FBS / DMEM par puits.
- Recueillir le virus en culture de tissus conditionnés moyenne 48 heures plus tard par pipetage et le transfert à 2 ml microtubes.
- Centrifuger à 1600 rpm pendant 5 min pour culotter les cellules.
- Enlever le surnageant dans un tube propre et conserver à -80 ° C.
- Les cellules à un retrovirus transduites sont étalées à 1,5 x 10 5 cellules par puits d'un plat à 6 puits et placés dans un incubateur humidifié à 37 ° C pendant la nuit.
- Le lendemain, retirez le support à partir des cellules et des annoncesd 1 ml de stock de virus complété avec 4 polybrène ul (2 mg / ml) dans chaque puits. Remplacer les plaques dans un incubateur.
- Après incubation pendant 5-6 heures, ajouter 2 ml 10% de FBS / DMEM à chaque puits et les plaques sont remplacés par 37 ° C inbubator nuit.
- Le lendemain, remplacez les médias et permettre aux cellules 24 heures avant d'ajouter milieux sélectifs appropriés.
- Lorsque confluentes (qui dépend du taux de croissance des cellules, et l'efficacité de la transduction rétrovirale, mais prend généralement de 4 à 14 jours), trypsiniser cellules et de tri des cellules par fluorescence à l'aide non-transduites comme une référence, la collecte et la piscine avec des cellules fluorescence plus grande que les non-cellules transduites et des aliquots congeler à -80 ° C pour une utilisation future.
2. Inverse test d'invasion de Matrigel
- Lentement le dégel d'une partie aliquote de Matrigel complète (c'est à dire contenant des facteurs de croissance) sur la glace (figure 1A).
- Une fois décongelé, diluer Matrigel 1:1 dans PBS glacé (avec toute les autres supplémentairestraitements à une concentration 2x dans la PBS avant dilution; figure 1B). Pour le rendre plus facile à manipuler Matrigel avant polymérisation, tous en matière plastique (par exemple des conseils, tuyaux, etc) doit être glacée.
- Insérer autant de pores 8 microns 6,5 mm de diamètre non couchés Transwells tel que requis dans le puits d'une plaque de culture de tissu 24 puits, puis soigneusement la pipette 100 pi de la Matrigel dilué dans les puits et laisser incuber pendant ~ 30 minutes à 37 ° C pour solidifier (figure 1C).
- Pendant ce temps, préparer un ou plusieurs marqués à la fluorescence des suspensions cellulaires entre 1 à 4 x 10 5 cellules par ml, en fonction de la lignée cellulaire, de chaque condition pré-traités (e. g. Traitement médicamenteux siARN,) dans leur croissance normale moyenne (figure 1D).
- Lorsque le Matrigel s'est solidifié, inverser la Transwells et la pipette 100 ul de la suspension cellulaire sur la partie inférieure orientée vers le haut du filtre (figure 1E).
- Soigneusement couvrir les Transwells avec la base d'un tissu à 24 puitsplaque de culture, de prendre contact avec chaque gouttelette de suspension cellulaire (figure 1F).
- Incuber la plaque dans l'état inversé pendant 4 heures pour permettre la fixation des cellules (figure 1G).
- Après ce temps, tournez les plaques droite-up et lavez chaque Transwell par trempage séquentielle en 2 x 1 ml de sérum moyennes libre (figure 2A).
- Laissez le Transwells dans un troisième puits contenant des médicaments ou des traitements nécessaires (figure 2B).
- Délicatement la pipette 100 ul de 10% de FBS / DMEM plus chimiotactique (e. g. EGF à 25 ng / ml) dans le Transwell sur le dessus du Matrigel solidifié / mélange PBS, remettre le couvercle et incuber pendant 3-5 jours à 37 ° C avec 5% de CO 2 (figure 2C).
3. Coloration et la visualisation
- Les cellules exprimant des protéines fluorescentes peuvent sauter les étapes ci-dessous avant de microscopie confocale
- Pour l'image non fluorescent cellules envahissant Transwells Matrigel place, en eau douce 24 plats bien et pipette de 1 ml de 4 uMCalcéine AM solution de coloration sur le dessus de chaque fiche de Matrigel, lui permettant de déborder sur les côtés et tacher d'en haut et en bas. Calcéine AM (ester acétoxyméthyle de calcéine) est un colorant de cellules vivantes qui colore les cellules ensemble vert et ne nécessite aucune fixation.
- Incuber 1 heure à 37 ° C dans 5% de CO 2 atmosphère humidifiée, à laquelle les cellules sont entièrement teinté points et prêt à être visualisé par microscopie confocale.
- Alternativement, les cellules non fluorescentes invasion de Matrigel peuvent être fixées et colorées comme décrit ci-dessous en 3.5 à 3.9.
- Transfert de chaque Transwell à une nouvelle plaque de 24 puits. Superposition de 1 ml de 4% para-formaldehyde/0.2% de Triton-X 100.
- Incuber à température ambiante pendant 0,5 heure.
- Retirer fixateur et laver 3 fois avec 1 ml de PBS.
- Retirer ARN cytoplasmique avec 30 min de traitement utilisant la RNase 100 pg / ml de RNase. Laver 2 fois avec du PBS.
- Pour la visualisation ajoutez 0,01 iodure de propidium mg / ml (PI) dilué dans du PBS et laisser à température ambiante dans la daRK pendant 0,5 heure. Laver 3 fois avec du PBS. A ce stade, PI teinté transwell peut être conservé à température ambiante dans l'obscurité pendant au moins 1 mois.
- Méthodes d'imagerie par microscopie confocale précis dépendent des ressources disponibles. En utilisant un microscope inversé confocal, Transwell place avec une petite quantité de résidus de PBS sur la lamelle de grande taille (s'assurer qu'aucun des bulles sont présentes) sur les non-objectif 20 X d'immersion et de capture des sections optiques toutes les 10-15 um à partir du bas de la fiche Matrigel. Individuels tranches optiques peuvent être utilisés pour quantifier l'ampleur de l'invasion (figure 3A) ou à construire en 3 dimensions des objets en utilisant un logiciel approprié tel que Volocity (figure 3B).
4. Les résultats représentatifs
Un exemple d'une série Z des tranches optiques est montré dans la figure 3A. Dans ce cas, les cellules ont été colorées avec calcéine AM et le nombre de cellules jusqu'à l'invasion du filtre peut être vu à diminuer avec la distance. Quantification devasion peut être fait en analysant le rapport de calcéine AM pixels positive à négative pixels à chaque intervalle, ou en utilisant la méthode de fixation / coloration détaillées ci-dessus et le comptage PI noyaux positifs à chaque position. Un avantage de calcéine AM coloration est que les reconstructions en 3 dimensions de l'invasion des cellules peuvent être assemblés en utilisant des logiciels tels que Volocity, donnant une représentation visuelle du mode d'invasion (figure 3B). Si les cellules sont marquées par l'expression de protéines fluorescentes, les positions de chacune des cellules de couleur peuvent être visualisées en trois dimensions des reconstructions, soit vu de côté (figure 3C) ou en faisant des tranches grâce à la reconstruction (figure 3D).
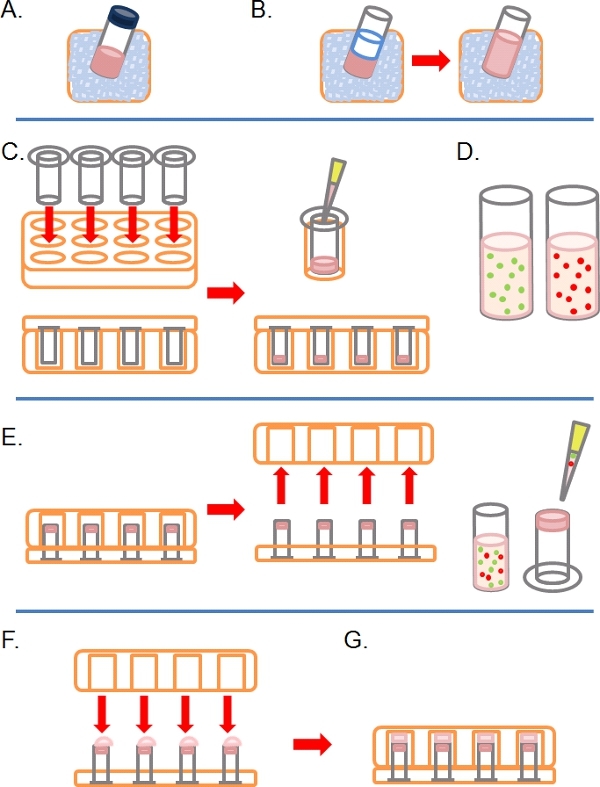
Figure 1. Schéma de principe d'étapes impliquées dans la mise en place de dosage d'invasion inverse. A) Matrigel ECM décongelées sur glace. B) Matrigel est dilué 1:1 avec PBS contenant aucun des traitements médicamenteux à une concentration deux fois plus définitive. C) Insère Transwell sont placés dans des plaques multipuits, et Matrigel pipetés dans chacune. D) Les suspensions cellulaires faites à la concentration désirée. E) Une fois le Matrigel a mis, la plaque est inversé et enlevé, les cellules sont étalées sur le filtre sous-face des inserts Transwell. F) en position inversée, la plaque alvéolaire est soigneusement placée sur inserts Transwell, prise de contact avec la suspension cellulaire. G) Les cellules sont autorisés à adhérer au filtre pendant 4 heures.
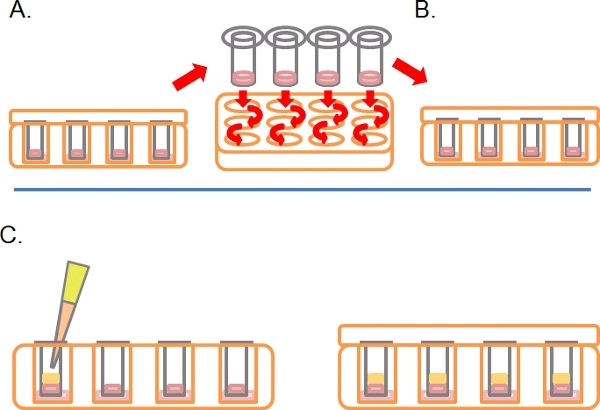
Figure 2. Poursuite du schéma pour le dosage de l'invasion inverse. A) Une fois les cellules ont adhéré, tremper chaque Transwell en milieu sans sérum à deux reprises pour enlever les cellules lâches. B) Lieu lavés dans un média Transwell finale puits contenant plus de traitements nécessaires. C) Les médias contenant chimiotactique (par exemple 10% de sérum de veau fœtal) avec des traitements comme l'exige est soigneusement déposé sur Matrigel.
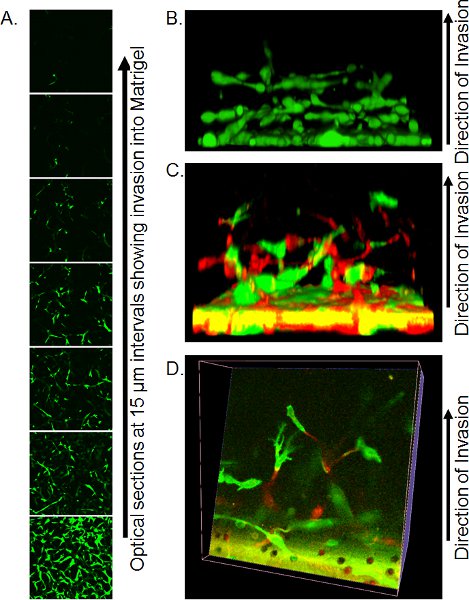
Figure 3. Images représentant des résultats de dosage de l'invasion inverse. A) des sections optiques des cellules colorées avec calcéine AM invasion de Matrigel, prises à intervalles de 15 um par microscopie confocale. B) la reconstruction d'une reconstruction en 3 dimensions de l'invasion des cellules d'une pile de confocale série Z des images, des vues de côté. Reproduit de la référence 10. C) Reconstruction tridimensionnelle de cellules GFP et RFP marqué l'invasion de Matrigel vu de côté. D) slice optique grâce à la reconstruction en 3 dimensions de cellules GFP et RFP-étiquetés. Reproduit de la référence 10.
Access restricted. Please log in or start a trial to view this content.
Discussion
Dosages invasion de Matrigel ont traditionnellement été mis en place avec des cellules placées sur une couche de protéine de la matrice extracellulaire avec chimiotactique induite par la motilité vers et à travers un filtre à la base. Envahissement a été marqué en fonction du nombre de cellules peut être compté sur la partie inférieure du filtre. Bien que pratiquement il ya peu de différence avec le dosage de l'invasion "inverse" décrit ci-dessus, il ya beaucoup plus d'informations sur l...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Le financement de cette recherche est de Cancer Research du Royaume-Uni.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | |
|---|---|---|---|
| DMEM (milieu Dulbecco modifié Eagle) | GIBCO | 21969 | |
| Sérum de veau fœtal | AAP | A15-101 | |
| La streptomycine Pénicilline | GIBCO | 15140 | |
| 200 mM de L-glutamine (100x) | GIBCO | 25050-032 | |
| Puromycine | Sigma-Aldrich | P8833 | |
| 0,05% de trypsine EDTA | GIBCO | 25300 | |
| Polybrène | Sigma-Aldrich | AL-118 | |
| Lipofectamine 2000 Réactif | Invitrogen | 11668019 | |
| Transwells 6.5mm, taille des pores 8,0 um | Corning | 3422 | |
| Remplissez Matrigel | BD Biosciences | 354234 | |
| Calcéine AM | Invitrogen | C1430 | |
| RNase | Qiagen | 19101 | |
| L'iodure de propidium | Sigma-Aldrich | P4864 | |
| Confocale microcope | Leica | SP2MP |
Références
- Olson, M. F., Sahai, E. The actin cytoskeleton in cancer cell motility. Clin. Exp. Metastasis. 26, 273-287 (2008).
- Hoelzinger, D. B., Demuth, T., Berens, M. E. Autocrine factors that sustain glioma invasion and paracrine biology in the brain microenvironment. J. Natl. Cancer. Inst. 99, 1583-1593 (2007).
- Chaffer, C. L., Weinberg, R. A. A perspective on cancer cell metastasis. Science. 331, 1559-1564 (2011).
- Hanahan, D., Weinberg, R. A. The Hallmarks of Cancer. Cell. 100, 57-70 (2000).
- Francia, G., Cruz-Munoz, W., Man, S., Xu, P., Kerbel, R. S. Mouse models of advanced spontaneous metastasis for experimental therapeutics. Nat. Rev. Cancer. 11, 135-141 (2011).
- Hooper, S., Marshall, J. F., Sahai, E. Tumor cell migration in three dimensions. Methods. Enzymol. 406, 625-643 (2006).
- Croft, D. R., Olson, M. F. Regulating the conversion between rounded and elongated modes of cancer cell movement. Cancer Cell. 14, 349-351 (2008).
- Wolf, K. Multi-step pericellular proteolysis controls the transition from individual to collective cancer cell invasion. Nat. Cell. Biol. 9, 893-904 (2007).
- Hennigan, R. F., Hawker, K. L., Ozanne, B. W. Fos-transformation activates genes associated with invasion. Oncogene. 9, 3591-3600 (1994).
- Scott, R. W. LIM kinases are required for invasive path generation by tumor and tumor-associated stromal cells. J. Cell. Biol. 191, 169-185 (2010).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon