Method Article
Animal entero fijación por perfusión de los roedores
En este artículo
Resumen
Aquí se describe un bajo costo, procedimiento rápido, fijación controlada y uniforme usando 4% de paraformaldehído perfundido a través del sistema vascular: a través del corazón de la rata para obtener la mejor conservación posible del cerebro.
Resumen
El objetivo de la fijación es preservar rápida y uniformemente tejido en un estado de vida similar. Mientras que la colocación de tejido directamente en obras fijador bien para pequeños trozos de tejido, los especímenes más grandes como el cerebro intacto plantean un problema para la fijación de inmersión porque el fijador no llega a todas las regiones del tejido a la misma velocidad 5,7. A menudo, los cambios en respuesta a la hipoxia comenzar antes de que el tejido se puede conservar 12. La ventaja de la fijación directa perfusión a través del sistema circulatorio es que el producto químico puede llegar rápidamente a todos los rincones del organismo a través de la red vascular natural. A fin de utilizar el sistema circulatorio más eficaz, se debe tener cuidado para que coincida con presiones fisiológicas 3. Es importante señalar que las presiones fisiológicas son dependientes de la especie utilizada. Las técnicas para la fijación de perfusión varían en función del tejido a ser fijado y cómo el tejido será procesado posterior a la fijación. En este vídeo, Se describe un bajo costo, procedimiento rápido, fijación controlada y uniforme usando 4% de paraformaldehído perfundido a través del sistema vascular: a través del corazón de la rata para obtener la mejor conservación posible del cerebro para inmunohistoquímica. La principal ventaja de esta técnica (vs alimentada por gravedad sistemas) es que el sistema circulatorio se utiliza más eficazmente.
Protocolo
1. Preparar Fijador
(Ver tabla de fijador y tampones.)
2. Preparar los búferes de perfusión
(Ver tabla de fijador y tampones.)
3. Preparar Aparatos y Anestesia
- Usando el baño de agua, tampón de perfusión caliente a 37 ° C. Colocar la válvula de salida en un vaso lleno con tampón. Llenar una jeringa de 50 ml con tampón y se conecte a un tubo fijador. Lave la tubería en varias ocasiones por la expulsión y retirada del tampón.
- Borrar la línea con el tampón hasta que todas las burbujas de aire en la tubería se eliminan. Es crucial para el éxito de una perfusión no tener burbujas de aire en cualquiera de las líneas.
- Retirar la jeringa y conectar el fijador de paraformaldehído al 4% (temperatura ambiente) el contenedor. Para evitar burbujas de aire en el extremo del tubo, apretar el tubo, mientras que la colocación del tubo en el recipiente de manera que una gota de tampón sobresale desde el extremo to ponerse en contacto con la superficie del fluido dentro del contenedor.
- Cierre la puerta de salida (extremo de la aguja). Gire la válvula de amortiguación (azul) a la misma posición que la válvula de fijador (blanco). Esto permitirá que el flujo desde la línea de tampón solo.
- Abra la puerta de salida y repita el paso A1 a A3 para el llenado de la línea de amortiguación. Después de que todas las burbujas de aire se eliminan cerrar el orificio de salida, retire la jeringa y conectar el recipiente tampón, teniendo cuidado de no introducir burbujas de aire en la tubería.
- Sistema de prueba para la capacidad de mantener la presión de bombeo del blub manómetro de goma. Normalmente existe una cierta resistencia debido a la compresión de aire en el sistema.
- Instalación de herramientas de la cirugía con el fin de de fácil acceso. Llenar aguja de perfusión con tampón para eliminar la posibilidad de burbujas de aire.
- Antes de la cirugía, una mezcla de ketamina / xilazina (hasta 80 mg / kg de peso corporal y ketamina 10 mg / kg de peso corporal xilazina) se administra mediante inyección intraperitoneal (27 aguja de calibre y jeringa de 1 cc). La administración adicional de anestésico se llevará a cabo según sea necesario durante el curso de cada operación para mantener un plano quirúrgico de anestesia.
4. Perfusión Cirugía
- Una vez que el animal ha llegado a un plano quirúrgico de anestesia, colóquelo en la bandeja poco profunda llena de hielo picado. (Use dedo pizca de respuesta el método para determinar la profundidad de la anestesia. Animal debe ser que no responde antes de continuar).
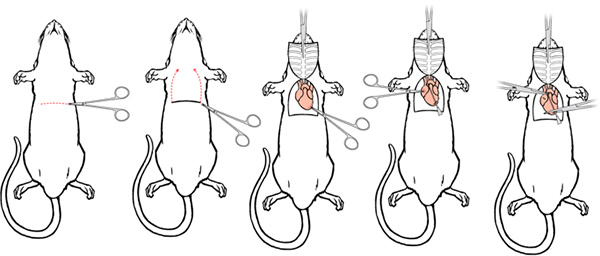
- Haga una incisión 5-6 cm lateral a través del tegumento y la pared abdominal justo debajo de la caja torácica. Con cuidado, separar el hígado a partir del diafragma.
- Haga una pequeña incisión en la membrana con las tijeras curvas, romas. La posición y la presión del dedo puede ayudar en la capacidad de cortar el diafragma.
- Continuar la incisión diafragma a lo largo de toda la longitud de la caja torácica para exponer la cavidad pleural.
- Coloque las tijeras curvas, romas a un lado de las costillas, el desplazamiento de cuidado de los pulmones, y hacer un cuT a través de la caja torácica hasta la clavícula. Haga un corte similar en el lado contralateral.
- Elevación del esternón de distancia, recortar cuidadosamente cualquier tejido que lo conecta con el corazón. Sujetar la punta del esternón con la pinza hemostática y colocar la pinza hemostática sobre la cabeza. Cuando se hace correctamente, el timo se levanta desde el corazón, junto con el esternón, que proporciona una visión clara de los grandes vasos.
- Hacer una pequeña incisión en el extremo posterior del ventrículo izquierdo con unas tijeras iris.
Haga clic aquí para ver más grande la figura .
- Pasar una aguja de calibre 15-perfusión romo o de oliva con punta-a través del ventrículo corte en la aorta ascendente. La punta debe ser visible a través de la pared de la aorta, y no debe llegar al arco de la aorta en las arterias braquial y carotídeo divergen.
- Utilizar una pinza hemostática para sujetar el corazón, esto asegura la aguja y evita la fuga. Si se desea, el hemostato modificado puede ser utilizado para sujetar la aorta alrededor de la punta de la aguja (estas hemostatos permanecer en su lugar hasta que comienza la disección, pero se omiten las ilustraciones futuras para mayor claridad).
- Por último, hacer una incisión a la aurícula derecha del animal con unas tijeras iris para crear una toma de corriente tan grande como sea posible sin dañar la aorta descendente. En este punto el animal está listo para ser perfundido.
5. Perfusión
- Abrir y conectar el puerto de salida a la aguja de la base con cuidado de no introducir burbujas de aire.
- Sube el manómetro de la bombilla a una presión de 80 mm Hg con rapidez y de manera uniforme. Mantener esta presión durante todo el período de infusión de amortiguamiento. Inicie el temporizador.
- Ajuste el ángulo de la aguja. El ángulo de la aguja es crítica para la consecución de una tasa máxima de flujo (observar el cambio de flujo con ajuste del ángulo).
- Cambie el beneficioER válvula (azul) una vez tampón está casi terminado (200 ml). El líquido debe estar en ejecución claro. La limpieza del hígado es un indicador de una buena perfusión. El hígado debe ser clara en este punto. Indique el tiempo para sus registros.
- Temblores de fijación deben ser observadas en cuestión de segundos, lo que debería ser considerado como el verdadero tiempo de la fijación. Indique el tiempo para sus registros.
- La presión puede ser gradualmente aumentar hasta un máximo de 130 mm de Hg 2 para mantener un caudal constante.
- Cierre la válvula de salida una vez que el fijador está casi terminado. Indique que termina el tiempo para sus registros.
- La rata debe ser rígida en esta etapa.
- El paraformaldehído se ha de recoger y almacenar para su eliminación de acuerdo a los reglamentos de su institución.
6. Disección de 4,11
- Retire el cabezal con un par de tijeras.
- Hacer una incisión a lo largo del tegumento desde el cuello hasta la nariz y exponer lacráneo.
- Se quita el músculo del cuello que queda para que la base del cráneo está expuesto; eliminar cualquier muscular residual con tijera o gubias.
- Coloque el extremo afilado de un par de tijeras iris en el agujero magno en un lado, cuidadosamente deslizando las tijeras a lo largo de la superficie interna del cráneo.
- A continuación, hacer un corte que se extiende hasta el borde distal de la superficie del cráneo posterior. Haga un corte idéntico en el lado contralateral. Utilice las gubias para despejar el cráneo por el cerebelo.
- Deslice cuidadosamente las tijeras a lo largo de la superficie interna del cráneo como la punta se desplaza desde la esquina posterior dorsal distal al borde distal frontal del cráneo, levantando la hoja a medida que se corte para evitar daños en el cerebro. Repita para el lado opuesto.
- Usando pinzas para pelar la superficie dorsal de la cabeza fuera del cerebro. Recorte los lados del cráneo usando pinzas también.
- Usando una espátula, cortar los bulbos olfatorios y las conexiones nerviosociones a lo largo de la superficie ventral del cerebro.
- Suavemente se burlan de el cerebro lejos de la cabeza, el recorte de cualquier duración que aún conecta el cerebro con el cráneo con unas tijeras iris.
- Quitar el cerebro y lo coloca en un vial de fijador líquido que contiene por lo menos 10 veces el volumen del cerebro mismo. Agitar el vial de vez en cuando.
7. Posterior a la fijación y almacenamiento
- Mantener el cerebro en fijador durante 24 horas a 4 ° C, agitando de vez en cuando.
- Después de 24 horas, lave el cerebro con tampón fosfato salino mediante el intercambio de los medios de comunicación 3 veces y girando cada vez.
- Los cerebros se pueden almacenar en tampón fosfato salino o HBHS con azida de sodio y se mantuvo a 4 ° C.
8. Los resultados representativos
Un primer indicador del éxito de la perfusión es la limpieza de las extremidades, tales como la nariz, orejas y patas y los órganos internos tales como la glándula del timo y el hígado (IHC Mundial).Inspección macroscópica del cerebro revela el vacío vaso sanguíneo de la sangre (de color blanco a la apariencia de color amarillo pálido). Esto será cierto también en secciones de tejido destinar para la tinción e inmunohistoquímica. El indicador final de los resultados de la perfusión es la condición de la ultraestructura en el tejido. 1,6,7,8
| Preparar Fijador: |
| Preparar un 8% de valores paraformaldehído |
|
| Preparar 0,2 M tampón fosfato de sodio, pH 7,4 |
|
| Preparar un 4% paraformaldehído fijador |
|
| Preparar la perfusión y tampones de almacenamiento: |
| Preparar tampón fosfato salino pH, 7,4 |
|
| HEPES buffer Hanks solución (HBHS) con un pH de 7,4 Azida sódica |
|
Tabla 1. Preparación del fijador y tampones.
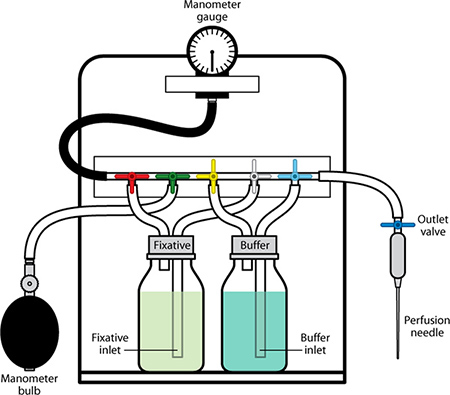
Figura 1. aparato de perfusión con componentes etiquetados.
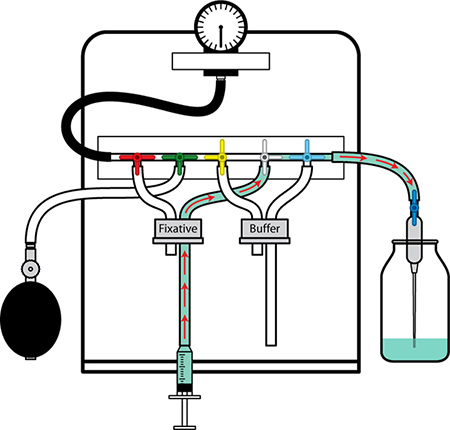
Figura 2. Preparación de la perfusión Aparato I. Comienza con la línea de fijador. Lavar el tubo de burbujas de aire y llenar con tampón por rápidamente expulsar o retirar el tampón en la jeringa ya través de la línea. Cerrar la válvula en el extremo de la aguja fuera. Coloque la línea de fijador en la botella de fijador sin introducir burbujas de aire.
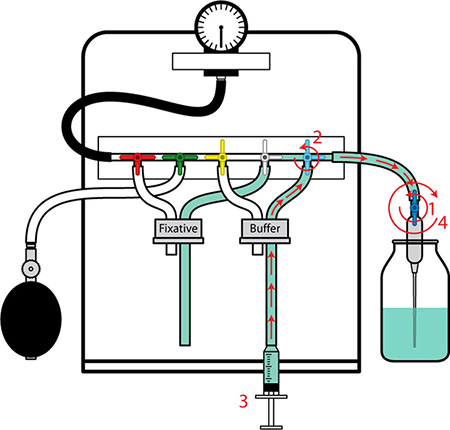
Figura 3. Preparación de la perfusión Aparato II. 1. Abrir la válvula en el extremo de la aguja. 2. Gire la válvula de amortiguación (azul) en la posición de flujo. 3. Lavar el tubo de burbujas de aire y llenar con tampón por rápidamente expulsar o retirar el tampón con la jeringa. 4. Cerrar la válvula en el extremo de la aguja. Coloque el tubo en la botella de amortiguación. Presión de prueba para asegurarse de que el sistema está sellado correctomente por el bombeo de la bombilla manómetro y observa el manómetro. El aparato está ahora listo para el procedimiento de perfusión.
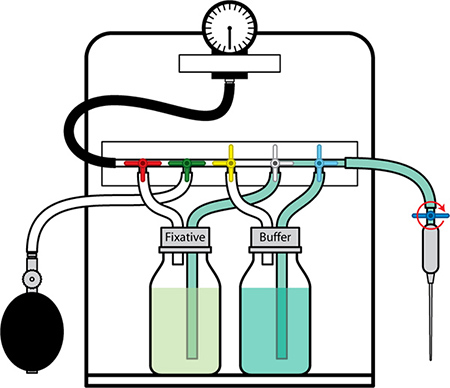
Figura 4. Aparato de perfusión en la posición para la entrega de amortiguación.
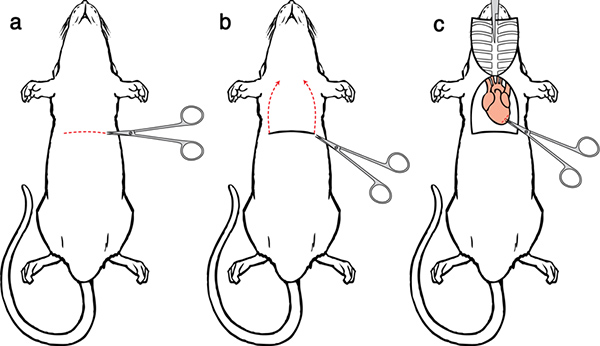
Figura 5. Perfusión Cirugía I. a) Haga una incisión lateral a través del tegumento y la pared abdominal. b) Hacer una incisión en el diafragma y cortar a través del diafragma exponer el corazón. Hacer cortes paralelos a cada lado de las costillas hasta la clavícula. c) sujetar la punta del esternón con la pinza hemostática y colocar la pinza hemostática sobre la cabeza.
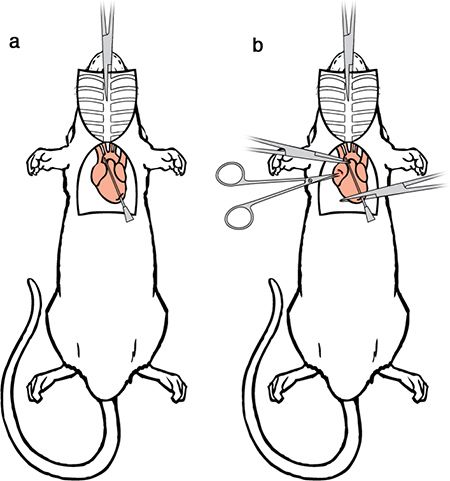
Figura 6. Perfusión Cirugía II. a) Se pasa la aguja de perfusión a través del ventrículo corte en la aorta ascendente. b) Fijar ella aguja de perfusión uso de un conjunto de pinzas hemostáticas para poner freno al corazón. Un segundo conjunto de una pinza hemostática modificada también se puede utilizar para sujetar la aorta alrededor de la punta de la aguja para evita la fuga. Con unas tijeras iris hará una pequeña incisión en el extremo posterior del ventrículo izquierdo.
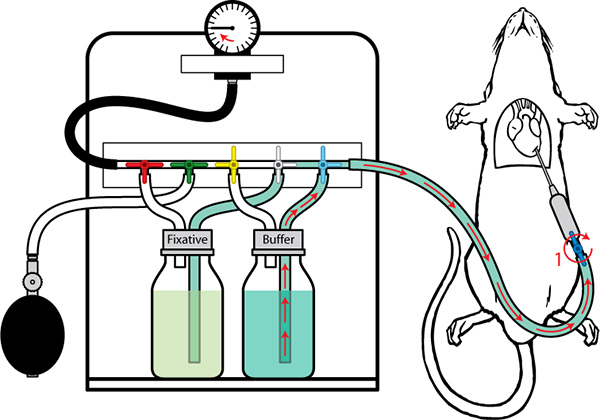
Figura 7. Perfusión con bomba en el búfer de la bombilla de manómetro para crear presión en la línea. Abra la válvula (1) y conectar a la base de la aguja. Es fundamental asegurarse de que no queden burbujas de aire introducido. Sube el bulbo manómetro a una presión de 80 mm Hg y mantener esta presión durante todo el período de infusión tampón.
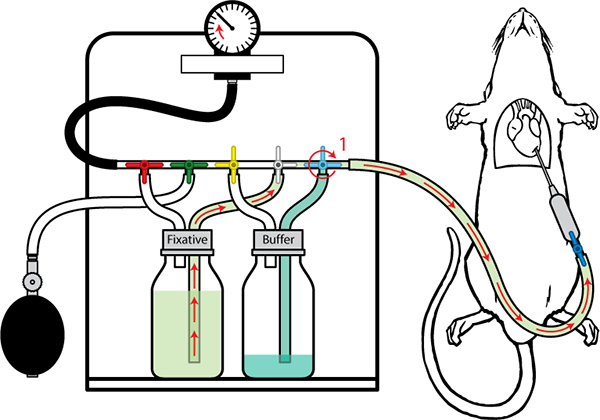
Figura 8. De perfusión con tampón de Fijación vez está casi terminado (200 ml) conmutar la válvula de tampón (1) para permitir la fijación al flujo. La presión se puede aumentar gradualmente hasta unmáximo de 130 mm de Hg.
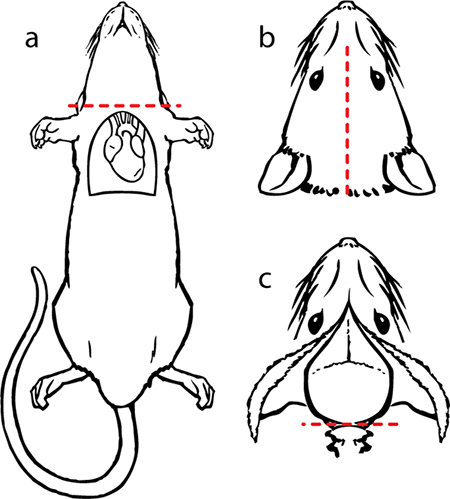
I. En la figura 9. La disección a) quitar de la cabeza con un par de tijeras. b) hacer una incisión en la piel a lo largo de la línea media desde el cuello hasta la nariz y exponer el cráneo. c) cortar el músculo del cuello restante de modo que la base del cráneo está expuesto. Sostenga la cabeza de modo que la gran abertura en la superficie del cráneo (foramen magnum) es accesible. Con cuidado, inserte la punta de unas tijeras iris en el foramen magnum y haga un corte. Repita la misma maniobra en el lado contralateral. Utilice las gubias para despejar el cráneo por el cerebelo.
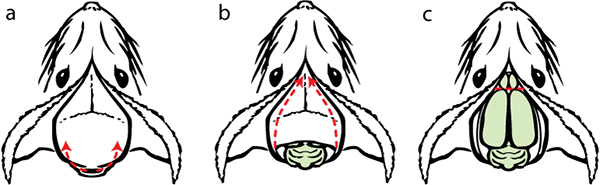
Figura 10. Disección II. a) deslice cuidadosamente las tijeras a lo largo de la superficie interna del cráneo. Levante la punta a medida que se corte para evitar daños en el cerebro. Repita el mismo paralado opuesto. Utilizar gubias pelar el cráneo fuera del cerebro. b) ilustración con el cráneo removido y expuesto el cerebro. c) utilizar una espátula para cortar los bulbos olfatorios y las conexiones nerviosas en la zona más anterior del cerebro. Guíe con cuidado la punta de la espátula a lo largo de la parte inferior del cerebro para separar las conexiones para facilitar su eliminación. Retire el cerebro y lo coloca en un vial de fijador.
Discusión
Notas adicionales para una operación exitosa:
- Una vez que el diafragma se rompe, precede rápidamente a medida que la hipoxia y la hipercapnia iniciará irreversibles los cambios fisiológicos que pueden confundir el análisis posterior.
- Cuando se inserta la aguja y se sujeta en su lugar, la presión residual empujar la sangre a la base de la aguja (flashback). De hecho, los animales más grandes con fuerza puede expulsar sangre. Es crítico que la sangre por lo menos llegar a la base de la aguja para evitar la introducción de burbujas de aire que se presentan un obstáculo para completar la perfusión. Si no se observa sangre en la base de la aguja, retire la aguja y vuelva a llenar con el tampón de su anexión al puerto de salida de la torre de la perfusión. Una vez búfer se ha ejecutado a través de la punta de la aguja puede ser reinsertada en el corazón.
- La colocación correcta de la aguja dentro de la aorta es crítico, no debe llegar tan lejos como el arco aórtico.
- Si perfusiones múltiples están llevando a cabo no es necesario to la instalación desde el principio cada vez. El usuario debe tener el volumen adecuado, tanto para el buffer y fijador en cada botella (200 ml animal / solución). Las botellas también se puede rellenar si es necesario. El aspecto más importante a considerar es el lavado de la línea de perfusión que va desde la configuración para el animal (la válvula de salida). Después de la terminación de una perfusión, esta línea tendrá paraformaldehído al 4% en el mismo. Retirar el tubo de la botella de tampón y utilizar una jeringa de 50 ml lleno de agua para enjuagar el fijador. Asegúrese de que la válvula de salida se coloca en un vaso de recogida de residuos para su eliminación adecuada de la paraformaldehído. Repita esto tres veces. Rellene con buffer usando el mismo método que se muestra en la 2.3.
- Este método para la fijación es altamente adaptable con la capacidad de cambiar tanto tampón y fijadores otros fijadores (tales como los utilizados para EM) de acuerdo con los requisitos del experimento.
- El sistema también se utiliza frecuentemente para la extracción de tejido vivo. Por estaun proceso simplemente utiliza la entrega de tampón solo (la botella de tampón, mientras que todavía unido a todo el sistema se coloca en un cubo de hielo y la botella fijador esté preparada como vacío pero sellado). Esto asegura una perfusión tampón frío a la presión óptima. Desde aquí, el sistema puede ser adaptado a la infusión de colorantes fixable por cualquiera de añadir el colorante directamente a la memoria intermedia (si la cantidad no es un problema) o utilizar una jeringa con una cantidad mínima de tampón / solución de colorante en el tampón de entre - paso fijador.
- En el caso de colada vascular, la monitorización de la presión paso tampón es crucial sin embargo debido a la viscosidad y solidificando la naturaleza de la solución de colada o bien una jeringa 50ml debe ser utilizado para la entrega directa o un accesorio desechable secundaria al aparato (tubos, válvulas y manteniendo contenedor) hecho a la interfaz con el sistema actual se utilizará. Nuestros laboratorios de fundición vascular precedió al diseño y fabricación del aparato de perfusión. Por lo tanto no podemos ST al hacerlecomió que las mediciones de la presión será una medición exacta en el sitio de entrega. Los números pueden tener que ser ajustados para conseguir un suministro exitoso de fluidos viscosos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por el Centro de Tecnología de Comunicación Neural (CNCT), un Centro de Recursos P41 financiado por el Instituto Nacional de Bioingeniería e Imágenes Biomédicas (NIBIB, P41 EB002030) y apoyado por los Institutos Nacionales de Salud (NIH).
Materiales
| Name | Company | Catalog Number | Comments |
| Equipo | Empresa | Número de catálogo | Comentarios |
| Anestésico: | |||
| La ketamina / xilazina mezcla (Anestesia pueden variar según el laboratorio / institución) | Ketaset | NDC 0856-2013-01 | 10 ml frasco |
| Cirugía: | |||
| Punta de la aguja, 27 x 1,25 GA " | Servicios de material | 25251 | |
| Grandes romas / romas tijeras curvas (aproximadamente 14,5 cm) | Herramientas de Bellas Ciencia | 14519-14 | |
| Recta tijeras iris | Herramientas de Bellas Ciencia | 14058-11 | |
| Norma pinzas | Herramientas de Bellas Ciencia | 11027-12 | |
| Par de fino (Graefe) pinzas | Herramientas de Bellas Ciencia | 11050-10 | |
| 1 pinza hemostática grandes - curvas o rectas (~ 19 cm) | surgicaltools.com | 17.21.51 | |
| 2 pinzas de hemostato estándar - recta dentada (14 cm) | Herramientas de Bellas Ciencia | 13013-14 | |
| Una pinza hemostática modificada (con orificio de calibre 15 presentada por la punta) | Herramientas de Bellas Ciencia | 13013-14 | |
| 15-calibre de la aguja con punta roma o de oliva-(aguja de perfusión) | Fisnar | 5601137 | |
| Perfusión: | |||
| HyPerfusion sistema o equivalente | |||
| Tamponada con fosfato salino pH, 7,4 | |||
| Paraformaldehído al 4% en tampón fosfato 0,1 M, pH 7,4 | |||
| De vidrio poco profundo o una bandeja de plástico, de aproximadamente 10 "x 10" | |||
| Hielo picado | |||
| Baño de agua (37 ° C) | |||
| Temporizador | |||
| 50 ml de jeringa | Medline Industries | NPMJD50LZ | |
| La disección: | |||
| Pensilvaniair de la norma tijeras rectas, rectas / romas (~ 12 cm) | Herramientas de Bellas Ciencia | 14054-13 | |
| Medio gubias curvas o rectas (14-16 cm) o pinzas de hueso del cráneo de eliminación | Herramientas de Bellas Ciencia | 16020-14 | |
| Recta tijeras iris (~ 9 cm) | Herramientas de Bellas Ciencia | 14058-11 | |
| Micro-espátula (2 dobles "extremos planos, uno redondeado, cónico uno a 1/8") | Herramientas de Bellas Ciencia | 10091-12 | |
| Posterior a la fijación y el almacenamiento: | |||
| 50 ml frasco de vidrio | |||
| 40 ml de HEPES-Buffered Hanks Solución (HBHS) con azida de sodio (90 mg / l) |
Referencias
- Cinar, O., Semiz, O., Can, A. A microscopic survey on the efficiency of well-known routine chemical fixatives on cryosections. Acta. Histochem. 108, 487-496 (2006).
- Fritz, M., Rinaldi, G. Blood pressure measurement with the tail-cuff method in Wistar and spontaneously hypertensive rats: Influence of adrenergic- and nitric oxide-mediated vasomotion. J. Pharmacol. Toxicol. Methods. 58, 215-221 (2008).
- Ikeda, K., Nara, Y., Yamorii, Y. Indirect systolic and mean blood pressure determination by anew tail cuff method in spontaneously hypertensive rats. Laboratory Animals. 25, 26-29 (1991).
- Jacobowitz, D. M. Removal of discrete fresh regions of rat brain. Brain Res. 80, 111-115 (1974).
- Jonkers, B. W., Sterk, J. C., Wouterlood, F. G. Transcardial perfusion fixation of the CNS by means of a compressed-air-driven device. Journal of Neurosci. Meth. 12, 141-149 (1984).
- Jung-Hwa, T. a. o. -. C. h. e. n. g., Gallant, J., Brightman, P. E., Dosemeci, M. W., A, ., Reese, T. S. Structural changes at the synapse after delayed perfusion fixation in different regions of the mouse brain. J. Comp. Neurol. 501, 731-740 (2007).
- Kasukurthi, R., Brenner, M. J., Morre, A. M., Moradzadeh, A., Wilson, Z. R., Santosa, K. B., Mackinnon, S. E., Hunter, D. A. Transcardial perfusion versus immersion fixation for assessment of peripheral nerve regeneration. J. Neurosci. Meth. 184, 303-309 (2009).
- Lamberts, R., Goldsmith, P. C. Fixation, fine structure, and immunostaining for neuropeptides: perfusion versus immersion of the neuroendocrine hypothalamus. J. Histochem. Cytochem. 34, 389-398 (1986).
- Ramos-Vara, J. A. Technical Aspects of Immunohistochemistry. Vet. Pathol. 42, 405-426 (2005).
- Shi, Z. R., Itzkowitz, S. H., Kim, Y. S. A comparison of three immunoperoxidase techniques for antigen detection in colorectal carcinoma tissues. J. Histochem. Cytochem. 36, 317-322 (1988).
- Walker, W. F. . Vertebrate dissection. , (1980).
- Zwienenberg, M., Gong, Q., Lee, L. L., Berman, R. F., Lyeth, B. G. J. Neurotrauma. Monitoring in the Rat: Comparison of Monitoring in the Ventricle, Brain Parenchyma, and Cisterna Magna. 16, 1095-1102 (1999).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados