Method Article
Whole fixation par perfusion des animaux pour rongeurs
Dans cet article
Résumé
Nous décrivons ici un faible coût, rapide, procédure de fixation contrôlée et uniforme à l'aide de paraformaldéhyde à 4% perfusé par le système vasculaire: à travers le cœur du rat pour obtenir la meilleure conservation possible du cerveau.
Résumé
Le but de la fixation est de rapidement et uniformément préserver le tissu dans un état de vie, comme. En plaçant le tissu directement dans les œuvres de fixateur bien pour de petits morceaux de tissus, les plus grands spécimens, comme le cerveau intact poser un problème pour la fixation d'immersion parce que le fixateur ne parvient pas à toutes les régions du tissu à la même vitesse 5,7. Souvent, les changements en réponse à l'hypoxie commencer avant le tissu peut être conservé 12. L'avantage de perfusion directement fixateur à travers le système circulatoire est que le produit chimique peut rapidement atteindre tous les coins de l'organisme en utilisant le réseau naturel vasculaire. Afin de pouvoir utiliser le système circulatoire le plus efficacement possible, il faut prendre soin pour correspondre à des pressions physiologiques 3. Il est important de noter que les pressions physiologiques sont dépendantes des espèces utilisées. Techniques pour la fixation de perfusion varient en fonction du tissu à fixer et comment le tissu seront traitées après fixation. Dans cette vidéo,, Nous décrivons un faible coût, rapide, procédure de fixation contrôlée et uniforme à l'aide de paraformaldéhyde à 4% perfusé par le système vasculaire: à travers le cœur du rat pour obtenir la meilleure conservation possible du cerveau pour l'immunohistochimie. Le principal avantage de cette technique (vs systèmes gravitaires d'adduction), c'est que le système circulatoire est utilisé le plus efficacement possible.
Protocole
1. Préparer fixateur
(Voir Fixatif table et tampons.)
2. Préparation des tampons de perfusion
(Voir Fixatif table et tampons.)
3. Préparer un appareil et d'anesthésie
- Utilisation de l'eau du bain, tampon de perfusion chaude à 37 ° C. Vanne de sortie Placer dans un bécher rempli de tampon. Remplir une seringue de 50 ml avec le tampon et le joindre à tube de fixateur. Rincer tube à plusieurs reprises par l'expulsion et de retrait du tampon.
- Effacer la ligne avec un tampon jusqu'à ce que toutes les bulles d'air dans le tube sont éliminés. Il est crucial pour le succès d'une perfusion de ne pas avoir de bulles d'air dans l'une des lignes.
- Retirer la seringue et connecter le fixateur du paraformaldéhyde à 4% (température ambiante) conteneur. Pour éviter les bulles d'air à l'extrémité du tuyau, presser le tube tout en positionnant le tube dans le récipient de telle sorte qu'une goutte de tampon dépasse de la fin to contact avec la surface de fluide à l'intérieur du récipient.
- Fermer l'orifice de sortie (extrémité de l'aiguille). Tournez la vanne de tampon (bleu) à la même position que la soupape de fixateur (blanc). Cela permettra d'écoulement de la ligne de tampon seul.
- Ouvrez l'orifice de sortie et répétez l'étape A1 à A3 pour le remplissage de la ligne de tampon. Après toutes les bulles d'air sont éliminées à proximité du port de sortie, retirer la seringue et raccorder le réservoir tampon, en prenant soin de ne pas introduire de bulles d'air dans le tube.
- Système de test pour la capacité à maintenir la pression en pompant le blub manomètre en caoutchouc. Il est normalement une résistance due à la compression de l'air dans le système.
- Configuration des outils de chirurgie pour que facile d'accès. Remplir l'aiguille de perfusion avec un tampon pour éliminer la possibilité de bulles d'air.
- Avant la chirurgie, un mélange kétamine / xylazine (jusqu'à 80 mg / kg de poids corporel et de la kétamine 10 mg / kg de xylazine poids corporel) est administré par injection intrapéritonéale (aiguille de calibre 27 et 1 seringue cc). L'administration du produit de l'anesthésique est réalisée comme nécessaire au cours de chaque opération de maintenir un plan chirurgical de l'anesthésie.
4. Chirurgie perfusion
- Une fois que l'animal a atteint un plan chirurgical de l'anesthésie, le placer sur le plateau peu profond rempli de glace pilée. (Utilisez orteil pincement réponse de la méthode pour déterminer la profondeur de l'anesthésie. L'animal doit être insensible avant de continuer).
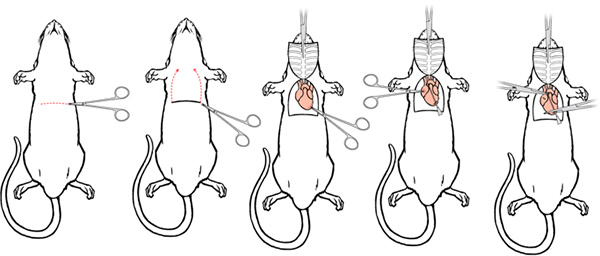
- Faire une incision latérale 5-6 cm à travers le tégument et la paroi abdominale juste en dessous de la cage thoracique. Soin séparer le foie du diaphragme.
- Faire une petite incision dans la membrane à l'aide des courbes, ciseaux à bouts ronds. La position et la pression de votre doigt peut aider à la possibilité de couper la membrane.
- Continuer l'incision membrane sur toute la longueur de la cage thoracique pour exposer la cavité pleurale.
- Placez courbes, ciseaux à bouts ronds le long d'un côté des nervures, soigneusement déplacer les poumons, et de faire une cut par le biais de la cage thoracique jusqu'à la clavicule. Faites une coupe similaire sur le côté opposé.
- Levée du sternum loin, couper avec précaution tout tissu de le connecter au coeur. Serrer la pointe du sternum à la pince hémostatique et placez la pince hémostatique sur la tête. Une fois fait correctement, le thymus se soulève du fond du cœur avec le sternum, fournissant une vue claire des principaux vaisseaux.
- Faire une petite incision à l'extrémité postérieure du ventricule gauche à l'aide de ciseaux à iris.
Cliquez ici pour agrandir la figure .
- Passez une aiguille de calibre 15 perfusion contondant ou d'olive-pointe à travers le ventricule coupe dans l'aorte ascendante. La pointe doit être visible à travers la paroi de l'aorte, et ne devrait pas atteindre la crosse aortique, où les artères brachiales et carotides divergent.
- Utilisez une pince hémostatique pour serrer le cœur, ce sécurise l'aiguille et empêche les fuites. Si vous le souhaitez, la pince hémostatique modifié peut être utilisé pour bloquer l'aorte autour de la pointe de l'aiguille (ces hémostatiques restera en place jusqu'à la dissection commence, mais ne figurent pas dans l'avenir illustrations pour plus de clarté).
- Enfin, faire une incision à l'oreillette droite de l'animal en utilisant des ciseaux à iris pour créer aussi grand que possible une prise sans endommager l'aorte descendante. À ce stade, l'animal est prêt à être perfusé.
5. Perfusion
- Ouvrez et joindre orifice de sortie de base de l'aiguille en prenant soin de ne pas introduire de bulles d'air.
- Pomper l'ampoule à une pression manométrique de 80 mm Hg rapidement et uniformément. Maintenir cette pression pendant toute la durée de la perfusion de tampon. Démarrer la minuterie.
- Ajustez l'angle de l'aiguille. L'angle de l'aiguille est essentiel à la réalisation d'un débit maximal (noter le changement de flux avec réglage de l'angle).
- Mettez le buffer de valve (bleu), une fois de tampon est presque terminé (200 ml). Le liquide doit être claire courante. La compensation du foie est un indicateur d'une bonne perfusion. Le foie doit être clair à ce stade. Indiquer le temps pour vos dossiers.
- Tremblements de fixation doivent être observées en quelques secondes, ce qui devrait être considéré comme le véritable temps de fixation. Indiquer le temps pour vos dossiers.
- La pression peut être progressivement augmenter jusqu'à un maximum de 130 mm Hg 2 à maintenir un débit constant.
- Fermez la vanne de sortie une fois que le fixateur est presque terminé. Indiquez l'heure de fin pour vos dossiers.
- Le rat doit être rigide à ce stade.
- Le paraformaldéhyde utilisé doit être recueillies et stockées pour l'élimination conformément aux règlements de votre établissement.
6. Dissection 4,11
- Retirez la tête à l'aide d'une paire de ciseaux.
- Faire une incision médiane le long du tégument de la nuque au nez et à exposer lacrâne.
- Coupez le muscle du cou restant de sorte que la base du crâne est exposé; enlever tout le muscle résiduel en utilisant ciseaux ou rongeurs.
- Placez l'extrémité pointue d'une paire de ciseaux iris dans le foramen magnum d'un côté, soigneusement glisser les ciseaux le long de la surface interne du crâne.
- Ensuite, faire une découpe s'étendant jusqu'à la bordure distale de la surface du crâne postérieur. Faire une coupe identique sur le côté opposé. Utilisez les rongeurs pour déblayer le crâne autour du cervelet.
- Faites glisser délicatement les ciseaux le long de la surface interne du crâne que la pointe se déplace à partir du coin dorsale postérieure distale jusqu'à la bordure distale frontale du crâne, soulevant la lame que vous êtes de coupe pour éviter d'endommager le cerveau. Répéter pour le côté opposé.
- Utilisation de rongeurs peler la surface dorsale du crâne loin du cerveau. Rogner les côtés du crâne en utilisant ainsi rongeurs.
- Avec une spatule, détacher les bulbes olfactifs et branchements nerveuxtions le long de la surface ventrale du cerveau.
- Doucement taquiner le cerveau loin de la tête, coupe toute mère qui relie encore le cerveau du crâne avec des ciseaux à iris.
- Enlever le cerveau et le placer dans un flacon de liquide fixateur contenant au moins 10x le volume du cerveau lui-même. Agiter le flacon de temps en temps.
7. Post-fixation et de stockage
- Gardez le cerveau dans un fixateur pendant 24 heures à 4 ° C, en agitant de temps en temps.
- Après 24 heures, laver le cerveau avec du tampon phosphate salin en échangeant les 3 médias et tourbillonnant fois à chaque fois.
- Brains peuvent ensuite être stockées en tampon phosphate salin ou HBHS avec l'azoture de sodium et conservé à 4 ° C.
8. Les résultats représentatifs
Un premier indicateur de la réussite de la perfusion est la compensation des extrémités comme le nez, les oreilles, les pattes et les organes internes tels que le thymus et le foie (IHC mondiale).L'inspection brut du cerveau révèle le vide des vaisseaux sanguins du sang (blanc à l'apparence jaune pâle). Ce sera également vrai au sein des sections de tissus destinera pour la coloration et l'immunohistochimie. Le dernier indicateur de résultat de la perfusion est la condition de l'ultrastructure dans le tissu. 1,6,7,8
| Préparer fixatif: |
| Préparez le bouillon Paraformaldéhyde 8% |
|
| Préparer tampon phosphate 0,2 M de sodium, pH 7,4 |
|
| Préparer Fixatif paraformaldéhyde 4% |
|
| Préparer perfusion et tampons de stockage: |
| Préparer Phosphate Buffered Saline, pH 7,4 |
|
| HEPES tampon Hanks Solution (HBHS) avec un pH de l'azoture de sodium 7,4 |
|
Tableau 1. Préparation de fixateur et de tampons.
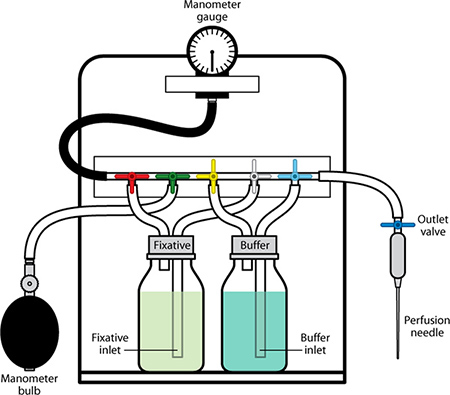
Figure 1. Appareil de perfusion avec des composants marqués.
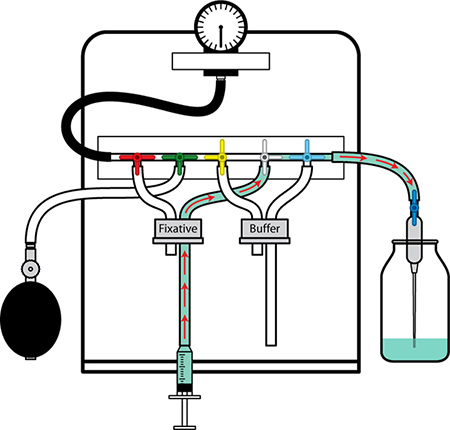
Figure 2. Préparation de l'appareil de perfusion I. Commencez par la ligne de fixateur. Rincer le tube de bulles d'air et de remplir avec le tampon en mettant rapidement expulser et de retrait du tampon dans la seringue et par le biais de la ligne. Fermez la vanne sur la pointe d'aiguille hors tension. Placez la ligne de fixateur dans la bouteille de fixateur sans introduire de bulles d'air.
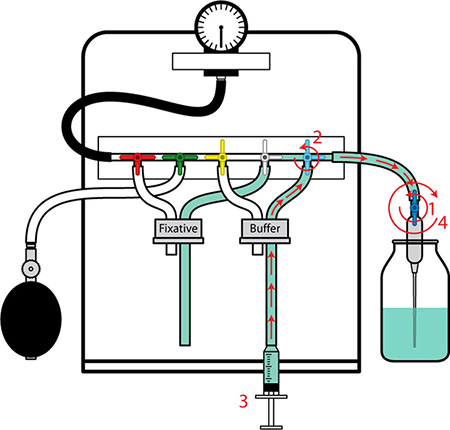
Figure 3. Préparation de l'appareil de perfusion II. 1. Ouvrir le robinet à l'extrémité de l'aiguille. 2. Tournez la vanne de tampon (bleu) pour positionner pour l'écoulement. 3. Rincer le tube de bulles d'air et de remplir avec le tampon en mettant rapidement expulser et de retrait du tampon avec la seringue. 4. Fermer le robinet à l'extrémité de l'aiguille. Placez le tube dans le flacon. Pression d'épreuve pour s'assurer que le système est scellé correctement par pompage jusqu'à l'ampoule manomètre et en observant le manomètre. L'appareil est maintenant prêt pour la technique de perfusion.
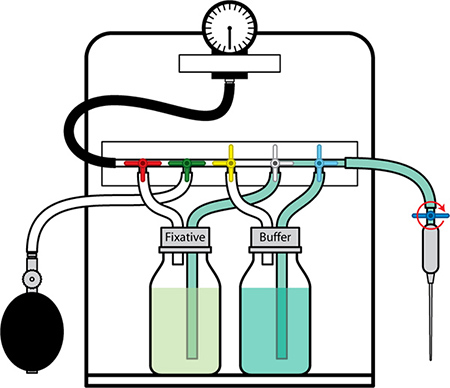
Figure 4. Appareil de perfusion en position pour la livraison de tampon.
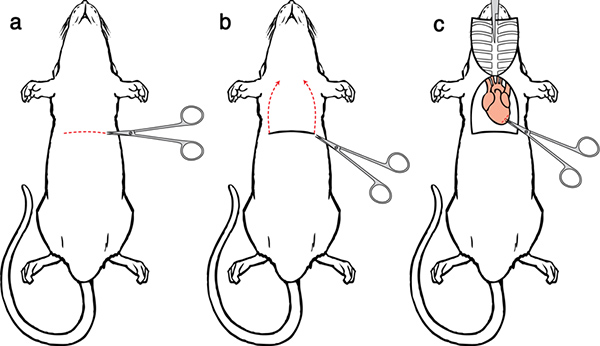
Figure 5. Perfusion Chirurgie I. a) Faire une incision latérale à travers le tégument et la paroi abdominale. b) Faire une incision dans la membrane et couper à travers la membrane d'exposer le cœur. Faire des coupes parallèles de chaque côté des nervures jusqu'à la clavicule. c) serrer la pointe du sternum avec la pince hémostatique et placer la pince hémostatique sur la tête.
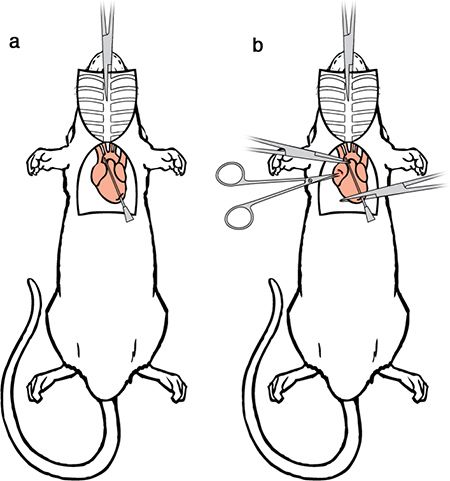
Figure 6. Chirurgie perfusion II. a) Passez l'aiguille de perfusion à travers le ventricule coupe dans l'aorte ascendante. b) Fixer lel'utilisation de seringues de perfusion un ensemble de pinces hémostatiques pour serrer le cœur. Un second ensemble de pince hémostatique une modification peut également être utilisé pour serrer l'aorte autour de la pointe de l'aiguille à éviter les fuites. L'aide de ciseaux iris faire une petite incision à l'extrémité postérieure du ventricule gauche.
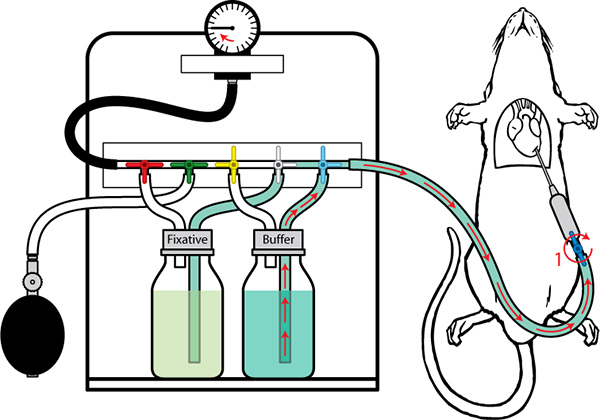
Figure 7. Perfusion avec pompe tampon de l'ampoule manomètre pour créer une pression dans la ligne. Ouvrez la vanne (1) et le joindre à l'embout de l'aiguille. Il est essentiel de s'assurer qu'aucune bulle d'air sont introduits. Pomper l'ampoule à une pression manométrique de 80 mm de Hg et à maintenir cette pression pendant toute la période d'infusion tampon.
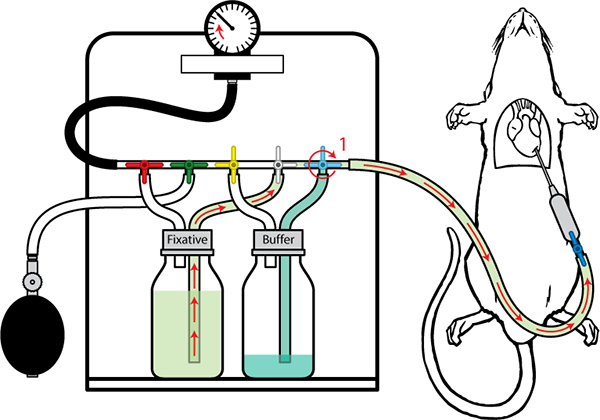
Figure 8. Perfusion avec fixateur fois tampon est presque terminé (200 ml) basculer la vanne de tampon (1) pour permettre le fixateur d'écoulement. La pression peut être augmenté progressivement jusqu'à unmaximale de 130 mm Hg.
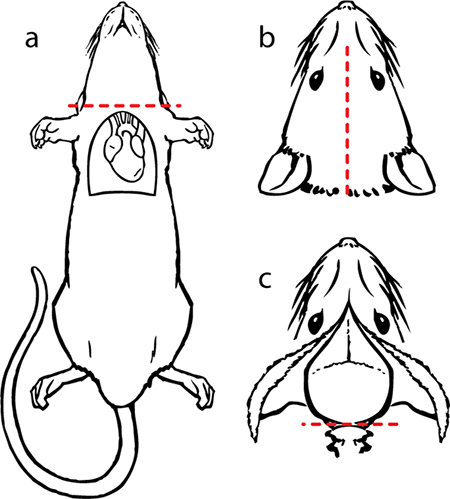
I. Dissection Figure 9. A) d'enlever la tête en utilisant une paire de ciseaux. b) faire une incision dans la peau le long de la ligne médiane du cou au nez et à exposer le crâne. c) couper le muscle du cou restant de sorte que la base du crâne est exposé. Maintenez la tête de telle sorte que la grande ouverture dans la surface du crâne (foramen magnum) est accessible. Insérez soigneusement l'extrémité pointue d'une paire de ciseaux iris dans le foramen magnum et faire une coupe. Répéter la même manoeuvre pour le côté controlatéral. Utilisez les rongeurs pour déblayer le crâne autour du cervelet.
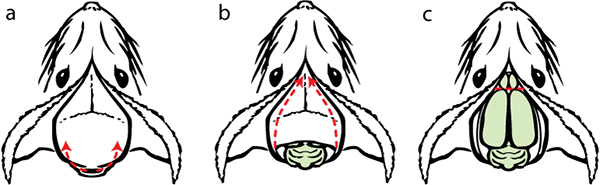
Figure 10. Dissection II. a) faire glisser soigneusement les ciseaux le long de la surface intérieure du crâne. Soulevez la pointe que vous coupez pour éviter d'endommager le cerveau. Répétez la même chose pour lescôté opposé. Utilisez rongeurs peau du crâne loin du cerveau. b) illustration avec le crâne et le cerveau enlevé exposés. c) utiliser une spatule pour couper les bulbes olfactifs et connexions nerveuses à l'endroit le plus antérieur du cerveau. Guider avec précaution le long de la pointe de spatule dessous du cerveau pour couper les connexions pour la facilité de supprimer. Enlever le cerveau et le placer dans un flacon de fixateur.
Discussion
Notes complémentaires pour une chirurgie réussie:
- Une fois que le diaphragme est violé, faites précéder rapidement que l'hypoxie et l'hypercapnie lancera irréversibles des changements physiologiques qui peuvent confondre l'analyse ultérieure.
- Lorsque l'aiguille est insérée et fixée en place, la pression résiduelle de pomper le sang à la base de l'aiguille (retour de flamme). En fait, les plus gros animaux peuvent vigoureusement expulser le sang. Il est essentiel que le sang d'au moins atteindre la base de l'aiguille pour éviter l'introduction de bulles d'air qui constituent un obstacle à compléter la perfusion. Si le sang ne s'observe à la base d'aiguille, retirez l'aiguille et le remplir avec un tampon en l'attachant à l'orifice de sortie de la plate-forme de perfusion. Une fois que la mémoire tampon a été exécuté par la pointe, l'aiguille peut être réinséré dans le coeur.
- Le positionnement correct de l'aiguille dans l'aorte est essentiel, il ne devrait pas aller aussi loin que la crosse aortique.
- Si plusieurs perfusions sont en cours, elle n'est pas nécessaire tconfiguration o dès le début à chaque fois. L'utilisateur doit avoir le volume approprié pour les deux la mémoire tampon et de fixateur dans chaque bouteille (200mls animale / solution). Les bouteilles peuvent également être renouvelée si nécessaire. L'aspect le plus important à considérer est débusquer la ligne de perfusion qui va de la mise en place à l'animal (la valve de sortie). Après l'achèvement d'une perfusion, cette ligne aura paraformaldéhyde à 4% en elle. Retirez le tuyau de la bouteille tampon et utiliser une seringue de 50 ml remplie avec de l'eau pour rincer le fixateur. Assurez-vous que la valve de sortie est placé dans un bécher de collecte des déchets pour une élimination appropriée de la paraformaldéhyde. Répétez ceci trois fois. Recharge avec un tampon en utilisant la même méthode indiquée au paragraphe 2.3.
- Cette méthode de fixation est très adaptable à la capacité de modifier à la fois de tampon et de fixateur fixateurs d'autres (tels que ceux utilisés pour les EM) selon les exigences de l'expérience.
- Le système est aussi fréquemment utilisé pour l'extraction de tissu vivant. Pour cetteun procédé utilise seulement la livraison de tampon seule (mémoire tampon de la bouteille pendant encore fixé à ensemble du système est placé dans un seau et la bouteille fixateur est configuré comme vide, mais étanche). Ceci assure une perfusion tampon froid à la pression optimale. De là, le système peut être adapté à l'infusion de colorants pouvant être fixés soit en ajoutant le colorant directement dans le tampon (si la quantité n'est pas un problème) ou d'utiliser une seringue avec une quantité minimale de tampon / solution de colorant dans la mémoire tampon entre - l'étape de fixateur.
- Dans le cas de la coulée vasculaire, l'étape de tampon surveillance de la pression est toutefois fondamental en raison de la viscosité et la solidification de la nature de la solution de coulée soit une seringue de 50 ml doit être utilisé pour la livraison directe ou avec un accessoire jetable secondaire à l'appareil (tuyau, la vanne et la tenue conteneur) fait l'interface avec le système actuel être utilisé. Nos laboratoires de coulée des vasculaire précédé la conception et la fabrication de l'appareil de perfusion. Par conséquent nous ne pouvons pas Stmangé que les mesures de pression sera une mesure précise sur le site de livraison. Les numéros peuvent être ajustées pour obtenir la livraison réussie de fluides visqueux.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ce travail a été financé par le Centre pour les technologies de la communication neuronale (CNCT), un Centre de ressources P41 financée par l'Institut national d'imagerie biomédicale et de bio-ingénierie (NIBIB, P41 EB002030) et soutenu par le National Institutes of Health (NIH).
matériels
| Name | Company | Catalog Number | Comments |
| Équipement | Entreprise | Numéro de catalogue | Commentaires |
| Anesthésique: | |||
| La kétamine / xylazine mélange (anesthésique peut varier selon le laboratoire / institution) | Ketaset | NDC 0856-2013-01 | Flacon de 10 ml |
| Chirurgie: | |||
| Pointe de l'aiguille, 27 x GA 1.25 " | Services du matériel | 25251 | |
| Les grands ronds / ronds ciseaux courbes (environ 14,5 cm) | Outils belle science | 14519-14 | |
| Droit Ciseaux Iris | Outils belle science | 14058-11 | |
| Norme pincettes | Outils belle science | 11027-12 | |
| Paire d'amende (Graefe) pince à épiler | Outils belle science | 11050-10 | |
| 1 pince hémostatique grandes courbes ou droites - (~ 19 cm) | surgicaltools.com | 17.21.51 | |
| 2 pinces hémostatiques standards - droite dentelées (14 cm) | Outils belle science | 13013-14 | |
| 1 pince hémostatique modifié (avec de calibre 15 trous déposée par l'intermédiaire de la pointe) | Outils belle science | 13013-14 | |
| 15-aiguille de calibre contondant ou d'olive-pointe (aiguille de perfusion) | Fisnar | 5601137 | |
| Perfusion: | |||
| Système HyPerfusion ou l'équivalent | |||
| Saline tamponnée au phosphate, pH 7,4 | |||
| Paraformaldéhyde 4% dans un tampon phosphate 0,1 M, pH 7,4 | |||
| En verre peu profond ou un plateau en plastique, environ 10 "x 10" | |||
| La glace concassée | |||
| Bain-marie (37 ° C) | |||
| Minuteur | |||
| Seringue de 50 ml | Medline Industries | NPMJD50LZ | |
| Dissection: | |||
| Pennsylvanieir des standards pointus / mousses ciseaux droits (~ 12 cm) | Outils belle science | 14054-13 | |
| Moyen rongeurs courbes ou droites (14-16 cm) ou des pinces os du crâne de déménagement | Outils belle science | 16020-14 | |
| Droit Ciseaux Iris (~ 9 cm) | Outils belle science | 14058-11 | |
| Micro-spatule (2 doubles "extrémités plates, l'une arrondie, un conique à 1/8") | Outils belle science | 10091-12 | |
| Post-fixation et de stockage: | |||
| Flacon de 50 ml en verre | |||
| 40 ml de HEPES-Buffered Hanks Solution (HBHS) avec de l'azoture de sodium (90 mg / l) |
Références
- Cinar, O., Semiz, O., Can, A. A microscopic survey on the efficiency of well-known routine chemical fixatives on cryosections. Acta. Histochem. 108, 487-496 (2006).
- Fritz, M., Rinaldi, G. Blood pressure measurement with the tail-cuff method in Wistar and spontaneously hypertensive rats: Influence of adrenergic- and nitric oxide-mediated vasomotion. J. Pharmacol. Toxicol. Methods. 58, 215-221 (2008).
- Ikeda, K., Nara, Y., Yamorii, Y. Indirect systolic and mean blood pressure determination by anew tail cuff method in spontaneously hypertensive rats. Laboratory Animals. 25, 26-29 (1991).
- Jacobowitz, D. M. Removal of discrete fresh regions of rat brain. Brain Res. 80, 111-115 (1974).
- Jonkers, B. W., Sterk, J. C., Wouterlood, F. G. Transcardial perfusion fixation of the CNS by means of a compressed-air-driven device. Journal of Neurosci. Meth. 12, 141-149 (1984).
- Jung-Hwa, T. a. o. -. C. h. e. n. g., Gallant, J., Brightman, P. E., Dosemeci, M. W., A, ., Reese, T. S. Structural changes at the synapse after delayed perfusion fixation in different regions of the mouse brain. J. Comp. Neurol. 501, 731-740 (2007).
- Kasukurthi, R., Brenner, M. J., Morre, A. M., Moradzadeh, A., Wilson, Z. R., Santosa, K. B., Mackinnon, S. E., Hunter, D. A. Transcardial perfusion versus immersion fixation for assessment of peripheral nerve regeneration. J. Neurosci. Meth. 184, 303-309 (2009).
- Lamberts, R., Goldsmith, P. C. Fixation, fine structure, and immunostaining for neuropeptides: perfusion versus immersion of the neuroendocrine hypothalamus. J. Histochem. Cytochem. 34, 389-398 (1986).
- Ramos-Vara, J. A. Technical Aspects of Immunohistochemistry. Vet. Pathol. 42, 405-426 (2005).
- Shi, Z. R., Itzkowitz, S. H., Kim, Y. S. A comparison of three immunoperoxidase techniques for antigen detection in colorectal carcinoma tissues. J. Histochem. Cytochem. 36, 317-322 (1988).
- Walker, W. F. . Vertebrate dissection. , (1980).
- Zwienenberg, M., Gong, Q., Lee, L. L., Berman, R. F., Lyeth, B. G. J. Neurotrauma. Monitoring in the Rat: Comparison of Monitoring in the Ventricle, Brain Parenchyma, and Cisterna Magna. 16, 1095-1102 (1999).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon