Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Análisis de la migración de la cresta neural y la diferenciación de las especies cruzadas Trasplante
En este artículo
Resumen
Un enfoque para el análisis de la migración y el destino final de las aves las células de la cresta neural en la codorniz, pollo embriones quiméricos se describe. Este método es una técnica simple y directa para el seguimiento de las células de la cresta neural durante la migración y la diferenciación que son difíciles de distinguir dentro de un embrión de pollo no manipulado.
Resumen
Embriones de aves proporcionar una plataforma única para el estudio de muchos procesos de desarrollo de vertebrados, debido a la facilidad de acceso de los embriones dentro del huevo. Quiméricos embriones de aves, en los que se trasplantan tejidos de donantes de codorniz en un embrión de pollo in ovo, se combinan el poder de etiquetado indeleble genética de las poblaciones de células con la facilidad de manipulación presentada por el embrión aviar.
Pollo Codorniz-quimeras son una herramienta clásica para el seguimiento de las células migratorias de la cresta neural (CCN) 1-3. NCC son una población flotante migratorio de las células en el embrión, que se originan en la región dorsal del tubo neural en desarrollo 4. Se someten a un epitelio mesenquimal de transición y posteriormente migrar a otras regiones del embrión, donde se diferencian en varios tipos de células incluyendo el cartílago 5-13, 11,14-20 melanocitos, neuronas y células de 21-32. NCC son multipotentes, y su destino final es influirinfluenciados por 1) la región del tubo neural en el que se originan a lo largo del eje rostro-caudal del embrión 11,33-37, 2) las señales de las células vecinas a medida que migran 38-44, y 3) el microambiente de su última destino en el embrión 45,46. Seguimiento de estas células desde su punto de origen en el tubo neural, a su posición final y el destino en el embrión, aporta datos importantes en los procesos de desarrollo que regulan los patrones y la organogénesis.
El trasplante de regiones complementarias del tubo neural de los donantes (homotópica injerto) o las diferentes regiones del tubo neural del donante (injerto heterotópico) puede revelar las diferencias en la pre-especificación de los países contribuyentes netos a lo largo del eje rostro-caudal 2,47. Esta técnica puede ser adaptado para el trasplante unilateral de un compartimiento del tubo neural, de tal manera que una parte se deriva de tejido de un donante, y los restos lado contralateral imperturbable en el embrión de acogida, yiElding un control interno dentro de la misma muestra, 2,47. También se puede adaptar para el trasplante de segmentos cerebrales de embriones posteriores, después de HH10, cuando el tubo neural anterior ha cerrado 47.
Aquí mostramos las técnicas para la generación de pollos de codorniz-quimeras mediante el trasplante del tubo neural, lo que permite el seguimiento de los países contribuyentes netos migratorios derivados de un segmento discreto del tubo neural. Específicos de una especie de etiquetado de las células derivadas del donante con el anticuerpo específico de la codorniz QCPN 48-56 permite al investigador para distinguir los donantes y las células huésped en el punto final experimental. Esta técnica es sencilla, barata y tiene muchas aplicaciones, incluyendo el destino de mapeo, linaje de células de seguimiento, y la identificación de pre-eventos de modelado a lo largo del eje rostro-caudal 45. Debido a la facilidad de acceso para el embrión aviar, la técnica de injerto codorniz-polluelo puede combinarse con otras manipulaciones, incluyendo pero no limitado a ablación lente 40, la inyección de moléculas inhibidoras 57,58, o la manipulación genética a través de electroporación de 59-61 plásmidos de expresión, para identificar la respuesta de determinados flujos migratorios de los países contribuyentes netos a las perturbaciones en el programa de desarrollo del embrión. Además, esta técnica de injerto también puede utilizarse para generar otros embriones interespecíficos quiméricos tales como codorniz-pato quimeras para estudiar la contribución NCC a la morfogénesis craneofacial, o quimeras pollo ratón para combinar el poder de la genética del ratón con la facilidad de manipulación del embrión aviar 62.
Protocolo
1. Incubar de pollo y huevos de codorniz a la etapa deseada
Para HH9 embriones, los tiempos típicos de incubación van desde 29-33 horas a 38 ° C. 63
- Lave todos los residuos de los huevos con agua tibia.
- Organizar los huevos de gallina en la bandeja en posición horizontal. Marcar la cara superior con lápiz; esto corresponderá a la región donde se localiza el embrión. Incubar los huevos de codorniz final contundente arriba.
- Lugar en los 38 ° C humidificado incubadora. Encienda la función de balanceo.
2. Prepare los huevos de ventanas y la disección
- Retire los huevos de incubadora, y esterilizar las tapas con el 70% de etanol. Lo mejor es rociar en el etanol y límpiela rápidamente con una toalla de papel o Kimwipe para evitar la absorción de etanol a través de la cáscara del huevo.
- Lugar huevo de gallina en un soporte individual de los huevos (se utiliza una placa de Petri cubierta con toallas de papel doblado, por ejemplo, "Kimwipes"). Con unas pinzas de AA, puntee en una pequeña holE en la superficie superior de la cáscara del huevo en el extremo puntiagudo del huevo.
- Retire 1,5 3 ml de la luz de la albúmina de huevo de gallina con una aguja hipodérmica 18 ½ G y jeringa de 5 ml. Lo mejor es insertar la aguja verticalmente en el agujero, con el bisel hacia el extremo puntiagudo del huevo (Figura 2A). De esta manera, cuando se retira la albúmina, existe poco riesgo de dañar accidentalmente a través de la yema de succión. Deseche la albúmina. Este paso reducirá la yema de huevo y el embrión dentro del huevo para permitir una ventana que se abrirá en la cáscara del huevo.
- Limpie el agujero con un 70% de etanol como se describió anteriormente y sellarlo con cinta adhesiva. Es importante que la cáscara de huevo que rodea el agujero está totalmente desprovisto de albúmina y seco o el adhesivo no se sellan.
- Con las pinzas de AA, toque otro agujero en la superficie marcada superior del huevo horizontal, no del todo en el ápice. Tenga cuidado de no dejar las pinzas de ir demasiado lejos a través de la cáscara de los huevos para evitar dañar la yema de huevo o embrión.
- Eninserte un lado de las curvas fórceps iris en el orificio paralelo a la cáscara huevos. Pinchazos hacia abajo en la cáscara, que trabaja en un movimiento circular para romper un ~ 2 cm de diámetro en la ventana en la cáscara del huevo de pollo. Deseche la cáscara de los huevos eliminados. Otra forma es cubrir la superficie superior del huevo con cinta de embalaje y utilizar un par de tijeras para cortar por la ventana. Esto minimiza la posibilidad de escombros cascarón caer en el huevo. El embrión debe aparecer como un disco opaco en la parte superior de la yema. Deseche todos los huevos no fertilizados (identificado por una pequeña mancha blanca en la superficie de la yema de huevo, o la ausencia de blastodermo).
- Inyectar una pequeña cantidad de tinta china (diluido 1:10 en solución de Ringer estéril que contiene "Pen / Strep" antibiótico: concentración final 100 mg / ml de penicilina y 100 ug / ml de estreptomicina) por debajo de la blastodermo para ayudar a organizar el embrión. Utilizar una jeringa de 1 ml y 26 ½ aguja hipodérmica G, doblado en un ángulo de 45 ° en la base de la aguja, con el bisel hacia arriba, alternativamente, un may utilizar una tira de vidrio pipeta de Pasteur y de aparato bucal de pipeteado (gafas de protección cuando se inclina la aguja hipodérmica o romper la aguja de vidrio). La punción de la membrana de la yema fuera del perímetro de la blastodermo y deslice la punta de la aguja por debajo del embrión, cerca de la superficie de la yema, pero no en las capas embrionarias (Figura 2B). Inyectar sólo tinta suficiente para delinear el embrión, luego, con cuidado retire la aguja (Figura 2C). La inyección de tinta en exceso puede conducir a la muerte del embrión. Es importante no inyectar cualquier burbuja de aire debajo del embrión, ya que esto puede ser una fuente de contaminación. Nota: Todos solución de Ringer utilizado en este procedimiento se esteriliza y contiene Pen / Strep como se definió anteriormente. Fosfato estéril (PBS) también es una alternativa aceptable a la solución de Ringer en todos los pasos de este protocolo.
- Etapa del embrión según Hamburger y Hamilton 63 y grabar la escena en la cáscara de los huevos con tinta indeleble o lápiz. Las etapas se evalúan mejor en estéreoomicroscopy, con fibra óptica de las fuentes de luz "cuello de cisne", que tienen una carga térmica limitada.
- Aplicar 2-3 gotas de solución de Ringer estéril caliente a la superficie del embrión para evitar la deshidratación y la contaminación. Temporalmente sellar la ventana con parafilm estirada sobre la superficie del huevo.
- Repita los pasos 2.2-2.9, con todos los huevos de pollo antes de comenzar los experimentos de transplante.
- Dado que los embriones de codorniz sólo se utilizan para tejidos de donantes, en los pasos ovo 2.2-2.9 puede omitirse. Para la preparación de ex ovo de embriones de donantes, huevos de codorniz se incuban parte roma y abrió sus puertas en esta región con pinzas curvas para mostrar el embrión. Utilizando unas tijeras de disección, hacer cuatro cortes en la forma de un cuadrado a través de la membrana vitelina y blastodermo fuera del embrión (asegúrese de que todos los cortes se encuentran). El uso de un fórceps de iris curvas, agarre suavemente un borde de corte y levante el embrión del huevo y la transfiere a la solución de Ringer en una placa de Petri. Alternativamente, se puede utilizar la curvad iris fórceps para levantar el embrión extirpados de debajo, o una cuchara embrión o pipeta de transferencia de plástico cortar a través de la parte más ancha del cilindro, puede ser utilizado para transferir el embrión del huevo. Retire con cuidado la membrana vitelina por el n º 5 fórceps. Recoger los embriones de codorniz restantes como anteriormente, y la etapa bajo un microscopio de disección.
3. Preparar el embrión de acogida para recibir el injerto
- Retirar parafina desde el host (chica) de embriones y el uso de una aguja de tungsteno afilado o unas pinzas # 5, arrancar un pequeño agujero en la membrana vitelina en la región deseada del tubo neural (Figura 3).
- Añadir una gota de solución de Ringer para el embrión. Tenga cuidado de mantener el embrión completamente sumergido en la solución de Ringer durante todo el procedimiento para evitar la deshidratación del tejido. Mantener la adición de gotas de solución de Ringer a la superficie del embrión a través de una pipeta de transferencia, si es necesario.
- Usando una aguja de vidrio tirado, cuidadosamente haga rostral y caUdal incisiones transversales correspondientes a la longitud y la región de interés en el tubo neural dorsal. (Pulled agujas de vidrio se generan a partir de silicio tubos capilares de vidrio que han sido extraídos por medio de calor con una aguja tirando aparato.) Para los injertos unilaterales las incisiones sólo debe extenderse a la luz del tubo neural dorsal, y para los injertos bilaterales, hacer las incisiones a través la totalidad del tubo neural dorsal. A continuación, corte bilateral entre el tubo neural y el dorsal del mesodermo paraxial.
- Separar cuidadosamente el explante escindió del tubo neural luego retirarlo del embrión por aspiración en una micropipeta de vidrio (Figura 3B).
4. Prepare el tejido del injerto del donante
- Elige una etapa de concordancia de embriones de codorniz. Sostenga el embrión hacia abajo con unas pinzas de AA, retire la membrana vitelina, y los impuestos especiales de una región de tamaño similar del tubo neural como se describió anteriormente (3.3 a 3.4) (Figura 3A'-B '). Dependiendo de las necesidades de su experimento, esta región puede ser unregión complementaria de la de acogida (de pollo) del tubo neural o de una región diferente a lo largo del eje rostro-caudal. (Nota: para las grandes injertos regionales, incluyendo injertos completos del tubo neural, los investigadores pueden desear agregar una digestión de la proteasa en este paso para eliminar los tejidos adherentes mesenquimales del tejido del donante antes del trasplante Sin embargo, para los pequeños injertos dorsales del tubo neural en las primeras etapas. , como se detalla aquí, la digestión de proteasa no es necesario ya que el tubo neural se separa fácilmente de mesénquima adyacente por medio de técnicas quirúrgicas estrictamente.)
5. Injerto del tejido
- Aspirar el explante donante en una micropipeta de vidrio que contenía la solución de Ringer. Tenga cuidado de no introducir burbujas en la pipeta.
- Transferir el explante adyacente a la región escindió del huésped polluelo. Utilizando aguja tira de cristal, orientar el explante y guiar suavemente en la región ablacionada (Figura 3C).
- Añadir con cuidado unas gotas de solución de Ringerpara el embrión para evitar la deshidratación. Tenga cuidado de no dejar caer el líquido directamente en el sitio del injerto, ya que puede desplazar el injerto.
- Cierre la ventana con cinta de embalaje. Asegúrese de que la cinta de juntas de toda la región del huevo ventana. Esto evita la deshidratación y la contaminación del embrión durante la incubación posterior.
- Vuelva a colocar el huevo a la incubadora hasta el punto deseado. Asegúrese de que la "mecedora" la función está desactivada, mientras que la incubación de las quimeras. Los huevos se pueden girar con la mano suavemente dos veces al día ya que esto puede aumentar su viabilidad si las etapas posteriores del desarrollo se dirigen.
6. Preparar embriones quiméricos para seccionar
- En el punto final experimental, cortó la cinta que cubre la ventana con unas tijeras finas.
- Sujete el borde del blastodermo con unas pinzas curvas iris (más fácil que ver con puntas estriadas), a continuación, cortar el embrión fuera de la yema de huevo con 4 grandes cortes fuera de los límites del blastodermo.
- Transferir el embrión a una placa de Petri que contenía solución de Ringer. Tenga cuidado para minimizar la exposición del embrión al aire con el fin de evitar la deshidratación del tejido.
- Bajo microscopía estereoscópica, con cuidado separar la membrana vitelina del blastodermo usando # 5 fórceps.
- Con cuidado, organizar el embrión en el plato para que el embrión se encuentra en la misma orientación, ya que estaba en el huevo, con membranas que rodean el plano presentado.
- El uso de disección agujas hechas de tungsteno 64 cables para eliminar limpiamente el blastodermo circundante del embrión por la organización de la aguja en el límite del embrión y tejidos extraembrionarias, con la longitud del alambre de tungsteno paralelo a la parte inferior del plato. Use un movimiento suave para cortar a través de los tejidos.
- Retire con cuidado el amnios por el n º 5 fórceps. En este punto usted puede, o bien desea más disección de la región de su interés, o dejar todo el embrión.
- Transferencia del embrión a la helada PARAF 4%ormaldehyde y el rock la noche a 4 ° C.
- Preparar las muestras e incorporar para la sección crio-o parafina.
Trace el tejido injertado en el embrión de acogida. Existen varias técnicas para la identificación de los tejidos de codorniz en un embrión de pollo, incluyendo la detección de codorniz nucleolos por tinción hematoxilina (núcleos de codorniz tienen muy grandes, más oscuros que los núcleos de tinción de inclusiones de pollo), la reacción de Feulgen-Rossenbeck, naranja de acridina-o biz benzamida mancha de combinado con microscopia electrónica, o inmunomarcaje para la codorniz antígenos específicos 3,47,65,66. Aquí se utiliza el antígeno QCPN estándar y todo el montaje o la sección de técnicas de inmunofluorescencia para identificar las células de la cresta neural de codorniz en la codorniz, pollo quimeras (Figura 4). Esta técnica proporciona la mayor flexibilidad en el diseño experimental, como la inmunofluorescencia QCPN también puede combinarse con otros anticuerpos para identificar las células diferenciadas derivadas del donante (codornices) del tejido. Utilice Standaª todo el montaje o las técnicas de la sección de inmunofluorescencia para etiquetar las células derivadas de la codorniz en quimeras.
7. Los resultados representativos
Una imagen representativa de la región injertada del tubo neural después de 6 horas de re-incubación (para HH11) muestra la incorporación de la espera del donante injertadas (codornices) tejidos en el huésped (pollo) del tubo neural (Figura 4). Los embriones que muestran la integración incompleta del injerto, o el desarrollo asimétrico de la región craneal o somitas después reincubación debe ser desechada.
Sección transversal de la región injertado en HH11 CCN muestran marcadas con el HNK-1 migrar lateralmente hacia fuera del tubo neural. Las células de codorniz que contribuyen a la corriente migratoria del NCC, y el tubo neural, están claramente etiquetados con QCPN (Figura 4B).
En etapas posteriores, codorniz CNC derivados de células se puede buscar a su tejido diana final. QCPN células marcadas se intercalan en el mesénquima del embrión de pollodel proceso maxilar en E5 (Figura 4C).
El anticuerpo QCPN se puede combinar fácilmente con otros anticuerpos para examinar la diferenciación de las codornices derivados de los países contribuyentes netos en el entorno de acogida. Codorniz CNC derivados de las neuronas sensoriales del trigémino son etiquetados por QCPN y Tuj1 anticuerpos (Figura 4D).
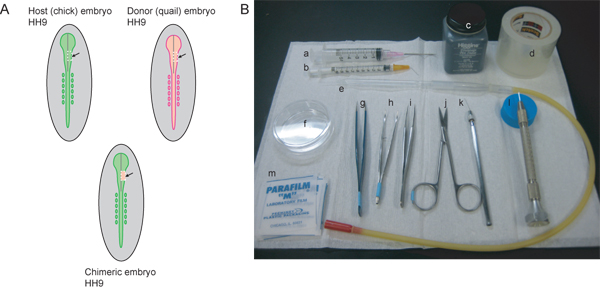
Figura 1. Descripción del procedimiento experimental y los instrumentos necesarios. Un anfitrión) (chica) y embriones de donantes (codornices) debe estar en el escenario acompañado. Para etiquetar la corriente que contribuye a la CNC el ganglio del trigémino y la región maxilo-mandibular, HH9 es ideal. En HH9, el tubo neural se está empezando a cerrarse en la región rostral, pero aún no está completamente sellada. La línea gris en el diagrama representa la línea media del tubo neural de cierre. Las líneas blancas punteadas indican las líneas de corte para extirpar una región mesencéfalo del lado derecho del tubo neural del anfitrión y el donante embryos. La región escindió del embrión huésped se desecha y el tejido del donante trasplantadas para generar en el embrión quimérico. B) Los instrumentos necesarios son: una jeringa) 5 ml con 18 ½ aguja de calibre hipodérmica, b) 1 ml jeringa con 26 ½ hipodérmica G inclinación de la aguja en ángulo de 45 °, c) la tinta china, d) la cinta de embalaje transparente, e) pipeta de vidrio con la boca pipeteo aparato, f) 60 mm de placa de Petri, g) AA fórceps, h) con fórceps curvos iris con puntas estriadas, i) # 5 pinzas, tijeras finas j), k) afilado alambre de tungsteno, l) sacó aguja de cristal, m) Parafilm cuadrados.
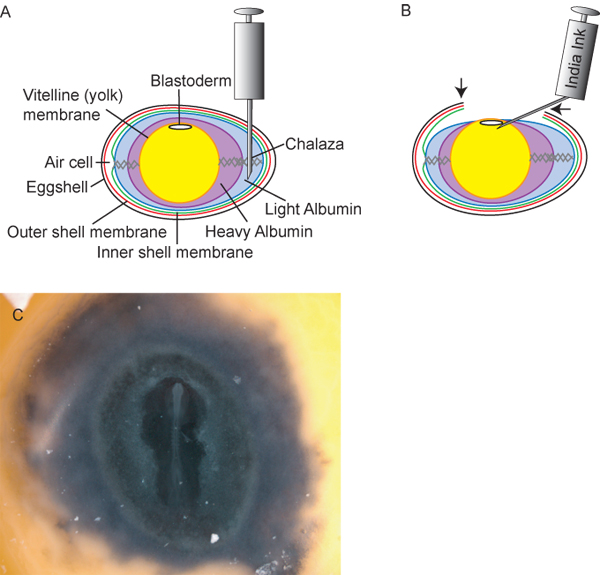
Figura 2. Preparación de los huevos y embriones. A) transversal diagrama del huevo, incluyendo el punto de inserción ideal de 18 ½ aguja hipodérmica G para la retirada de la luz de albúmina. B) Después de la retirada de la luz ~ 3 ml de albúmina, la yema de huevo y el embrión dentro del huevo disminuye, permitiendo a los investigadores para cortar una "ventana" (flechas) en tque la cáscara de huevo para acceder al embrión. Tinta china, diluido 1:10 en solución de Ringer estéril, entonces puede ser inyectada debajo de la blastodermo para proporcionar un contraste de montaje fácil de los embriones. C) de embrión de pollo después de entintar.
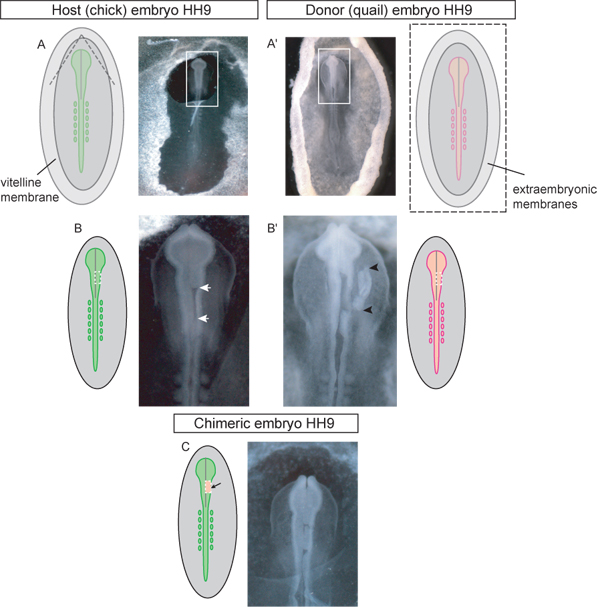
Figura 3. Esquema y ejemplos de la etapa 9 HH embriones de donantes y de acogida en cada paso del procedimiento de injerto. Un embrión) El polluelo de acogida. Las líneas punteadas en el diagrama indica que la membrana vitelina debe ser arrancada para acceder a la región craneal para el injerto. Una vez rota la aleta triangular de membrana vitelina deben ser peladas caudalmente. Caja de imagen indica el recuadro utilizado en (BC). A ') de los donantes de embriones de codorniz. La imagen es de embriones de donantes extirpados de huevo y colocar en placa de Petri para la disección del tejido injertado. Caja de imagen indica el recuadro utilizado en (B '). Las líneas punteadas en el diagrama esquemático (A ') indican que la vitelina y las membranas yema se debe cortar con el fin de eliminar el tél embrión del huevo. B) Host de embriones con la región del mesencéfalo unilateral del tubo neural extirpado (flechas blancas) en espera de injerto. La línea de puntos en el diagrama esquemático indica que los cortes deben hacerse extirpar el tubo neural en la región del cerebro medio. ) B 'de embriones de donantes con el dorsal de tejido neural injerto de tubo extirpado (injerto de tejido indicado por flechas negras). La línea de puntos en el diagrama indica que los cortes deben hacerse en el embrión de codorniz de extirpar tejido del donante para el injerto unilateral de la región del cerebro medio del tubo neural. C) embrión quimérico después del injerto de codorniz explante dorsal del tubo neural en la región del cerebro medio pollito.
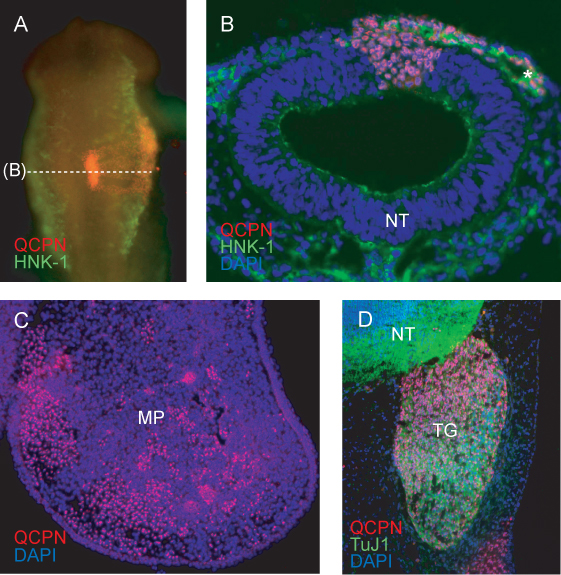
Figura 4. Inmunofluorescencia para detectar la codorniz específica QCPN antígeno nuclear de células derivadas del donante en el embrión quimérico. A) todo el montaje de la imagen de quimera HH11 (injertado en HH9) que muestra tinción QCPN en rojo, y HNK-1 tinción (un marcador de la migración de los países contribuyentes netos) enverde. Un aumento de 10X, vista dorsal. B) Sección transversal a través del embrión en (A), mostrando QCPN células positivas derivadas de codorniz en el tubo neural y migratorias NCC co-teñidos con HNK-1 (verde). Ampliación 40X. C) Sección transversal del maxilar a través del proceso de quimera E5 (se incubaron durante 3 días después del injerto), mostrando QCPN NCC-positivos derivados de las células (en rojo), que han emigrado de la región injertada del tubo neural en su ubicación final en el embrión. Un aumento de 10X. D) Sección a E5 quimera que muestra la contribución de codorniz deriva NCC al ganglio trigémino (rojo) y la diferenciación en Tuj1 neuronas positivas (verde). Ampliación 40X. *, Los países contribuyentes netos, MP, proceso maxilar, NT, del tubo neural; ganglio de TG, del trigémino.
Discusión
El injerto de tubo neural codorniz en embriones de pollo de acogida se describe aquí es una técnica sencilla y de bajo costo para el seguimiento de subpoblaciones específicas de la migración de los países contribuyentes netos provenientes de diferentes regiones a lo largo del eje rostro-caudal 21,67-69. Esta técnica aprovecha las ventajas de la facilidad de acceso a los embriones aviares (en comparación a los embriones de mamíferos) y se puede combinar con otras técnicas, tales como la ablación del ...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen a los miembros del laboratorio Lwigale para la crítica del manuscrito. SLG se apoya en una Ruth L. Kirschstein NRSA beca del National Eye Institute (F32 EY02167301). PYL es apoyada por el National Eye Institute (EY018050).
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo | Empresa | Número de catálogo | |
| Los huevos del polluelo | Varios - usamos la Texas A & M University, Departamento de Ciencias Avícolas, TX. | ||
| Huevos de codorniz | Varios - usamos Empresa Ozarks huevo, MO. | ||
| Huevo de incubadora (Lectura Digital 1502 Sportsman Incubadora w / Humedad de 110-120 voltios de CA) | www.poultrysupply.com | 1502 | |
| Dumont AA fórceps, Inox con recubrimiento epóxico | Herramientas de Bellas Ciencia | 11210-10 | |
| Cinta adhesiva | Cualquier tienda de suministros de oficina | ||
| Curva pinza Iris | Herramientas de Bellas Ciencia | 11065-07 | |
| Yondia de tinta | Cualquier tienda de arte | ||
| Penicilina / estreptomicina (penicilina, estreptomicina) Solución | VWR International | 101447-068 | |
| La cinta de embalaje transparente | Cualquier tienda de suministros de oficina | ||
| Aguja aparato tirando | Narashige, Japón | PE-21 | |
| Vidrio sacó la aguja, hizo 1,5 a 1,8 x 100 mm tubo de vidrio de borosilicato capilar | Kimble Chase, | 34500 99 | |
| Tirado pipeta de vidrio, a partir de 5 ¾ "pipeta Pasteur | Fisher Scientific | 13-678-6A | |
| Boca pipeta de aparatos (montaje de aspiración del tubo de pipeta calibrada microcapilar) | Sigma-Aldrich | A5177-52A | |
| Dumont n º 5 con fórceps | Herramientas de Bellas Ciencia | 11251-30 | |
| Tonelalambre de gsten, diámetro 0,1 mm | VWR International | AA10404-H2 | |
| Los porta-agujas (niquelado soporte del pasador) | Herramientas de Bellas Ciencia | 26018-17 | |
| QCPN antisuero | Hibridoma Estudios del Desarrollo del Banco, de la Universidad de Iowa. | QCPN | |
| Alexa Fluor anticuerpo secundario (por ejemplo, Alexa Fluor 594 cabra anti-ratón IgG1) | Invitrogen | A21125 | |
Solución de Ringer (2L):
| Todos los reactivos de Fisher Scientific |
|
Referencias
- Le Douarin, G., Renaud, D. Morphologic and physiologic study of the differentiation in vitro of quail embryo precardial mesoderm. Bull. Biol. Fr. Belg. 103 (3), 453-468 (1969).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods. Mol. Biol. 461, 337-350 (2008).
- Le Douarin, N. A biological cell labeling technique and its use in expermental embryology. Dev. Biol. 30 (1), 217-222 (1973).
- Noden, D. M. An analysis of migratory behavior of avian cephalic neural crest cells. Dev. Biol. 42 (1), 106-130 (1975).
- Johnston, M. C. A radioautographic study of the migration and fate of cranial neural crest cells in the chick embryo. Anat. Rec. 156 (2), 143-155 (1966).
- Noden, D. M. The control of avian cephalic neural crest cytodifferentiation. I. Skeletal and connective tissues. Dev. Biol. 67 (2), 296-312 (1978).
- Oka, K. The role of TGF-beta signaling in regulating chondrogenesis and osteogenesis during mandibular development. Dev. Biol. 303 (1), 391-404 (2007).
- Chai, Y. Fate of the mammalian cranial neural crest during tooth and mandibular morphogenesis. Development. 127 (8), 1671-1679 (2000).
- Lengele, B., Schowing, J., Dhem, A. Embryonic origin and fate of chondroid tissue and secondary cartilages in the avian skull. Anat. Rec. 246 (3), 377-393 (1996).
- Le Douarin, N. M., Ziller, C., Couly, G. F. Patterning of neural crest derivatives in the avian embryo: in vivo and in vitro studies. Dev. Biol. 159 (1), 24-49 (1993).
- Lallier, T. E. Cell lineage and cell migration in the neural crest. Ann. N.Y. Acad. Sci. 615, 158-171 (1991).
- Nakamura, H. Mesenchymal derivatives from the neural crest. Arch. Histol. Jpn. 45 (2), 127-138 (1982).
- Le Lievre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. J. Embryol. Exp. Morphol. 34 (1), 125-154 (1975).
- Rawles, M. E. The Development of Melanophores from Embryonic Mouse Tissues Grown in the Coelom of Chick Embryos. Proc. Natl. Acad. Sci. U.S.A. 26 (12), 673-680 (1940).
- Rawles, M. E. The Pigment-Forming Potency of Early Chick Blastoderms. Proc. Natl. Acad. Sci. U.S.A. 26 (1), 86-94 (1940).
- Mosher, J. T. Intrinsic differences among spatially distinct neural crest stem cells in terms of migratory properties, fate determination, and ability to colonize the enteric nervous system. Dev. Biol. 303 (1), 1-15 (2007).
- Dupin, E., Le Douarin, N. M. Development of melanocyte precursors from the vertebrate neural crest. Oncogene. 22 (20), 3016-3023 (2003).
- Faraco, C. D., Vaz, S. A., Pastor, M. V., Erickson, C. A. Hyperpigmentation in the Silkie fowl correlates with abnormal migration of fate-restricted melanoblasts and loss of environmental barrier molecules. Dev. Dyn. 220 (3), 212-225 (2001).
- Selleck, M. A., Bronner-Fraser, M. Avian neural crest cell fate decisions: a diffusible signal mediates induction of neural crest by the ectoderm. Int. J. Dev. Neurosci. 18 (7), 621-627 (2000).
- Stocker, K. M., Sherman, L., Rees, S., Ciment, G. Basic FGF and TGF-beta 1 influence commitment to melanogenesis in neural crest-derived cells of avian embryos. Development. 111 (2), 635-645 (1991).
- Le Douarin, N. M., Teillet, M. A. Experimental analysis of the migration and differentiation of neuroblasts of the autonomic nervous system and of neurectodermal mesenchymal derivatives, using a biological cell marking technique. Dev. Biol. 41 (1), 162-184 (1974).
- Noden, D. M. The control of avian cephalic neural crest cytodifferentiation. II. Neural tissues. Dev. Biol. 67 (2), 313-329 (1978).
- Barraud, P. Neural crest origin of olfactory ensheathing glia. Proc. Natl. Acad. Sci. U.S.A. 107 (49), 21040-21045 (2010).
- Li, H. Y., Say, E. H., Zhou, X. F. Isolation and characterization of neural crest progenitors from adult dorsal root ganglia. Stem Cells. 25 (8), 2053-2065 (2007).
- Carney, T. J. A direct role for Sox10 in specification of neural crest-derived sensory neurons. Development. 133 (23), 4619-4630 (2006).
- Maro, G. S. Neural crest boundary cap cells constitute a source of neuronal and glial cells of the PNS. Nat. Neurosci. 7 (9), 930-938 (2004).
- Bronner-Fraser, M. Molecular analysis of neural crest formation. J. Physiol. Paris. 96 (1-2), 3-8 (2002).
- Paratore, C., Goerich, D. E., Suter, U., Wegner, M., Sommer, L. Survival and glial fate acquisition of neural crest cells are regulated by an interplay between the transcription factor Sox10 and extrinsic combinatorial signaling. Development. 128 (20), 3949-3961 (2001).
- Britsch, S. The transcription factor Sox10 is a key regulator of peripheral glial development. Genes Dev. 15 (1), 66-78 (2001).
- Bronner-Fraser, M. Origin of the avian neural crest. Stem Cells. 13 (6), 640-646 (1995).
- Jessen, K. R., Mirsky, R. Neural development. Fate diverted. Curr. Biol. 4 (9), 824-827 (1994).
- Le Douarin, N., Dulac, C., Dupin, E., Cameron-Curry, P. Glial cell lineages in the neural crest. Glia. 4 (2), 175-184 (1991).
- Chan, W. Y., Cheung, C. S., Yung, K. M., Copp, A. J. Cardiac neural crest of the mouse embryo: axial level of origin, migratory pathway and cell autonomy of the splotch (Sp2H) mutant effect. Development. 131 (14), 3367-3379 (2004).
- Bronner-Fraser, M. Segregation of cell lineage in the neural crest. Curr. Opin. Genet. Dev. 3 (4), 641-647 (1993).
- Peters-vander Sanden, M. J., Luider, T. M., vander Kamp, A. W., Tibboel, D., Meijers, C. Regional differences between various axial segments of the avian neural crest regarding the formation of enteric ganglia. Differentiation. 53 (1), 17-24 (1993).
- Kuratani, S., Bockman, D. E. Capacity of neural crest cells from various axial levels to participate in thymic development. Cell Tissue Res. 263 (1), 99-105 (1991).
- Leblanc, G. G., Epstein, M. L., Bronner-Fraser, M. E. Differential development of cholinergic neurons from cranial and trunk neural crest cells in vitro. 137 (2), 318-330 (1990).
- Golding, J. P., Trainor, P., Krumlauf, R., Gassmann, M. Defects in pathfinding by cranial neural crest cells in mice lacking the neuregulin receptor ErbB4. Nat. Cell. Biol. 2 (2), 103-109 (2000).
- Kulesa, P. M., Bailey, C. M., Kasemeier-Kulesa, J. C., McLennan, R. Cranial neural crest migration: new rules for an old road. Dev. Biol. 344 (2), 543-554 (2009).
- Lwigale, P. Y., Bronner-Fraser, M. Semaphorin3A/neuropilin-1 signaling acts as a molecular switch regulating neural crest migration during cornea development. Dev. Biol. 336 (2), 257-265 (2009).
- Killian, O. l. e. s. n. i. c. k. y., Birkholz, E. C., A, D., Artinger, K. B. A role for chemokine signaling in neural crest cell migration and craniofacial. Dev. Biol. 333 (1), 161-172 (2009).
- Gammill, L. S., Gonzalez, C., Bronner-Fraser, M. Neuropilin 2/semaphorin 3F signaling is essential for cranial neural crest migration and trigeminal ganglion condensation. Dev. Neurobiol. 67 (1), 47-56 (2007).
- Osborne, N. J., Begbie, J., Chilton, J. K., Schmidt, H., Eickholt, B. J. Semaphorin/neuropilin signaling influences the positioning of migratory neural crest cells within the hindbrain region of the chick. Dev. Dyn. 232 (4), 939-949 (2005).
- Kanzler, B., Foreman, R. K., Labosky, P. A., Mallo, M. BMP signaling is essential for development of skeletogenic and neurogenic cranial neural crest. Development. 127 (5), 1095-1104 (2000).
- Garcia-Lopez, R., Pombero, A., Martinez, S. Fate map of the chick embryo neural tube. Dev. Growth Differ. 51 (3), 145-165 (2009).
- Goldstein, A. M., Nagy, N. A bird's eye view of enteric nervous system development: lessons from the avian embryo. Pediatr. Res. 64 (4), 326-333 (2008).
- Le Douarin, N., Dieterlen-Lievre, F., Creuzet, S., Teillet, M. A. Quail-chick transplantations. Methods Cell. Biol. 87, 19-58 (2008).
- Wingate, R. J., Lumsden, A. Persistence of rhombomeric organisation in the postsegmental hindbrain. Development. 122 (7), 2143-2152 (1996).
- Karagenc, L., Sandikci, M. Tissue distribution of cells derived from the area opaca in heterospecific quail-chick blastodermal chimeras. J. Anat. 216 (1), 16-22 (2010).
- Teague, W. J., Jayanthi, N. V., Lear, P. V., Johnson, P. R. Foregut mesenchyme contributes cells to pancreatic acini during embryonic development in a chick-quail chimera model. Pediatr. Surg. Int. 21 (3), 138-142 (2005).
- Borue, X., Noden, D. M. Normal and aberrant craniofacial myogenesis by grafted trunk somitic and segmental plate mesoderm. Development. 131 (16), 3967-3980 (2004).
- He, L. Three different fates of cells migrating from somites into the limb bud. Anat. Embryol. (Berl). 207 (1), 29-34 (2003).
- Huang, R., Zhi, Q., Christ, B. The relationship between limb muscle and endothelial cells migrating from single somite. Anat. Embryol. (Berl). 206 (4), 283-289 (2003).
- Hidalgo-Sanchez, M., Simeone, A., Alvarado-Mallart, R. M. Fgf8 and Gbx2 induction concomitant with Otx2 repression is correlated with midbrain-hindbrain fate of caudal prosencephalon. Development. 126 (14), 3191-3203 (1999).
- Verberne, M. E., Gittenberger-de Groot, A. C., Poelmann, R. E. Lineage and development of the parasympathetic nervous system of the embryonic chick heart. Anat. Embryol. (Berl). 198 (3), 171-184 (1998).
- Burns, A. J., Douarin, N. M. The sacral neural crest contributes neurons and glia to the post-umbilical gut: spatiotemporal analysis of the development of the enteric nervous system. Development. 125 (21), 4335-4347 (1998).
- Debby-Brafman, A., Burstyn-Cohen, T., Klar, A., Kalcheim, C. F-Spondin, expressed in somite regions avoided by neural crest cells, mediates inhibition of distinct somite domains to neural crest migration. Neuron. 22 (3), 475-488 (1999).
- Lwigale, P. Y., Bronner-Fraser, M. Lens-derived Semaphorin3A regulates sensory innervation of the cornea. Dev. Biol. 306 (2), 750-759 (2007).
- Nakamura, H., Funahashi, J. Introduction of DNA into chick embryos by in ovo electroporation. Methods. 24 (1), 43-48 (2001).
- Chen, Y. X., Krull, C. E., Reneker, L. W. Targeted gene expression in the chicken eye by in ovo electroporation. Mol. Vis. 10, 874-883 (2004).
- Sato, F., Nakagawa, T., Ito, M., Kitagawa, Y., Hattori, M. A. Application of RNA interference to chicken embryos using small interfering RNA. J. Exp. Zool. A. Comp. Exp. Biol. 301 (10), 820-827 (2004).
- Lwigale, P. Y., Schneider, R. A. Other chimeras: quail-duck and mouse-chick. Methods Cell. Biol. 87, 59-74 (2008).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev. Dyn. 195 (4), 231-272 (1992).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bull. World Health Organ. 32 (1), 143-144 (1965).
- Le Douarin, N. M. A Feulgen-positive nucleolus. Exp. Cell. Res. 77 (1), 459-468 (1973).
- Feulgen, R., Rossenbeck, H. Mikroskopisch-chemischer Nachweis einer Nucleinsaure vom typus der Thymonucleinsiiure und die darauf beruhende elektive Faibung von Zellkemen in mikroskopischen Praparaten. Hoppe-Seyler's Z. Physiol. Chem. 135, 203-252 (1924).
- Lwigale, P. Y., Conrad, G. W., Bronner-Fraser, M. Graded potential of neural crest to form cornea, sensory neurons and cartilage along the rostrocaudal axis. Development. 131 (9), 1979-1991 (2004).
- Weston, J. A. A radioautographic analysis of the migration and localization of trunk neural crest cells in the chick. Dev. Biol. 6, 279-310 (1963).
- Le Douarin, N. M., Kalcheim, C. . The Neural Crest. , (2009).
- Le Douarin, N. M., Teillet, M. A. The migration of neural crest cells to the wall of the digestive tract in avian embryo. J. Embryol. Exp. Morphol. 30 (1), 31-48 (1973).
- Douarin, N. M. L. e., Jotereau, F. V. Tracing of cells of the avian thymus through embryonic life in interspecific chimeras. J. Exp. Med. 142 (1), 17-40 (1975).
- Le Douarin, N. M., Renaud, D., Teillet, M. A., Le Douarin, G. H. Cholinergic differentiation of presumptive adrenergic neuroblasts in interspecific chimeras after heterotopic transplantations. Proc. Natl. Acad. Sci. U. S. A. 72 (2), 728-732 (1975).
- Houssaint, E., Belo, M., Le Douarin, N. M. Investigations on cell lineage and tissue interactions in the developing bursa of Fabricius through interspecific chimeras. Dev. Biol. 53 (2), 250-264 (1976).
- Le Douarin, N. M., Jotereau, F. V., Houssaint, E., Belo, M. Ontogeny of the avian thymus and bursa of Fabricius studied in interspecific chimeras. Ann. Immunol. (Paris). 127 (6), 849-856 (1976).
- Fontaine, J., Le Douarin, N. M. Analysis of endoderm formation in the avian blastoderm by the use of quail-chick chimaeras. The problem of the neurectodermal origin of the cells of the APUD series. J. Embryol. Exp. Morphol. 41, 209-222 (1977).
- Narayanan, C. H., Narayanan, Y. On the origin of the ciliary ganglion in birds studied by the method of interspecific transplantation of embryonic brain regions between quail and chick. J. Embryol. Exp. Morphol. 47, 137-148 (1978).
- Lwigale, P. Y., Cressy, P. A., Bronner-Fraser, M. Corneal keratocytes retain neural crest progenitor cell properties. Dev. Biol. 288 (1), 284-293 (2005).
- Lwigale, P. Y. Embryonic origin of avian corneal sensory nerves. Dev. Biol. 239 (2), 323-337 (2001).
- Tanaka, H., Kinutani, M., Agata, A., Takashima, Y., Obata, K. Pathfinding during spinal tract formation in the chick-quail chimera analysed by species-specific monoclonal antibodies. Development. 110 (2), 565-571 (1990).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados