このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
クロス種の移植による神経堤の移行および分化の解析
要約
ウズラ - ニワトリキメラ胚における鳥類の神経堤細胞の遊走と最終的な運命を分析するためのアプローチが説明されています。このメソッドは、unmanipulatedニワトリ胚内で区別することはそうでなければ困難な移行および分化における神経堤細胞をトレースするためのシンプルで簡単なテクニックです。
要約
鳥類の胚は卵内の胚の簡単なアクセスのために多くの脊椎動物の発達過程を研究するためのユニークなプラットフォームを提供します。ウズラのドナー組織がOVOでニワトリ胚に移植されたキメラ鳥類の胚は、鳥類の胚によって提示された操作の容易さと細胞集団の消えない遺伝標識のパワーを兼ね備えています。
ウズラ-ニワトリキメラ1-3渡り鳥神経堤細胞(NCCS)をトレースするための古典的なツールです。 NCCSは、発展途上の神経管4の背側領域に由来する胚における細胞の一過性の渡り鳥集団である。彼らは、葉への移行上皮を受け、その後、彼らは軟骨5-13、メラノサイト11,14-20、ニューロンとグリア21から32までを含む様々な種類の細胞に分化する胚の他の地域に移行します。 NCCSは多能性であり、その究極の運命はインフルです。1)彼らは胚11,33-37、2 rostro -尾軸に沿って発信された神経管の領域)が38から44に移行するように隣接セルからの信号を、その究極の3)微小で積んだ胚45,46内の宛先。胚内での最終的な位置と運命に、神経管に由来それらの点から、これらの細胞を追跡し、パターニングおよび器官形成を制御する発達過程に重要な洞察を提供します。
ドナー神経管(グラフトホモトピック)またはドナー神経管(グラフト異所性)の異なる領域の相補的領域の移植はrostro-尾軸に沿って2,47 NCCSの事前の仕様の違いを明らかにすることができます。この手法は、さらに一側がドナー組織由来されるように、神経管の一方的なコンパートメントを移植するように適応し、反対側の遺跡は、ホスト胚に動じない、yiをすることができます同じサンプル2,47の内部制御を薪。前方神経管47を閉じたときにも、HH10した後、後で胚の脳セグメントの移植に適合させることができます。
ここでは、神経管の独立したセグメントから派生した渡り鳥NCCSのトレースを可能にする神経管移植を介して、ウズラ - ニワトリキメラを生成するための手法を報告します。ウズラ固有QCPN抗体を48から56のドナー由来細胞の種特異的標識は、研究者は実験終了時点で、ドナーと宿主細胞を区別することができます。この手法は、安価で、簡単で、トレース、およびrostro-尾軸45に沿って事前にパターニングイベントを識別する運命マッピング、細胞系譜を含む多くのアプリケーションを持っています。ので、鳥類の胚へのアクセスのしやすさから、ウズラ-ニワトリ移植技術は、他の操作と組み合わせて含むが、レンズのアブレーション4に限定されるものではない0の場合、胚の発達プログラムの摂動にNCCSの特定の渡り鳥ストリームの応答を識別するために、阻害分子57,58、または59から61発現プラスミドのエレクトロポレーションを介した遺伝子操作の注入。さらに、この移植技術はまた、鳥類の胚の操作のしやすさとマウス遺伝学の力を組み合わせることがNCCの顔面形態形成への貢献や、マウス、ニワトリキメラを勉強するようなウズラ、アヒルのキメラのような他の種間キメラ胚を生成するために使用することができ62
プロトコル
1。希望するステージにインキュベートひよこやウズラの卵
HH9胚については、典型的なインキュベーション時間は38℃63に29から33時間の範囲
- ぬるま湯と卵からの破片を洗ってください。
- 水平トレイ上に鶏の卵を配置します。鉛筆で上を向く側をマークし、これは胚がローカライズされる領域に対応します。ウズラの卵平滑末端をインキュベートします。
- 38℃の加湿インキュベーター内に置きます。関数のロッキングオンにします。
2。ウィンドウと解剖のために卵を準備します。
- インキュベーターから卵を除去し、70%エタノールでトップを滅菌する。エタノールをスプレーし、卵殻を通してエタノールのいずれかの吸収を避けるために、紙タオルまたはキムワイプですばやく拭き取ってくださいすることをお勧めします。
- 個々の卵ホルダー(我々は折り畳まれたペーパータオルを敷いたペトリ皿を使用して、例えば、 "キムワイプ")上に配置鶏の卵。 AA鉗子を用いて、小さなHOLをタップ卵の尖った端に卵の殻の上面に電子。
- 18½G注射針、5 mLシリンジと鶏の卵からの光アルブミン1.5-3MLを削除します。卵(図2A)の先のとがった端に直面してベベルで、穴に垂直に針を挿入することをお勧めします。この方法では、アルブミンが取り下げられたときに、誤って吸引を介して卵黄を損傷のほとんどリスクがあります。アルブミンを破棄します。このステップでは、卵の殻で開かれるウィンドウを可能にするために卵内で卵黄と胚を下げます。
- 上記のように70%エタノールで穴を拭き、スコッチテープでシールします。それは穴の周囲卵殻が完全に欠けているアルブミンと乾燥しているか、接着剤、シールされないことが重要です。
- AAの鉗子ではなく、非常に心尖部では、水平卵の著しい上面に別の穴をタップします。鉗子は、卵黄や胚の損傷を防ぐために、卵殻を通して遠く行かせないように注意してください。
- で卵の殻に穴を平行に湾曲した虹彩の鉗子の片側をSERT。鶏の卵の殻の直径ウィンドウで〜2センチメートルを破壊する円を描くように働いて、シェルの上にピンチ。削除され卵殻を破棄します。また、ガムテープで卵の上面を覆う、窓の外をカットするはさみのペアを使用しています。これは卵に陥る卵殻の破片の可能性を最小限に抑えることができます。胚は卵黄の上に不透明なディスクとして表示されます。すべての未受精卵を(胚盤葉の小さな白い卵黄の表面上のスポット、または不在で識別される)破棄します。
- 胚のステージングを支援するための胚盤葉の下に:インドインク(最終濃度100μg/ mlのペニシリンおよび100μg/ mlストレプトマイシン "ペン/連鎖球菌"抗生物質を含有する滅菌リンゲル液で1:10に希釈)を少量注入します。代わりに、1ミリアンペア、1 mLシリンジと26½Gの皮下注射針、針の基部に45°の角度に曲げ、上向きに面取りを使用します。yが引っ張らガラスパスツールピペットと口ピペッティング装置(皮下注射針を曲げたり、ガラスの針を壊したときに目の保護具を着用)を使用します。卵黄の胚盤葉の境界の外膜に近い卵黄の表面に、胚の下に針の先端をスライドさせて穿刺ではなく胚層で(図2B)。胚性に関する概要を説明するだけで十分なインクを注入し、慎重に針(図2C)を撤回することができる。あまりにも多くのインクを注入すると胚の死につながることができます。これは汚染の原因となる可能性がありますので、胚の下に気泡を注入しないことが重要です。 NB:この手順で使用されるすべてのリンゲル液を滅菌し、上記で定義されたペン/連鎖球菌が含まれています。緩衝生理食塩水(PBS)滅菌リン酸塩はまた、このプロトコルのすべてのステップでリンゲル液に受け入れられる代替手段です。
- ハンバーガーとハミルトン63に従って胚をステージングして、永久的なインクや鉛筆で卵殻上のステージを記録します。ステージは最高のステールの下に評価されているomicroscopy、限られた熱負荷を持つ光ファイバ "グースネック"の光源である。
- 2〜3滴脱水や汚染を防ぐために、胚の表面に暖かい滅菌リンゲル液を適用します。パラフィルムは、卵の表面上に伸ばして一時的にウィンドウをシールします。
- 繰り返し移植実験を開始する前に、すべてのニワトリ卵で2.2から2.9を繰り返します。
- ウズラの胚のみがドナー組織のために使用されるので、OVOの手順で 2.2から2.9までを省略することができます。ドナー胚の元卵を調製するため、ウズラの卵は鈍い面を上にしてインキュベートし、胚を明らかにするために湾曲したピンセットで、この地域にオープンしました。解剖はさみを使用して、胚外卵黄膜と胚盤葉(すべてのカットが満たしていることを確認してください)を使用して正方形の形をした4カットを行います。湾曲した虹彩の鉗子を使用して、静かにワンカットエッジをつかみ、卵から胚を持ち上げ、ペトリ皿にリンゲル液に移します。また、一つの曲線を使用することができますDアイリスは下から摘出した胚を持ち上げるために鉗子、または胚スプーンまたはシリンダの広い部分を切ってプラスチック製のピペットは、卵の胚を転送するために使用されることがあります。優しく#5ピンセットで卵黄膜を除去します。上記のように残っているウズラの胚を収集し、解剖顕微鏡下でそれらをステージングします。
3。移植を受けるために宿主胚を準備します。
- ホスト(ニワトリ)胚からパラフィルムを除去し、シャープタングステン針または#5鉗子を用いて、神経管の所望の領域(図3A)における卵黄膜に小さな穴を開ける。
- 胚へのリンゲル液のドロップを追加します。完全に組織の脱水を防ぐために、全体の手順の実行中にリンゲル液に浸漬胚を保つために世話をする。必要に応じてピペットを介した胚の表面にリンゲル液滴を追加してください。
- 引っ張らガラス針を用いて、慎重に吻側およびCAを作る神経管背側の関心の長さと領域に対応する自由保有権横切開。一方的な移植のために切開だけで背側神経管の内腔を拡張する必要があります(プルガラス針は針引っ張って装置を加熱下で取得されたシリコンガラス毛細管から生成される)、および二国間の移植のために、全体で切開を行う全体の神経管背側。その後、神経管背側と沿軸中胚葉の間で二国間でカット。
- 神経管から切り出し片を慎重に分離し、ガラスマイクロピペット(図3B)に吸引することによって胚から削除します。
4。ドナー移植片組織を準備する
- ステージにマッチウズラの胚を選択します。 AAの鉗子で胚を押したまま、卵黄膜を除去し、消費税上記のように神経管の類似したサイズの領域(3.3から3.4)(図3A'-B ')。あなたの実験のニーズに応じて、この領域は可能性がありますrostro-尾軸に沿ったホスト(ひよこ)神経管または異なる領域からの相補的な領域。 (注:完全な神経管移植片を含むより大きな地域の移植のために、研究者は、移植前にドナー組織から任意の接着性の間葉組織を削除するには、この段階でプロテアーゼ消化を追加したい場合がありますしかし、初期段階での小さな背側神経管移植のためにここで詳述されている神経管が容易に厳密に外科的手法により、隣接する間充織から分離されているように、プロテアーゼ消化は必要ありません。)
5。移植組織
- リンゲル液を含むガラスピペットにドナー移植片を吸引除去する。ピペットに任意の気泡を導入しないように注意してください。
- ひよこホストの摘出した領域に隣接する植を転送します。東洋は、プルダウンガラス針を用いて植ゆっくりとアブレーション領域(図3C)にそれを導く。
- 慎重にリンゲル液の数滴を追加脱水を防ぐために、胚へ。これは、移植片を取り除くことができるように移植部位に直接液体を落とさないように注意してください。
- ガムテープで窓をシールします。ウィンドウ卵のテープシールは、地域全体いることを確認してください。これにより、その後のインキュベーション中に脱水および胚の汚染を防ぐことができます。
- 希望する段階までインキュベーターに卵を返します。キメラをインキュベートしながら、 "ロッキング"機能がオフになっていることを確認してください。開発の後期段階を対象としている場合、これは彼らの生存率を増加させる可能性がある卵が優しく手で1日2回をオンにすることができます。
6。セクショニングのキメラ胚を準備する
- 実験的なエンドポイントで、上質なハサミを使用してウィンドウを覆うテープを切り取る。
- 湾曲した虹彩の鉗子(鋸歯状のヒントを実行する最も簡単な)と胚盤葉の端をつかみ、その後胚盤葉の境界の外側に4つの大きなカットを廃止する卵黄から胚を切った。
- リンゲル液を含むペトリ皿に胚を転送します。組織の脱水を避けるために、空気への胚の曝露を最小限に抑えるように注意してください。
- 実体顕微鏡下で、静かに第5鉗子を用いて胚盤葉から卵黄膜を分離します。
- それがフラットにレイアウト周囲の膜で、卵であったとして、胚が同じ向きになるように皿に胚を慎重に配置します。
- きれいに皿の底にタングステン線と平行の長さ、胚および胚体外組織の境界に針を配置することにより、胚から胚盤周囲を削除するには、タングステン線64から作られた解剖針を使用しています。組織を切断するために穏やかな鋸の動きを使用しています。
- 慎重に#5鉗子で羊膜を除去します。この時点で、どちらさらにご関心のある領域を分析する、または胚全体を残したいと思うかもしれません。
- 氷冷4%PARAFに胚を転送する4℃で一晩ormaldehydeとロック
- サンプルを調製し、凍結またはパラフィン切片用に埋め込むことができます。
宿主胚内に移植した組織をトレースします 。ヘマトキシリン染色によるウズラ核小体の検出(ウズラの核がひよこの核よりも非常に大きく、暗い染色封入体を持っています)、フォイルゲン-Rossenbeck反応、アクリジン·オレンジまたはBIZ-ベンズアミド染色を含むニワトリ胚内ウズラ組織を識別するためのいくつかの手法があります。ウズラ特異的抗原3,47,65,66ための電子顕微鏡、または免疫標識と組み合わせた。ここでは、ウズラ - ニワトリキメラ(図4)ウズラ神経堤細胞を識別するためにQCPN抗原、標準ホールマウントまたはセクション免疫蛍光技術を使用しています。 QCPNの免疫はまた、ドナー(ウズラ)組織に由来する分化細胞を識別するために、他の抗体と組み合わせることができるように、この技術は、実験的なデザインの中で最も柔軟性を提供します。 standaを使用します。RD全体のマウントまたはセクション免疫蛍光テクニックはキメラでウズラ由来の細胞を標識します。
7。代表的な結果
再インキュベーションの6時間後の神経管のグラフト化地域の代表的なイメージ(HH11に)ホスト(ひよこ)神経管(図4A)に移植したドナー(ウズラ)組織の期待の取り込みを示しています。 reincubation後、移植の不完全な統合、または頭蓋領域や体節の非対称発展を示す胚は破棄する必要があります。
HNK-1は、横方向に離れて神経管からの移行で標識されたHH11ショーNCCSでグラフトされた領域を通ってセクションを渡ります。 NCC渡り鳥ストリームにし、神経管に貢献ウズラ細胞は、明らかにQCPN(図4B)で標識されています。
後の段階で、ウズラNCC-由来細胞は、その最終的な標的組織にさかのぼることができます。 QCPN標識された細胞は、ニワトリ胚の間充織内に散在しているE5(図4C)で上顎のプロセス。
QCPN抗体は簡単にホスト環境でのウズラ由来NCCSの分化を調べるために他の抗体と組み合わせることができます。ウズラNCC由来の三叉神経感覚ニューロンはQCPNとTuj1抗体(図4D)によってラベルが付けられています。
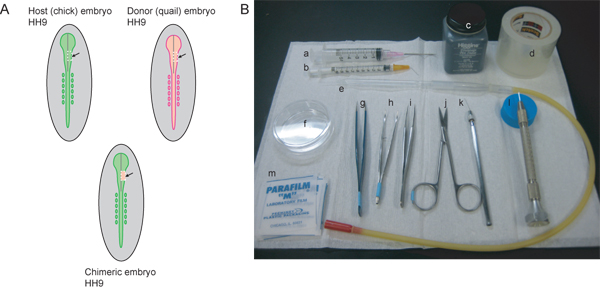
図1。実験手順と必要な機器の概要について説明します。)ホスト(ひよこ)とドナー(ウズラ)の胚ステージ一致する必要があります。三叉神経節および顎下顎、地域に貢献するNCCストリームにラベルを付けるには、HH9が理想的です。 HH9で、神経管は、吻側領域で閉じ始めているが、まだ完全に密封されていません。図中の灰色の線は、閉鎖神経管の正中線を表しています。点線の白い線は、ホストとドナーから神経管の右側の脳領域を切り出すため、切断線を示すEMbryos。宿主胚の摘出した領域が破棄され、ドナー組織は、キメラ胚を生成するために移植されています。 B)必要な機器は、次のとおりです。)5mLを18とシリンジ½Gの注射針、b)が26と1 mLのシリンジ½45°の角度、c)を墨でGの注射針を曲げ、d)の明確なパッキングテープ、e)を口にピペッティングしたガラスピペット装置、f)は60ミリメートル、ペトリ皿、G)AAピンセット、h)の鋸歯状のヒント、私の湾曲した虹彩の鉗子)#5鉗子、j)の罰金はさみ、k)はlのタングステン線をシャープ)ガラス針、m)をパラフィルムを引っ張った正方形。
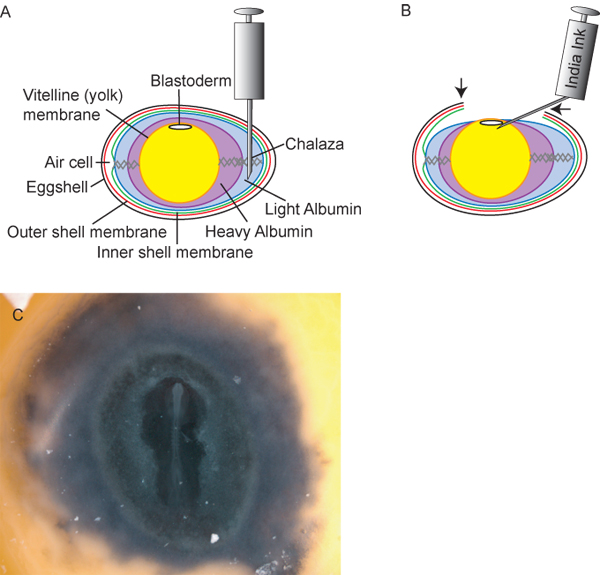
図2。 18の理想的な挿入ポイントを含む卵の卵および胚の作製 )断面図、½アルブミン光の撤退のためにGの注射針。 B)光アルブミンの〜3mlのを撤回した後、卵黄と胚は、研究者は、tに "窓"(矢印)をカットすることができ、卵内に下げる彼は、胚にアクセスするには卵殻。インドのインクは、滅菌リンゲル液で1:10に希釈し、胚の簡単なステージング用にコントラストを提供するために、胚盤葉の下に注入することができます。インクの後C)ニワトリ胚。
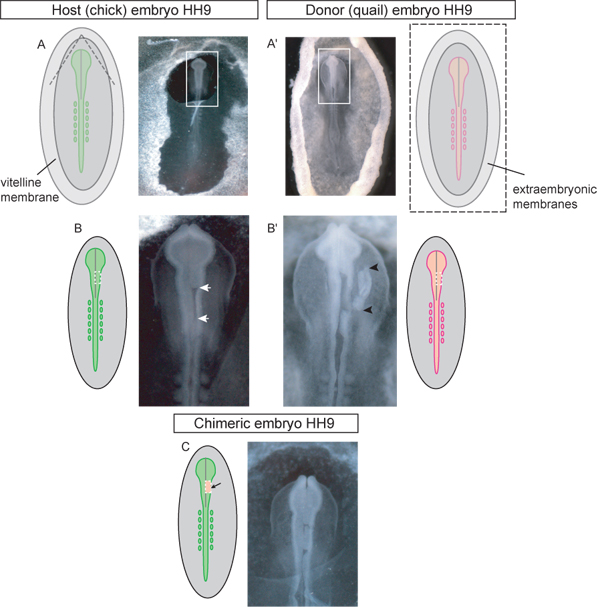
図3。移植手順の各ステップで回路図とHHステージ9ドナーとホスト胚の例)。ニワトリ宿主胚。図中の破線は、卵黄膜が移植のための脳神経領域にアクセスするために引き裂かれるべき場所を示しています。卵黄膜のかつて引き裂かれた三角形のフラップが尾側に剥離する必要があります。画像内のボックスは、(BC)に使用されるはめ込みを示しています。 ')ウズラのドナー胚。画像は、ドナー胚卵から摘出し、移植組織の解剖用シャーレに入れである。画像内のボックスははめ込みます(B ')で使用されていることを示します。卵黄と卵黄膜がtを除去するためにカットすべき場所の概略図の破線は( ')を示す卵から彼は胚。移植を待って摘出した神経管(白矢印)の一方的な脳領域とB)ホスト胚。カットは、中脳領域での消費税神経管に行われるべき場所の概略図で点線を示します。 B ')摘出した神経管背側に移植組織(黒の矢印で示された移植組織)を持つドナー胚。カットが神経管の脳領域の移植のために一方的な消費税ドナー組織にウズラ胚で行われるべき場所の図の点線が示しています。ニワトリ中脳領域にウズラの神経管背側の外植の移植後のC)キメラ胚。
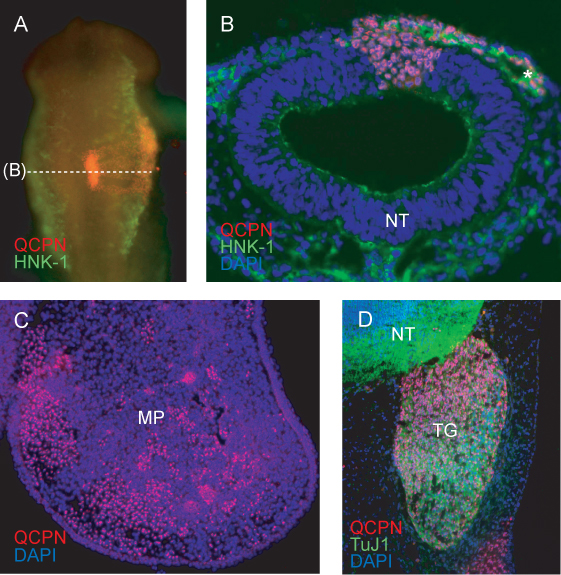
図4。免疫は、キメラ胚におけるドナー由来細胞におけるウズラ特異的核抗原QCPNを検出する。A)キメラHH11(HH9でグラフトされた)のホールマウントイメージQCPN赤で染色し、HNK-1染色(NCCSの移行のマーカー)を示すで緑色に点灯します。倍率10倍、背ビュー。神経管と渡り鳥NCC HNK-1(緑)との共染色にQCPN陽性ウズラ由来の細胞を示す(A)の胚を介してB)断面図。 40X倍率。 C)キメラE5の上顎のプロセスを介してクロスセクション(3日後に移植インキュベート)、胚の最終ロケーションに神経管のグラフト領域から移行したQCPN陽性NCC-由来細胞(赤)を示す。倍率10倍。 TuJ1陽性ニューロン(緑)に三叉神経節(赤)と分化にNCCを導出したウズラのE5キメラを示す貢献を通じて、D)のセクションをご覧ください。 40X倍率。 *、NCCS、MP、上顎のプロセス、NT、神経管、TG、三叉神経節。
ディスカッション
ホストのニワトリ胚にウズラの神経管の移植はrostro-尾軸に沿って21,67-69さまざまな地域から発せられるNCCSを移行し、特定の集団を追跡するための簡単で安価な手法であるここで説明する。この手法は、実験的に調べるために、鳥類の胚へのアクセスのしやすさ(哺乳類胚に比べて)を活用し、そのような組織切除、阻害分子の注入、または発現プラスミドのエレクトロポレーション?...
開示事項
著者らは、開示することは何もありません。
謝辞
著者は、原稿の批評のためにLwigale研究室のメンバーに感謝。 SLGは、国立眼研究所(F32 EY02167301)からルースL.キルシュシュタインNRSAフェローシップでサポートされています。 PYLは、国立眼研究所(EY018050)によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬 | 会社 | カタログ番号 | |
| ひよこの卵 | 様々な - 私たちはテキサスA&M大学の家禽科学部、TXを使用しています。 | ||
| ウズラの卵 | 様々な - 我々はオザークエッグ社、MOを使用しています。 | ||
| 卵インキュベーター(デジタルリードアウト1502スポーツマンインキュベーターのw /湿度110から120ボルトAC) | www.poultrysupply.com | 1502 | |
| デュモンAAピンセット、イノックスエポキシコーティング | ファイン科学ツール | 11210から10 | |
| スコッチテープ | すべてのオフィス用品店 | ||
| 湾曲したアイリス鉗子 | ファイン科学ツール | 11065から07 | |
| 私はndiaインク | 任意の画材店 | ||
| ペン/連鎖球菌(ペニシリン、ストレプトマイシン)ソリューション | VWRインターナショナル | 101447-068 | |
| 明確なパッキングテープ | すべてのオフィス用品店 | ||
| 針引っ張って装置 | Narashige、日本 | PE-21 | |
| 1.5から1.8×100ホウケイ酸ガラス毛細管から作られたプルアップガラス針、 | キンブルチェイス | 34500 99 | |
| 5から作られたガラスピペット、¾ "パスツールピペットを引く | フィッシャー·サイエンティフィック | 13から678-6A | |
| 口ピペット装置(キャリブレーションマイクロキャピラリーピペット用吸引チューブアセンブリ) | Sigma-Aldrich社 | A5177-52A | |
| デュモン#5鉗子 | ファイン科学ツール | 11251から30 | |
| トゥンgsten線、0.1ミリメートルの直径 | VWRインターナショナル | AA10404-H2 | |
| ニードルホルダー(ニッケルメッキピンホルダー) | ファイン科学ツール | 26018から17 | |
| QCPN抗血清 | 発達研究ハイブリドーマバンク、アイオワ大学 | QCPN | |
| のAlexa Fluor®二次抗体(例えば、Alexa Fluor 594のヤギ抗マウスIgG1) | インビトロジェン | A21125 | |
リンゲル液(2L):
| フィッシャーサイエンティフィックからすべての試薬 |
|
参考文献
- Le Douarin, G., Renaud, D. Morphologic and physiologic study of the differentiation in vitro of quail embryo precardial mesoderm. Bull. Biol. Fr. Belg. 103 (3), 453-468 (1969).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods. Mol. Biol. 461, 337-350 (2008).
- Le Douarin, N. A biological cell labeling technique and its use in expermental embryology. Dev. Biol. 30 (1), 217-222 (1973).
- Noden, D. M. An analysis of migratory behavior of avian cephalic neural crest cells. Dev. Biol. 42 (1), 106-130 (1975).
- Johnston, M. C. A radioautographic study of the migration and fate of cranial neural crest cells in the chick embryo. Anat. Rec. 156 (2), 143-155 (1966).
- Noden, D. M. The control of avian cephalic neural crest cytodifferentiation. I. Skeletal and connective tissues. Dev. Biol. 67 (2), 296-312 (1978).
- Oka, K. The role of TGF-beta signaling in regulating chondrogenesis and osteogenesis during mandibular development. Dev. Biol. 303 (1), 391-404 (2007).
- Chai, Y. Fate of the mammalian cranial neural crest during tooth and mandibular morphogenesis. Development. 127 (8), 1671-1679 (2000).
- Lengele, B., Schowing, J., Dhem, A. Embryonic origin and fate of chondroid tissue and secondary cartilages in the avian skull. Anat. Rec. 246 (3), 377-393 (1996).
- Le Douarin, N. M., Ziller, C., Couly, G. F. Patterning of neural crest derivatives in the avian embryo: in vivo and in vitro studies. Dev. Biol. 159 (1), 24-49 (1993).
- Lallier, T. E. Cell lineage and cell migration in the neural crest. Ann. N.Y. Acad. Sci. 615, 158-171 (1991).
- Nakamura, H. Mesenchymal derivatives from the neural crest. Arch. Histol. Jpn. 45 (2), 127-138 (1982).
- Le Lievre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. J. Embryol. Exp. Morphol. 34 (1), 125-154 (1975).
- Rawles, M. E. The Development of Melanophores from Embryonic Mouse Tissues Grown in the Coelom of Chick Embryos. Proc. Natl. Acad. Sci. U.S.A. 26 (12), 673-680 (1940).
- Rawles, M. E. The Pigment-Forming Potency of Early Chick Blastoderms. Proc. Natl. Acad. Sci. U.S.A. 26 (1), 86-94 (1940).
- Mosher, J. T. Intrinsic differences among spatially distinct neural crest stem cells in terms of migratory properties, fate determination, and ability to colonize the enteric nervous system. Dev. Biol. 303 (1), 1-15 (2007).
- Dupin, E., Le Douarin, N. M. Development of melanocyte precursors from the vertebrate neural crest. Oncogene. 22 (20), 3016-3023 (2003).
- Faraco, C. D., Vaz, S. A., Pastor, M. V., Erickson, C. A. Hyperpigmentation in the Silkie fowl correlates with abnormal migration of fate-restricted melanoblasts and loss of environmental barrier molecules. Dev. Dyn. 220 (3), 212-225 (2001).
- Selleck, M. A., Bronner-Fraser, M. Avian neural crest cell fate decisions: a diffusible signal mediates induction of neural crest by the ectoderm. Int. J. Dev. Neurosci. 18 (7), 621-627 (2000).
- Stocker, K. M., Sherman, L., Rees, S., Ciment, G. Basic FGF and TGF-beta 1 influence commitment to melanogenesis in neural crest-derived cells of avian embryos. Development. 111 (2), 635-645 (1991).
- Le Douarin, N. M., Teillet, M. A. Experimental analysis of the migration and differentiation of neuroblasts of the autonomic nervous system and of neurectodermal mesenchymal derivatives, using a biological cell marking technique. Dev. Biol. 41 (1), 162-184 (1974).
- Noden, D. M. The control of avian cephalic neural crest cytodifferentiation. II. Neural tissues. Dev. Biol. 67 (2), 313-329 (1978).
- Barraud, P. Neural crest origin of olfactory ensheathing glia. Proc. Natl. Acad. Sci. U.S.A. 107 (49), 21040-21045 (2010).
- Li, H. Y., Say, E. H., Zhou, X. F. Isolation and characterization of neural crest progenitors from adult dorsal root ganglia. Stem Cells. 25 (8), 2053-2065 (2007).
- Carney, T. J. A direct role for Sox10 in specification of neural crest-derived sensory neurons. Development. 133 (23), 4619-4630 (2006).
- Maro, G. S. Neural crest boundary cap cells constitute a source of neuronal and glial cells of the PNS. Nat. Neurosci. 7 (9), 930-938 (2004).
- Bronner-Fraser, M. Molecular analysis of neural crest formation. J. Physiol. Paris. 96 (1-2), 3-8 (2002).
- Paratore, C., Goerich, D. E., Suter, U., Wegner, M., Sommer, L. Survival and glial fate acquisition of neural crest cells are regulated by an interplay between the transcription factor Sox10 and extrinsic combinatorial signaling. Development. 128 (20), 3949-3961 (2001).
- Britsch, S. The transcription factor Sox10 is a key regulator of peripheral glial development. Genes Dev. 15 (1), 66-78 (2001).
- Bronner-Fraser, M. Origin of the avian neural crest. Stem Cells. 13 (6), 640-646 (1995).
- Jessen, K. R., Mirsky, R. Neural development. Fate diverted. Curr. Biol. 4 (9), 824-827 (1994).
- Le Douarin, N., Dulac, C., Dupin, E., Cameron-Curry, P. Glial cell lineages in the neural crest. Glia. 4 (2), 175-184 (1991).
- Chan, W. Y., Cheung, C. S., Yung, K. M., Copp, A. J. Cardiac neural crest of the mouse embryo: axial level of origin, migratory pathway and cell autonomy of the splotch (Sp2H) mutant effect. Development. 131 (14), 3367-3379 (2004).
- Bronner-Fraser, M. Segregation of cell lineage in the neural crest. Curr. Opin. Genet. Dev. 3 (4), 641-647 (1993).
- Peters-vander Sanden, M. J., Luider, T. M., vander Kamp, A. W., Tibboel, D., Meijers, C. Regional differences between various axial segments of the avian neural crest regarding the formation of enteric ganglia. Differentiation. 53 (1), 17-24 (1993).
- Kuratani, S., Bockman, D. E. Capacity of neural crest cells from various axial levels to participate in thymic development. Cell Tissue Res. 263 (1), 99-105 (1991).
- Leblanc, G. G., Epstein, M. L., Bronner-Fraser, M. E. Differential development of cholinergic neurons from cranial and trunk neural crest cells in vitro. 137 (2), 318-330 (1990).
- Golding, J. P., Trainor, P., Krumlauf, R., Gassmann, M. Defects in pathfinding by cranial neural crest cells in mice lacking the neuregulin receptor ErbB4. Nat. Cell. Biol. 2 (2), 103-109 (2000).
- Kulesa, P. M., Bailey, C. M., Kasemeier-Kulesa, J. C., McLennan, R. Cranial neural crest migration: new rules for an old road. Dev. Biol. 344 (2), 543-554 (2009).
- Lwigale, P. Y., Bronner-Fraser, M. Semaphorin3A/neuropilin-1 signaling acts as a molecular switch regulating neural crest migration during cornea development. Dev. Biol. 336 (2), 257-265 (2009).
- Killian, O. l. e. s. n. i. c. k. y., Birkholz, E. C., A, D., Artinger, K. B. A role for chemokine signaling in neural crest cell migration and craniofacial. Dev. Biol. 333 (1), 161-172 (2009).
- Gammill, L. S., Gonzalez, C., Bronner-Fraser, M. Neuropilin 2/semaphorin 3F signaling is essential for cranial neural crest migration and trigeminal ganglion condensation. Dev. Neurobiol. 67 (1), 47-56 (2007).
- Osborne, N. J., Begbie, J., Chilton, J. K., Schmidt, H., Eickholt, B. J. Semaphorin/neuropilin signaling influences the positioning of migratory neural crest cells within the hindbrain region of the chick. Dev. Dyn. 232 (4), 939-949 (2005).
- Kanzler, B., Foreman, R. K., Labosky, P. A., Mallo, M. BMP signaling is essential for development of skeletogenic and neurogenic cranial neural crest. Development. 127 (5), 1095-1104 (2000).
- Garcia-Lopez, R., Pombero, A., Martinez, S. Fate map of the chick embryo neural tube. Dev. Growth Differ. 51 (3), 145-165 (2009).
- Goldstein, A. M., Nagy, N. A bird's eye view of enteric nervous system development: lessons from the avian embryo. Pediatr. Res. 64 (4), 326-333 (2008).
- Le Douarin, N., Dieterlen-Lievre, F., Creuzet, S., Teillet, M. A. Quail-chick transplantations. Methods Cell. Biol. 87, 19-58 (2008).
- Wingate, R. J., Lumsden, A. Persistence of rhombomeric organisation in the postsegmental hindbrain. Development. 122 (7), 2143-2152 (1996).
- Karagenc, L., Sandikci, M. Tissue distribution of cells derived from the area opaca in heterospecific quail-chick blastodermal chimeras. J. Anat. 216 (1), 16-22 (2010).
- Teague, W. J., Jayanthi, N. V., Lear, P. V., Johnson, P. R. Foregut mesenchyme contributes cells to pancreatic acini during embryonic development in a chick-quail chimera model. Pediatr. Surg. Int. 21 (3), 138-142 (2005).
- Borue, X., Noden, D. M. Normal and aberrant craniofacial myogenesis by grafted trunk somitic and segmental plate mesoderm. Development. 131 (16), 3967-3980 (2004).
- He, L. Three different fates of cells migrating from somites into the limb bud. Anat. Embryol. (Berl). 207 (1), 29-34 (2003).
- Huang, R., Zhi, Q., Christ, B. The relationship between limb muscle and endothelial cells migrating from single somite. Anat. Embryol. (Berl). 206 (4), 283-289 (2003).
- Hidalgo-Sanchez, M., Simeone, A., Alvarado-Mallart, R. M. Fgf8 and Gbx2 induction concomitant with Otx2 repression is correlated with midbrain-hindbrain fate of caudal prosencephalon. Development. 126 (14), 3191-3203 (1999).
- Verberne, M. E., Gittenberger-de Groot, A. C., Poelmann, R. E. Lineage and development of the parasympathetic nervous system of the embryonic chick heart. Anat. Embryol. (Berl). 198 (3), 171-184 (1998).
- Burns, A. J., Douarin, N. M. The sacral neural crest contributes neurons and glia to the post-umbilical gut: spatiotemporal analysis of the development of the enteric nervous system. Development. 125 (21), 4335-4347 (1998).
- Debby-Brafman, A., Burstyn-Cohen, T., Klar, A., Kalcheim, C. F-Spondin, expressed in somite regions avoided by neural crest cells, mediates inhibition of distinct somite domains to neural crest migration. Neuron. 22 (3), 475-488 (1999).
- Lwigale, P. Y., Bronner-Fraser, M. Lens-derived Semaphorin3A regulates sensory innervation of the cornea. Dev. Biol. 306 (2), 750-759 (2007).
- Nakamura, H., Funahashi, J. Introduction of DNA into chick embryos by in ovo electroporation. Methods. 24 (1), 43-48 (2001).
- Chen, Y. X., Krull, C. E., Reneker, L. W. Targeted gene expression in the chicken eye by in ovo electroporation. Mol. Vis. 10, 874-883 (2004).
- Sato, F., Nakagawa, T., Ito, M., Kitagawa, Y., Hattori, M. A. Application of RNA interference to chicken embryos using small interfering RNA. J. Exp. Zool. A. Comp. Exp. Biol. 301 (10), 820-827 (2004).
- Lwigale, P. Y., Schneider, R. A. Other chimeras: quail-duck and mouse-chick. Methods Cell. Biol. 87, 59-74 (2008).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev. Dyn. 195 (4), 231-272 (1992).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bull. World Health Organ. 32 (1), 143-144 (1965).
- Le Douarin, N. M. A Feulgen-positive nucleolus. Exp. Cell. Res. 77 (1), 459-468 (1973).
- Feulgen, R., Rossenbeck, H. Mikroskopisch-chemischer Nachweis einer Nucleinsaure vom typus der Thymonucleinsiiure und die darauf beruhende elektive Faibung von Zellkemen in mikroskopischen Praparaten. Hoppe-Seyler's Z. Physiol. Chem. 135, 203-252 (1924).
- Lwigale, P. Y., Conrad, G. W., Bronner-Fraser, M. Graded potential of neural crest to form cornea, sensory neurons and cartilage along the rostrocaudal axis. Development. 131 (9), 1979-1991 (2004).
- Weston, J. A. A radioautographic analysis of the migration and localization of trunk neural crest cells in the chick. Dev. Biol. 6, 279-310 (1963).
- Le Douarin, N. M., Kalcheim, C. . The Neural Crest. , (2009).
- Le Douarin, N. M., Teillet, M. A. The migration of neural crest cells to the wall of the digestive tract in avian embryo. J. Embryol. Exp. Morphol. 30 (1), 31-48 (1973).
- Douarin, N. M. L. e., Jotereau, F. V. Tracing of cells of the avian thymus through embryonic life in interspecific chimeras. J. Exp. Med. 142 (1), 17-40 (1975).
- Le Douarin, N. M., Renaud, D., Teillet, M. A., Le Douarin, G. H. Cholinergic differentiation of presumptive adrenergic neuroblasts in interspecific chimeras after heterotopic transplantations. Proc. Natl. Acad. Sci. U. S. A. 72 (2), 728-732 (1975).
- Houssaint, E., Belo, M., Le Douarin, N. M. Investigations on cell lineage and tissue interactions in the developing bursa of Fabricius through interspecific chimeras. Dev. Biol. 53 (2), 250-264 (1976).
- Le Douarin, N. M., Jotereau, F. V., Houssaint, E., Belo, M. Ontogeny of the avian thymus and bursa of Fabricius studied in interspecific chimeras. Ann. Immunol. (Paris). 127 (6), 849-856 (1976).
- Fontaine, J., Le Douarin, N. M. Analysis of endoderm formation in the avian blastoderm by the use of quail-chick chimaeras. The problem of the neurectodermal origin of the cells of the APUD series. J. Embryol. Exp. Morphol. 41, 209-222 (1977).
- Narayanan, C. H., Narayanan, Y. On the origin of the ciliary ganglion in birds studied by the method of interspecific transplantation of embryonic brain regions between quail and chick. J. Embryol. Exp. Morphol. 47, 137-148 (1978).
- Lwigale, P. Y., Cressy, P. A., Bronner-Fraser, M. Corneal keratocytes retain neural crest progenitor cell properties. Dev. Biol. 288 (1), 284-293 (2005).
- Lwigale, P. Y. Embryonic origin of avian corneal sensory nerves. Dev. Biol. 239 (2), 323-337 (2001).
- Tanaka, H., Kinutani, M., Agata, A., Takashima, Y., Obata, K. Pathfinding during spinal tract formation in the chick-quail chimera analysed by species-specific monoclonal antibodies. Development. 110 (2), 565-571 (1990).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved