Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Analyse de la migration des crêtes neurales et la différenciation par la Croix-espèces transplantation
Dans cet article
Résumé
Une approche pour l'analyse des migrations et le destin éventuel de cellules aviaires de la crête neurale chez la caille-poulet embryons chimériques est décrite. Cette méthode est une technique simple et directe pour le traçage des cellules de la crête neurale au cours de la migration et la différenciation qui seraient autrement difficiles à distinguer au sein d'un embryon de poulet non manipulée.
Résumé
Embryons aviaires fournir une plate-forme unique pour l'étude de nombreux vertébrés processus de développement, en raison de la facilité d'accès des embryons dans l'œuf. Chimériques embryons aviaires, dans lequel le tissu des bailleurs de fonds de caille est transplanté dans un embryon de poulet in ovo, combiner la puissance de l'étiquetage génétique indélébile de populations de cellules avec la facilité de manipulation présenté par l'embryon aviaire.
Quail-chiches chimères sont un outil classique pour tracer migratoires des cellules de la crête neurale (CCN) 1-3. CCN sont une population de passage migratoire des cellules dans l'embryon, qui sont originaires de la région dorsale de la 4 du tube neural en développement. Ils subissent une transition épithélio-mésenchymateuse et migrent vers d'autres régions de l'embryon, où ils se différencient en différents types cellulaires, y compris le cartilage 5-13, 11,14-20 mélanocytes, les neurones et cellules gliales 21-32. CCN sont multipotentes, et leur sort ultime est influencéeexpérimentés par 1) la région du tube neural dont ils sont issus le long de l'axe rostro-caudale de l'embryon 11,33-37, 2) des signaux provenant des cellules voisines de leur migration 38-44, et 3) le micro-ultime de leur destination à l'intérieur de l'embryon 45,46. Suivre ces cellules à partir de leur point d'origine à du tube neural, à leur position finale et le sort au sein de l'embryon, donne un aperçu important dans les processus de développement qui régulent structuration et de l'organogenèse.
Transplantation des régions complémentaires du tube neural des bailleurs de fonds (homotopes greffage) ou différentes régions du tube neural des bailleurs de fonds (hétérotopique greffage) peut révéler des différences dans pré-spécification de CCN le long de l'axe rostro-caudal 2,47. Cette technique peut être en outre adapté pour transplanter un compartiment unilatérale du tube neural, de telle sorte que d'un côté est dérivé du tissu du donneur, et les restes côté controlatéral imperturbable dans l'embryon d'accueil, yiElding un contrôle interne au sein du même échantillon 2,47. Il peut également être adapté pour la transplantation de segments du cerveau chez les embryons plus tard, après HH10, lorsque le tube neural antérieur a fermé 47.
Nous rapportons ici les techniques pour générer des cailles-chiches chimères par transplantation du tube neural, qui permettent de tracer des CNC migratoires provenant d'un segment distinct du tube neural. Spécifique à l'espèce marquage des cellules dérivées des bailleurs de fonds avec l'anticorps spécifique à la caille QCPN 48-56 permet au chercheur de distinguer des donateurs et des cellules hôtes au point de fin d'expérimentation. Cette technique est simple, peu coûteux, et a de nombreuses applications, y compris le sort de cartographie, la lignée cellulaire de traçage et l'identification des pré-patterning événements le long de l'axe rostro-caudal 45. En raison de la facilité d'accès à l'embryon aviaire, la technique de greffe caille-poussin peut être combiné avec d'autres manipulations, y compris mais non limité à 4 ablation lentille0, l'injection de molécules inhibitrices 57,58, ou la manipulation génétique par électroporation de plasmides d'expression 59-61, afin d'identifier la réponse de certains flux migratoires de CCN à des perturbations dans le programme de développement de l'embryon. En outre, cette technique de greffage peut aussi être utilisé pour générer d'autres embryons interspécifiques chimériques tels que la caille-canard chimères d'étudier la contribution de la CCN à la morphogenèse cranio-faciale, ou la souris-chiches chimères de combiner la puissance de la génétique de la souris avec la facilité de manipulation de l'embryon aviaire 62.
Protocole
1. Incuber poussin et oeufs de caille à l'étape désirée
Pour HH9 embryons, les durées d'incubation typiques vont de 29-33 heures à 38 ° C. 63
- Laver les débris sur les oeufs avec l'eau tiède.
- Disposer des œufs de poule sur le plateau horizontalement. Marquer le côté orienté vers le haut avec le crayon; ce correspond à la région où l'embryon est localisé. Incuber oeufs de caille extrémité émoussée vers le haut.
- Lieu à 38 ° C incubateur humidifié. Tournez à bascule fonction.
2. Préparez les œufs pour le fenêtrage et la dissection
- Retirer les oeufs de l'incubateur, et stériliser les sommets avec de l'éthanol 70%. Il est préférable de vaporiser sur l'éthanol et l'essuyer rapidement avec une serviette en papier ou Kimwipe afin d'éviter toute absorption de l'éthanol à travers la coquille.
- Oeuf de poule en place sur le titulaire individuel de l'œuf (nous utilisons une boîte de Pétri avec des serviettes en papier pliées, par exemple, "Kimwipes"). En utilisant des pinces AA, appuyez sur une petite hole dans la surface supérieure de la coquille d'oeuf à l'extrémité pointue de l'oeuf.
- Retirer de 1,5 3mL de la lumière albumine de l'œuf de poule avec une aiguille hypodermique G 18 ½ et 5 mL. Il est préférable d'insérer l'aiguille à la verticale dans le trou, avec le biseau orienté le bout pointu de l'œuf (figure 2A). De cette façon, lorsque l'albumine est retiré, il ya peu de risque de un endommagement accidentel du jaune d'oeuf par aspiration. Jeter l'albumine. Cette étape réduira le jaune et l'embryon dans l'œuf afin de permettre une fenêtre à ouvrir dans la coquille.
- Essuyez le trou avec de l'éthanol à 70% tel que décrit ci-dessus et sceller avec du scotch. Il est important que la coquille qui entoure le trou est complètement dépourvu d'albumine et sec ou de la colle ne sont pas étanches.
- Avec la pince AA, appuyez sur un autre trou dans la surface supérieure marquée de l'œuf horizontale, pas tout à fait au sommet. Prenez soin de ne pas laisser les pinces aller trop loin à travers la coquille pour éviter d'endommager le jaune ou l'embryon.
- DansSert un côté de la pince iris incurvées dans le trou parallèle à la coque oeufs. Pincement vers le bas sur la coque, de travailler dans un mouvement circulaire pour briser un 2 ~ cm de diamètre dans la fenêtre dans la coquille d'oeuf de poulet. Jeter la coquille enlevée. Alternativement, recouvrir la surface supérieure de l'œuf avec du ruban d'emballage et d'utiliser une paire de ciseaux pour découper la fenêtre. Cela réduit le risque de débris coquille de tomber dans l'œuf. L'embryon doit apparaître comme un disque opaque sur le dessus du jaune. Jeter les œufs non fécondés (identifié par petite tache blanche sur la surface de jaune d'oeuf, ou l'absence de blastoderme).
- Injecter une petite quantité de l'encre de Chine (dilué à 1:10 dans la solution Ringer stérile contenant "Pen / Strep« antibiotique: la concentration finale de 100 pg / ml de pénicilline et 100 pg / ml de streptomycine) sous le blastoderme pour aider à la tenue de l'embryon. Utilisez une seringue de 1 ml et 26 ½ aiguille hypodermique G, plié en angle de 45 ° à la base de l'aiguille, avec le biseau vers le haut, ou alternativement, un may utiliser un tire Pasteur en verre pipette et un appareil pipetage à la bouche (porter une protection oculaire lors de la flexion aiguille hypodermique ou de casser l'aiguille de verre). Percer la membrane du jaune l'extérieur du périmètre du blastoderme et glisser la pointe de l'aiguille sous l'embryon, à proximité de la surface du jaune, mais pas dans les couches embryonnaires (figure 2B). Injecter simplement assez d'encre pour décrire l'embryon, puis retirer avec précaution l'aiguille (figure 2C). L'injection de trop d'encre peut entraîner la mort des embryons. Il est important de ne pas injecter des bulles d'air sous l'embryon, comme cela peut être une source de contamination. NB: une solution de Ringer tous utilisé dans ce procédé est stérilisé et contient pénicilline / streptomycine tel que défini ci-dessus. Phosphate stérile (PBS) est également une alternative acceptable à la solution de Ringer à toutes les étapes de ce protocole.
- Stade de l'embryon en fonction de Hamburger et Hamilton 63 et enregistrer la scène sur la coquille à l'encre indélébile ou d'un crayon. Les étages sont mieux évaluées en vertu de stèreomicroscopy, avec fibre optique sources «Gooseneck» de lumière qui ont une charge thermique limitée.
- Appliquer 2-3 gouttes solution chaude Ringer stérile à la surface de l'embryon à empêcher la contamination et la déshydratation. Sceller temporairement la fenêtre de parafilm tendue sur la surface de l'oeuf.
- Répétez les étapes 02.02 à 02.09 avec tous les œufs de poulet avant de commencer les expériences de transplantation.
- Depuis embryons de caille ne sont utilisés que pour les tissus des donateurs, dans les étapes 2.2 à 2.9 ovo peut être omis. Pour la préparation ovo ex d'embryons donateurs, oeufs de caille sont incubés côté non tranchant et a ouvert dans cette région avec des pinces courbes de révéler l'embryon. Avec des ciseaux de dissection, faire quatre coupes en forme d'un carré à travers la membrane vitelline et blastoderme en dehors de l'embryon (assurez-vous que toutes les coupes de répondre). En utilisant une pince courbes iris, pincez doucement une arête de coupe et soulever l'embryon de l'oeuf et de le transférer à une solution de Ringer dans une boîte de Pétri. Alternativement, on peut utiliser la courbed iris Pince à lever l'embryon excisé du dessous, ou une cuillère embryon ou d'une pipette de transfert en plastique couper à travers la partie la plus large du cylindre, peut être utilisé pour transférer l'embryon de l'oeuf. Retirer délicatement la membrane vitelline avec # 5 forceps. Recueillir les embryons de caille autres que ci-dessus, et les mettre en scène sous un microscope à dissection.
3. Préparer l'embryon d'accueil pour recevoir la greffe
- Retirer parafilm partir de l'hôte (poussin) embryon et en utilisant une aiguille de tungstène affûtée ou # 5 forceps, déchirer un petit trou dans la membrane vitelline à la région désirée du tube neural (figure 3A).
- Ajouter une goutte de solution de Ringer à l'embryon. Prenez soin de garder l'embryon complètement immergé dans la solution de Ringer pendant toute la procédure pour prévenir la déshydratation des tissus. Continuer à ajouter des gouttes de la solution de Ringer à la surface de l'embryon par l'intermédiaire d'une pipette de transfert, si nécessaire.
- En utilisant une aiguille de verre tiré, soigneusement faire rostral et caUdal incisions transversales correspondant à la longueur et la région d'intérêt dans le tube neural dorsal. (Aiguilles de verre Entraînées sont générés à partir des tubes de verre de silicium capillaires qui ont été tirés à la chaleur avec une aiguille de traction appareil.) Pour des greffes unilatérales les incisions ne devraient s'étendre à la lumière du tube neural dorsal, et pour des greffes bilatérales, faire des incisions dans l'ensemble du tube neural dorsal. Ensuite, couper bilatéral entre le tube neural dorsal et le mésoderme paraxial.
- Soin séparer l'explant excisé du tube neural puis l'enlever de l'embryon par aspiration dans une micropipette de verre (figure 3B).
4. Préparer le tissu greffon du donneur
- Choisissez une étape appariés embryon de caille. Maintenez l'embryon vers le bas avec une pince AA, retirez la membrane vitelline, et de l'accise une région de taille similaire du tube neural, comme décrit ci-dessus (3.3 à 3.4) (Figure 3A'-B '). Selon les besoins de votre expérience, cette région peut être unrégion complémentaire de l'hôte (poussin) du tube neural ou d'une autre région le long de l'axe rostro-caudal. (NB: pour les grandes greffes régionaux, y compris les greffes complètes du tube neural, les chercheurs pourraient vouloir ajouter une digestion par les protéases à cette étape pour supprimer tous les tissus adhérents mésenchymateuse du tissu du donneur avant la transplantation Toutefois, pour les petites dorsales greffes du tube neural à un stade précoce. , comme cela est détaillé ici, la digestion de protéase n'est pas nécessaire que le tube neural se sépare facilement de mésenchyme adjacent par des techniques chirurgicales strictement.)
5. Greffe du tissu
- Aspirer l'explant donneur dans une micropipette de verre contenant une solution de Ringer. Veillez à ne pas introduire de bulles dans la pipette.
- Transférer l'explant adjacente à la région excisé de l'hôte de poulet. Avec une aiguille de verre tiré, d'orienter l'explant et guidez dans la région ayant subi une ablation (figure 3C).
- Ajouter avec précaution quelques gouttes de solution de Ringerà l'embryon à empêcher la déshydratation. Prenez soin de ne pas laisser tomber le liquide directement sur le site de la greffe, car cela pourrait déloger le greffon.
- Sceller la fenêtre avec du ruban d'emballage. Assurez-vous que la bande des joints toute la région de l'œuf fenêtré. Cela empêche la déshydratation et la contamination de l'embryon pendant l'incubation ultérieure.
- Retour de l'œuf dans l'incubateur jusqu'à ce que le stade de croissance désiré. Assurez-vous que la "bascule" la fonction est coupée alors que l'incubation des chimères. Les oeufs peuvent être légèrement tourné à la main deux fois par jour car cela peut augmenter leur viabilité si les stades ultérieurs du développement sont ciblés.
6. Préparer embryons chimériques pour la coupe
- Au point limite expérimental, coupé le ruban couvrant la fenêtre à l'aide de ciseaux fins.
- Saisissez le bord du blastoderme avec courbe iris pince (plus facile à faire avec mors striés), puis couper l'embryon loin de le jaune avec 4 grosses coupes en dehors des limites du blastoderme.
- Transfert de l'embryon à une boîte de Pétri contenant une solution de Ringer. Prenez soin de minimiser l'exposition de l'embryon à l'air afin d'éviter la déshydratation des tissus.
- En vertu de la stéréomicroscopie, séparer délicatement la membrane vitelline de l'aide blastoderme n ° 5 forceps.
- Disposez soigneusement l'embryon dans le plat pour que l'embryon se trouve dans la même orientation que c'était dans l'œuf, avec des membranes entourant prévues à plat.
- Utilisation de dissection aiguilles à base de tungstène fils 64 à enlever proprement du blastoderme entourant de l'embryon en agençant l'aiguille à la limite de l'embryon et des tissus extraembryonnaires, avec la longueur de la parallèle à un fil de tungstène du fond de la boîte. Utilisez un mouvement de scie douce pour couper à travers les tissus.
- Retirez soigneusement l'amnios avec # 5 forceps. À ce stade, vous pouvez, souhaitent soit de disséquer la région de votre intérêt, ou de laisser l'ensemble embryon.
- Transfert de l'embryon à la glace paraffine 4% à froidormaldehyde et le rock toute la nuit à 4 ° C.
- Préparer les échantillons et d'intégrer pour la coupe cryo-ou de la paraffine.
Tracez le tissu greffé au sein de l'embryon hôte. Il existe plusieurs techniques pour identifier un tissu de caille dans un embryon de poulet, y compris la détection de caille nucléoles par coloration hématoxyline (noyaux de caille ont de très grandes, les inclusions de coloration plus foncée que les noyaux de poulet), la réaction de Feulgen-Rossenbeck, acridine-orange ou biz-benzamide tache combinée avec la microscopie électronique, ou immunomarquage pour les cailles des antigènes spécifiques de 3,47,65,66. Ici, nous utilisons l'antigène QCPN et standard tout-montage ou de l'article des techniques d'immunofluorescence pour identifier les cellules de la crête neurale de caille chez la caille-chick chimères (Figure 4). Cette technique permet plus de souplesse dans la conception expérimentale, comme l'immunofluorescence QCPN peuvent également être combinées avec d'autres anticorps pour identifier les cellules différenciées issues du donneur (la caille) des tissus. Utilisez standae toute-mount ou des techniques d'immunofluorescence section d'étiqueter caille des cellules dérivées de chimères.
7. Les résultats représentatifs
Une image représentative de la région greffée du tube neural, après 6h de ré-incubation (à HH11) montre l'incorporation devrait du donneur (la caille) tissu greffé dans l'hôte (poussin) du tube neural (figure 4A). Les embryons présentant l'intégration incomplète de la greffe, ou le développement asymétrique de la région crânienne ou somites après Réincubation doit être jeté.
Coupe transversale à travers la région greffée à HH11 CNC montrent marqués par HNK-1 migration latéralement loin du tube neural. Cellules de caille qui contribuent à la CCN flux migratoire, et le tube neural, sont clairement étiquetés avec QCPN (figure 4B).
Aux stades ultérieurs, les cailles de la CCN des cellules dérivées peuvent être attribués à leur tissu cible finale. Cellules QCPN étiquetés sont entrecoupées dans le mésenchyme embryon de pouletdu processus maxillaire à E5 (figure 4C).
L'anticorps QCPN peuvent être facilement combinés avec d'autres anticorps pour examiner la différenciation des cailles dérivés CNC dans l'environnement hôte. Caille CCN dérivés du trijumeau neurones sensoriels sont étiquetés par QCPN et Tuj1 anticorps (figure 4D).
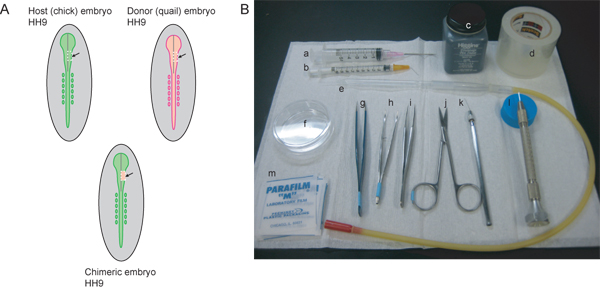
Figure 1. Vue d'ensemble de la procédure expérimentale et les instruments nécessaires. Un hôte) (poussin) et bailleurs de fonds (la caille) embryons devrait être assorti stade. Pour marquer le flux de la CCN qui contribue à la ganglion de Gasser et maxillo-mandibulaire région, HH9 est idéal. Au HH9, le tube neural commence à se combler dans la région rostrale, mais n'est pas encore complètement scellé. La ligne grise dans les diagrammes représente la ligne médiane du tube neural de clôture. Les lignes pointillées blanches indiquent les lignes de coupe pour exciser une région du mésencéphale du côté droit du tube neural de l'hôte et du donneur embryos. La région de l'embryon excisé hôte est éliminé et le tissu du donneur transplantés pour générer l'embryon chimérique. B) les instruments nécessaires comprennent: une seringue) 5 ml avec 18 ½ aiguille hypodermique G, b) seringue de 1 ml à 26 ½ plié G aiguille hypodermique à angle de 45 °, c) l'encre de Chine, d) du ruban adhésif d'emballage, e) pipette en verre avec la bouche de pipetage appareil, f) 60 mm-boîte de Pétri, g) AA forceps, h) courbes pince iris avec mors striés, i) # 5 forceps, j) ciseaux fins, k) aiguisé fil de tungstène, l) tiré aiguille de verre, m) parafilm carrés.
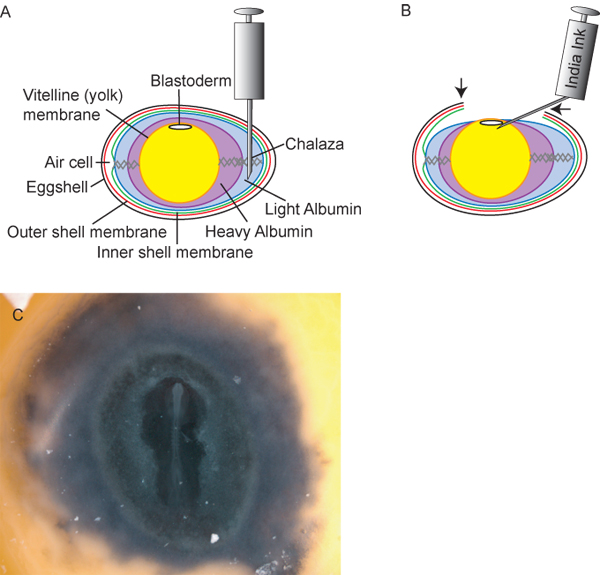
Figure 2. Préparation des œufs et des embryons. A) transversale schéma de l'oeuf, y compris le point d'insertion idéal de 18 ½ aiguille hypodermique G pour le retrait de la lumière albumine. B) Après le retrait de l'albumine 3mL ~ la lumière, le jaune et l'embryon dans l'œuf diminue, permettant aux chercheurs de couper une «fenêtre» (flèches) en til coquille d'accéder à l'embryon. L'encre de Chine, 1:10 dilué dans une solution Ringer stérile, peut alors être injecté sous la blastoderme pour offrir un contraste pour la mise en scène facile des embryons. Embryon de poulet C) après encrage.
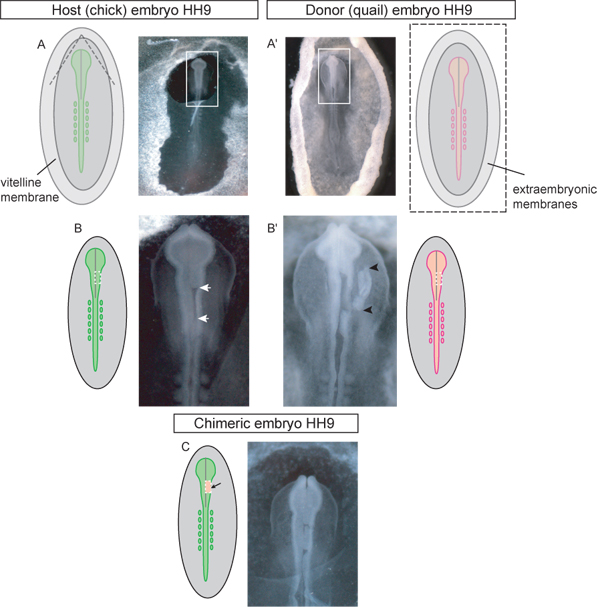
Figure 3. Schéma et des exemples de HH embryons au stade de donateurs et d'accueil 9 à chaque étape de la procédure de greffe. Un embryon), l'hôte de poussin. Les lignes pointillées dans le diagramme indiquent où la membrane vitelline devrait être déchirée pour accéder à la région crânienne pour le greffage. Une fois déchiré le lambeau triangulaire de la membrane vitelline doivent être pelés caudale. Boîte à image indique encart utilisé dans (Colombie-Britannique). A ') embryon donneur Quail. L'image est d'un embryon donneur excisé de l'œuf et mis en boîte de Pétri pour la dissection du tissu greffé. Boîte à image indique encart utilisé dans (B '). Les lignes pointillées dans le diagramme schématique (A ') indiquent où la vitelline et les membranes vitellines doivent être coupés afin d'éliminer til embryon à partir de l'œuf. Embryon hôte B) avec la région du mésencéphale unilatérale du tube neural excisée (flèches blanches) en attente de greffe. La ligne en pointillé dans le schéma indique où les coupes devraient être faites à l'accise du tube neural dans la région du mésencéphale. Embryon B 'des donateurs) avec tube de tissu greffé dorsale neurones excisée (greffe de tissu indiqué par des flèches noires). La ligne en pointillé dans le schéma indique où les coupes devraient être faites dans l'embryon de caille aux tissus du donneur d'accise pour la greffe unilatérale de la région du mésencéphale du tube neural. C) l'embryon chimérique après la greffe de caille explant tube neural dorsal dans la région du mésencéphale poussin.
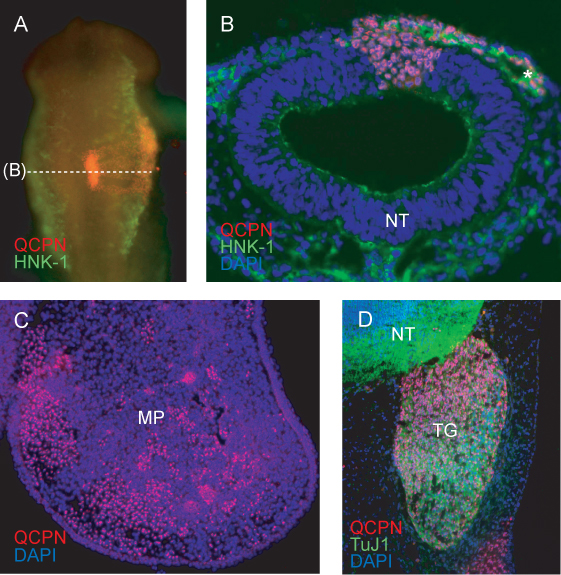
Figure 4. Immunofluorescence détecter cailles spécifique QCPN antigène nucléaire dans les pays donateurs des cellules dérivées de l'embryon chimérique. A) Le total des montage image de HH11 chimère (greffé à HH9) montrant une coloration QCPN en rouge, et HNK-1 coloration (un marqueur de migration CCN) dansverte. Un grossissement de 10X, vue dorsale. B) Coupe transversale embryon dans (A), montrant des cellules de caille QCPN-positifs obtenus dans le tube neural et migrateurs CCN co-colorées avec HNK-1 (vert). Grossissement 40X. C) de la Croix-section à travers le processus maxillaire de chimère E5 (incubées pendant 3 jours après greffe), montrant QCPN-positifs CCN des cellules dérivées de (rouge) qui ont migré de la région greffée du tube neural à leur emplacement définitif dans l'embryon. Un grossissement de 10X. D) L'article à E5 contribution montrant chimère de cailles dérivée de la CCN à l'ganglion de Gasser (rouge) et la différenciation des neurones positifs TuJ1 (vert). Grossissement 40X. *, CNC; MP, processus maxillaire; NT, du tube neural; TG, ganglion de Gasser.
Discussion
Le greffage du tube neural de caille dans des embryons de poulet d'accueil décrit ici est une technique simple et peu coûteuse pour le traçage des sous-populations spécifiques de la migration CCN émanant de différentes régions le long de l'axe rostro-caudal 21,67-69. Cette technique tire avantage de la facilité d'accès aux embryons d'oiseaux (par rapport aux embryons de mammifères) et peuvent être combinés avec d'autres techniques, telles que l'ablation des tissus, l'in...
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs tiennent à remercier les membres du laboratoire Lwigale pour la critique du manuscrit. SLG est soutenu par une bourse de Ruth L. Kirschstein NRSA du National Eye Institute (F32 EY02167301). PYL est soutenu par le National Eye Institute (EY018050).
matériels
| Name | Company | Catalog Number | Comments |
| Réactif | Entreprise | Le numéro de catalogue | |
| Le poussin oeufs | Divers - nous utilisons la Texas A & M University Poultry Science Department, TX. | ||
| Les oeufs de caille | Divers - nous utilisons Société Egg Ozarks, MO. | ||
| Egg incubateur (affichage numérique 1502 Sportsman Incubateur w / Humidité alternatif de 110-120 volts) | www.poultrysupply.com | 1502 | |
| Dumont AA forceps, Inox revêtement époxy | Outils belle science | 11210-10 | |
| Ruban adhésif | N'importe quel magasin de fournitures de bureau | ||
| Courbé Iris pince | Outils belle science | 11065-07 | |
| Jende d'encre | Tout magasin de fournitures artistiques | ||
| Pen / Strep (pénicilline, streptomycine) Solution | VWR International | 101447-068 | |
| Clair ruban d'emballage | N'importe quel magasin de fournitures de bureau | ||
| Aiguille appareil de traction | Narashige, le Japon | PE-21 | |
| Aiguille de verre tiré, fait de 1,5 à 1,8 x tube de verre de borosilicate 100mm capillaire | Kimble Chase | 34500 99 | |
| Tiré de verre pipette, fabriqué à partir de 5 ¾ "pipette Pasteur | Fisher Scientific | 13-678-6A | |
| Bouche pipette appareil (tube aspirateur pour pipettes microcapillaire calibré) | Sigma-Aldrich | A5177-52A | |
| Dumont # 5 forceps | Outils belle science | 11251-30 | |
| Tonneaufil gsten, diamètre 0,1 mm | VWR International | AA10404-H2 | |
| Porte-aiguilles (support de broche nickelé) | Outils belle science | 26018-17 | |
| QCPN antisérum | Des études de développement de la Banque d'hybridome, Université de l'Iowa | QCPN | |
| Alexa Fluor anticorps secondaire (par exemple, Alexa Fluor 594 chèvre anti-souris IgG1) | Invitrogen | A21125 | |
Une solution de Ringer (2L):
| Tous les réactifs de Fisher Scientific |
|
Références
- Le Douarin, G., Renaud, D. Morphologic and physiologic study of the differentiation in vitro of quail embryo precardial mesoderm. Bull. Biol. Fr. Belg. 103 (3), 453-468 (1969).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods. Mol. Biol. 461, 337-350 (2008).
- Le Douarin, N. A biological cell labeling technique and its use in expermental embryology. Dev. Biol. 30 (1), 217-222 (1973).
- Noden, D. M. An analysis of migratory behavior of avian cephalic neural crest cells. Dev. Biol. 42 (1), 106-130 (1975).
- Johnston, M. C. A radioautographic study of the migration and fate of cranial neural crest cells in the chick embryo. Anat. Rec. 156 (2), 143-155 (1966).
- Noden, D. M. The control of avian cephalic neural crest cytodifferentiation. I. Skeletal and connective tissues. Dev. Biol. 67 (2), 296-312 (1978).
- Oka, K. The role of TGF-beta signaling in regulating chondrogenesis and osteogenesis during mandibular development. Dev. Biol. 303 (1), 391-404 (2007).
- Chai, Y. Fate of the mammalian cranial neural crest during tooth and mandibular morphogenesis. Development. 127 (8), 1671-1679 (2000).
- Lengele, B., Schowing, J., Dhem, A. Embryonic origin and fate of chondroid tissue and secondary cartilages in the avian skull. Anat. Rec. 246 (3), 377-393 (1996).
- Le Douarin, N. M., Ziller, C., Couly, G. F. Patterning of neural crest derivatives in the avian embryo: in vivo and in vitro studies. Dev. Biol. 159 (1), 24-49 (1993).
- Lallier, T. E. Cell lineage and cell migration in the neural crest. Ann. N.Y. Acad. Sci. 615, 158-171 (1991).
- Nakamura, H. Mesenchymal derivatives from the neural crest. Arch. Histol. Jpn. 45 (2), 127-138 (1982).
- Le Lievre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. J. Embryol. Exp. Morphol. 34 (1), 125-154 (1975).
- Rawles, M. E. The Development of Melanophores from Embryonic Mouse Tissues Grown in the Coelom of Chick Embryos. Proc. Natl. Acad. Sci. U.S.A. 26 (12), 673-680 (1940).
- Rawles, M. E. The Pigment-Forming Potency of Early Chick Blastoderms. Proc. Natl. Acad. Sci. U.S.A. 26 (1), 86-94 (1940).
- Mosher, J. T. Intrinsic differences among spatially distinct neural crest stem cells in terms of migratory properties, fate determination, and ability to colonize the enteric nervous system. Dev. Biol. 303 (1), 1-15 (2007).
- Dupin, E., Le Douarin, N. M. Development of melanocyte precursors from the vertebrate neural crest. Oncogene. 22 (20), 3016-3023 (2003).
- Faraco, C. D., Vaz, S. A., Pastor, M. V., Erickson, C. A. Hyperpigmentation in the Silkie fowl correlates with abnormal migration of fate-restricted melanoblasts and loss of environmental barrier molecules. Dev. Dyn. 220 (3), 212-225 (2001).
- Selleck, M. A., Bronner-Fraser, M. Avian neural crest cell fate decisions: a diffusible signal mediates induction of neural crest by the ectoderm. Int. J. Dev. Neurosci. 18 (7), 621-627 (2000).
- Stocker, K. M., Sherman, L., Rees, S., Ciment, G. Basic FGF and TGF-beta 1 influence commitment to melanogenesis in neural crest-derived cells of avian embryos. Development. 111 (2), 635-645 (1991).
- Le Douarin, N. M., Teillet, M. A. Experimental analysis of the migration and differentiation of neuroblasts of the autonomic nervous system and of neurectodermal mesenchymal derivatives, using a biological cell marking technique. Dev. Biol. 41 (1), 162-184 (1974).
- Noden, D. M. The control of avian cephalic neural crest cytodifferentiation. II. Neural tissues. Dev. Biol. 67 (2), 313-329 (1978).
- Barraud, P. Neural crest origin of olfactory ensheathing glia. Proc. Natl. Acad. Sci. U.S.A. 107 (49), 21040-21045 (2010).
- Li, H. Y., Say, E. H., Zhou, X. F. Isolation and characterization of neural crest progenitors from adult dorsal root ganglia. Stem Cells. 25 (8), 2053-2065 (2007).
- Carney, T. J. A direct role for Sox10 in specification of neural crest-derived sensory neurons. Development. 133 (23), 4619-4630 (2006).
- Maro, G. S. Neural crest boundary cap cells constitute a source of neuronal and glial cells of the PNS. Nat. Neurosci. 7 (9), 930-938 (2004).
- Bronner-Fraser, M. Molecular analysis of neural crest formation. J. Physiol. Paris. 96 (1-2), 3-8 (2002).
- Paratore, C., Goerich, D. E., Suter, U., Wegner, M., Sommer, L. Survival and glial fate acquisition of neural crest cells are regulated by an interplay between the transcription factor Sox10 and extrinsic combinatorial signaling. Development. 128 (20), 3949-3961 (2001).
- Britsch, S. The transcription factor Sox10 is a key regulator of peripheral glial development. Genes Dev. 15 (1), 66-78 (2001).
- Bronner-Fraser, M. Origin of the avian neural crest. Stem Cells. 13 (6), 640-646 (1995).
- Jessen, K. R., Mirsky, R. Neural development. Fate diverted. Curr. Biol. 4 (9), 824-827 (1994).
- Le Douarin, N., Dulac, C., Dupin, E., Cameron-Curry, P. Glial cell lineages in the neural crest. Glia. 4 (2), 175-184 (1991).
- Chan, W. Y., Cheung, C. S., Yung, K. M., Copp, A. J. Cardiac neural crest of the mouse embryo: axial level of origin, migratory pathway and cell autonomy of the splotch (Sp2H) mutant effect. Development. 131 (14), 3367-3379 (2004).
- Bronner-Fraser, M. Segregation of cell lineage in the neural crest. Curr. Opin. Genet. Dev. 3 (4), 641-647 (1993).
- Peters-vander Sanden, M. J., Luider, T. M., vander Kamp, A. W., Tibboel, D., Meijers, C. Regional differences between various axial segments of the avian neural crest regarding the formation of enteric ganglia. Differentiation. 53 (1), 17-24 (1993).
- Kuratani, S., Bockman, D. E. Capacity of neural crest cells from various axial levels to participate in thymic development. Cell Tissue Res. 263 (1), 99-105 (1991).
- Leblanc, G. G., Epstein, M. L., Bronner-Fraser, M. E. Differential development of cholinergic neurons from cranial and trunk neural crest cells in vitro. 137 (2), 318-330 (1990).
- Golding, J. P., Trainor, P., Krumlauf, R., Gassmann, M. Defects in pathfinding by cranial neural crest cells in mice lacking the neuregulin receptor ErbB4. Nat. Cell. Biol. 2 (2), 103-109 (2000).
- Kulesa, P. M., Bailey, C. M., Kasemeier-Kulesa, J. C., McLennan, R. Cranial neural crest migration: new rules for an old road. Dev. Biol. 344 (2), 543-554 (2009).
- Lwigale, P. Y., Bronner-Fraser, M. Semaphorin3A/neuropilin-1 signaling acts as a molecular switch regulating neural crest migration during cornea development. Dev. Biol. 336 (2), 257-265 (2009).
- Killian, O. l. e. s. n. i. c. k. y., Birkholz, E. C., A, D., Artinger, K. B. A role for chemokine signaling in neural crest cell migration and craniofacial. Dev. Biol. 333 (1), 161-172 (2009).
- Gammill, L. S., Gonzalez, C., Bronner-Fraser, M. Neuropilin 2/semaphorin 3F signaling is essential for cranial neural crest migration and trigeminal ganglion condensation. Dev. Neurobiol. 67 (1), 47-56 (2007).
- Osborne, N. J., Begbie, J., Chilton, J. K., Schmidt, H., Eickholt, B. J. Semaphorin/neuropilin signaling influences the positioning of migratory neural crest cells within the hindbrain region of the chick. Dev. Dyn. 232 (4), 939-949 (2005).
- Kanzler, B., Foreman, R. K., Labosky, P. A., Mallo, M. BMP signaling is essential for development of skeletogenic and neurogenic cranial neural crest. Development. 127 (5), 1095-1104 (2000).
- Garcia-Lopez, R., Pombero, A., Martinez, S. Fate map of the chick embryo neural tube. Dev. Growth Differ. 51 (3), 145-165 (2009).
- Goldstein, A. M., Nagy, N. A bird's eye view of enteric nervous system development: lessons from the avian embryo. Pediatr. Res. 64 (4), 326-333 (2008).
- Le Douarin, N., Dieterlen-Lievre, F., Creuzet, S., Teillet, M. A. Quail-chick transplantations. Methods Cell. Biol. 87, 19-58 (2008).
- Wingate, R. J., Lumsden, A. Persistence of rhombomeric organisation in the postsegmental hindbrain. Development. 122 (7), 2143-2152 (1996).
- Karagenc, L., Sandikci, M. Tissue distribution of cells derived from the area opaca in heterospecific quail-chick blastodermal chimeras. J. Anat. 216 (1), 16-22 (2010).
- Teague, W. J., Jayanthi, N. V., Lear, P. V., Johnson, P. R. Foregut mesenchyme contributes cells to pancreatic acini during embryonic development in a chick-quail chimera model. Pediatr. Surg. Int. 21 (3), 138-142 (2005).
- Borue, X., Noden, D. M. Normal and aberrant craniofacial myogenesis by grafted trunk somitic and segmental plate mesoderm. Development. 131 (16), 3967-3980 (2004).
- He, L. Three different fates of cells migrating from somites into the limb bud. Anat. Embryol. (Berl). 207 (1), 29-34 (2003).
- Huang, R., Zhi, Q., Christ, B. The relationship between limb muscle and endothelial cells migrating from single somite. Anat. Embryol. (Berl). 206 (4), 283-289 (2003).
- Hidalgo-Sanchez, M., Simeone, A., Alvarado-Mallart, R. M. Fgf8 and Gbx2 induction concomitant with Otx2 repression is correlated with midbrain-hindbrain fate of caudal prosencephalon. Development. 126 (14), 3191-3203 (1999).
- Verberne, M. E., Gittenberger-de Groot, A. C., Poelmann, R. E. Lineage and development of the parasympathetic nervous system of the embryonic chick heart. Anat. Embryol. (Berl). 198 (3), 171-184 (1998).
- Burns, A. J., Douarin, N. M. The sacral neural crest contributes neurons and glia to the post-umbilical gut: spatiotemporal analysis of the development of the enteric nervous system. Development. 125 (21), 4335-4347 (1998).
- Debby-Brafman, A., Burstyn-Cohen, T., Klar, A., Kalcheim, C. F-Spondin, expressed in somite regions avoided by neural crest cells, mediates inhibition of distinct somite domains to neural crest migration. Neuron. 22 (3), 475-488 (1999).
- Lwigale, P. Y., Bronner-Fraser, M. Lens-derived Semaphorin3A regulates sensory innervation of the cornea. Dev. Biol. 306 (2), 750-759 (2007).
- Nakamura, H., Funahashi, J. Introduction of DNA into chick embryos by in ovo electroporation. Methods. 24 (1), 43-48 (2001).
- Chen, Y. X., Krull, C. E., Reneker, L. W. Targeted gene expression in the chicken eye by in ovo electroporation. Mol. Vis. 10, 874-883 (2004).
- Sato, F., Nakagawa, T., Ito, M., Kitagawa, Y., Hattori, M. A. Application of RNA interference to chicken embryos using small interfering RNA. J. Exp. Zool. A. Comp. Exp. Biol. 301 (10), 820-827 (2004).
- Lwigale, P. Y., Schneider, R. A. Other chimeras: quail-duck and mouse-chick. Methods Cell. Biol. 87, 59-74 (2008).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev. Dyn. 195 (4), 231-272 (1992).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bull. World Health Organ. 32 (1), 143-144 (1965).
- Le Douarin, N. M. A Feulgen-positive nucleolus. Exp. Cell. Res. 77 (1), 459-468 (1973).
- Feulgen, R., Rossenbeck, H. Mikroskopisch-chemischer Nachweis einer Nucleinsaure vom typus der Thymonucleinsiiure und die darauf beruhende elektive Faibung von Zellkemen in mikroskopischen Praparaten. Hoppe-Seyler's Z. Physiol. Chem. 135, 203-252 (1924).
- Lwigale, P. Y., Conrad, G. W., Bronner-Fraser, M. Graded potential of neural crest to form cornea, sensory neurons and cartilage along the rostrocaudal axis. Development. 131 (9), 1979-1991 (2004).
- Weston, J. A. A radioautographic analysis of the migration and localization of trunk neural crest cells in the chick. Dev. Biol. 6, 279-310 (1963).
- Le Douarin, N. M., Kalcheim, C. . The Neural Crest. , (2009).
- Le Douarin, N. M., Teillet, M. A. The migration of neural crest cells to the wall of the digestive tract in avian embryo. J. Embryol. Exp. Morphol. 30 (1), 31-48 (1973).
- Douarin, N. M. L. e., Jotereau, F. V. Tracing of cells of the avian thymus through embryonic life in interspecific chimeras. J. Exp. Med. 142 (1), 17-40 (1975).
- Le Douarin, N. M., Renaud, D., Teillet, M. A., Le Douarin, G. H. Cholinergic differentiation of presumptive adrenergic neuroblasts in interspecific chimeras after heterotopic transplantations. Proc. Natl. Acad. Sci. U. S. A. 72 (2), 728-732 (1975).
- Houssaint, E., Belo, M., Le Douarin, N. M. Investigations on cell lineage and tissue interactions in the developing bursa of Fabricius through interspecific chimeras. Dev. Biol. 53 (2), 250-264 (1976).
- Le Douarin, N. M., Jotereau, F. V., Houssaint, E., Belo, M. Ontogeny of the avian thymus and bursa of Fabricius studied in interspecific chimeras. Ann. Immunol. (Paris). 127 (6), 849-856 (1976).
- Fontaine, J., Le Douarin, N. M. Analysis of endoderm formation in the avian blastoderm by the use of quail-chick chimaeras. The problem of the neurectodermal origin of the cells of the APUD series. J. Embryol. Exp. Morphol. 41, 209-222 (1977).
- Narayanan, C. H., Narayanan, Y. On the origin of the ciliary ganglion in birds studied by the method of interspecific transplantation of embryonic brain regions between quail and chick. J. Embryol. Exp. Morphol. 47, 137-148 (1978).
- Lwigale, P. Y., Cressy, P. A., Bronner-Fraser, M. Corneal keratocytes retain neural crest progenitor cell properties. Dev. Biol. 288 (1), 284-293 (2005).
- Lwigale, P. Y. Embryonic origin of avian corneal sensory nerves. Dev. Biol. 239 (2), 323-337 (2001).
- Tanaka, H., Kinutani, M., Agata, A., Takashima, Y., Obata, K. Pathfinding during spinal tract formation in the chick-quail chimera analysed by species-specific monoclonal antibodies. Development. 110 (2), 565-571 (1990).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon