È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Analisi della migrazione cresta neurale e la differenziazione delle specie da Cross-trapianto
In questo articolo
Riepilogo
Un approccio per l'analisi della migrazione e il destino finale di aviaria cellule della cresta neurale a quaglie-chick embrioni chimera è descritta. Questo metodo è una tecnica semplice e diretto per il tracciamento cellule della cresta neurale durante la migrazione e la differenziazione che sono altrimenti difficili da distinguere all'interno di un embrione di pollo non manipolata.
Abstract
Embrioni di uccelli fornire una piattaforma unica per studiare molti processi vertebrati sviluppo, a causa della facile accesso degli embrioni all'interno dell'uovo. Chimerici embrioni di uccelli, in cui è trapianto di tessuto donatore quaglie in un embrione di pollo in ovo, combinano la potenza di etichettatura indelebile genetica di popolazioni cellulari con la facilità di manipolazione presentata dalla embrione aviaria.
Quail-pulcino chimere sono uno strumento classico per il tracciamento migratori cellule della cresta neurale (CNC) 1-3. CNC sono una popolazione transitoria migratoria delle cellule nell'embrione, che sono originari della regione dorsale del 4 in via di sviluppo del tubo neurale. Sono sottoposte a uno di transizione epitelio mesenchimale e successivamente migrare verso altre regioni dell'embrione, dove si differenziano in vari tipi cellulari tra cui la cartilagine 5-13, 11,14-20 melanociti, neuroni e glia 21-32. I CNC sono multipotenti, e il loro destino finale è influenzato da 1) la regione del tubo neurale in cui hanno origine lungo l'asse rostro-caudale dell'embrione 11,33-37, 2) i segnali provenienti da cellule vicine mentre migrano 38-44, e 3) il microambiente della loro definitiva destinazione all'interno dell'embrione 45,46. Tracing queste cellule dal loro punto di origine al tubo neurale, alla loro posizione finale e il destino all'interno dell'embrione, fornisce informazioni importanti sui processi evolutivi che regolano patterning e l'organogenesi.
Il trapianto di regioni complementari del tubo neurale del donatore (omotopi innesto) o di diverse regioni del tubo neurale del donatore (trapianto eterotopico) può rivelare differenze di pre-specifiche della NCC lungo l'asse rostro-caudale 2,47. Questa tecnica può essere ulteriormente adattata per trapiantare un compartimento unilaterale del tubo neurale, in modo tale che un lato è derivato da tessuto donatore, e resti lato controlaterale imperturbato nell'embrione ospite, yiElding un controllo interno all'interno del campione stesso 2,47. Può anche essere adattato per il trapianto di segmenti del cervello in embrioni successive, dopo HH10, quando il tubo anteriore neurale è chiuso 47.
Qui riportiamo le tecniche per la generazione di quaglia-chick chimere Con il trapianto del tubo neurale, che consentono di rintracciare CNC migratori provenienti da un segmento discreta del tubo neurale. Specie-specifica etichettatura dei donatori cellule derivate con la quaglia anticorpo specifico QCPN 48-56 consente al ricercatore di distinguere donatore e cellule ospiti al punto finale sperimentale. Questa tecnica è molto semplice, poco costoso, e ha molte applicazioni, tra cui il destino-mapping, linea cellulare l'analisi e l'individuazione pre-patterning eventi lungo l'asse rostro-caudale 45. A causa della facilità di accesso al embrione aviaria, la quaglia-pulcino tecnica innesto può essere combinato con altre manipolazioni, inclusi ma non limitati a ablazione lente 40, l'iniezione di molecole inibitrici 57,58 o manipolazione genetica mediante elettroporazione di plasmidi di espressione 59-61, per identificare la risposta di particolari flussi migratori di CNC alle perturbazioni nel programma di sviluppo dell'embrione. Inoltre, questa tecnica innesto può anche essere usato per generare altri embrioni interspecifiche chimerici come quaglia anatra chimere per studiare contributo al NCC morfogenesi craniofacciale, o mouse-pulcino chimere di combinare la potenza di topo genetica con la facilità di manipolazione dell'embrione aviaria 62.
Protocollo
1. Incubare pulcino e uova di quaglia allo stadio desiderato
Per HH9 gli embrioni, i tempi di incubazione tipici variano da 29-33 ore a 38 ° C. 63
- Lavare i detriti dalle uova con acqua tiepida.
- Disporre uova di gallina sul vassoio orizzontale. Contrassegnare il lato rivolto verso l'alto con matita, questo corrisponde alla regione in cui l'embrione viene localizzato. Incubare le uova di quaglia fine smussata up.
- Luogo in 38 ° C incubatore umidificato. Accendere funzione dondolo.
2. Preparare le uova per finestre e dissezione
- Rimuovere le uova da incubatrice, e sterilizzare le cime con il 70% di etanolo. E 'meglio spruzzare sul etanolo e pulirla velocemente con un tovagliolo di carta o Kimwipe per evitare l'assorbimento di etanolo attraverso il guscio d'uovo.
- Luogo uovo di gallina su un portauovo individuale (usiamo una piastra di Petri foderato con asciugamani di carta piegati, ad esempio, "Kimwipes"). Utilizzando pinze AA, toccare un piccolo hole nella superficie superiore del guscio alla estremità appuntita dell'uovo.
- Rimuovere 1,5-3 ml di luce albumina dall'uovo di pollo con un ago ipodermico 18 ½ G e siringa da 5 ml. È preferibile inserire l'ago verticalmente nel foro, con lo smusso rivolto verso l'estremità appuntita dell'uovo (Figura 2A). In questo modo, quando l'albumina è ritirato, vi è scarso rischio di danneggiare accidentalmente il tuorlo mediante aspirazione. Eliminare l'albumina. Questo passaggio abbasserà il tuorlo e l'uovo all'interno dell'embrione per consentire una finestra da aprire nel guscio d'uovo.
- Pulire il foro con il 70% di etanolo come descritto sopra e sigillare con nastro adesivo. È importante che il guscio circonda il foro è completamente privo di albumina e secco o l'adesivo non sigillare.
- Con le pinze AA, toccare un altro buco nella superficie marcata superiore dell'uovo orizzontale, non proprio al vertice. Fate attenzione a non lasciare che le pinze andare troppo lontano con il guscio per evitare di danneggiare il tuorlo o embrione.
- Inserire un lato delle pinze curve dell'iride nel foro parallelo al guscio delle uova. Stringendo verso il basso il guscio, lavorando in un movimento circolare per rompere un ~ 2 cm di diametro finestra nel guscio dell'uovo di gallina. Eliminare il guscio d'uovo rimosso. In alternativa, coprire la superficie superiore dell'uovo con nastro da imballaggio e utilizzare un paio di forbici per tagliare la finestra. Questo riduce al minimo la possibilità di detriti guscio cadere l'uovo. L'embrione dovrebbe apparire come un disco opaco in cima al tuorlo. Eliminare le uova non fecondate (identificati da una piccola macchia bianca sulla superficie di tuorlo, o assenza di Blastoderm).
- Iniettare una piccola quantità di inchiostro di china (1:10 diluito in soluzione di Ringer sterile contenente "Pen / Strep" antibiotico: concentrazione finale di 100 pg / ml di penicillina e 100 pg / mL di streptomicina) sotto il Blastoderm per assistere staging l'embrione. Utilizzare una siringa da 1 ml e 26 ½ ago ipodermico G, piegati a 45 ° rispetto alla base dell'ago, con lo smusso rivolto verso l'alto, in alternativa, uno may utilizzare una pipetta Pasteur di vetro tirato e pipettaggio apparato della bocca (indossare protezioni per gli occhi quando ci si piega ago ipodermico o rottura ago di vetro). Puntura la membrana tuorlo fuori del perimetro del Blastoderm e far scorrere la punta dell'ago sotto l'embrione, vicino alla superficie del tuorlo, ma non negli strati embrionali (Figura 2B). Iniettare solo l'inchiostro sufficiente per delineare l'embrione, poi accuratamente estrarre l'ago (Figura 2C). Iniettare l'inchiostro troppo può portare alla morte dell'embrione. È importante non iniettare eventuali bolle d'aria sotto l'embrione, in quanto questo può essere una fonte di contaminazione. NB: Tutte soluzione di Ringer utilizzato in questa procedura è sterilizzato e contiene Pen / Strep come sopra definito. Fosfato sterile soluzione salina tamponata (PBS) è anche un'alternativa accettabile per la soluzione di Ringer in tutte le fasi di questo protocollo.
- Stadio l'embrione in base alla Hamburger e Hamilton 63 e registrare la tappa sul guscio con inchiostro permanente o matita. Le fasi sono più valutati in base stereomicroscopy, con fibre ottiche "a collo di cigno", sorgenti luminose che hanno un carico limitato di calore.
- Applicare 2-3 gocce soluzione calda di Ringer sterile alla superficie dell'embrione per prevenire la disidratazione e la contaminazione. Temporaneamente sigillare la finestra con parafilm allungato sopra la superficie dell'uovo.
- Ripetere i passaggi da 2,2-2,9 con tutte le uova di pollo prima di iniziare gli esperimenti di trapianto.
- Dal momento che gli embrioni di quaglia sono utilizzate solo per i tessuti dei donatori, nei passaggi ovo 2,2-2,9 può essere omessa. Per la preparazione ex ovo donatori di embrioni, uova di quaglia sono incubate lato smussato e la sua apertura in questa regione con le pinze curve di rivelare l'embrione. Dissezione con forbici, fare quattro tagli a forma di un quadrato attraverso la membrana vitellina e Blastoderm fuori l'embrione (assicurarsi che tutti i tagli si incontrino). Utilizzando una pinza curva dell'iride, prenda delicatamente un bordo di taglio e sollevare l'embrione da l'uovo e trasferirlo alla soluzione Ringers in una capsula di Petri. In alternativa, si può utilizzare la curvad iris pinza per sollevare l'embrione escisso da sotto, o un cucchiaio o embrione pipetta di plastica tagliare la parte più larga del cilindro, può essere utilizzato per trasferire l'embrione dall'uovo. Rimuovere delicatamente la membrana vitellina con # 5 pinze. Raccogliere gli embrioni quaglia rimanenti come sopra, e scena sotto un microscopio da dissezione.
3. Preparare l'embrione di accoglienza per ricevere l'innesto
- Rimuovere parafilm dall'host (chick) dell'embrione e usando un ago di tungsteno appuntito o # 5 pinze, strappare un piccolo foro nella membrana vitellina alla regione desiderata del tubo neurale (Figura 3A).
- Aggiungere una goccia di soluzione di Ringer per l'embrione. Fare attenzione a mantenere l'embrione completamente immerso in soluzione di Ringer durante tutto il procedimento per prevenire la disidratazione del tessuto. Mantenere aggiungendo gocce di soluzione di Ringer alla superficie dell'embrione tramite pipetta se necessario.
- Usando un ago di vetro tirato, con cura rendono rostrale e caUdal incisioni trasversali corrispondenti alla lunghezza e la regione di interesse nel tubo dorsale neurale. (Aghi vetro Tirato sono generati da tubi di vetro di silicio capillari che sono state tirate a caldo con un ago trazione apparato.) Per innesti unilaterali le incisioni deve estendersi al lume del tubo dorsale neurale, e per innesti bilaterali, rendono le incisioni tutta l'intero tubo dorsale neurale. Poi tagliare bilaterale tra il tubo neurale dorsale e il mesoderma parassiale.
- Accuratamente separare l'espianto escisso dal tubo neurale poi rimuoverlo dall'embrione aspirando in una micropipetta di vetro (Figura 3B).
4. Preparare il tessuto innesto donatore
- Scegliere una fase-abbinato embrione quaglia. Tenere premuto l'embrione con le pinze AA, rimuovere la membrana vitellina, e accise uno di dimensioni simili regione del tubo neurale come descritto in precedenza (3,3-3,4) (Figura 3A'-B '). A seconda delle esigenze del vostro esperimento, questa regione può essere unregione complementare del tubo ospite (pulcino) neurale o da una regione diversa lungo l'asse rostro-caudale. (NB: per i più grandi innesti regionali, tra cui completi innesti del tubo neurale, i ricercatori potrebbe voler aggiungere una digestione della proteasi in questa fase di rimuovere qualsiasi tessuto aderente dal tessuto mesenchimale donatore prima del trapianto, tuttavia, per i piccoli innesti dorsali del tubo neurale nelle fasi iniziali. , come è descritto qui, digestione proteasica non è necessaria in quanto il tubo neurale viene facilmente separato dal mesenchima adiacente mediante tecniche chirurgiche rigorosamente.)
5. Innesto il tessuto
- Aspirare il espianto donatore in una micropipetta di vetro contenente soluzione di Ringer. Fare attenzione a non introdurre bolle nella pipetta.
- Trasferire la espianto adiacente alla regione asportata dell'ospite pulcino. Utilizzando ago di vetro tirato, orientare l'espianto e delicatamente guidare nella regione ablato (Figura 3C).
- Aggiungere con cautela alcune gocce di soluzione di Ringerper l'embrione per prevenire la disidratazione. Fare attenzione a non far cadere liquido direttamente sul sito del trapianto in quanto ciò potrebbe staccare l'innesto.
- Chiudere la finestra con nastro da imballaggio. Assicurarsi che il nastro sigilla l'intera regione dell'uovo finestra. Ciò impedisce la disidratazione e la contaminazione dell'embrione durante la successiva incubazione.
- Ritorna l'uovo alla incubatrice fino allo stadio desiderato. Assicurarsi che la funzione "rocking" è disattivata, mentre incubando le chimere. Le uova possono essere leggermente ruotato a mano due volte al giorno come questo può aumentare la loro redditività, se le fasi successive di sviluppo sono presi di mira.
6. Preparare gli embrioni chimerici per il sezionamento
- Al endpoint sperimentale, tagliare il nastro che copre la finestra con le forbici sottili.
- Afferrare il bordo della Blastoderm con pinza curva dell'iride (più facile a che fare con seghettato punte), poi tagliare l'embrione dal tuorlo con 4 tagli di grandi dimensioni al di fuori dei confini del Blastoderm.
- Trasferire l'embrione di una capsula Petri contenente soluzione di Ringer. Fare attenzione a minimizzare l'esposizione dell'embrione di aria per evitare la disidratazione del tessuto.
- In stereomicroscopia, separare delicatamente la membrana vitellina dal Blastoderm utilizzando # 5 pinze.
- Cura organizzare l'embrione nel piatto in modo che l'embrione è nello stesso orientamento come era nell'uovo, con membrane che circondano distesi.
- Utilizzare dissezione aghi realizzati da 64 fili di tungsteno per rimuovere in modo pulito il Blastoderm circostante dall'embrione disponendo l'ago al confine dell'embrione e tessuti extraembrionali, con la lunghezza del filo di tungsteno parallelo al fondo del piatto. Con un movimento delicato sega per tagliare i tessuti.
- Rimuovere con cura la membrana amniotica con # 5 pinze. A questo punto si può, né vuole ulteriormente analizzare la regione di tuo interesse, o lasciare il tutto embrione.
- Trasferire l'embrione di ghiaccio solfo freddo 4%ormaldehyde e rock per una notte a 4 ° C.
- Preparare i campioni e incorporare per il sezionamento crio-o paraffina.
Tracciare il tessuto trapiantato all'interno dell'embrione host. Ci sono diverse tecniche per l'identificazione dei tessuti quaglia all'interno di un embrione di pollo, compresa l'individuazione di quaglia nucleoli mediante colorazione ematossilina (nuclei di quaglia sono molto grandi, inclusioni di colorazione più scura rispetto a nuclei pulcino), il Feulgen-Rossenbeck reazione, acridina-arancio o biz-benzammide macchia in combinazione con la microscopia elettronica, o per le quaglie immunomarcatura specifici antigeni 3,47,65,66. Qui usiamo l'antigene QCPN e standard intero-mount o sezione tecniche di immunofluorescenza per identificare le cellule della cresta neurale di quaglia in quaglia-chick chimere (Figura 4). Questa tecnica offre la massima flessibilità nel disegno sperimentale, come la immunofluorescenza QCPN possono anche essere combinati con altri anticorpi per identificare cellule differenziate derivate da tessuto del donatore (quaglie). Utilizzare Standard whole-mount o tecniche di immunofluorescenza sezione di etichettare quaglia cellule derivate in chimere.
7. Risultati rappresentativi
Una immagine rappresentativa della regione innestata del tubo neurale, dopo 6h di ri-incubazione (per HH11) mostra prevede l'incorporazione della innestato donatore (quaglie) tessuto nell'ospite (chick) del tubo neurale (Figura 4A). Gli embrioni che mostrano integrazione incompleta del trapianto, o lo sviluppo asimmetrico della regione cranica o somiti dopo reincubation deve essere eliminata.
Sezione attraverso la regione innestato a HH11 CNC show etichettati con HNK-1 migrazione lateralmente dal tubo neurale. Quail cellule che contribuiscono al flusso NCC migratorio, e al tubo neurale, sono chiaramente etichettati con QCPN (Figura 4B).
Nelle fasi successive, quaglia NCC-cellule derivate possono essere ricondotti alla loro tessuto bersaglio finale. QCPN cellule marcate si alternano all'interno del mesenchima dell'embrione di pollodel processo mascellare a E5 (Figura 4C).
L'anticorpo QCPN possono essere facilmente combinati con altri anticorpi per esaminare la differenziazione della quaglia derivati NCC per l'ambiente host. Quail neuroni trigeminali NCC-derivati sensoriali sono etichettati da QCPN e Tuj1 anticorpi (Figura 4D).
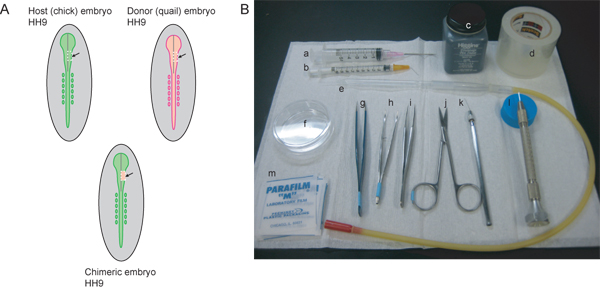
Figura 1. Panoramica della procedura sperimentale e strumenti necessari. A) Host (chick) e donatori (quaglie) gli embrioni devono essere stage abbinato. Per etichettare il flusso di NCC che contribuisce alla ganglio trigeminale e maxillo-mandibolare regione HH9 è l'ideale. Al HH9, il tubo neurale sta cominciando a chiudere nella regione rostrale, ma non è ancora completamente sigillato. La linea grigia nei diagrammi rappresenta la linea mediana del tubo di chiusura neurale. Le linee tratteggiate bianche indicano le linee di taglio per asportare una regione del mesencefalo lato destro del tubo neurale dall'host e donatore embryos. La regione escisse dell'embrione host viene scartato e il tessuto trapiantato nel donatore per generare l'embrione chimerico. B) gli strumenti necessari sono: a) siringa da 5 ml con 18 ½ ago ipodermico G, b) siringa da 1 ml con 26 ½ piegato ipodermico G ago a 45 °, c), inchiostro di china, d) cancella il nastro di imballaggio, e) pipetta di vetro con la bocca pipettaggio apparato, f) 60 mm-Petri, g) AA pinze, h) curve pinza dentata iris con punte, i) # 5 pinze, forbici sottili j), k) affilato filo di tungsteno, l) tirato ago di vetro, m) parafilm quadrati.
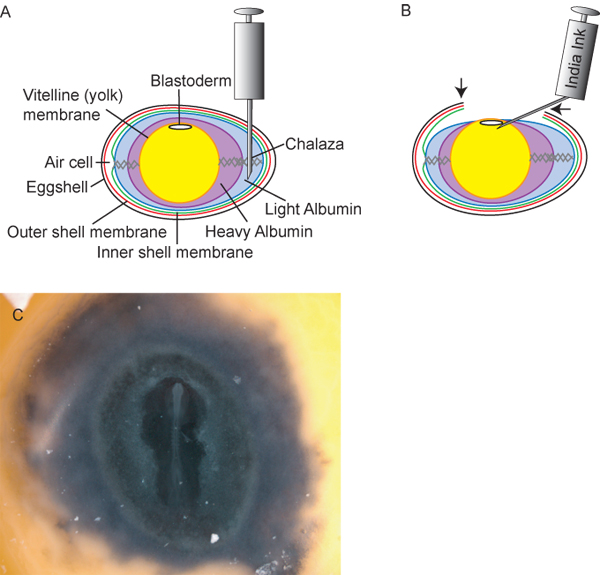
Figura 2. La preparazione delle uova e degli embrioni. A) Sezione trasversale di un uovo, compreso punto di inserimento ideale di 18 ½ ago ipodermico G per il ritiro della luce albumina. B) Dopo aver estratto ~ 3 ml di albumina luce, il tuorlo e abbassa dell'embrione all'interno dell'uovo, permettendo ai ricercatori di tagliare una "finestra" (frecce) in tguscio d'uovo che per accedere al embrione. Inchiostro di china, diluito 1:10 in soluzione di Ringer sterile, può essere iniettato sotto il Blastoderm per fornire contrasto per un facile messa in scena degli embrioni. C) di embrioni di pollo dopo l'inchiostrazione.
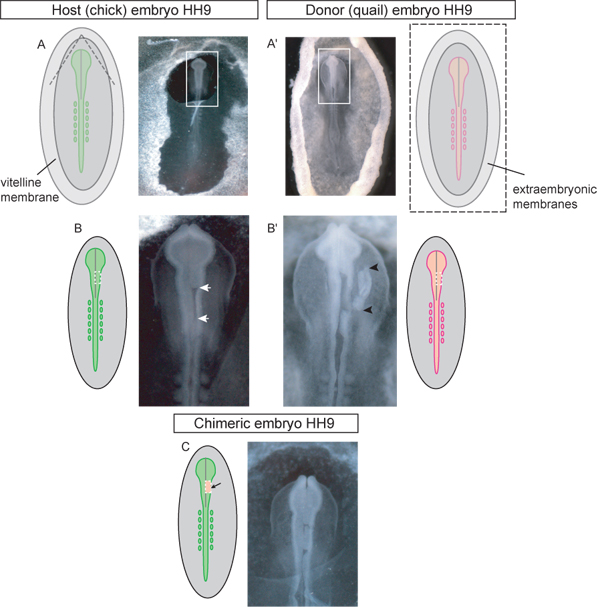
Figura 3. Schema ed esempi di scena HH 9 embrioni di donatori e di accoglienza in ogni fase della procedura di innesto. A) embrione ospite Chick. Le linee tratteggiate nel diagramma indicano dove la membrana vitellina dovrebbe essere strappato per accedere al cranio per l'innesto. Una volta strappato il lembo triangolare di membrana vitellina dovrebbe essere sbucciata caudalmente. Box in immagine indica inserto utilizzato (BC). A ') Quail embrione donatore. L'immagine è di embrioni prelevati da donatori uovo e messo in piastra di Petri per la dissezione del tessuto trapiantato. Box in immagine indica inserto utilizzato in (B '). Le linee tratteggiate in diagramma schematico (A ') indicano dove la vitellina e membrane tuorlo deve essere tagliato in modo da rimuovere tha embrione dall'uovo. B) embrione Host con la regione del mesencefalo unilaterale del tubo neurale espunto (frecce bianche) in attesa di trapianto. La linea tratteggiata in schema indica dove i tagli dovrebbero essere di asportare il tubo neurale nella regione del mesencefalo. B ') embrione donatore con la dorsale del tessuto asportato del tubo neurale graft (innesto di tessuto indicato da frecce nere). Linea tratteggiata in figura indica dove i tagli dovrebbero essere in embrione quaglia ad accisa dei tessuti del donatore per il trapianto unilaterale della regione mesencefalo del tubo neurale. C) embrione chimerico dopo il trapianto di quaglia espianto dorsale del tubo neurale nella regione del mesencefalo pulcino.
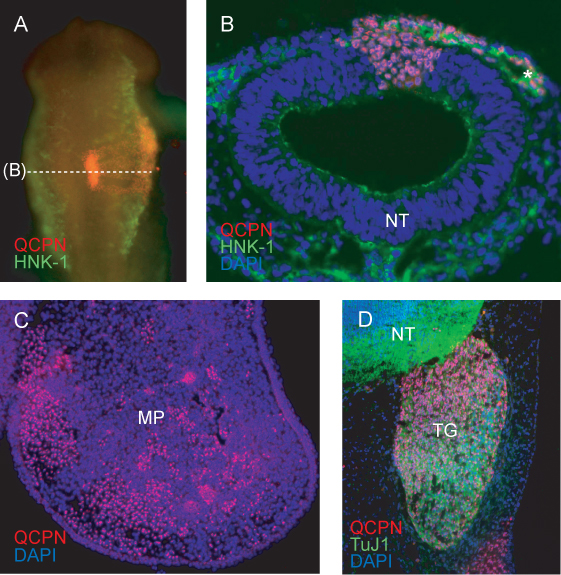
Figura 4. Immunofluorescenza rilevare quaglia specifico QCPN antigene nucleare del donatore-derivate cellule embrionali chimerico. A) Whole-mount immagine di HH11 chimera (innestato a HH9) che mostra QCPN colorazione in rosso, e HNK-1 colorazione (un marcatore di migrazione CNC) inverde. Ingrandimento 10X, vista dorsale. B) Sezione trasversale dell'embrione (A), mostrando QCPN cellule positive quaglia derivate nel tubo neurale e migratorio NCC co-macchiata di HNK-1 (verde). Ingrandimento 40X. C) Sezione trasversale attraverso il processo mascellare chimera E5 (incubate per tre giorni dopo graft), mostrando QCPN-positivi NCC-cellule derivate (rosso) che sono migrati dalla regione innestato del tubo neurale alla loro posizione finale nell'embrione. Ingrandimento 10X. D) il punto attraverso il contributo E5 chimera mostrando di quaglia derivato NCC al ganglio trigeminale (rosso) e differenziazione in neuroni TuJ1-positivi (verde). Ingrandimento 40X. *, CNC, MP, processo mascellare; NT, tubo neurale, TG, ganglio trigeminale.
Discussione
L'innesto di quaglia tubo neurale in embrioni di pollo di accoglienza qui descritto è una tecnica semplice e poco costoso per il tracciamento sottopopolazioni specifiche di migrazione NCC provenienti da diverse regioni lungo l'asse rostro-caudale 21,67-69. Questa tecnica sfrutta la facilità di accesso alle embrioni di uccelli (rispetto a embrioni mammiferi) e possono essere combinati con altre tecniche, come l'ablazione del tessuto, l'iniezione di molecole inibitrici, manipolazione genetica ...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano i membri del laboratorio Lwigale per la critica del manoscritto. SLG è supportato da una Ruth L. Kirschstein NRSA Fellowship dal National Eye Institute (F32 EY02167301). PYL è supportato dal National Eye Institute (EY018050).
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente | Azienda | Numero di catalogo | |
| Chick uova | Various - usiamo Texas A & M University Poultry Science Department, TX. | ||
| Uova di quaglia | Various - usiamo Egg Ozarks Company, MO. | ||
| Egg incubatore (Digital Readout 1502 Sportsman Incubator w / Umidità 110-120 Volt AC) | www.poultrysupply.com | 1502 | |
| Dumont AA pinze, Inox con verniciatura epossidica | Strumenti di Scienza Fine | 11210-10 | |
| Nastro adesivo | Qualsiasi negozio di forniture per ufficio | ||
| Iris curvo pinza | Strumenti di Scienza Fine | 11065-07 | |
| Iondia inchiostro | Qualsiasi negozio di forniture per l'arte | ||
| Pen / Strep (penicillina, streptomicina) Soluzione | VWR International | 101447-068 | |
| Cancella nastro di imballaggio | Qualsiasi negozio di forniture per ufficio | ||
| Needle apparecchi tirando | Narashige, Giappone | PE-21 | |
| Aghi di vetro tirato, fatto 1,5-1,8 x 100mm tubo di vetro borosilicato capillare | Kimble chase | 34500 99 | |
| Tirato pipetta di vetro, realizzata da 5 ¾ "pipetta Pasteur | Fisher Scientific | 13-678-6A | |
| Apparecchi Mouth pipetta (tubo aspiratore per il montaggio calibrato pipetta microcapillare) | Sigma-Aldrich | A5177-52A | |
| Dumont # 5 pinze | Strumenti di Scienza Fine | 11251-30 | |
| Bottegsten filo, diametro 0,1 millimetri | VWR International | AA10404-H2 | |
| Porta aghi (nichelato titolare pin) | Strumenti di Scienza Fine | 26018-17 | |
| QCPN antisiero | Developmental Studies ibridomi Bank, University of Iowa | QCPN | |
| Alexa Fluor anticorpo secondario (per esempio, Alexa Fluor 594 capra anti-topo IgG1) | Invitrogen | A21125 | |
Soluzione di Ringer (2L):
| Tutti i reagenti da Fisher Scientific |
|
Riferimenti
- Le Douarin, G., Renaud, D. Morphologic and physiologic study of the differentiation in vitro of quail embryo precardial mesoderm. Bull. Biol. Fr. Belg. 103 (3), 453-468 (1969).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods. Mol. Biol. 461, 337-350 (2008).
- Le Douarin, N. A biological cell labeling technique and its use in expermental embryology. Dev. Biol. 30 (1), 217-222 (1973).
- Noden, D. M. An analysis of migratory behavior of avian cephalic neural crest cells. Dev. Biol. 42 (1), 106-130 (1975).
- Johnston, M. C. A radioautographic study of the migration and fate of cranial neural crest cells in the chick embryo. Anat. Rec. 156 (2), 143-155 (1966).
- Noden, D. M. The control of avian cephalic neural crest cytodifferentiation. I. Skeletal and connective tissues. Dev. Biol. 67 (2), 296-312 (1978).
- Oka, K. The role of TGF-beta signaling in regulating chondrogenesis and osteogenesis during mandibular development. Dev. Biol. 303 (1), 391-404 (2007).
- Chai, Y. Fate of the mammalian cranial neural crest during tooth and mandibular morphogenesis. Development. 127 (8), 1671-1679 (2000).
- Lengele, B., Schowing, J., Dhem, A. Embryonic origin and fate of chondroid tissue and secondary cartilages in the avian skull. Anat. Rec. 246 (3), 377-393 (1996).
- Le Douarin, N. M., Ziller, C., Couly, G. F. Patterning of neural crest derivatives in the avian embryo: in vivo and in vitro studies. Dev. Biol. 159 (1), 24-49 (1993).
- Lallier, T. E. Cell lineage and cell migration in the neural crest. Ann. N.Y. Acad. Sci. 615, 158-171 (1991).
- Nakamura, H. Mesenchymal derivatives from the neural crest. Arch. Histol. Jpn. 45 (2), 127-138 (1982).
- Le Lievre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. J. Embryol. Exp. Morphol. 34 (1), 125-154 (1975).
- Rawles, M. E. The Development of Melanophores from Embryonic Mouse Tissues Grown in the Coelom of Chick Embryos. Proc. Natl. Acad. Sci. U.S.A. 26 (12), 673-680 (1940).
- Rawles, M. E. The Pigment-Forming Potency of Early Chick Blastoderms. Proc. Natl. Acad. Sci. U.S.A. 26 (1), 86-94 (1940).
- Mosher, J. T. Intrinsic differences among spatially distinct neural crest stem cells in terms of migratory properties, fate determination, and ability to colonize the enteric nervous system. Dev. Biol. 303 (1), 1-15 (2007).
- Dupin, E., Le Douarin, N. M. Development of melanocyte precursors from the vertebrate neural crest. Oncogene. 22 (20), 3016-3023 (2003).
- Faraco, C. D., Vaz, S. A., Pastor, M. V., Erickson, C. A. Hyperpigmentation in the Silkie fowl correlates with abnormal migration of fate-restricted melanoblasts and loss of environmental barrier molecules. Dev. Dyn. 220 (3), 212-225 (2001).
- Selleck, M. A., Bronner-Fraser, M. Avian neural crest cell fate decisions: a diffusible signal mediates induction of neural crest by the ectoderm. Int. J. Dev. Neurosci. 18 (7), 621-627 (2000).
- Stocker, K. M., Sherman, L., Rees, S., Ciment, G. Basic FGF and TGF-beta 1 influence commitment to melanogenesis in neural crest-derived cells of avian embryos. Development. 111 (2), 635-645 (1991).
- Le Douarin, N. M., Teillet, M. A. Experimental analysis of the migration and differentiation of neuroblasts of the autonomic nervous system and of neurectodermal mesenchymal derivatives, using a biological cell marking technique. Dev. Biol. 41 (1), 162-184 (1974).
- Noden, D. M. The control of avian cephalic neural crest cytodifferentiation. II. Neural tissues. Dev. Biol. 67 (2), 313-329 (1978).
- Barraud, P. Neural crest origin of olfactory ensheathing glia. Proc. Natl. Acad. Sci. U.S.A. 107 (49), 21040-21045 (2010).
- Li, H. Y., Say, E. H., Zhou, X. F. Isolation and characterization of neural crest progenitors from adult dorsal root ganglia. Stem Cells. 25 (8), 2053-2065 (2007).
- Carney, T. J. A direct role for Sox10 in specification of neural crest-derived sensory neurons. Development. 133 (23), 4619-4630 (2006).
- Maro, G. S. Neural crest boundary cap cells constitute a source of neuronal and glial cells of the PNS. Nat. Neurosci. 7 (9), 930-938 (2004).
- Bronner-Fraser, M. Molecular analysis of neural crest formation. J. Physiol. Paris. 96 (1-2), 3-8 (2002).
- Paratore, C., Goerich, D. E., Suter, U., Wegner, M., Sommer, L. Survival and glial fate acquisition of neural crest cells are regulated by an interplay between the transcription factor Sox10 and extrinsic combinatorial signaling. Development. 128 (20), 3949-3961 (2001).
- Britsch, S. The transcription factor Sox10 is a key regulator of peripheral glial development. Genes Dev. 15 (1), 66-78 (2001).
- Bronner-Fraser, M. Origin of the avian neural crest. Stem Cells. 13 (6), 640-646 (1995).
- Jessen, K. R., Mirsky, R. Neural development. Fate diverted. Curr. Biol. 4 (9), 824-827 (1994).
- Le Douarin, N., Dulac, C., Dupin, E., Cameron-Curry, P. Glial cell lineages in the neural crest. Glia. 4 (2), 175-184 (1991).
- Chan, W. Y., Cheung, C. S., Yung, K. M., Copp, A. J. Cardiac neural crest of the mouse embryo: axial level of origin, migratory pathway and cell autonomy of the splotch (Sp2H) mutant effect. Development. 131 (14), 3367-3379 (2004).
- Bronner-Fraser, M. Segregation of cell lineage in the neural crest. Curr. Opin. Genet. Dev. 3 (4), 641-647 (1993).
- Peters-vander Sanden, M. J., Luider, T. M., vander Kamp, A. W., Tibboel, D., Meijers, C. Regional differences between various axial segments of the avian neural crest regarding the formation of enteric ganglia. Differentiation. 53 (1), 17-24 (1993).
- Kuratani, S., Bockman, D. E. Capacity of neural crest cells from various axial levels to participate in thymic development. Cell Tissue Res. 263 (1), 99-105 (1991).
- Leblanc, G. G., Epstein, M. L., Bronner-Fraser, M. E. Differential development of cholinergic neurons from cranial and trunk neural crest cells in vitro. 137 (2), 318-330 (1990).
- Golding, J. P., Trainor, P., Krumlauf, R., Gassmann, M. Defects in pathfinding by cranial neural crest cells in mice lacking the neuregulin receptor ErbB4. Nat. Cell. Biol. 2 (2), 103-109 (2000).
- Kulesa, P. M., Bailey, C. M., Kasemeier-Kulesa, J. C., McLennan, R. Cranial neural crest migration: new rules for an old road. Dev. Biol. 344 (2), 543-554 (2009).
- Lwigale, P. Y., Bronner-Fraser, M. Semaphorin3A/neuropilin-1 signaling acts as a molecular switch regulating neural crest migration during cornea development. Dev. Biol. 336 (2), 257-265 (2009).
- Killian, O. l. e. s. n. i. c. k. y., Birkholz, E. C., A, D., Artinger, K. B. A role for chemokine signaling in neural crest cell migration and craniofacial. Dev. Biol. 333 (1), 161-172 (2009).
- Gammill, L. S., Gonzalez, C., Bronner-Fraser, M. Neuropilin 2/semaphorin 3F signaling is essential for cranial neural crest migration and trigeminal ganglion condensation. Dev. Neurobiol. 67 (1), 47-56 (2007).
- Osborne, N. J., Begbie, J., Chilton, J. K., Schmidt, H., Eickholt, B. J. Semaphorin/neuropilin signaling influences the positioning of migratory neural crest cells within the hindbrain region of the chick. Dev. Dyn. 232 (4), 939-949 (2005).
- Kanzler, B., Foreman, R. K., Labosky, P. A., Mallo, M. BMP signaling is essential for development of skeletogenic and neurogenic cranial neural crest. Development. 127 (5), 1095-1104 (2000).
- Garcia-Lopez, R., Pombero, A., Martinez, S. Fate map of the chick embryo neural tube. Dev. Growth Differ. 51 (3), 145-165 (2009).
- Goldstein, A. M., Nagy, N. A bird's eye view of enteric nervous system development: lessons from the avian embryo. Pediatr. Res. 64 (4), 326-333 (2008).
- Le Douarin, N., Dieterlen-Lievre, F., Creuzet, S., Teillet, M. A. Quail-chick transplantations. Methods Cell. Biol. 87, 19-58 (2008).
- Wingate, R. J., Lumsden, A. Persistence of rhombomeric organisation in the postsegmental hindbrain. Development. 122 (7), 2143-2152 (1996).
- Karagenc, L., Sandikci, M. Tissue distribution of cells derived from the area opaca in heterospecific quail-chick blastodermal chimeras. J. Anat. 216 (1), 16-22 (2010).
- Teague, W. J., Jayanthi, N. V., Lear, P. V., Johnson, P. R. Foregut mesenchyme contributes cells to pancreatic acini during embryonic development in a chick-quail chimera model. Pediatr. Surg. Int. 21 (3), 138-142 (2005).
- Borue, X., Noden, D. M. Normal and aberrant craniofacial myogenesis by grafted trunk somitic and segmental plate mesoderm. Development. 131 (16), 3967-3980 (2004).
- He, L. Three different fates of cells migrating from somites into the limb bud. Anat. Embryol. (Berl). 207 (1), 29-34 (2003).
- Huang, R., Zhi, Q., Christ, B. The relationship between limb muscle and endothelial cells migrating from single somite. Anat. Embryol. (Berl). 206 (4), 283-289 (2003).
- Hidalgo-Sanchez, M., Simeone, A., Alvarado-Mallart, R. M. Fgf8 and Gbx2 induction concomitant with Otx2 repression is correlated with midbrain-hindbrain fate of caudal prosencephalon. Development. 126 (14), 3191-3203 (1999).
- Verberne, M. E., Gittenberger-de Groot, A. C., Poelmann, R. E. Lineage and development of the parasympathetic nervous system of the embryonic chick heart. Anat. Embryol. (Berl). 198 (3), 171-184 (1998).
- Burns, A. J., Douarin, N. M. The sacral neural crest contributes neurons and glia to the post-umbilical gut: spatiotemporal analysis of the development of the enteric nervous system. Development. 125 (21), 4335-4347 (1998).
- Debby-Brafman, A., Burstyn-Cohen, T., Klar, A., Kalcheim, C. F-Spondin, expressed in somite regions avoided by neural crest cells, mediates inhibition of distinct somite domains to neural crest migration. Neuron. 22 (3), 475-488 (1999).
- Lwigale, P. Y., Bronner-Fraser, M. Lens-derived Semaphorin3A regulates sensory innervation of the cornea. Dev. Biol. 306 (2), 750-759 (2007).
- Nakamura, H., Funahashi, J. Introduction of DNA into chick embryos by in ovo electroporation. Methods. 24 (1), 43-48 (2001).
- Chen, Y. X., Krull, C. E., Reneker, L. W. Targeted gene expression in the chicken eye by in ovo electroporation. Mol. Vis. 10, 874-883 (2004).
- Sato, F., Nakagawa, T., Ito, M., Kitagawa, Y., Hattori, M. A. Application of RNA interference to chicken embryos using small interfering RNA. J. Exp. Zool. A. Comp. Exp. Biol. 301 (10), 820-827 (2004).
- Lwigale, P. Y., Schneider, R. A. Other chimeras: quail-duck and mouse-chick. Methods Cell. Biol. 87, 59-74 (2008).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev. Dyn. 195 (4), 231-272 (1992).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bull. World Health Organ. 32 (1), 143-144 (1965).
- Le Douarin, N. M. A Feulgen-positive nucleolus. Exp. Cell. Res. 77 (1), 459-468 (1973).
- Feulgen, R., Rossenbeck, H. Mikroskopisch-chemischer Nachweis einer Nucleinsaure vom typus der Thymonucleinsiiure und die darauf beruhende elektive Faibung von Zellkemen in mikroskopischen Praparaten. Hoppe-Seyler's Z. Physiol. Chem. 135, 203-252 (1924).
- Lwigale, P. Y., Conrad, G. W., Bronner-Fraser, M. Graded potential of neural crest to form cornea, sensory neurons and cartilage along the rostrocaudal axis. Development. 131 (9), 1979-1991 (2004).
- Weston, J. A. A radioautographic analysis of the migration and localization of trunk neural crest cells in the chick. Dev. Biol. 6, 279-310 (1963).
- Le Douarin, N. M., Kalcheim, C. . The Neural Crest. , (2009).
- Le Douarin, N. M., Teillet, M. A. The migration of neural crest cells to the wall of the digestive tract in avian embryo. J. Embryol. Exp. Morphol. 30 (1), 31-48 (1973).
- Douarin, N. M. L. e., Jotereau, F. V. Tracing of cells of the avian thymus through embryonic life in interspecific chimeras. J. Exp. Med. 142 (1), 17-40 (1975).
- Le Douarin, N. M., Renaud, D., Teillet, M. A., Le Douarin, G. H. Cholinergic differentiation of presumptive adrenergic neuroblasts in interspecific chimeras after heterotopic transplantations. Proc. Natl. Acad. Sci. U. S. A. 72 (2), 728-732 (1975).
- Houssaint, E., Belo, M., Le Douarin, N. M. Investigations on cell lineage and tissue interactions in the developing bursa of Fabricius through interspecific chimeras. Dev. Biol. 53 (2), 250-264 (1976).
- Le Douarin, N. M., Jotereau, F. V., Houssaint, E., Belo, M. Ontogeny of the avian thymus and bursa of Fabricius studied in interspecific chimeras. Ann. Immunol. (Paris). 127 (6), 849-856 (1976).
- Fontaine, J., Le Douarin, N. M. Analysis of endoderm formation in the avian blastoderm by the use of quail-chick chimaeras. The problem of the neurectodermal origin of the cells of the APUD series. J. Embryol. Exp. Morphol. 41, 209-222 (1977).
- Narayanan, C. H., Narayanan, Y. On the origin of the ciliary ganglion in birds studied by the method of interspecific transplantation of embryonic brain regions between quail and chick. J. Embryol. Exp. Morphol. 47, 137-148 (1978).
- Lwigale, P. Y., Cressy, P. A., Bronner-Fraser, M. Corneal keratocytes retain neural crest progenitor cell properties. Dev. Biol. 288 (1), 284-293 (2005).
- Lwigale, P. Y. Embryonic origin of avian corneal sensory nerves. Dev. Biol. 239 (2), 323-337 (2001).
- Tanaka, H., Kinutani, M., Agata, A., Takashima, Y., Obata, K. Pathfinding during spinal tract formation in the chick-quail chimera analysed by species-specific monoclonal antibodies. Development. 110 (2), 565-571 (1990).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon