Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Анализ нейронной миграции Крест и дифференциация по межвидовой трансплантации
В этой статье
Резюме
Подход к анализу миграции и в конечном итоге судьба птичьего клеток нервного гребня в перепелиных-химерных эмбрионов куриных описано. Этот метод является простым и техника для отслеживания клеток нервного гребня во время миграции и дифференциации, которые иначе трудно различить в unmanipulated куриного эмбриона.
Аннотация
Avian embryos provide a unique platform for studying many vertebrate developmental processes, due to the easy access of the embryos within the egg. Chimeric avian embryos, in which quail donor tissue is transplanted into a chick embryo in ovo, combine the power of indelible genetic labeling of cell populations with the ease of manipulation presented by the avian embryo.
Quail-chick chimeras are a classical tool for tracing migratory neural crest cells (NCCs)1-3. NCCs are a transient migratory population of cells in the embryo, which originate in the dorsal region of the developing neural tube4. They undergo an epithelial to mesenchymal transition and subsequently migrate to other regions of the embryo, where they differentiate into various cell types including cartilage5-13, melanocytes11,14-20, neurons and glia21-32. NCCs are multipotent, and their ultimate fate is influenced by 1) the region of the neural tube in which they originate along the rostro-caudal axis of the embryo11,33-37, 2) signals from neighboring cells as they migrate38-44, and 3) the microenvironment of their ultimate destination within the embryo45,46. Tracing these cells from their point of origin at the neural tube, to their final position and fate within the embryo, provides important insight into the developmental processes that regulate patterning and organogenesis.
Transplantation of complementary regions of donor neural tube (homotopic grafting) or different regions of donor neural tube (heterotopic grafting) can reveal differences in pre-specification of NCCs along the rostro-caudal axis2,47. This technique can be further adapted to transplant a unilateral compartment of the neural tube, such that one side is derived from donor tissue, and the contralateral side remains unperturbed in the host embryo, yielding an internal control within the same sample2,47. It can also be adapted for transplantation of brain segments in later embryos, after HH10, when the anterior neural tube has closed47.
Here we report techniques for generating quail-chick chimeras via neural tube transplantation, which allow for tracing of migratory NCCs derived from a discrete segment of the neural tube. Species-specific labeling of the donor-derived cells with the quail-specific QCPN antibody48-56 allows the researcher to distinguish donor and host cells at the experimental end point. This technique is straightforward, inexpensive, and has many applications, including fate-mapping, cell lineage tracing, and identifying pre-patterning events along the rostro-caudal axis45. Because of the ease of access to the avian embryo, the quail-chick graft technique may be combined with other manipulations, including but not limited to lens ablation40, injection of inhibitory molecules57,58, or genetic manipulation via electroporation of expression plasmids59-61, to identify the response of particular migratory streams of NCCs to perturbations in the embryo's developmental program. Furthermore, this grafting technique may also be used to generate other interspecific chimeric embryos such as quail-duck chimeras to study NCC contribution to craniofacial morphogenesis, or mouse-chick chimeras to combine the power of mouse genetics with the ease of manipulation of the avian embryo.62
протокол
1. Инкубируйте куриных и перепелиных яиц желаемый этап
Для HH9 эмбрионов, типичное время инкубации составляет от 29-33 часов при 38 ° C. 63
- Смойте остатки из яиц с теплой водой.
- Упорядочить куриные яйца на подносе по горизонтали. Отметить вверх с карандашом, это будет соответствовать той области, где эмбрион будет локализована. Инкубировать перепелиные яйца тупым концом вверх.
- Место в 38 ° C увлажненном инкубаторе. Включите функцию качания.
2. Подготовка яиц для окон и вскрытия
- Удалите яйца из инкубатора, и стерилизовать вершины с 70% этанола. Лучше всего распылять на этанол и стереть ее быстро с бумажным полотенцем или Kimwipe, чтобы избежать поглощения этанола через яичную скорлупу.
- Место куриные яйца на отдельный держатель яйцо (мы используем чашке Петри выстроились со сложенными бумажные полотенца, например, "Kimwipes"). Используя щипцы А.А., нажмите небольшой холе на верхней поверхности скорлупы на остром конце яйца.
- Удалить 3 мл 1,5 света альбумина с куриное яйцо с 18 ½ G иглой подкожно и 5 мл шприц. Лучше всего вставить иглу вертикально в отверстие с конической перед заостренный конец яйца (рис. 2A). Таким образом, когда альбумина сняты, есть небольшой риск случайно повредить желток с помощью всасывания. Откажитесь от альбумина. Этот шаг позволит снизить желток и зародыш в яйце, чтобы обеспечить окно будет открыто в яичной скорлупе.
- Протрите отверстие с 70% этанолом, как описано выше и скрепите скотчем. Важно, что яичная скорлупа окружающих отверстие полностью лишена альбумина и сухой или клей не запечатать.
- С щипцы А.А., нажмите еще одну дыру в отмеченной верхней поверхности горизонтальной яйца, не совсем на вершине. Будьте осторожны, чтобы не допустить щипцы заходить слишком далеко через яичную скорлупу, чтобы не повредить желток или эмбриона.
- ВСерт одной стороны изогнутый пинцет ирис в отверстие параллельно яиц. Сжатие вниз на корпусе, работающий в круговое движение, чтобы сломать ~ 2 см в диаметре окна в оболочке яйца куриные. Отменить удалить скорлупу. Кроме того, покрытие верхней поверхности яйца с упаковочной ленты и использовать ножницы, чтобы вырезать окно. Это сводит к минимуму вероятность падения обломков скорлупы в яйце. Эмбрион должен появиться как непрозрачный диск на верхней части желтка. Откажитесь от любого неоплодотворенных яиц (определенные небольшие белые пятна на поверхности желтка или отсутствие бластодерма).
- Вводите небольшое количество тушь (разбавленный 1:10 в стерильного раствора Рингера, содержащие "Pen / Strep" антибиотик: конечная концентрация 100 мкг / мл пенициллина и 100 мкг / мл стрептомицина) под бластодерма для оказания помощи в постановке эмбриона. Используйте 1 мл шприц и 26 ½ G шприц, согнувшись в 45 ° у основания иглы, с конической вверх, наоборот, одна маУ использовать вытащил стекло пипеткой Пастера и рот пипеткой аппарата (надевайте защитные очки при изгибе шприц или игла разбитого стекла). Прокол мембраны желток за пределами периметра бластодерма и вставьте кончик иглы под эмбриона, близких к поверхности желтка, но не в зародышевых листков (рис. 2В). Вводите достаточно чернил, чтобы наметить эмбриона, затем осторожно снять иглу (рис. 2). Потребители инъекционных слишком много чернил может привести к смерти эмбриона. Важно, чтобы не вводить любые воздушные пузыри под эмбриона, так как это может быть источником заражения. Примечание: Все решения Рингера, используемых в этой процедуре стерилизации и содержит Pen / Острый, как указано выше. Стерильный фосфатный буферный раствор (PBS) также является приемлемой альтернативой раствор Рингера на всех этапах этого протокола.
- Этап эмбриона в соответствии с Гамбургер и Гамильтон 63 и записать сцену на яичной скорлупы в несмываемыми чернилами или карандашом. Этапы лучше всего оценивать по стерomicroscopy с волоконно-оптической "гусиная шея" источников света, которые имеют ограниченный тепловой нагрузки.
- Нанесите 2-3 капли теплого стерильного решение Рингера на поверхности эмбриона, чтобы избежать обезвоживания и загрязнения. Временное уплотнение окна с парафильмом растягивается по поверхности яйца.
- Повторите шаги 2.2-2.9 со всеми куриных яиц перед началом пересадки экспериментов.
- С перепелиным эмбрионов будут использованы только для донорских тканей, в ово шаги 2.2-2.9 может быть опущен. Для бывших ово подготовки доноров эмбрионов, перепелиные яйца инкубируют тупой стороной вверх и открыл в этом регионе с изогнутыми щипцами выявить эмбрион. Использование рассечение ножницами, сделать четыре сокращений в форме квадрата через мембрану желточного и бластодерма вне эмбриона (убедитесь, что все сокращения встречаются). Использование изогнутых щипцов ириса, нежно схватить одного разреза края и поднять эмбриона из яйцеклетки и перенести его на Рингера раствор в чашке Петри. Кроме того, можно использовать кривуюг ириса щипцы для снятия вырезали зародыш снизу, или эмбрион ложкой или пластмассовой пипетки передачи прорубить широкую часть цилиндра, могут быть использованы для передачи эмбриона из яйцеклетки. Аккуратно снимите желточной мембраны с 5 щипцы. Соберите оставшиеся эмбрионы перепела, как указано выше, и поставить их под микроскоп рассечения.
3. Подготовка принимающей эмбриона для получения трансплантата
- Удалить парафильмом от хозяина (куриного) эмбриона и использование заостренной иглы вольфрама или 5 щипцы, рвать небольшое отверстие в мембране желточной в нужной области нервной трубки (рис. 3А).
- Добавить каплю раствора Рингера в зародыше. Позаботьтесь, чтобы сохранить эмбрион полностью погружен в раствор Рингера в течение всей процедуры, чтобы предотвратить обезвоживание тканей. Продолжайте добавлять капли раствора Рингера на поверхности эмбриона путем передачи пипетки, если необходимо.
- Использование стекла вытащил иглу, осторожно сделать ростральной и околоudal поперечные разрезы, соответствующей длине и область интереса в спинной нервной трубки. (Вытащил иглы стекла формируются из кремния стеклянные капилляры, которые были выведены под воздействием высокой температуры с помощью иглы тянуть аппарат.) Для одностороннего трансплантатов разрезы должны распространяться лишь на просвет спинной нервной трубки, так и для двусторонних трансплантатов, сделать надрезы по всей весь спинной нервной трубки. Затем вырежьте на двусторонней основе между спинной нервной трубки и параксиальной мезодермы.
- Аккуратно отделить вырезали эксплантов из нервной трубки, то удалить его из эмбриона аспирационных в стакан микропипетки (рис. 3В).
4. Подготовка донорской ткани трансплантата
- Выберите стадии соответствует перепелов эмбриона. Держите эмбриона вниз щипцами А.А., удалить желточной оболочки, а также акцизные аналогичного размера области нервной трубки, как описано выше (3,3-3,4) (рис. 3A'-B). В зависимости от потребностей эксперимента, эта область может бытьдополнительные области узла (цыпленок) нервной трубки или из другого региона по-ростро хвостовой оси. (Примечание: для более крупных региональных прививок, в том числе полное нейронных трансплантатов трубки, исследователи, возможно, пожелают добавить протеазы пищеварения на этот шаг, чтобы удалить любой приверженец мезенхимальных тканей от донора ткани до трансплантации, однако, для малых спинной нервный трансплантат трубки на ранних стадиях. , как описанные здесь, протеазы пищеварение не нужно, как нервная трубка легко отделяется от соседних мезенхимы строго хирургических методов.)
5. Graft ткани
- Аспирируйте доноров эксплантов в стеклянной пипетки с раствором Рингера. Будьте осторожны, чтобы не вводить никаких пузырьков в пипетку.
- Передача эксплантов, прилегающих к вырезали области куриных хозяина. Использование стекла вытащил иглу, ориентироваться эксплантов и осторожно направлять его в удаленной области (рис. 3).
- Осторожно добавьте несколько капель раствора Рингерана эмбрион, чтобы предотвратить обезвоживание. Будьте осторожны, чтобы не уронить жидкость непосредственно на трансплантат сайта, поскольку это может выбить трансплантата.
- Закройте окно с упаковочной лентой. Убедитесь, что лента уплотнения всей области оконного яйца. Это предотвращает обезвоживание и загрязнение зародыша во время последующей инкубации.
- Вернуться яйцо в инкубатор до нужной стадии. Убедитесь, что "качалка" функция отключена при инкубации химеры. Яйца могут быть слегка повернут на руки два раза в день, поскольку это может увеличить свою жизнеспособность, если более поздних стадиях развития ориентированы.
6. Подготовить химерных эмбрионов для секционирования
- В экспериментальных конечную точку, отрезать ленту, закрывающую окно с помощью тонких ножниц.
- Возьмитесь за край бластодерма с изогнутым пинцетом диафрагмы (проще всего сделать с зубчатыми советов), а затем вырезать эмбриона от желтка с 4 больших сокращений за пределами бластодерма.
- Передача эмбриона к чашке Петри с раствором Рингера. Позаботьтесь, чтобы минимизировать воздействие на эмбрион в воздух для того, чтобы избежать обезвоживания тканей.
- Под стереомикроскопия, осторожно отделить желточной оболочки с использованием бластодерма # 5 щипцы.
- Тщательно организовать эмбриона в блюдо так, что эмбрион в ту же ориентацию, как это было в яйце, с окружающими мембраны изложены квартире.
- Используйте рассечения иглы из 64 вольфрамовых проводов начисто удалить окружающих бластодерма из эмбриона путем организации иглу на границе зародыш и внеэмбриональной ткани, длиной параллельного вольфрамовой проволоки на дно тарелки. Используйте нежное движение пиления, чтобы прорваться через ткань.
- Осторожно снимите амнион с 5 щипцы. В этот момент вы можете, хотите или дальнейшего анализировать область ваших интересов, или оставить эмбрион целом.
- Передача эмбриона ледяной 4% парафиновойormaldehyde и рок ночи при 4 ° C.
- Подготовка образцов и вставлять для секционирования крио-или парафин.
Проследите пересаженной ткани в принимающей эмбриона. Есть несколько методов для определения перепелов в ткани куриного эмбриона, в том числе выявление перепела ядрышки окрашиванием гематоксилином (перепел ядра имеют очень большие, темные окрашивание включений, чем куриных зародышей), Фельгена-Rossenbeck реакции, акридиновым-оранжевым или бизнес-бензамид пятно в сочетании с электронной микроскопией, или immunolabeling для перепелов антигенов 3,47,65,66. Здесь мы используем антиген QCPN и стандартные целом монтажа или раздел иммунофлюоресценции методы для определения перепелиных клеток нервного гребня в перепелиных-птенец химеры (рис. 4). Эта технология обеспечивает максимальную гибкость в опытно-конструкторских, а иммунофлюоресценции QCPN также может быть объединена с другими антителами для определения дифференцированных клеток, полученных от донора (перепел) тканей. Используйте Standaго целого монтажа или методы иммунофлюоресценции разделе для обозначения перепелиных клеток, полученных в химеры.
7. Представитель Результаты
Представитель образ привиты области нервной трубки после 6ч повторной инкубации (в HH11) показывает, ожидается включение привитых доноров (перепел) ткани в хост (цыпленок) нервной трубки (рис. 4а). Эмбрионы показывает неполной интеграции трансплантата, или асимметричным развитием черепной или сомитов после reincubation должен быть уничтожен.
Поперечное сечение через привитые области на HH11 шоу НКЦ меченных HNK-1 миграции сбоку от нервной трубки. Перепела клетки способствуют NCC миграционных потоков, а также нервной трубки, четко обозначены с QCPN (рис. 4В).
На более поздних стадиях, перепелиные NCC-клеток, полученных можно проследить до их окончательного ткани цели. QCPN меченых клеток перемежаются в мезенхимы куриного эмбрионаверхнечелюстной процесса в E5 (рис. 4С).
Антитела QCPN можно легко комбинировать с другими антителами для изучения дифференциации перепела производных НКЦ в принимающей среде. Перепела NCC-производных тройничного сенсорных нейронов помечены QCPN и Tuj1 антител (Рис. 4D).
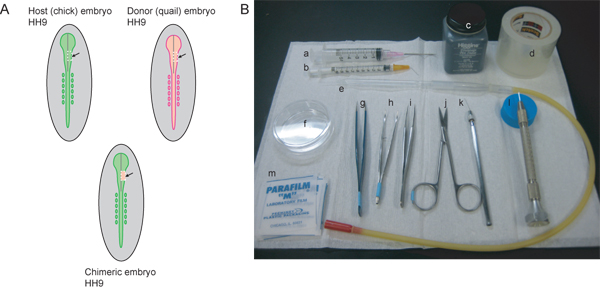
Рисунок 1. Обзор экспериментальной процедуры и необходимые инструменты.) Host (куриных) и доноров (перепел) эмбрионы должны быть этапе совпадают. Чтобы пометить поток NCC, которая способствует тройничный ганглий и челюстно-нижнечелюстной области, HH9 идеально. В HH9, нервная трубка начинает закрываться в ростральной области, но еще не полностью решена. Серая линия на графиках представляет средней линии закрытия нервной трубки. Пунктирные белые линии указывают на сокращение линии для вырезания области мозга с правой стороны нервной трубки от хозяина и донора етbryos. Исключены регионе принимающей зародыш удаляют, а пересадить донорские ткани для создания в химерных эмбрионов. Б) Необходимые документы: а) 5 мл шприц с 18 ½ G шприц, б) 1 мл шприц с 26 ½ G шприц изогнутый под углом 45 °, в) тушью, г) ясно упаковочную ленту, е), стеклянной пипетки ртом пипетки аппарата, е) 60 мм-Петри, г) А. А. щипцы, ч) изогнутый пинцет ирис с зубчатыми советы, я) # 5 щипцы, у) декоративные ножницы, к), заостренные вольфрамовой проволоки, л) вытащил стекло иглой, м) парафильмом квадратов.
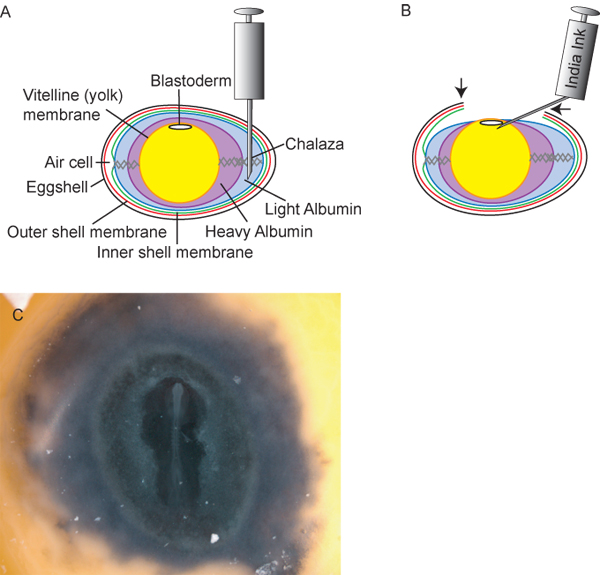
Рисунок 2. Подготовка яиц и эмбрионов.) Поперечного сечения диаграммы яйцо, в том числе идеальная точка вставки 18 ½ G шприц для вывода легких альбумина. Б) После снятия ~ 3 мл света альбумин, желток и зародыш снижает внутри яйца, позволяя исследователям сократить «окно» (стрелки) в тОн яичной скорлупы для доступа к эмбриону. Тушь, разбавленное 1:10 в стерильного раствора Рингера, может быть введен под бластодерма обеспечить контраст для удобства постановки эмбрионов. C) куриного эмбриона после красочного.
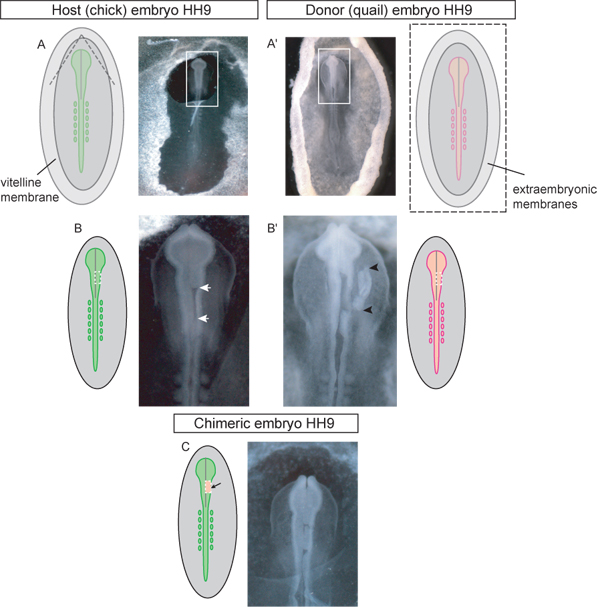
Рисунок 3. Схема и примеры HH этап 9 донора и реципиента эмбрионов на каждом этапе процедуры пересадки.) Chick хозяин эмбриона. Пунктирные линии на диаграмме указано, где желточной оболочки должны быть разорваны на доступ к черепной части для пересадки. Когда разрывается треугольный лоскут желточной оболочки должны быть очищены каудально. Box в изображении указывает вставка используется в (ВС). ») Перепела доноров эмбрионов. Изображение донорского эмбриона вырезали из яйца и помещают в чашку Петри для рассечения тканей трансплантата. Box в изображении указывает вставка используется в (B). Пунктирные линии на схеме (А ') указывают, где желточного и желток мембраны должны быть сокращены для того, чтобы удалить тОн эмбриона из яйцеклетки. B) Host эмбрион с односторонним области мозга нервной трубки вырезают (белые стрелки) ожидает трансплантата. Пунктирная линия на схеме показывает, где сокращения должны быть направлены на акцизные нервной трубки в среднем мозге региона. ) B 'доноров эмбрионов с спинной нервной ткани трансплантата трубки вырезают (трансплантат тканей показано черными стрелками). Пунктирная линия на рисунке показывает, где сокращения должны быть сделаны в перепелиных эмбрионов акцизными тканей донора для одностороннего прививки мозга области нервной трубки. C) химерические эмбрионов после пересадки спинного перепела нейронных эксплантов трубки в области среднего мозга цыпленка.
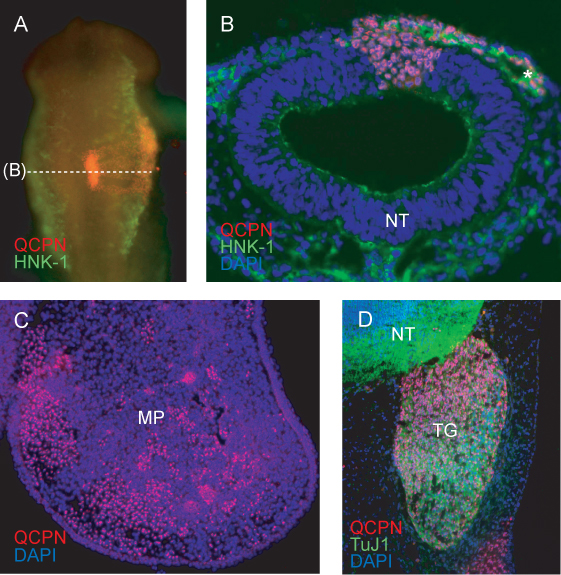
Рисунок 4. Иммунофлуоресценции обнаружения перепела конкретных ядерных QCPN антигена донора клеток, полученных в химерных эмбрионов.) Всего монтажа изображения HH11 химера (привитые на HH9) с указанием QCPN окрашивание в красный и HNK-1 окрашивания (маркер миграции НКЦ) взеленый. 10х увеличение, вид сверху. Б) Сечение через эмбриона в (A), показывая QCPN-положительных перепелов, полученных клеток в нервной трубки и миграционных NCC совместно окрашивали HNK-1 (зеленый). 40-кратном увеличении. C) поперечное сечение верхней челюсти процесс E5 химера (инкубируют в течение 3 дней после трансплантата), показывая QCPN-положительных NCC-клеток, полученных (красный), которые мигрировали из привитых области нервной трубки до их окончательного места в зародыше. 10-кратным увеличением. D) Раздел через E5 химера показывающие вклад перепелов, полученных НКК тройничный ганглий (красный) и дифференциации в TuJ1-позитивных нейронов (зеленый). 40-кратном увеличении. * НКЦ, депутат, верхнечелюстной процесса; NT, нервная трубка, ТГ, тройничный ганглий.
Обсуждение
Прививки перепела нервной трубки эмбриона в принимающей куриных описанный здесь простой и недорогой способ для отслеживания конкретных субпопуляций мигрирующих НКЦ, исходящие из разных регионов по-ростро хвостовой оси 21,67-69. Эта техника использует легкость доступа к птичьему э...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы выражают благодарность членам Lwigale лаборатории критику рукописи. SLG поддерживается Рут Л. Kirschstein НРСА стипендии от Национального института глаза (F32 EY02167301). Пыл при поддержке Национального института глаза (EY018050).
Материалы
| Name | Company | Catalog Number | Comments |
| Реагент | Компания | Номер в каталоге | |
| Чик яйца | Различные - мы используем Техас & M университета Кафедра птицы, штат Техас. | ||
| Перепелиные яйца | Различные - мы используем Ozarks Яйцо компании, МО. | ||
| Яйцо инкубатор (цифровой дисплей 1502 Спортсмен инкубатор ж / Влажность 110-120 вольт переменного тока) | www.poultrysupply.com | 1502 | |
| Дюмон А.А. щипцы, нержавеющей стали с эпоксидным покрытием | Изобразительных средств наук | 11210-10 | |
| Скотч | Любой магазин канцелярских товаров | ||
| Изогнутые щипцы Iris | Изобразительных средств наук | 11065-07 | |
| Яndia чернила | Любой магазин художественных изделий | ||
| Pen / Strep (пенициллин, стрептомицин) решение | VWR International | 101447-068 | |
| Очистить Упаковочная лента | Любой магазин канцелярских товаров | ||
| Иглы потянув аппарат | Narashige, Япония | ПЭ-21 | |
| Тянут стекло иглой, из 1,5-1,8 х 100 мм боросиликатного стекла капилляра | Кимбл погони | 34500 99 | |
| Тянут стеклянную пипетку, из 5 ¾ "пипетки Пастера | Fisher Scientific | 13-678-6A | |
| Рот пипетки аппарата (аспиратор трубкой для калиброванного микрокапиллярных пипетки) | Sigma-Aldrich | A5177-52А | |
| Дюмон # 5 щипцы | Изобразительных средств наук | 11251-30 | |
| Тунgsten проволоки, диаметром 0,1 мм | VWR International | AA10404-H2 | |
| Иглодержатели (никелированная контактный держатель) | Изобразительных средств наук | 26018-17 | |
| QCPN антисыворотки | Развития исследований Hybridoma банк, Университет штата Айова | QCPN | |
| Alexa Fluor вторичные антитела (например, Alexa Fluor 594 антимышиного IgG1) | Invitrogen | A21125 | |
Рингера раствор (2 л):
| Все реагенты от Fisher Scientific |
|
Ссылки
- Le Douarin, G., Renaud, D. Morphologic and physiologic study of the differentiation in vitro of quail embryo precardial mesoderm. Bull. Biol. Fr. Belg. 103 (3), 453-468 (1969).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods. Mol. Biol. 461, 337-350 (2008).
- Le Douarin, N. A biological cell labeling technique and its use in expermental embryology. Dev. Biol. 30 (1), 217-222 (1973).
- Noden, D. M. An analysis of migratory behavior of avian cephalic neural crest cells. Dev. Biol. 42 (1), 106-130 (1975).
- Johnston, M. C. A radioautographic study of the migration and fate of cranial neural crest cells in the chick embryo. Anat. Rec. 156 (2), 143-155 (1966).
- Noden, D. M. The control of avian cephalic neural crest cytodifferentiation. I. Skeletal and connective tissues. Dev. Biol. 67 (2), 296-312 (1978).
- Oka, K. The role of TGF-beta signaling in regulating chondrogenesis and osteogenesis during mandibular development. Dev. Biol. 303 (1), 391-404 (2007).
- Chai, Y. Fate of the mammalian cranial neural crest during tooth and mandibular morphogenesis. Development. 127 (8), 1671-1679 (2000).
- Lengele, B., Schowing, J., Dhem, A. Embryonic origin and fate of chondroid tissue and secondary cartilages in the avian skull. Anat. Rec. 246 (3), 377-393 (1996).
- Le Douarin, N. M., Ziller, C., Couly, G. F. Patterning of neural crest derivatives in the avian embryo: in vivo and in vitro studies. Dev. Biol. 159 (1), 24-49 (1993).
- Lallier, T. E. Cell lineage and cell migration in the neural crest. Ann. N.Y. Acad. Sci. 615, 158-171 (1991).
- Nakamura, H. Mesenchymal derivatives from the neural crest. Arch. Histol. Jpn. 45 (2), 127-138 (1982).
- Le Lievre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. J. Embryol. Exp. Morphol. 34 (1), 125-154 (1975).
- Rawles, M. E. The Development of Melanophores from Embryonic Mouse Tissues Grown in the Coelom of Chick Embryos. Proc. Natl. Acad. Sci. U.S.A. 26 (12), 673-680 (1940).
- Rawles, M. E. The Pigment-Forming Potency of Early Chick Blastoderms. Proc. Natl. Acad. Sci. U.S.A. 26 (1), 86-94 (1940).
- Mosher, J. T. Intrinsic differences among spatially distinct neural crest stem cells in terms of migratory properties, fate determination, and ability to colonize the enteric nervous system. Dev. Biol. 303 (1), 1-15 (2007).
- Dupin, E., Le Douarin, N. M. Development of melanocyte precursors from the vertebrate neural crest. Oncogene. 22 (20), 3016-3023 (2003).
- Faraco, C. D., Vaz, S. A., Pastor, M. V., Erickson, C. A. Hyperpigmentation in the Silkie fowl correlates with abnormal migration of fate-restricted melanoblasts and loss of environmental barrier molecules. Dev. Dyn. 220 (3), 212-225 (2001).
- Selleck, M. A., Bronner-Fraser, M. Avian neural crest cell fate decisions: a diffusible signal mediates induction of neural crest by the ectoderm. Int. J. Dev. Neurosci. 18 (7), 621-627 (2000).
- Stocker, K. M., Sherman, L., Rees, S., Ciment, G. Basic FGF and TGF-beta 1 influence commitment to melanogenesis in neural crest-derived cells of avian embryos. Development. 111 (2), 635-645 (1991).
- Le Douarin, N. M., Teillet, M. A. Experimental analysis of the migration and differentiation of neuroblasts of the autonomic nervous system and of neurectodermal mesenchymal derivatives, using a biological cell marking technique. Dev. Biol. 41 (1), 162-184 (1974).
- Noden, D. M. The control of avian cephalic neural crest cytodifferentiation. II. Neural tissues. Dev. Biol. 67 (2), 313-329 (1978).
- Barraud, P. Neural crest origin of olfactory ensheathing glia. Proc. Natl. Acad. Sci. U.S.A. 107 (49), 21040-21045 (2010).
- Li, H. Y., Say, E. H., Zhou, X. F. Isolation and characterization of neural crest progenitors from adult dorsal root ganglia. Stem Cells. 25 (8), 2053-2065 (2007).
- Carney, T. J. A direct role for Sox10 in specification of neural crest-derived sensory neurons. Development. 133 (23), 4619-4630 (2006).
- Maro, G. S. Neural crest boundary cap cells constitute a source of neuronal and glial cells of the PNS. Nat. Neurosci. 7 (9), 930-938 (2004).
- Bronner-Fraser, M. Molecular analysis of neural crest formation. J. Physiol. Paris. 96 (1-2), 3-8 (2002).
- Paratore, C., Goerich, D. E., Suter, U., Wegner, M., Sommer, L. Survival and glial fate acquisition of neural crest cells are regulated by an interplay between the transcription factor Sox10 and extrinsic combinatorial signaling. Development. 128 (20), 3949-3961 (2001).
- Britsch, S. The transcription factor Sox10 is a key regulator of peripheral glial development. Genes Dev. 15 (1), 66-78 (2001).
- Bronner-Fraser, M. Origin of the avian neural crest. Stem Cells. 13 (6), 640-646 (1995).
- Jessen, K. R., Mirsky, R. Neural development. Fate diverted. Curr. Biol. 4 (9), 824-827 (1994).
- Le Douarin, N., Dulac, C., Dupin, E., Cameron-Curry, P. Glial cell lineages in the neural crest. Glia. 4 (2), 175-184 (1991).
- Chan, W. Y., Cheung, C. S., Yung, K. M., Copp, A. J. Cardiac neural crest of the mouse embryo: axial level of origin, migratory pathway and cell autonomy of the splotch (Sp2H) mutant effect. Development. 131 (14), 3367-3379 (2004).
- Bronner-Fraser, M. Segregation of cell lineage in the neural crest. Curr. Opin. Genet. Dev. 3 (4), 641-647 (1993).
- Peters-vander Sanden, M. J., Luider, T. M., vander Kamp, A. W., Tibboel, D., Meijers, C. Regional differences between various axial segments of the avian neural crest regarding the formation of enteric ganglia. Differentiation. 53 (1), 17-24 (1993).
- Kuratani, S., Bockman, D. E. Capacity of neural crest cells from various axial levels to participate in thymic development. Cell Tissue Res. 263 (1), 99-105 (1991).
- Leblanc, G. G., Epstein, M. L., Bronner-Fraser, M. E. Differential development of cholinergic neurons from cranial and trunk neural crest cells in vitro. 137 (2), 318-330 (1990).
- Golding, J. P., Trainor, P., Krumlauf, R., Gassmann, M. Defects in pathfinding by cranial neural crest cells in mice lacking the neuregulin receptor ErbB4. Nat. Cell. Biol. 2 (2), 103-109 (2000).
- Kulesa, P. M., Bailey, C. M., Kasemeier-Kulesa, J. C., McLennan, R. Cranial neural crest migration: new rules for an old road. Dev. Biol. 344 (2), 543-554 (2009).
- Lwigale, P. Y., Bronner-Fraser, M. Semaphorin3A/neuropilin-1 signaling acts as a molecular switch regulating neural crest migration during cornea development. Dev. Biol. 336 (2), 257-265 (2009).
- Killian, O. l. e. s. n. i. c. k. y., Birkholz, E. C., A, D., Artinger, K. B. A role for chemokine signaling in neural crest cell migration and craniofacial. Dev. Biol. 333 (1), 161-172 (2009).
- Gammill, L. S., Gonzalez, C., Bronner-Fraser, M. Neuropilin 2/semaphorin 3F signaling is essential for cranial neural crest migration and trigeminal ganglion condensation. Dev. Neurobiol. 67 (1), 47-56 (2007).
- Osborne, N. J., Begbie, J., Chilton, J. K., Schmidt, H., Eickholt, B. J. Semaphorin/neuropilin signaling influences the positioning of migratory neural crest cells within the hindbrain region of the chick. Dev. Dyn. 232 (4), 939-949 (2005).
- Kanzler, B., Foreman, R. K., Labosky, P. A., Mallo, M. BMP signaling is essential for development of skeletogenic and neurogenic cranial neural crest. Development. 127 (5), 1095-1104 (2000).
- Garcia-Lopez, R., Pombero, A., Martinez, S. Fate map of the chick embryo neural tube. Dev. Growth Differ. 51 (3), 145-165 (2009).
- Goldstein, A. M., Nagy, N. A bird's eye view of enteric nervous system development: lessons from the avian embryo. Pediatr. Res. 64 (4), 326-333 (2008).
- Le Douarin, N., Dieterlen-Lievre, F., Creuzet, S., Teillet, M. A. Quail-chick transplantations. Methods Cell. Biol. 87, 19-58 (2008).
- Wingate, R. J., Lumsden, A. Persistence of rhombomeric organisation in the postsegmental hindbrain. Development. 122 (7), 2143-2152 (1996).
- Karagenc, L., Sandikci, M. Tissue distribution of cells derived from the area opaca in heterospecific quail-chick blastodermal chimeras. J. Anat. 216 (1), 16-22 (2010).
- Teague, W. J., Jayanthi, N. V., Lear, P. V., Johnson, P. R. Foregut mesenchyme contributes cells to pancreatic acini during embryonic development in a chick-quail chimera model. Pediatr. Surg. Int. 21 (3), 138-142 (2005).
- Borue, X., Noden, D. M. Normal and aberrant craniofacial myogenesis by grafted trunk somitic and segmental plate mesoderm. Development. 131 (16), 3967-3980 (2004).
- He, L. Three different fates of cells migrating from somites into the limb bud. Anat. Embryol. (Berl). 207 (1), 29-34 (2003).
- Huang, R., Zhi, Q., Christ, B. The relationship between limb muscle and endothelial cells migrating from single somite. Anat. Embryol. (Berl). 206 (4), 283-289 (2003).
- Hidalgo-Sanchez, M., Simeone, A., Alvarado-Mallart, R. M. Fgf8 and Gbx2 induction concomitant with Otx2 repression is correlated with midbrain-hindbrain fate of caudal prosencephalon. Development. 126 (14), 3191-3203 (1999).
- Verberne, M. E., Gittenberger-de Groot, A. C., Poelmann, R. E. Lineage and development of the parasympathetic nervous system of the embryonic chick heart. Anat. Embryol. (Berl). 198 (3), 171-184 (1998).
- Burns, A. J., Douarin, N. M. The sacral neural crest contributes neurons and glia to the post-umbilical gut: spatiotemporal analysis of the development of the enteric nervous system. Development. 125 (21), 4335-4347 (1998).
- Debby-Brafman, A., Burstyn-Cohen, T., Klar, A., Kalcheim, C. F-Spondin, expressed in somite regions avoided by neural crest cells, mediates inhibition of distinct somite domains to neural crest migration. Neuron. 22 (3), 475-488 (1999).
- Lwigale, P. Y., Bronner-Fraser, M. Lens-derived Semaphorin3A regulates sensory innervation of the cornea. Dev. Biol. 306 (2), 750-759 (2007).
- Nakamura, H., Funahashi, J. Introduction of DNA into chick embryos by in ovo electroporation. Methods. 24 (1), 43-48 (2001).
- Chen, Y. X., Krull, C. E., Reneker, L. W. Targeted gene expression in the chicken eye by in ovo electroporation. Mol. Vis. 10, 874-883 (2004).
- Sato, F., Nakagawa, T., Ito, M., Kitagawa, Y., Hattori, M. A. Application of RNA interference to chicken embryos using small interfering RNA. J. Exp. Zool. A. Comp. Exp. Biol. 301 (10), 820-827 (2004).
- Lwigale, P. Y., Schneider, R. A. Other chimeras: quail-duck and mouse-chick. Methods Cell. Biol. 87, 59-74 (2008).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev. Dyn. 195 (4), 231-272 (1992).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bull. World Health Organ. 32 (1), 143-144 (1965).
- Le Douarin, N. M. A Feulgen-positive nucleolus. Exp. Cell. Res. 77 (1), 459-468 (1973).
- Feulgen, R., Rossenbeck, H. Mikroskopisch-chemischer Nachweis einer Nucleinsaure vom typus der Thymonucleinsiiure und die darauf beruhende elektive Faibung von Zellkemen in mikroskopischen Praparaten. Hoppe-Seyler's Z. Physiol. Chem. 135, 203-252 (1924).
- Lwigale, P. Y., Conrad, G. W., Bronner-Fraser, M. Graded potential of neural crest to form cornea, sensory neurons and cartilage along the rostrocaudal axis. Development. 131 (9), 1979-1991 (2004).
- Weston, J. A. A radioautographic analysis of the migration and localization of trunk neural crest cells in the chick. Dev. Biol. 6, 279-310 (1963).
- Le Douarin, N. M., Kalcheim, C. . The Neural Crest. , (2009).
- Le Douarin, N. M., Teillet, M. A. The migration of neural crest cells to the wall of the digestive tract in avian embryo. J. Embryol. Exp. Morphol. 30 (1), 31-48 (1973).
- Douarin, N. M. L. e., Jotereau, F. V. Tracing of cells of the avian thymus through embryonic life in interspecific chimeras. J. Exp. Med. 142 (1), 17-40 (1975).
- Le Douarin, N. M., Renaud, D., Teillet, M. A., Le Douarin, G. H. Cholinergic differentiation of presumptive adrenergic neuroblasts in interspecific chimeras after heterotopic transplantations. Proc. Natl. Acad. Sci. U. S. A. 72 (2), 728-732 (1975).
- Houssaint, E., Belo, M., Le Douarin, N. M. Investigations on cell lineage and tissue interactions in the developing bursa of Fabricius through interspecific chimeras. Dev. Biol. 53 (2), 250-264 (1976).
- Le Douarin, N. M., Jotereau, F. V., Houssaint, E., Belo, M. Ontogeny of the avian thymus and bursa of Fabricius studied in interspecific chimeras. Ann. Immunol. (Paris). 127 (6), 849-856 (1976).
- Fontaine, J., Le Douarin, N. M. Analysis of endoderm formation in the avian blastoderm by the use of quail-chick chimaeras. The problem of the neurectodermal origin of the cells of the APUD series. J. Embryol. Exp. Morphol. 41, 209-222 (1977).
- Narayanan, C. H., Narayanan, Y. On the origin of the ciliary ganglion in birds studied by the method of interspecific transplantation of embryonic brain regions between quail and chick. J. Embryol. Exp. Morphol. 47, 137-148 (1978).
- Lwigale, P. Y., Cressy, P. A., Bronner-Fraser, M. Corneal keratocytes retain neural crest progenitor cell properties. Dev. Biol. 288 (1), 284-293 (2005).
- Lwigale, P. Y. Embryonic origin of avian corneal sensory nerves. Dev. Biol. 239 (2), 323-337 (2001).
- Tanaka, H., Kinutani, M., Agata, A., Takashima, Y., Obata, K. Pathfinding during spinal tract formation in the chick-quail chimera analysed by species-specific monoclonal antibodies. Development. 110 (2), 565-571 (1990).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены