Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Analyse der Neuralleiste Migration und Differenzierung von Cross-Spezies Transplantation
In diesem Artikel
Zusammenfassung
Ein Ansatz zur Analyse von Migration und schließlich das Schicksal der aviären Neuralleistenzellen in Wachtel-Küken chimären Embryos beschrieben wird. Diese Methode ist eine einfache und unkomplizierte Technik zum Aufspüren Neuralleistenzellen während der Migration und Differenzierung, die sonst schwer zu unmanipulierten innerhalb eines Hühnerembryo zu unterscheiden sind.
Zusammenfassung
Vogelembryonen bieten eine einzigartige Plattform für die Erforschung von vielen Wirbeltieren Entwicklungsprozesse durch die gute Anbindung der Embryonen im Ei. Chimäre Vogelembryonen, in denen Wachteln Spendergewebe in einen Hühnerembryo in ovo transplantiert wird, verbinden die Kraft der unauslöschliche genetische Markierung von Zellpopulationen mit der einfachen Handhabung durch den Vogelembryo vorgestellt.
Wachtel-Küken Chimären sind ein klassisches Instrument zur Nachverfolgung von wandernden Neuralleistenzellen (NCC) 1-3. NCCs sind eine vorübergehende wandernden Population von Zellen im Embryo, die im dorsalen Bereich der Entwicklung von neuronalen Rohr 4 stammen. Sie durchlaufen eine epitheliale zu mesenchymale Transition und in der Folge auch auf andere Regionen des Embryos, wo sie sich unterscheiden in verschiedene Zelltypen, einschließlich Knorpel 5-13, Melanozyten 11,14-20, 21-32 Neuronen und Glia zu migrieren. NCCs sind multipotente, und ihr Schicksal ist beeinbeeinflusst durch 1) die Region des Neuralrohrs in dem sie ihren Ursprung entlang der rostro-caudale Achse des Embryos 11,33-37, 2) Signale von benachbarten Zellen, wie sie 38 bis 44 zu migrieren, und 3) der Mikroumgebung ihre ultimative Ziel innerhalb des Embryos 45,46. Tracing diese Zellen von ihrem Entstehungsort im Neuralrohr, um ihre endgültige Position und Schicksal innerhalb des Embryos, liefert wichtige Einblicke in die Entwicklungsprozesse, die Musterbildung und Organogenese zu regulieren.
Die Transplantation von komplementären Regionen der Spender Neuralrohr (homotop Transplantation) oder verschiedenen Regionen des Spenders Neuralrohr (heterotope Transplantation) kann zeigen Unterschiede in der Pre-Spezifikation von NCCs entlang der rostro-caudale Achse 2,47. Diese Technik kann angepasst werden, um eine einseitige Kammer des Neuralrohrs, so dass eine Seite von Spendergewebe abgeleitet transplantiert, und die Gegenseite Reste in der ungestörten Wirtsembryo, yiElding eine interne Kontrolle innerhalb der gleichen Probe 2,47. Es kann auch für die Transplantation von Gehirn-Segmente in späteren Embryonen angepasst werden, nachdem HH10, wenn die vordere Neuralrohr 47 geschlossen ist.
Hier berichten wir über Techniken zur Erzeugung von Wachtel-Küken Chimären über Neuralrohr Transplantation, die für die Rückverfolgung der wandernden NCCs aus einer diskreten Segment des Neuralrohrs ableiten lassen. Artspezifische Etikettierung der Spender stammenden Zellen mit dem Wachtel-spezifische Antikörper QCPN 48-56 erlaubt dem Forscher, Spender-und Wirtszellen bei der experimentellen Endpunkt unterscheiden. Diese Technik ist einfach, kostengünstig und hat viele Anwendungen, einschließlich Schicksal-Mapping, Zelllinie Rückverfolgung und Identifizierung von Pre-Events Musterbildung entlang der rostro-kaudalen Achse 45. Wegen der Leichtigkeit des Zugangs zu den Vogelembryo, kann die Wachtel-Küken-Graft-Technik mit anderen Manipulationen, auch kombiniert werden, aber nicht auf die Linse Ablation 4 begrenzt0, Injektion von inhibitorischen Moleküle 57,58, oder genetische Manipulation mittels Elektroporation von Expressionsplasmiden 59-61, um die Reaktion des bestimmten wandernden Ströme von NCCs auf Störungen in der embryonalen Entwicklung Programm zu identifizieren. Darüber hinaus kann diese Pfropfen Technik auch verwendet, um andere interspezifische chimären Embryonen wie Wachtel-Enten-Chimären zu erzeugen, um NCC Beitrag zur kraniofazialen Morphogenese, oder Maus-Chimären-Küken, die Macht der Maus-Genetik mit der Leichtigkeit der Manipulation des Vogelembryo kombinieren studieren werden . 62
Protokoll
1. Inkubieren Küken und Wachteleier auf die gewünschte Stufe
Für HH9 Embryonen, reichen typische Inkubationszeit von 29 bis 33 Stunden bei 38 ° C 63
- Waschen Sie alle Fremdkörper aus den Eiern mit lauwarmem Wasser.
- Vereinbaren Hühnereiern auf Tablett horizontal. Markieren Sie die Seite nach oben mit Bleistift, dies wird in die Region, wo der Embryo lokalisiert werden entsprechen wird. Inkubieren Wachteleier stumpfen Ende auf.
- Place in 38 ° C befeuchteten Inkubator. Schalten Sie rocken Funktion.
2. Bereiten Sie Eier für Fenstertechnik und Dissektion
- Entfernen Sie Eier von Inkubator und sterilisieren Sie die Oberseiten mit 70% Ethanol. Am besten ist es auf der Ethanol sprühen und wischen Sie ihn schnell mit einem Papiertuch oder Kimwipe einer etwaigen Übernahme von Ethanol durch die Eierschale zu vermeiden.
- Legen Sie das Huhn Ei auf einem einzelnen Ei-Halter (wir verwenden eine Petrischale mit gefalteten Papiertüchern ausgekleidet, zB "Kimwipes"). Mit AA Zangen, tippen Sie auf eine kleine HOLe in der oberen Oberfläche der Eischale am spitzen Ende des Eis.
- Entfernen Sie 1,5-3ml von Licht Albumin aus dem Hühnerei mit einem 18 ½ G Injektionsnadel und 5 ml Spritze. Am besten ist es, die Nadel vertikal einfügen in das Loch, mit dem Kegelrad mit Blick auf den spitzen Ende des Eies (Abbildung 2A). Auf diese Weise, wenn Albumin entnommen wird, gibt es wenig Risiko einer versehentlichen Beschädigung der Dotter über eine Saug. Entsorgen Sie das Albumin. Dieser Schritt senkt den Dotter und die Embryos in das Ei, um für ein Fenster in der Eischale geöffnet werden muss.
- Wischen Sie das Loch mit 70% Ethanol wie oben beschrieben und verschließen Sie diese mit Klebeband. Es ist wichtig, dass die Eischale das Loch umgibt vollständig frei von Albumin und trocken ist oder der Klebstoff nicht zu versiegeln.
- Mit den AA Zangen, tippen Sie auf ein weiteres Loch in die markierten oberen Fläche der horizontalen Ei, nicht ganz an der Spitze. Achten Sie darauf, lassen Sie die Zange zu weit gehen durch die Eierschale nicht zu beschädigen das Eigelb oder Embryos.
- Insert einer Seite der gekrümmten Irispinzetten in das Loch parallel zu der Eier Schale. Kneifen Sie auf der Schale, die in einer kreisförmigen Bewegung um ein ca. 2 cm im Durchmesser Fenster im Hühnerei Schale zu durchbrechen. Entsorgen Sie die Eierschale entfernt. Alternativ decken die obere Oberfläche des Eies mit Klebeband und verwenden eine Schere zu schneiden aus dem Fenster. Dies minimiert die Wahrscheinlichkeit von Eierschalen Trümmer fallen in die Eizelle. Der Embryo ist als eine undurchsichtige Platte auf der Oberseite des Eigelbs zu sehen. Entsorgen Sie alle unbefruchteten Eier (gekennzeichnet durch kleine weiße Fleck auf der Oberfläche Eigelb, oder Abwesenheit von Blastoderm).
- Spritzen Sie eine kleine Menge von Tusche (1:10 verdünnt in steriler Ringer-Lösung mit "Pen / Strep" Antibiotika: Endkonzentration 100 pg / ml Penicillin und 100 ug / ml Streptomycin) unter dem Blastoderm mit Inszenierung des Embryos zu unterstützen. Verwendung einer 1 ml Spritze und 26 ½ G Injektionsnadel, gebogen in einem 45 ° Winkel an der Basis der Nadel mit der Abschrägung nach oben, alternativ, ein may mit einem Glas Pasteur-Pipette gezogen und Pipettieren mit dem Mund Apparat (Augenschutz tragen beim Biegen oder Brechen Injektionsnadel Glasnadel). Die Punktion der Dottermembran außerhalb des Perimeters des Blastoderms und schieben Sie die Spitze der Nadel unter dem Embryo, dicht an der Oberfläche des Dotters aber nicht in den embryonalen Schichten (Abbildung 2B). Injizieren Sie gerade genug Tinte, um den Embryo zu umreißen, dann ziehen Sie die Nadel vorsichtig (Abbildung 2C). Die Injektion kann zu viel Tinte auf Embryo zum Tod führen. Es ist wichtig, dass keine Luftblasen unter dem Embryo zu injizieren, da dies eine Quelle für Verunreinigungen sein kann. NB: Ringer-Lösung in diesem Verfahren verwendet wird sterilisiert und enthält Pen / Strep wie oben definiert. Sterile Phosphat-gepufferte Salzlösung (PBS) ist ebenfalls als Alternative zu Ringer-Lösung in allen Schritten des Protokolls.
- Stadium des Embryos nach Hamburger und Hamilton 63 und notieren Sie die Bühne auf der Eierschale in permanenter Tinte oder Kugelschreiber. Stufen werden am besten unter Ster beurteiltomicroscopy, mit Glasfaser "Schwanenhals"-Lichtquellen, die eine begrenzte Wärmebelastung haben.
- 2-3 Tropfen warme sterile Ringer-Lösung auf der Oberfläche des Embryos zu Austrocknung und Kontamination zu verhindern. Vorübergehend abzudichten das Fenster mit Parafilm gestreckt über die Oberfläche des Eies.
- Wiederholen Sie die Schritte 2,2-2,9 mit allen Eiern Küken vor Beginn der Transplantation Experimente.
- Da Wachteln Embryonen nur für Donor Gewebe verwendet werden, in ovo Schritte 2,2-2,9 kann weggelassen werden. Für ex ovo Vorbereitung von Spender-Embryos, sind Wachteleier stumpfen Seite inkubiert geöffnet und in dieser Region mit einer gebogenen Pinzette, um den Embryo zu offenbaren. Mit Präparierscheren, machen vier Schnitten in der Form eines Quadrats durch die Dotterhaut und Blastoderm außerhalb des Embryos (stellen Sie sicher, dass alle Schnitte treffen). Mit einem gebogenen Pinzette Iris, sanft erfassen Schnittkante ein und heben Sie den Embryo aus dem Ei und überträgt es auf Ringer-Lösung in einer Petrischale. Alternativ kann man mit der Kurved Irispinzetten um die herausgeschnittenen Embryo von unten, oder einem Embryo Löffel oder Kunststoff Transferpipette durch den breiteren Teil des Zylinders abgeschnitten zu heben, kann verwendet werden, um den Embryo zu übertragen aus dem Ei werden. Entfernen Sie vorsichtig die Dotterhaut mit Nr. 5 Zange. Sammelt die übrigen Embryonen Wachtel wie oben, und inszenieren sie unter einem Binokular.
3. Bereiten Sie die Wirtsembryo, um das Transplantat empfangen
- Entfernen Sie Parafilm vom Host (Küken) und Embryo mit einem geschärften Wolframnadel oder Nr. 5 Zangen, reißt ein kleines Loch in der Dotterhaut an der gewünschten Region des Neuralrohrs (Abbildung 3A).
- Einen Tropfen Ringer-Lösung auf den Embryo. Achten Sie darauf, um den Embryo vollständig in Ringer-Lösung während des gesamten Verfahrens zur Austrocknung des Gewebes zu verhindern untergetaucht zu halten. Halten Hinzufügen von Tropfen von Ringer-Lösung auf die Oberfläche des Embryos über Überführungspipettenmechanismus falls erforderlich.
- Mit einer Nadel gezogen Glas, sorgfältig machen rostralen und ca.UDAL Quereinschnitte entsprechend der Länge und der Region des Interesses an der dorsalen Neuralrohr. (Gezapftes Nadeln aus Silicium Glaskapillarrohre die unter Wärme wurden mit einer Nadel Ziehvorrichtung hingezogen wird.) Für einseitige Transplantate die Einschnitte nur in das Lumen des dorsalen Neuralrohr erstrecken, und für die bilaterale Transplantate, um die Einschnitte in die gesamte dorsalen Neuralrohr. Dann schneiden bilateral zwischen dem dorsalen Neuralrohr und dem paraxialen Mesoderm.
- Sie vorsichtig die herausgeschnittenen Explantat aus dem Neuralrohr entfernen Sie sie dann aus dem Embryo durch Absaugen in ein Glas Mikropipette (3B).
4. Bereiten Sie die Spendertransplantat Gewebe
- Wählen Sie eine Etappe abgestimmt Wachtel Embryo. Halten Sie das Embryo sich mit AA-Zange, entfernen Sie die Dotterhaut, und Verbrauchsteuern ein ähnlich großer Bereich von Neuralrohrdefekten wie oben beschrieben (3,3-3,4) (Abbildung 3a'-B '). Je nach den Bedürfnissen des Experiments, kann diese Region zu einem seinkomplementären Bereich des Wirtes (Küken) Neuralrohr oder aus einer anderen Region entlang der rostro-caudale Achse. (NB: für eine größere regionale Transplantate, einschließlich vollständiger Neuralrohr Transplantate, können Forscher wollen eine Proteaseverdau bei diesem Schritt hinzufügen, um jeglichen anhaftenden mesenchymalen Gewebes aus dem Spendergewebe vor der Transplantation zu entfernen jedoch für kleine dorsalen Neuralrohr Transplantate in einem frühen Stadium. , wie hier erläutert, ist Proteaseverdau nicht erforderlich, da das Neuralrohr ist leicht von benachbarten Mesenchym durch streng chirurgischen Techniken getrennt.)
5. Graft das Gewebe
- Saugen Sie die Spender Explantat in ein Glas Mikropipette mit Ringer-Lösung. Achten Sie darauf, dass keine Luftblasen in die Pipette einzuführen.
- Übertragen der benachbart zu dem Explantat ausgeschnitten Bereich des Hühnchens Host. Mit gezogen Glasnadel, das Explantat orientieren und sanft leiten es in die abgetragenen Bereichs (3C).
- Vorsichtig ein paar Tropfen von Ringer-Lösungauf den Embryo zu Austrocknung zu verhindern. Achten Sie darauf, um Stürze zu vermeiden Flüssigkeit direkt auf das Transplantat vor Ort, da dies das Transplantat zu verdrängen können.
- Verschließen Sie die Fenster mit Klebeband. Stellen Sie sicher, dass das Band dichtet den gesamten Bereich der Fenster Ei. Dadurch wird verhindert, Dehydratisierung und Verunreinigung des Embryos während anschließender Inkubation.
- Senden Sie das Ei in den Inkubator, bis die gewünschte Stufe. Stellen Sie sicher, dass die "Schaukel"-Funktion ausgeschaltet wird, während die Inkubation der Chimären gedreht. Eier können leicht von Hand zwei Mal pro Tag, da dies ihre Lebensfähigkeit zu erhöhen, wenn späteren Stadien der Entwicklung ausgerichtet sind, gedreht werden.
6. Bereiten chimären Embryonen zum Schneiden
- Bei der experimentellen Endpunkt, schneiden Sie das Klebeband auf das Fenster mit einer feinen Schere.
- Greifen Sie den Rand des Blastoderms mit gebogenen Pinzette Iris (am einfachsten mit geriffelten Spitzen zu tun), dann schneiden Sie den Embryo vom Dotter mit 4 großen Schnitte außerhalb der Grenzen des Blastoderms.
- Übertragen Sie den Embryo in eine Petrischale mit Ringer-Lösung. Achten Sie darauf, um die Exposition des Embryos in die Luft zu minimieren, um Dehydrierung des Gewebes zu vermeiden.
- Unter Stereomikroskopie, sanft trennen die Dotterhaut aus dem Blastoderm mit Nr. 5 Zange.
- Vorsichtig anzuordnen den Embryo in der Schale, so dass der Embryo in der gleichen Orientierung ist, wie es in der Ei war, mit umgebenden Membranen flach ausgelegt.
- Verwendung Sezieren Nadeln aus Wolfram-Drähten 64 angebracht sauber zu entfernen um die Keimscheibe aus dem Embryo durch Anordnen der Nadel an der Grenze des Embryos und extraembryonalen Gewebe, wobei die Länge des Wolframdrahts parallel zum Boden der Schale. Verwenden Sie einen sanften Sägebewegung um durch das Gewebe schneiden.
- Entfernen Sie vorsichtig das Amnion mit Nr. 5 Zange. An dieser Stelle können Sie, wollen entweder weiter sezieren die Region, die Sie interessieren, oder lassen Sie das ganze Embryo.
- Übertragen Sie den Embryo zu eiskaltem 4% Paraffinormaldehyde-und Rock-Nacht bei 4 ° C.
- Bereiten Sie die Proben und betten für Cryo-oder Paraffin-Schnitte.
Verfolgen Sie die transplantierten Gewebes innerhalb der Wirtsembryo. Es gibt verschiedene Techniken zur Identifizierung von Wachtel Gewebe innerhalb eines Hühnerembryo, einschließlich der Erkennung von Wachtel Nucleoli durch Hämatoxylin-Färbung (Wachtel Kerne haben sehr große, dunklere Färbung als Einschlüsse chick Kerne), der Feulgen-Reaktion Rossenbeck, Acridin-orange oder biz-benzamid Fleck kombiniert mit der Elektronenmikroskopie, oder Immunomarkierung für Wachtel-spezifische Antigene 3,47,65,66. Hier verwenden wir QCPN Antigen und Standard-whole-mount oder Abschnitt Immunfluoreszenztechniken zu Wachtel Neuralleistenzellen in Wachtel-Küken Chimären (Abbildung 4) zu identifizieren. Diese Technik bietet die größte Flexibilität im experimentellen Design, die QCPN Immunfluoreszenz können auch mit anderen Antikörper kombiniert werden, um differenzierte Zellen vom Spender (Wachteln) Gewebe gewonnen identifizieren. Verwenden Sie StandaRD whole-mount oder Abschnitt Immunfluoreszenztechniken auf Wachtel-abgeleiteten Zellen in Chimären zu beschriften.
7. Repräsentative Ergebnisse
Ein repräsentatives Bild des gepfropften Region des Neuralrohrs nach 6h der Re-Inkubation (bis HH11) zeigt, erwartet Einverleibung des gepfropften Spender (Wachtel) Gewebe in den Wirt (Küken) Neuralrohr (Abbildung 4A). Embryonen zeigt unvollständige Integration des Transplantats, oder asymmetrische Entwicklung der Oberkopf oder Somiten nach reincubation sollte verworfen werden.
Querschnitt durch den gepfropften Region anzeigen HH11 NCCs mit HNK-1-Migration in seitlicher Richtung vom Neuralrohr bezeichnet. Wachtel Zellen, die zur der NCC Migrationsstrom, und das Neuralrohr, sind eindeutig mit QCPN (4B) markiert.
In späteren Stadien kann Wachtel NCC-abgeleiteten Zellen bis zu ihrer endgültigen Zielgewebe zurückgeführt werden. QCPN markierten Zellen werden im Hühnerembryo Mesenchym durchsetztdes Oberkiefer-Prozess bei E5 (4C).
Die QCPN Antikörper können leicht mit anderen Antikörpern kombiniert werden, um die Differenzierung der Wachtel-derived NCCs in der Host-Umgebung zu untersuchen. Wachtel NCC-abgeleiteten Trigeminus sensorischen Neuronen durch QCPN und Tuj1 Antikörper (4D) markiert.
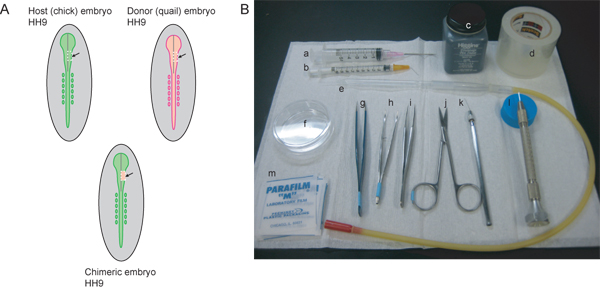
Abbildung 1. Übersicht über die experimentellen Verfahren und Instrumente notwendig. A) Moderator (Küken) und Spender (Wachtel) Embryonen dürfen Bühne abgestimmt. Um die NCC-Stream, die dem Trigeminus-Ganglion, Kiefer-und Unterkiefer-Region trägt zu beschriften, ist HH9 ideal. Am HH9, wird das Neuralrohr beginnt im rostralen Region zu schließen, ist aber noch nicht vollständig abgedichtet. Die graue Linie in den Diagrammen stellt die Mittellinie des Schließung des Neuralrohrs. Die gepunkteten Linien zeigen die weißen Schnittlinien zum Ausschneiden eines Mittelhirn Bereich der rechten Seite des Neuralrohrs aus Host und Donor emEmbryonen. Das ausgeschnittene Bereich der Wirtsembryo wird verworfen und das Spendergewebe in den chimären Embryo zu erzeugen transplantiert. B) notwendigen Instrumente umfassen: a) 5 ml Spritze mit 18 ½ G Injektionsnadel, b) 1 ml-Spritze mit 26 ½ G Injektionsnadel gebogen 45 °-Winkel, c) Tusche, d) klar, Packband, e) Glaspipette mit Pipettieren mit dem Mund Apparat, f) 60 mm-Petrischale, g) AA Zangen, h) gebogenen Pinzette Iris mit geriffelten Spitzen, i) # 5 Zangen, j) feinen Schere, k) geschärft Wolframdraht, l) gezogen Glasnadel, m) Parafilm Quadrate.
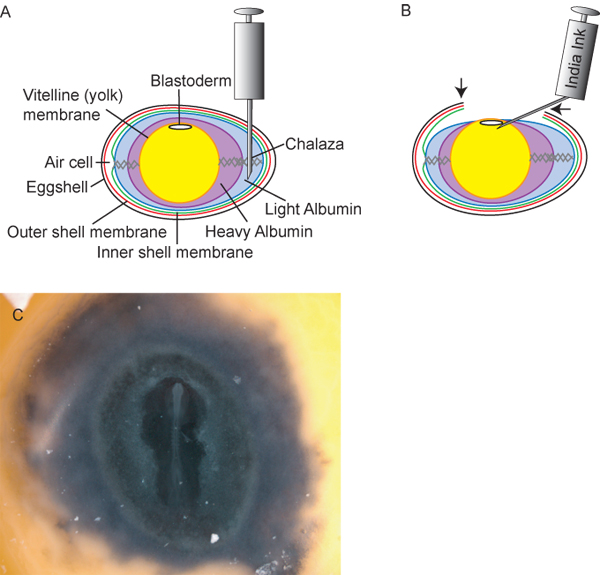
Abbildung 2. Vorbereitung der Eier und Embryonen. A) Querschnittsdiagramm des Eies, einschließlich ideale Einfügemarke von 18 ½ G Injektionsnadel für den Entzug von Licht Albumin. B) Nach dem Abziehen des Lichts ~ 3 ml Albumin, senkt das Eigelb und Embryo im Ei, so dass die Forscher ein "Fenster" (Pfeile) in t geschnittener Eierschalen, um den Embryo zugreifen. Tusche, 1:10 verdünnt in sterile Ringer-Lösung, kann dann unter der Keimscheibe injiziert werden, um zum leichten Staging der Embryonen bereitzustellen. C) Hühnerembryo nach Einfärbung.
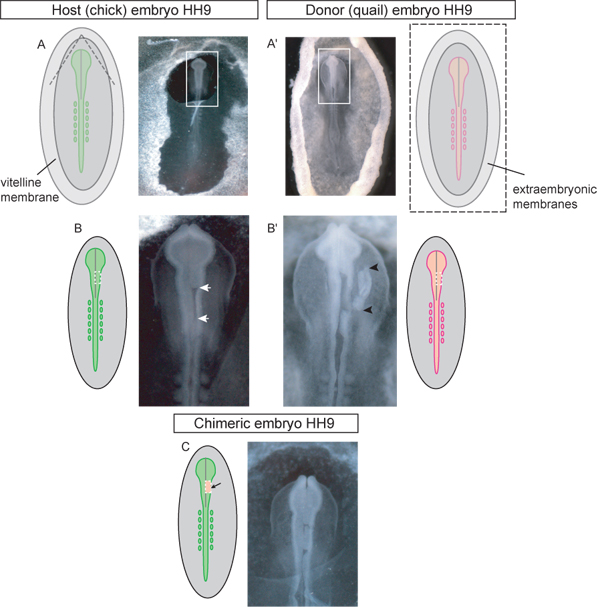
Abbildung 3. Schematische und Beispiele von HH-Stufe 9 Spender und Empfänger Embryonen bei jedem Schritt des Transplantationsverfahren. A) Küken Wirtsembryo. Die gestrichelten Linien im Diagramm zeigen an, wo die Dotterhaut sollte abgerissen, um den Oberkopf zum Pfropfen zugreifen zu können. Sobald zerrissen die dreieckige Klappe der Dotterhaut sollte kaudal geschält werden. Box im Bild zeigt Einschub eingesetzt in (BC). A ') Wachtel Donor Embryo. Das Bild ist von Spender-Embryo vom Ei herausgeschnitten und in die Petrischale für die Präparation des Transplantats Gewebe. Box im Bild zeigt Einschub eingesetzt in (B '). Die gestrichelten Linien im Schaltplan (A ') geben an, wo die Vitellin und Eigelb Membranen sollten geschnitten werden, um t zu entfernener Embryo aus dem Ei. B) Wirtsembryo mit einseitiger Mittelhirn Region des Neuralrohrs exzidiert (weiße Pfeile) erwartet Transplantat. Die gestrichelte Linie in schematische Darstellung zeigt an, wo Schnitte sollten verbrauchsteuerpflichtige des Neuralrohrs im Mittelhirn Region vorgenommen werden. B ') Donor Embryo mit dorsalen Neuralrohr Transplantatgewebe exzidiert (Transplantat-Gewebe durch schwarze Pfeilspitzen). Die gestrichelte Linie im Diagramm zeigt an, wo Kürzungen sollten in der Wachtel Embryo verbrauchsteuerpflichtige das Spendergewebe für einseitige Transplantation des Mittelhirns Region des Neuralrohrs gemacht werden. C) chimärer Embryo nach der Transplantation von Wachtel dorsalen Neuralrohr Explantat in die Küken Mittelhirn Region.
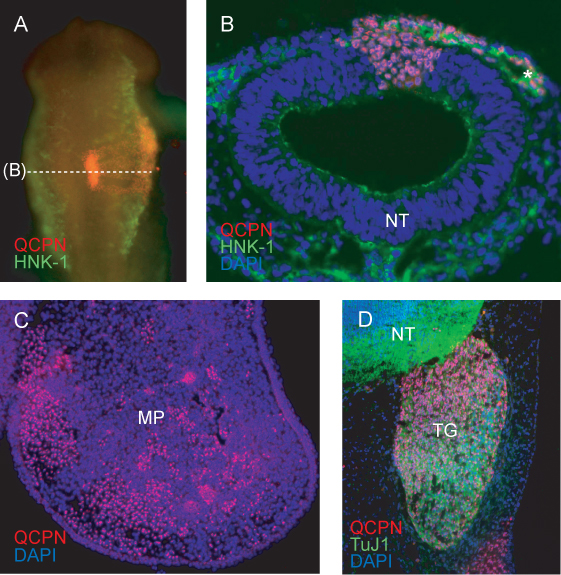
Abbildung 4. Immunfluoreszenz mit Antikörpern gegen Wachtel-spezifische nuclear antigen QCPN in Donor-abgeleiteten Zellen in der chimären Embryo. A) whole-mount Bild von HH11 Chimäre (aufgepfropft auf HH9) zeigt QCPN Färbung in rot, und HNK-1-Färbung (ein Marker für die Migration NCCs) ingrün. 10fache Vergrößerung, dorsale Ansicht. B) Querschnitt durch Embryo in (A), zeigt QCPN-positiven Zellen abgeleitet Wachtel im Neuralrohr und wandernde NCC mit HNK-1 (grün) co-gefärbt. 40-facher Vergrößerung. C) Querschnitt durch Oberkieferfortsatz von E5 Chimäre (inkubiert für 3 Tage nach Transplantation), zeigt QCPN-positiven NCC-abgeleiteten Zellen (rot), die aus dem gepfropften Bereich des Neuralrohr ihrem endgültigen Standort im Embryo gewandert sind. 10facher Vergrößerung. D) Abschnitt durch E5 Chimäre, welche von der Wachtel Beitrag NCC abgeleitet, um den Trigeminus-Ganglion (rot) und Differenzierung in TuJ1-positiven Neuronen (grün). 40-facher Vergrößerung. *, NCCs, MP-, Kiefer-Prozess, NT, Neuralrohr, TG, Trigeminus-Ganglion.
Diskussion
Das Pfropfen von der Wachtel Neuralrohr in Host Hühnerembryonen hier beschriebene ist eine unkomplizierte und kostengünstige Technik zur Verfolgung spezifischer Subpopulationen von Migration ausgehen NCCs aus verschiedenen Regionen entlang der rostro-caudale Achse 21,67-69. Diese Technik nutzt die Erleichterung des Zugangs zu Vogelembryonen (im Gegensatz zu Säugetierembryos Vergleich) und mit anderen Techniken, wie Gewebeablation, Injektion von inhibitorischen Moleküle, oder genetische Manipulation mittel...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren bedanken sich die Mitglieder des Lwigale Labor für die Kritik des Manuskripts. SLG wird von einem Ruth L. Kirschstein NRSA Stipendium des National Eye Institute (F32 EY02167301) unterstützt. PYL wird vom National Eye Institute (EY018050) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagens | Firma | Katalog-Nummer | |
| Küken Eier | Various - wir verwenden Texas A & M University Poultry Science Department, TX. | ||
| Wachteleier | Various - wir verwenden Ozarks Egg Company, MO. | ||
| Egg Inkubator (Digital Readout 1502 Sportsman Incubator w / Feuchtigkeit 110-120 Volt AC) | www.poultrysupply.com | 1502 | |
| Dumont AA Zangen, Inox Epoxibeschichtete | Fine Science Tools | 11210-10 | |
| Tesafilm | Jedes Geschäft für Bürobedarf | ||
| Gebogene Irispinzetten | Fine Science Tools | 11065-07 | |
| IchNDIA Tinte | Jede Art Supply Store | ||
| Pen / Strep (Penicillin, Streptomycin) Lösung | VWR International | 101447-068 | |
| Klare Packband | Jedes Geschäft für Bürobedarf | ||
| Needle Ziehvorrichtung | Narashige, Japan | PE-21 | |
| Gezogen Glasnadel, gemacht von 1,5 bis 1,8 x 100mm Borosilikatglas Kapillarrohr | Kimble Chase | 34500 99 | |
| Gezogen Glaspipette von 5 verwiesen ¾ "Pasteurpipette | Fisher Scientific | 13 bis 678-6A | |
| Mund pipettieren Apparat (Ansaugrohr für Montage kalibriert Mikrokapillare Pipette) | Sigma-Aldrich | A5177-52A | |
| Dumont Nr. 5 Zange | Fine Science Tools | 11251-30 | |
| Tungsten Draht, 0,1 mm Durchmesser | VWR International | AA10404-H2 | |
| Nadelhalter (vernickelt Stifthalter) | Fine Science Tools | 26018-17 | |
| QCPN Antiserum | Developmental Studies Hybridoma Bank, University of Iowa | QCPN | |
| Alexa Fluor sekundären Antikörper (z. B., Alexa Fluor 594 Ziege-anti-Maus-IgG1) | Invitrogen | A21125 | |
Ringer-Lösung (2L):
| Alle Reagenzien von Fisher Scientific |
|
Referenzen
- Le Douarin, G., Renaud, D. Morphologic and physiologic study of the differentiation in vitro of quail embryo precardial mesoderm. Bull. Biol. Fr. Belg. 103 (3), 453-468 (1969).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods. Mol. Biol. 461, 337-350 (2008).
- Le Douarin, N. A biological cell labeling technique and its use in expermental embryology. Dev. Biol. 30 (1), 217-222 (1973).
- Noden, D. M. An analysis of migratory behavior of avian cephalic neural crest cells. Dev. Biol. 42 (1), 106-130 (1975).
- Johnston, M. C. A radioautographic study of the migration and fate of cranial neural crest cells in the chick embryo. Anat. Rec. 156 (2), 143-155 (1966).
- Noden, D. M. The control of avian cephalic neural crest cytodifferentiation. I. Skeletal and connective tissues. Dev. Biol. 67 (2), 296-312 (1978).
- Oka, K. The role of TGF-beta signaling in regulating chondrogenesis and osteogenesis during mandibular development. Dev. Biol. 303 (1), 391-404 (2007).
- Chai, Y. Fate of the mammalian cranial neural crest during tooth and mandibular morphogenesis. Development. 127 (8), 1671-1679 (2000).
- Lengele, B., Schowing, J., Dhem, A. Embryonic origin and fate of chondroid tissue and secondary cartilages in the avian skull. Anat. Rec. 246 (3), 377-393 (1996).
- Le Douarin, N. M., Ziller, C., Couly, G. F. Patterning of neural crest derivatives in the avian embryo: in vivo and in vitro studies. Dev. Biol. 159 (1), 24-49 (1993).
- Lallier, T. E. Cell lineage and cell migration in the neural crest. Ann. N.Y. Acad. Sci. 615, 158-171 (1991).
- Nakamura, H. Mesenchymal derivatives from the neural crest. Arch. Histol. Jpn. 45 (2), 127-138 (1982).
- Le Lievre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. J. Embryol. Exp. Morphol. 34 (1), 125-154 (1975).
- Rawles, M. E. The Development of Melanophores from Embryonic Mouse Tissues Grown in the Coelom of Chick Embryos. Proc. Natl. Acad. Sci. U.S.A. 26 (12), 673-680 (1940).
- Rawles, M. E. The Pigment-Forming Potency of Early Chick Blastoderms. Proc. Natl. Acad. Sci. U.S.A. 26 (1), 86-94 (1940).
- Mosher, J. T. Intrinsic differences among spatially distinct neural crest stem cells in terms of migratory properties, fate determination, and ability to colonize the enteric nervous system. Dev. Biol. 303 (1), 1-15 (2007).
- Dupin, E., Le Douarin, N. M. Development of melanocyte precursors from the vertebrate neural crest. Oncogene. 22 (20), 3016-3023 (2003).
- Faraco, C. D., Vaz, S. A., Pastor, M. V., Erickson, C. A. Hyperpigmentation in the Silkie fowl correlates with abnormal migration of fate-restricted melanoblasts and loss of environmental barrier molecules. Dev. Dyn. 220 (3), 212-225 (2001).
- Selleck, M. A., Bronner-Fraser, M. Avian neural crest cell fate decisions: a diffusible signal mediates induction of neural crest by the ectoderm. Int. J. Dev. Neurosci. 18 (7), 621-627 (2000).
- Stocker, K. M., Sherman, L., Rees, S., Ciment, G. Basic FGF and TGF-beta 1 influence commitment to melanogenesis in neural crest-derived cells of avian embryos. Development. 111 (2), 635-645 (1991).
- Le Douarin, N. M., Teillet, M. A. Experimental analysis of the migration and differentiation of neuroblasts of the autonomic nervous system and of neurectodermal mesenchymal derivatives, using a biological cell marking technique. Dev. Biol. 41 (1), 162-184 (1974).
- Noden, D. M. The control of avian cephalic neural crest cytodifferentiation. II. Neural tissues. Dev. Biol. 67 (2), 313-329 (1978).
- Barraud, P. Neural crest origin of olfactory ensheathing glia. Proc. Natl. Acad. Sci. U.S.A. 107 (49), 21040-21045 (2010).
- Li, H. Y., Say, E. H., Zhou, X. F. Isolation and characterization of neural crest progenitors from adult dorsal root ganglia. Stem Cells. 25 (8), 2053-2065 (2007).
- Carney, T. J. A direct role for Sox10 in specification of neural crest-derived sensory neurons. Development. 133 (23), 4619-4630 (2006).
- Maro, G. S. Neural crest boundary cap cells constitute a source of neuronal and glial cells of the PNS. Nat. Neurosci. 7 (9), 930-938 (2004).
- Bronner-Fraser, M. Molecular analysis of neural crest formation. J. Physiol. Paris. 96 (1-2), 3-8 (2002).
- Paratore, C., Goerich, D. E., Suter, U., Wegner, M., Sommer, L. Survival and glial fate acquisition of neural crest cells are regulated by an interplay between the transcription factor Sox10 and extrinsic combinatorial signaling. Development. 128 (20), 3949-3961 (2001).
- Britsch, S. The transcription factor Sox10 is a key regulator of peripheral glial development. Genes Dev. 15 (1), 66-78 (2001).
- Bronner-Fraser, M. Origin of the avian neural crest. Stem Cells. 13 (6), 640-646 (1995).
- Jessen, K. R., Mirsky, R. Neural development. Fate diverted. Curr. Biol. 4 (9), 824-827 (1994).
- Le Douarin, N., Dulac, C., Dupin, E., Cameron-Curry, P. Glial cell lineages in the neural crest. Glia. 4 (2), 175-184 (1991).
- Chan, W. Y., Cheung, C. S., Yung, K. M., Copp, A. J. Cardiac neural crest of the mouse embryo: axial level of origin, migratory pathway and cell autonomy of the splotch (Sp2H) mutant effect. Development. 131 (14), 3367-3379 (2004).
- Bronner-Fraser, M. Segregation of cell lineage in the neural crest. Curr. Opin. Genet. Dev. 3 (4), 641-647 (1993).
- Peters-vander Sanden, M. J., Luider, T. M., vander Kamp, A. W., Tibboel, D., Meijers, C. Regional differences between various axial segments of the avian neural crest regarding the formation of enteric ganglia. Differentiation. 53 (1), 17-24 (1993).
- Kuratani, S., Bockman, D. E. Capacity of neural crest cells from various axial levels to participate in thymic development. Cell Tissue Res. 263 (1), 99-105 (1991).
- Leblanc, G. G., Epstein, M. L., Bronner-Fraser, M. E. Differential development of cholinergic neurons from cranial and trunk neural crest cells in vitro. 137 (2), 318-330 (1990).
- Golding, J. P., Trainor, P., Krumlauf, R., Gassmann, M. Defects in pathfinding by cranial neural crest cells in mice lacking the neuregulin receptor ErbB4. Nat. Cell. Biol. 2 (2), 103-109 (2000).
- Kulesa, P. M., Bailey, C. M., Kasemeier-Kulesa, J. C., McLennan, R. Cranial neural crest migration: new rules for an old road. Dev. Biol. 344 (2), 543-554 (2009).
- Lwigale, P. Y., Bronner-Fraser, M. Semaphorin3A/neuropilin-1 signaling acts as a molecular switch regulating neural crest migration during cornea development. Dev. Biol. 336 (2), 257-265 (2009).
- Killian, O. l. e. s. n. i. c. k. y., Birkholz, E. C., A, D., Artinger, K. B. A role for chemokine signaling in neural crest cell migration and craniofacial. Dev. Biol. 333 (1), 161-172 (2009).
- Gammill, L. S., Gonzalez, C., Bronner-Fraser, M. Neuropilin 2/semaphorin 3F signaling is essential for cranial neural crest migration and trigeminal ganglion condensation. Dev. Neurobiol. 67 (1), 47-56 (2007).
- Osborne, N. J., Begbie, J., Chilton, J. K., Schmidt, H., Eickholt, B. J. Semaphorin/neuropilin signaling influences the positioning of migratory neural crest cells within the hindbrain region of the chick. Dev. Dyn. 232 (4), 939-949 (2005).
- Kanzler, B., Foreman, R. K., Labosky, P. A., Mallo, M. BMP signaling is essential for development of skeletogenic and neurogenic cranial neural crest. Development. 127 (5), 1095-1104 (2000).
- Garcia-Lopez, R., Pombero, A., Martinez, S. Fate map of the chick embryo neural tube. Dev. Growth Differ. 51 (3), 145-165 (2009).
- Goldstein, A. M., Nagy, N. A bird's eye view of enteric nervous system development: lessons from the avian embryo. Pediatr. Res. 64 (4), 326-333 (2008).
- Le Douarin, N., Dieterlen-Lievre, F., Creuzet, S., Teillet, M. A. Quail-chick transplantations. Methods Cell. Biol. 87, 19-58 (2008).
- Wingate, R. J., Lumsden, A. Persistence of rhombomeric organisation in the postsegmental hindbrain. Development. 122 (7), 2143-2152 (1996).
- Karagenc, L., Sandikci, M. Tissue distribution of cells derived from the area opaca in heterospecific quail-chick blastodermal chimeras. J. Anat. 216 (1), 16-22 (2010).
- Teague, W. J., Jayanthi, N. V., Lear, P. V., Johnson, P. R. Foregut mesenchyme contributes cells to pancreatic acini during embryonic development in a chick-quail chimera model. Pediatr. Surg. Int. 21 (3), 138-142 (2005).
- Borue, X., Noden, D. M. Normal and aberrant craniofacial myogenesis by grafted trunk somitic and segmental plate mesoderm. Development. 131 (16), 3967-3980 (2004).
- He, L. Three different fates of cells migrating from somites into the limb bud. Anat. Embryol. (Berl). 207 (1), 29-34 (2003).
- Huang, R., Zhi, Q., Christ, B. The relationship between limb muscle and endothelial cells migrating from single somite. Anat. Embryol. (Berl). 206 (4), 283-289 (2003).
- Hidalgo-Sanchez, M., Simeone, A., Alvarado-Mallart, R. M. Fgf8 and Gbx2 induction concomitant with Otx2 repression is correlated with midbrain-hindbrain fate of caudal prosencephalon. Development. 126 (14), 3191-3203 (1999).
- Verberne, M. E., Gittenberger-de Groot, A. C., Poelmann, R. E. Lineage and development of the parasympathetic nervous system of the embryonic chick heart. Anat. Embryol. (Berl). 198 (3), 171-184 (1998).
- Burns, A. J., Douarin, N. M. The sacral neural crest contributes neurons and glia to the post-umbilical gut: spatiotemporal analysis of the development of the enteric nervous system. Development. 125 (21), 4335-4347 (1998).
- Debby-Brafman, A., Burstyn-Cohen, T., Klar, A., Kalcheim, C. F-Spondin, expressed in somite regions avoided by neural crest cells, mediates inhibition of distinct somite domains to neural crest migration. Neuron. 22 (3), 475-488 (1999).
- Lwigale, P. Y., Bronner-Fraser, M. Lens-derived Semaphorin3A regulates sensory innervation of the cornea. Dev. Biol. 306 (2), 750-759 (2007).
- Nakamura, H., Funahashi, J. Introduction of DNA into chick embryos by in ovo electroporation. Methods. 24 (1), 43-48 (2001).
- Chen, Y. X., Krull, C. E., Reneker, L. W. Targeted gene expression in the chicken eye by in ovo electroporation. Mol. Vis. 10, 874-883 (2004).
- Sato, F., Nakagawa, T., Ito, M., Kitagawa, Y., Hattori, M. A. Application of RNA interference to chicken embryos using small interfering RNA. J. Exp. Zool. A. Comp. Exp. Biol. 301 (10), 820-827 (2004).
- Lwigale, P. Y., Schneider, R. A. Other chimeras: quail-duck and mouse-chick. Methods Cell. Biol. 87, 59-74 (2008).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev. Dyn. 195 (4), 231-272 (1992).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bull. World Health Organ. 32 (1), 143-144 (1965).
- Le Douarin, N. M. A Feulgen-positive nucleolus. Exp. Cell. Res. 77 (1), 459-468 (1973).
- Feulgen, R., Rossenbeck, H. Mikroskopisch-chemischer Nachweis einer Nucleinsaure vom typus der Thymonucleinsiiure und die darauf beruhende elektive Faibung von Zellkemen in mikroskopischen Praparaten. Hoppe-Seyler's Z. Physiol. Chem. 135, 203-252 (1924).
- Lwigale, P. Y., Conrad, G. W., Bronner-Fraser, M. Graded potential of neural crest to form cornea, sensory neurons and cartilage along the rostrocaudal axis. Development. 131 (9), 1979-1991 (2004).
- Weston, J. A. A radioautographic analysis of the migration and localization of trunk neural crest cells in the chick. Dev. Biol. 6, 279-310 (1963).
- Le Douarin, N. M., Kalcheim, C. . The Neural Crest. , (2009).
- Le Douarin, N. M., Teillet, M. A. The migration of neural crest cells to the wall of the digestive tract in avian embryo. J. Embryol. Exp. Morphol. 30 (1), 31-48 (1973).
- Douarin, N. M. L. e., Jotereau, F. V. Tracing of cells of the avian thymus through embryonic life in interspecific chimeras. J. Exp. Med. 142 (1), 17-40 (1975).
- Le Douarin, N. M., Renaud, D., Teillet, M. A., Le Douarin, G. H. Cholinergic differentiation of presumptive adrenergic neuroblasts in interspecific chimeras after heterotopic transplantations. Proc. Natl. Acad. Sci. U. S. A. 72 (2), 728-732 (1975).
- Houssaint, E., Belo, M., Le Douarin, N. M. Investigations on cell lineage and tissue interactions in the developing bursa of Fabricius through interspecific chimeras. Dev. Biol. 53 (2), 250-264 (1976).
- Le Douarin, N. M., Jotereau, F. V., Houssaint, E., Belo, M. Ontogeny of the avian thymus and bursa of Fabricius studied in interspecific chimeras. Ann. Immunol. (Paris). 127 (6), 849-856 (1976).
- Fontaine, J., Le Douarin, N. M. Analysis of endoderm formation in the avian blastoderm by the use of quail-chick chimaeras. The problem of the neurectodermal origin of the cells of the APUD series. J. Embryol. Exp. Morphol. 41, 209-222 (1977).
- Narayanan, C. H., Narayanan, Y. On the origin of the ciliary ganglion in birds studied by the method of interspecific transplantation of embryonic brain regions between quail and chick. J. Embryol. Exp. Morphol. 47, 137-148 (1978).
- Lwigale, P. Y., Cressy, P. A., Bronner-Fraser, M. Corneal keratocytes retain neural crest progenitor cell properties. Dev. Biol. 288 (1), 284-293 (2005).
- Lwigale, P. Y. Embryonic origin of avian corneal sensory nerves. Dev. Biol. 239 (2), 323-337 (2001).
- Tanaka, H., Kinutani, M., Agata, A., Takashima, Y., Obata, K. Pathfinding during spinal tract formation in the chick-quail chimera analysed by species-specific monoclonal antibodies. Development. 110 (2), 565-571 (1990).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten