É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Análise de migração da crista neural e Diferenciação por Cross-espécies de Transplantes
Neste Artigo
Resumo
Uma abordagem para análise da migração e destino final dos aviários células da crista neural em codornas de-bico embriões quiméricos é descrito. Este método é uma técnica simples e direta para rastrear células da crista neural durante a migração e diferenciação que são de outra maneira difícil distinguir dentro de um embrião de galinha não-manipulado.
Resumo
Embriões de aves fornecer uma plataforma única para o estudo de muitos vertebrados processos de desenvolvimento, devido ao fácil acesso dos embriões dentro do ovo. Quiméricos embriões aviários, em que as codornizes tecido do dador é transplantado para um embrião de pinto in ovo, combinam o poder de rotulagem genética indelével de populações de células com a facilidade de manipulação apresentada pela embrião aviário.
Quail chick-quimeras são uma ferramenta clássica para a detecção migratórias células da crista neural (CNCC) 1-3. CNCC são uma população transitória migratório das células do embrião, que se originam na região dorsal do tubo 4 desenvolvimento neural. Eles sofrem uma transição epitelial para mesenquimal e, posteriormente, migrar para outras regiões do embrião, onde se diferenciam em vários tipos celulares, incluindo cartilagem 5-13, melanócitos 11,14-20, neurônios e células gliais 21-32. CNCC são multipotentes, e seu destino final é influenciadoinfluenciada por 1) a região do tubo neural em que são originários ao longo do eixo rostro-caudal do embrião 11,33-37, 2) sinais de células vizinhas à medida que migram 38-44, e 3) o microambiente do seu final destino dentro do embrião 45,46. Rastreamento essas células a partir de seu ponto de origem no tubo neural, a sua posição final e destino dentro do embrião, fornece informação importante sobre os processos de desenvolvimento que regulam a padronização e organogênese.
Transplante de regiões complementares de tubo neural doador (homotópico do miocárdio) ou diferentes regiões do tubo neural do doador (enxerto heterotópico) pode revelar diferenças de especificação pré-CNCC ao longo do eixo rostro-caudal 2,47. Esta técnica pode ser ainda adaptado para transplantar um compartimento unilateral do tubo neural, tal que um lado é derivado a partir de tecido do dador, e os restos lado contralateral não perturbada no embrião hospedeiro, yielding um controle interno, dentro da mesma amostra 2,47. Ele também pode ser adaptado para o transplante de segmentos cerebrais em embriões mais tarde, após HH10, quando o tubo neural anterior foi fechada 47.
Relatamos aqui técnicas para a geração de codorniz chick-quimeras por transplantação tubo neural, que permitem a detecção de CNCC migratórios derivados a partir de um segmento discreta do tubo neural. Específica da espécie rotulagem das células derivadas de dador com o anticorpo QCPN codorniz-específica 48-56 permite que o pesquisador para distinguir dador e células hospedeiras no ponto final experimental. Esta técnica é simples, barato, e tem muitas aplicações, incluindo mapeamento de destino, a linhagem celular de rastreamento, identificação e padronização de pré-eventos ao longo do eixo rostro-caudal 45. Devido à facilidade de acesso para o embrião aviário, a técnica de enxerto codorniz-chick pode ser combinada com outras manipulações, incluindo mas não limitado a ablação da lente 40, a injecção de moléculas inibidoras 57,58, ou manipulação genética através de electroporação de plasmídeos de expressão 59-61, para identificar a resposta de determinados fluxos migratórias de CNCC a perturbações no programa de desenvolvimento do embrião. Além disso, esta técnica de enxerto pode também ser usado para gerar outros embriões interespecíficos quiméricos, tais como codorniz-pato quimeras para estudar NCC contribuição para a morfogénese craniofacial, ou rato chick-quimeras para combinar o poder de rato genética com a facilidade de manipulação do embrião aviário 62.
Protocolo
1. Incubar pintinho e ovos de codorna ao estágio desejado
Para HH9 embriões, os tempos de incubação típicos variam de 29-33 horas a 38 ° C. 63
- Lave todos os restos dos ovos com água morna.
- Organizar os ovos de galinha na bandeja horizontal. Marcar o lado virado para cima com lápis, o que irá corresponder à região onde o embrião será localizado. Incubar ovos de codorna fim brusco para cima.
- Lugar em 38 ° C incubadora umidificada. Ligue balançando função.
2. Prepare ovos para janelas e dissecção
- Remover os ovos de incubadora, e esterilizar os topos com etanol a 70%. É melhor para pulverizar sobre o etanol e limpe-a rapidamente com uma toalha de papel ou Kimwipe para evitar qualquer absorção de etanol através da casca de ovo.
- Ovo de galinha em um lugar suporte do ovo individual (nós usamos uma placa de Petri forrada com toalhas de papel dobrados, por exemplo, "Kimwipes"). Utilizando uma pinça AA, toque em um pequeno hole na superfície superior da casca do ovo na extremidade pontiaguda do ovo.
- Remover 1,5-3ml de luz a partir de albumina do ovo de galinha, com uma agulha hipodérmica 18 G e ½ seringa de 5 ml. O melhor é inserir a agulha verticalmente dentro do furo, com o bisel voltado para a extremidade pontiaguda do ovo (Figura 2A). Dessa forma, quando a albumina é retirada, há pouco risco de danificar acidentalmente a gema através de sucção. Descarte a albumina. Esta etapa irá diminuir a gema eo embrião dentro do ovo para permitir uma janela a ser aberta na casca do ovo.
- Seque a furo com etanol a 70% como descrito acima e selar com fita adesiva. É importante que a casca do ovo em torno do furo é completamente desprovido de albumina e seco ou o adesivo não veda.
- Com os fórceps AA, toque um outro furo na superfície marcada superior do ovo horizontal, não completamente no ápice. Tome cuidado para não deixar a pinça ir muito longe através da casca, para evitar danificar a gema ou embrião.
- EmSert um lado das pinças curvas íris em paralelo o furo para a concha de ovos. Beliscar para baixo no shell, trabalhando em um movimento circular para quebrar um ~ 2 cm de diâmetro na janela de casca de ovo de galinha. Deite fora a casca removida. Alternativamente, cobrir a superfície superior do ovo com a fita da embalagem e usar um par de tesouras para cortar a janela. Isto minimiza a possibilidade de detritos da casca do ovo cair para dentro do ovo. O embrião deve aparecer como um disco opaco na parte superior da gema. Descarte todos os ovos não fertilizados (identificado por pequena mancha branca na superfície da gema, ou ausência de blastoderme).
- Injectar uma pequena quantidade de tinta da Índia (diluído 1:10 em solução de Ringer estéril, contendo "Pen / Strep" antibiótico: concentração final de 100 ug / mL de penicilina e 100 ug / ml de estreptomicina) por baixo da blastoderme para ajudar com paragem do embrião. Utilizar uma seringa de 1 ml e 26 ½ G agulha hipodérmica, dobrado em um ângulo de 45 ° na base da agulha, com o bisel voltado para cima, alternativamente, uma may usar um puxado vidro pipeta Pasteur e aparelhos boca pipetagem (óculos de protecção quando dobra agulha hipodérmica ou quebrar agulha de vidro). Punção membrana da gema fora do perímetro da blastoderme e deslize a ponta da agulha debaixo do embrião, perto da superfície da gema, mas não nas camadas embrionárias (Figura 2B). Injectar apenas tinta suficiente para delinear o embrião, então, cuidadosamente, retirar a agulha (Figura 2C). Injetando a tinta em excesso pode levar à morte do embrião. É importante que não se injectar quaisquer bolhas de ar por baixo do embrião, como esta pode ser uma fonte de contaminação. NB: Todos solução de Ringer utilizado neste procedimento é esterilizada e contém Pen / Strep, tal como definido acima. Fosfato estéril tamponada (PBS) é também uma alternativa aceitável para a solução de Ringer em todos os passos de este protocolo.
- Encenar o embrião de acordo com Hamburger e Hamilton 63 e gravar o estágio na casca de ovo com tinta permanente ou lápis. Estágios são melhor avaliados em estéreoomicroscopy, com fibra óptica "gooseneck" fontes de luz que têm uma carga de calor limitada.
- Aplicar 2-3 gotas de solução de Ringer estéril aquecer para a superfície do embrião para evitar a desidratação e contaminação. Selar temporariamente a janela com parafilme esticada sobre a superfície do ovo.
- Repita os passos de 2,2-2,9 com todos os ovos de galinha antes de iniciar os experimentos de transplante.
- Uma vez que os embriões de codorniz são utilizados apenas para os tecidos de dadores, em passos ovo 2,2-2,9 pode ser omitida. Para a preparação ovo ex de embriões de dadores, ovos de codorna são incubados lado franco e abriu nesta região com pinças curvas para revelar o embrião. Com uma tesoura de dissecção, fazer quatro cortes na forma de um quadrado através da membrana vitelina e blastoderme fora do embrião (certifique-se que todos os cortes se encontram). Usando um fórceps curvos íris, suavemente compreender um bordo de corte e levantar o embrião do ovo e transferi-lo para solução de Ringer numa placa de Petri. Alternativamente, pode-se usar a curvad íris fórceps para levantar o embrião excisado a partir de baixo, ou uma colher embrião ou pipeta de transferência de plástico cortar através da parte mais larga do cilindro, pode ser usado para transferir o embrião para fora do ovo. Remova cuidadosamente a membrana vitelina com # 5 fórceps. Colete os embriões restantes de codorna como acima, e organizar-las sob um microscópio de dissecação.
3. Preparar o embrião hospedeiro para receber o enxerto
- Remover parafilme a partir do hospedeiro (pintainho) embrião e usando uma agulha de tungsténio afiada ou # 5 fórceps, rasgar um pequeno orifício na membrana vitelina na região desejada do tubo neural (Figura 3A).
- Adicionar uma gota de solução de Ringer para o embrião. Tomar cuidado para manter o embrião completamente submerso na solução de Ringer durante todo o procedimento para evitar a desidratação do tecido. Manter a adição de gotas de solução de Ringer para a superfície do embrião via pipeta de transferência, se necessário.
- Usando uma agulha de vidro puxado, cuidadosamente fazer rostral e caUdal incisões transversal correspondente ao comprimento e região de interesse dentro do tubo neural dorsal. (Agulhas de vidro Puxado são gerados a partir de tubos capilares de vidro de silício que foram puxados sob calor com uma agulha de puxar aparelho.) Para enxertos unilaterais as incisões só deve estender-se ao lúmen do tubo neural dorsal, e para enxertos bilaterais, fazer as incisões através o tubo dorsal inteiro neural. Em seguida, corte a nível bilateral entre o tubo neural dorsal e do mesoderma paraxial.
- Cuidadosamente separar o explante excisados a partir do tubo neural em seguida, removê-lo a partir do embrião por aspiração em uma micropipeta de vidro (Figura 3B).
4. Prepare o tecido doador do enxerto
- Escolha um estágio combinado embrião de codorna. Segurar o embrião para baixo com uma pinça de AA, remover a membrana vitelina, e consumo de uma região semelhante do tamanho do tubo neural, tal como descrito acima (3,3-3,4) (Figura 3A'-B '). Dependendo das necessidades de sua experiência, esta região pode ser umregião complementar do hospedeiro tubo (pintainho) neural ou a partir de uma região diferente ao longo do eixo rostro-caudal. (NB: para maiores enxertos regionais, incluindo completos enxertos do tubo neural, os pesquisadores podem querer acrescentar uma digestão protease nesta etapa para remover todo o tecido aderente mesenquimal do tecido do doador antes do transplante No entanto, para pequenos enxertos dorsal do tubo neural em estágios iniciais. , como é descrito aqui, a digestão da protease não é necessária porque o tubo neural é facilmente separado do mesênquima adjacente por meio de técnicas estritamente cirúrgicos.)
5. Enxerto do tecido
- Aspirar o explante doador em uma micropipeta de vidro contendo a solução de Ringer. Tenha cuidado para não introduzir quaisquer bolhas na pipeta.
- Transferir o explante adjacente à região excisado do hospedeiro pinto. Usando agulha de vidro puxado, orientar o explante e suavemente guiá-la para a região ablacionada (Figura 3C).
- Adicionar cuidadosamente algumas gotas de solução de Ringerpara o embrião para evitar a desidratação. Tome cuidado para evitar o descarte de líquidos diretamente sobre o local do enxerto, pois isso pode deslocar o enxerto.
- Selar a janela com fita de embalagem. Certifique-se que a fita de vedação de toda a região do ovo de janela. Isto evita que a desidratação e contaminação do embrião durante a incubação subsequente.
- Devolver o ovo para a incubadora até a fase desejada. Certifique-se que a função de "balanço" é desligado enquanto incubando as quimeras. Os ovos podem ser suavemente girado com a mão duas vezes por dia, pois isso pode aumentar a sua viabilidade se as fases posteriores do desenvolvimento são direcionados.
6. Preparar embriões quiméricos para o seccionamento
- No endpoint experimental, cortar a fita que cobre a janela usando tesoura fina.
- Agarrar a borda da blastoderme com curvo íris pinça (mais fácil de fazer com serrilhada dicas), depois cortar o embrião para longe da gema com 4 cortes grandes fora dos limites da blastoderme.
- Transferência do embrião para uma placa de Petri contendo solução de Ringer. Ter o cuidado de minimizar a exposição do embrião para o ar, a fim de evitar a desidratação do tecido.
- Sob estereomicroscópio, separar delicadamente a membrana vitelina da blastoderme usando # 5 fórceps.
- Cuidadosamente providenciar o embrião no prato de modo que o embrião está na mesma orientação como era o ovo, com membranas que rodeiam estabelecidos plana.
- Use dissecando agulhas feitas a partir de 64 fios de tungsténio para remover o limpa blastoderme circundante a partir do embrião arranjando a agulha no limite do embrião e tecidos extra-embrionário, com o comprimento do fio de tungsténio paralelo ao fundo do prato. Use um movimento de corte suave para cortar os tecidos.
- Retire cuidadosamente o âmnio com # 5 fórceps. Neste ponto, você pode, quer ou dissecar ainda mais a região de seu interesse, ou deixar todo o embrião.
- Transferência do embrião para PARAF gelada 4%ormaldehyde e rocha durante a noite a 4 ° C.
- Preparar amostras e incorporar para o seccionamento crio-ou parafina.
Trace o tecido enxertado dentro do embrião hospedeiro. Existem várias técnicas para a identificação de tecido codorna dentro de um embrião de galinha, incluindo a detecção de codorna nucléolos pela coloração hematoxilina (núcleos de codorna têm muito grandes, de coloração mais escura do que inclusões núcleos pintinho), a reação de Feulgen-Rossenbeck, acridina-laranja ou biz-benzamida mancha combinado com microscopia eletrônica, ou imunomarcação com codornas antígenos específicos 3,47,65,66. Aqui usamos antígeno QCPN e todo padrão de montagem ou secção técnicas de imunofluorescência para identificar as células da crista neural de codorna em codorna-chick quimeras (Figura 4). Esta técnica fornece a maior flexibilidade no design experimental, como a imunofluorescência QCPN podem também ser combinados com outros anticorpos para identificar as células diferenciadas derivadas de tecido do dador (codornizes). Use Standard todo-mount ou técnicas de imunofluorescência seção para rotular codorna células derivadas de quimeras.
7. Os resultados representativos
Uma imagem representativa da região enxertada do tubo neural após 6 horas de re-incubação (para HH11) mostra a incorporação esperada do dador de tecidos enxertados (codornizes) no hospedeiro (pintainho) do tubo neural (Figura 4A). Embriões demonstrando a integração incompleta do enxerto, ou desenvolvimento assimétrico da região craniana ou sómitos após reincubação deve ser descartado.
Secção transversal através da região enxertado em HH11 CNCC mostram marcadas com HNK-1 migrar lateralmente para longe do tubo neural. Células de codorniz que contribuem para o fluxo de NCC migratório, e para o tubo neural, são claramente identificada com QCPN (Figura 4B).
Em fases posteriores, codorna NCC células derivadas pode ser atribuída a seu tecido alvo final. As células marcadas são intercaladas QCPN dentro do mesênquima embrião de pintodo processo da maxila em E5 (Figura 4C).
O anticorpo QCPN pode ser facilmente combinados com outros anticorpos para examinar a diferenciação de codorniz derivados CNCC no ambiente de acolhimento. Codorniz NCC-derivados trigeminais neurónios sensoriais são rotulados por QCPN e TUJ1 anticorpos (Figura 4D).
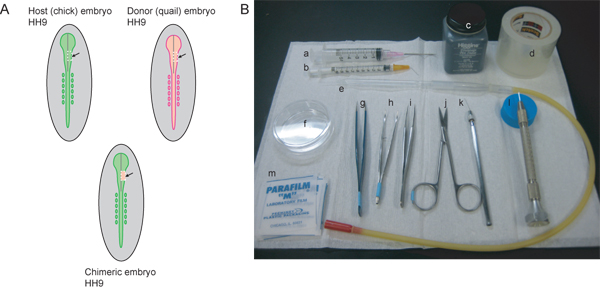
Figura 1. Resumo do procedimento experimental e instrumentos necessários. A Host) (pinto) e doadores (codorna) embriões deve ser palco correspondido. Para identificar o fluxo de NCC que contribui para o gânglio trigeminal e maxilo-mandibular região, HH9 é o ideal. No HH9, o tubo neural está começando a se fechar na região rostral, mas ainda não está completamente fechado. A linha de cinza nos diagramas representa a linha média do tubo de encerramento neural. As linhas pontilhadas brancas indicam as linhas de corte para excisar a região do mesencéfalo do lado direito do tubo neural do hospedeiro e doador inbryos. A região excisado do embrião hospedeiro é descartado eo tecido do doador transplantadas em gerar o embrião quimérico. B) instrumentos necessários incluem: uma seringa) 5mL com 18 ½ G agulha hipodérmica, b) uma seringa mL com 26 ½ G dobrado agulha hipodérmica a 45 ° nanquim ângulo, c), d) fita de embalagem clara, e) pipeta de vidro com a boca de pipetagem aparelho, f) 60 mm de prato Petri, g) AA fórceps, h) fórceps curvos íris com serrilhada dicas, i) # 5 pinças, tesouras finas j), k) aguçado fio de tungstênio, l) puxou o vidro de agulha, m) parafilme quadrados.
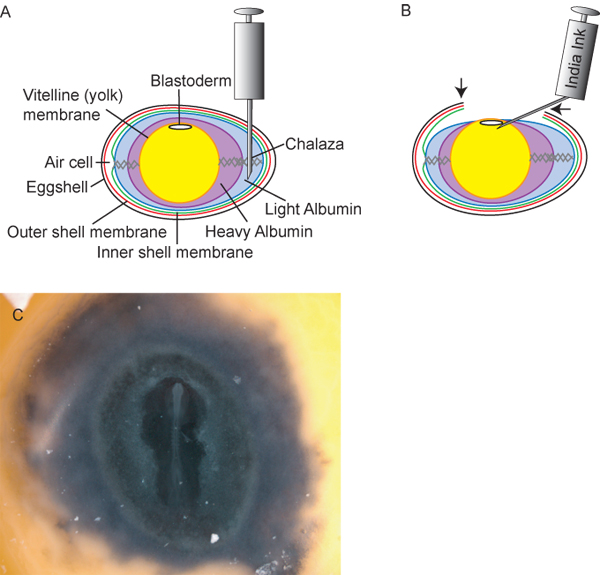
Figura 2. Preparação de óvulos e embriões. A) diagrama transversal do ovo, incluindo ponto de inserção ideal de 18 ½ G agulha hipodérmica para a retirada da luz de albumina. B) Após a retirada ~ 3 mL de albumina luz, a gema eo embrião dentro do ovo diminui, permitindo que os pesquisadores para cortar uma "janela" (setas) em tele casca de ovo para acessar o embrião. Nanquim, 1:10 diluídos em solução de Ringer estéril, podem então ser injectado por baixo da blastoderme para proporcionar contraste para teste fácil dos embriões. C) embrião de galinha depois de tinta.
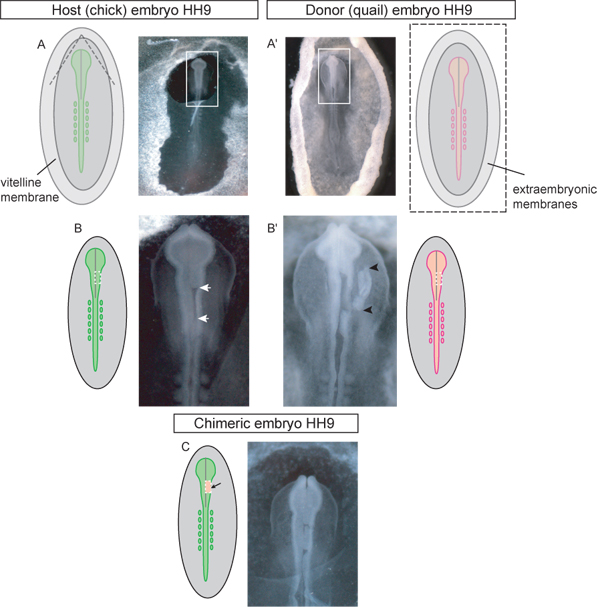
Figura 3. Esquemática e exemplos de fase HH 9 embriões doador e do receptor em cada passo do processo miocárdio. A) embrião hospedeiro pintainho. As linhas tracejadas no diagrama indicam que a membrana vitelina que deveriam ser rasgadas para acessar a região craniana para enxertia. Uma vez dividido o retalho triangular de membrana vitelina deve ser descascado caudalmente. Box em imagem indica inset usado em (BC). A ') Quail embrião doador. A imagem é de embrião doador excisado a partir de ovo e colocados em placas de Petri para dissecção do tecido do enxerto. Caixa na imagem indica inserção utilizado em (B '). As linhas tracejadas em diagrama esquemático (A ') indicar onde o vitelina e membranas de vitelo deve ser cortado, a fim de remover tele embrião do ovo. B) embrião hospedeiro com a região do mesencéfalo unilateral do tubo neural cortado (setas brancas) aguardando enxerto. Linha a tracejado na diagrama esquemático indica onde os cortes devem ser feitos para o tubo de consumo neural na região do mesencéfalo. Embrião B "Dador), com enxerto de tecido neural dorsal tubo cortado (tecido enxerto indicado por setas pretas). Linha a tracejado na diagrama indica onde os cortes deve ser feita no embrião codornizes ao tecido do doador de consumo para unilateral enxertia da região do mesencéfalo do tubo neural. C) embrião quimérico após a enxertia de explante tubo neural dorsal codorna para a região do mesencéfalo pintinho.
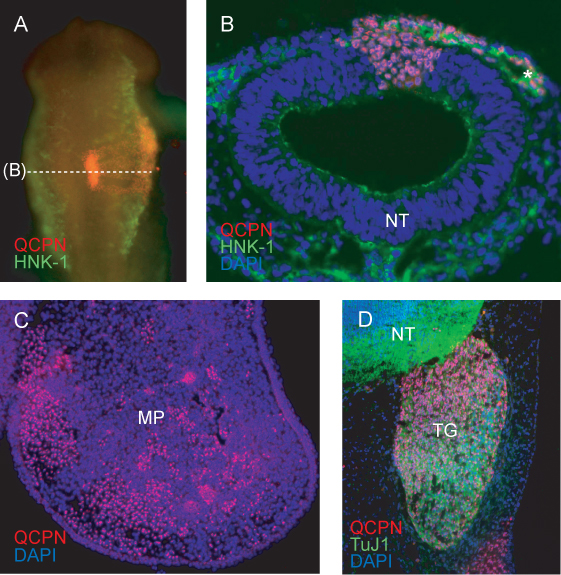
Figura 4. Imunofluorescência detectar codorna específico QCPN antígeno nuclear em células derivadas de doadores no embrião quimérico. A) imagem inteira de montagem de HH11 quimera (enxertados em HH9) mostrando coloração QCPN em vermelho, e HNK-1 coloração (um marcador de migração CNCC) emverde. Aumento de 10x, vista dorsal. B) Corte transversal através de embriões em (A), mostrando células QCPN-positivas codornizes derivados no tubo neural e NCC migratória co-coradas com HNK-1 (verde). Aumento de 40 vezes. C) Corte transversal através de um processo maxilar de E5 quimera (incubadas durante 3 dias pós enxerto), mostrando QCPN-positivas NCC células derivadas (vermelho) que migraram a partir da região enxertada do tubo neural para a sua localização final no embrião. Aumento de 10x. D Secção) através E5 contribuição quimera mostrando de codorna derivado NCC para o gânglio trigêmeo (vermelho) e diferenciação em neurônios TUJ1-positivos (verde). Aumento de 40 vezes. *, NCC; MP, processo maxilar; NT, tubo neural; gânglio, TG trigêmeo.
Discussão
O enxerto de tubo neural em embriões de galinha codorna acolhimento descrito aqui é uma técnica simples e barata para rastreamento subpopulações específicas de migração CNCC provenientes de diferentes regiões ao longo do eixo rostro-caudal 21,67-69. Esta técnica tira vantagem da facilidade de acesso para embriões aviários (em comparação com os embriões de mamíferos) e pode ser combinada com outras técnicas, tais como a ablação do tecido, a injecção de moléculas inibidoras, ou através de...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores agradecem os membros do laboratório Lwigale para a crítica do manuscrito. SLG é apoiado por uma L. Ruth Kirschstein NRSA Fellowship do National Eye Institute (F32 EY02167301). PYL é suportado pelo National Eye Institute (EY018050).
Materiais
| Name | Company | Catalog Number | Comments |
| Reagente | Companhia | Número de Catálogo | |
| Ovos Chick | Vários - usamos Texas A & M University Poultry Science Department, TX. | ||
| Ovos de codorna | Vários - usamos Ozarks Empresa Egg, MO. | ||
| Ovo incubadora (Digital Leitura 1502 Sportsman Incubadora w / Umidade 110-120 V CA) | www.poultrysupply.com | 1502 | |
| Dumont AA fórceps, Inox revestido de epóxi | Belas Ferramentas Ciência | 11210-10 | |
| Fita adesiva | Qualquer loja de material de escritório | ||
| Curvo Iris fórceps | Belas Ferramentas Ciência | 11065-07 | |
| Eundia tinta | Qualquer loja de material de arte | ||
| Pen / Strep Solution (penicilina, estreptomicina) | VWR International | 101447-068 | |
| A fita de embalagem clara | Qualquer loja de material de escritório | ||
| Agulha aparelho puxando | Narashige, Japão | PE-21 | |
| Agulha de vidro puxado, fez 1,5-1,8 tubo de vidro de borosilicato x 100mm capilar | Kimble perseguição | 34500 99 | |
| Puxado vidro pipeta, feita a partir de 5 ¾ "pipeta Pasteur | Fisher Scientific | 13-678-6A | |
| Aparelho de boca pipeta (tubo de aspirador de montagem para pipeta calibrada microcapilar) | Sigma-Aldrich | A5177-52A | |
| Dumont # 5 fórceps | Belas Ferramentas Ciência | 11251-30 | |
| Tonelarame gsten, diâmetro 0,1 milímetros | VWR International | AA10404-H2 | |
| Porta-agulhas (Niquelado titular pinos) | Belas Ferramentas Ciência | 26018-17 | |
| QCPN anti-soro | Desenvolvimento de Estudos Hybridoma Bank, da Universidade de Iowa | QCPN | |
| Alexa anticorpo Fluor secundário (por exemplo, Alexa Fluor 594 cabra anti-rato IgG1) | Invitrogen | A21125 | |
Solução de Ringer (2L):
| Todos os reagentes de Fisher Scientific |
|
Referências
- Le Douarin, G., Renaud, D. Morphologic and physiologic study of the differentiation in vitro of quail embryo precardial mesoderm. Bull. Biol. Fr. Belg. 103 (3), 453-468 (1969).
- Teillet, M. A., Ziller, C., Le Douarin, N. M. Quail-chick chimeras. Methods. Mol. Biol. 461, 337-350 (2008).
- Le Douarin, N. A biological cell labeling technique and its use in expermental embryology. Dev. Biol. 30 (1), 217-222 (1973).
- Noden, D. M. An analysis of migratory behavior of avian cephalic neural crest cells. Dev. Biol. 42 (1), 106-130 (1975).
- Johnston, M. C. A radioautographic study of the migration and fate of cranial neural crest cells in the chick embryo. Anat. Rec. 156 (2), 143-155 (1966).
- Noden, D. M. The control of avian cephalic neural crest cytodifferentiation. I. Skeletal and connective tissues. Dev. Biol. 67 (2), 296-312 (1978).
- Oka, K. The role of TGF-beta signaling in regulating chondrogenesis and osteogenesis during mandibular development. Dev. Biol. 303 (1), 391-404 (2007).
- Chai, Y. Fate of the mammalian cranial neural crest during tooth and mandibular morphogenesis. Development. 127 (8), 1671-1679 (2000).
- Lengele, B., Schowing, J., Dhem, A. Embryonic origin and fate of chondroid tissue and secondary cartilages in the avian skull. Anat. Rec. 246 (3), 377-393 (1996).
- Le Douarin, N. M., Ziller, C., Couly, G. F. Patterning of neural crest derivatives in the avian embryo: in vivo and in vitro studies. Dev. Biol. 159 (1), 24-49 (1993).
- Lallier, T. E. Cell lineage and cell migration in the neural crest. Ann. N.Y. Acad. Sci. 615, 158-171 (1991).
- Nakamura, H. Mesenchymal derivatives from the neural crest. Arch. Histol. Jpn. 45 (2), 127-138 (1982).
- Le Lievre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. J. Embryol. Exp. Morphol. 34 (1), 125-154 (1975).
- Rawles, M. E. The Development of Melanophores from Embryonic Mouse Tissues Grown in the Coelom of Chick Embryos. Proc. Natl. Acad. Sci. U.S.A. 26 (12), 673-680 (1940).
- Rawles, M. E. The Pigment-Forming Potency of Early Chick Blastoderms. Proc. Natl. Acad. Sci. U.S.A. 26 (1), 86-94 (1940).
- Mosher, J. T. Intrinsic differences among spatially distinct neural crest stem cells in terms of migratory properties, fate determination, and ability to colonize the enteric nervous system. Dev. Biol. 303 (1), 1-15 (2007).
- Dupin, E., Le Douarin, N. M. Development of melanocyte precursors from the vertebrate neural crest. Oncogene. 22 (20), 3016-3023 (2003).
- Faraco, C. D., Vaz, S. A., Pastor, M. V., Erickson, C. A. Hyperpigmentation in the Silkie fowl correlates with abnormal migration of fate-restricted melanoblasts and loss of environmental barrier molecules. Dev. Dyn. 220 (3), 212-225 (2001).
- Selleck, M. A., Bronner-Fraser, M. Avian neural crest cell fate decisions: a diffusible signal mediates induction of neural crest by the ectoderm. Int. J. Dev. Neurosci. 18 (7), 621-627 (2000).
- Stocker, K. M., Sherman, L., Rees, S., Ciment, G. Basic FGF and TGF-beta 1 influence commitment to melanogenesis in neural crest-derived cells of avian embryos. Development. 111 (2), 635-645 (1991).
- Le Douarin, N. M., Teillet, M. A. Experimental analysis of the migration and differentiation of neuroblasts of the autonomic nervous system and of neurectodermal mesenchymal derivatives, using a biological cell marking technique. Dev. Biol. 41 (1), 162-184 (1974).
- Noden, D. M. The control of avian cephalic neural crest cytodifferentiation. II. Neural tissues. Dev. Biol. 67 (2), 313-329 (1978).
- Barraud, P. Neural crest origin of olfactory ensheathing glia. Proc. Natl. Acad. Sci. U.S.A. 107 (49), 21040-21045 (2010).
- Li, H. Y., Say, E. H., Zhou, X. F. Isolation and characterization of neural crest progenitors from adult dorsal root ganglia. Stem Cells. 25 (8), 2053-2065 (2007).
- Carney, T. J. A direct role for Sox10 in specification of neural crest-derived sensory neurons. Development. 133 (23), 4619-4630 (2006).
- Maro, G. S. Neural crest boundary cap cells constitute a source of neuronal and glial cells of the PNS. Nat. Neurosci. 7 (9), 930-938 (2004).
- Bronner-Fraser, M. Molecular analysis of neural crest formation. J. Physiol. Paris. 96 (1-2), 3-8 (2002).
- Paratore, C., Goerich, D. E., Suter, U., Wegner, M., Sommer, L. Survival and glial fate acquisition of neural crest cells are regulated by an interplay between the transcription factor Sox10 and extrinsic combinatorial signaling. Development. 128 (20), 3949-3961 (2001).
- Britsch, S. The transcription factor Sox10 is a key regulator of peripheral glial development. Genes Dev. 15 (1), 66-78 (2001).
- Bronner-Fraser, M. Origin of the avian neural crest. Stem Cells. 13 (6), 640-646 (1995).
- Jessen, K. R., Mirsky, R. Neural development. Fate diverted. Curr. Biol. 4 (9), 824-827 (1994).
- Le Douarin, N., Dulac, C., Dupin, E., Cameron-Curry, P. Glial cell lineages in the neural crest. Glia. 4 (2), 175-184 (1991).
- Chan, W. Y., Cheung, C. S., Yung, K. M., Copp, A. J. Cardiac neural crest of the mouse embryo: axial level of origin, migratory pathway and cell autonomy of the splotch (Sp2H) mutant effect. Development. 131 (14), 3367-3379 (2004).
- Bronner-Fraser, M. Segregation of cell lineage in the neural crest. Curr. Opin. Genet. Dev. 3 (4), 641-647 (1993).
- Peters-vander Sanden, M. J., Luider, T. M., vander Kamp, A. W., Tibboel, D., Meijers, C. Regional differences between various axial segments of the avian neural crest regarding the formation of enteric ganglia. Differentiation. 53 (1), 17-24 (1993).
- Kuratani, S., Bockman, D. E. Capacity of neural crest cells from various axial levels to participate in thymic development. Cell Tissue Res. 263 (1), 99-105 (1991).
- Leblanc, G. G., Epstein, M. L., Bronner-Fraser, M. E. Differential development of cholinergic neurons from cranial and trunk neural crest cells in vitro. 137 (2), 318-330 (1990).
- Golding, J. P., Trainor, P., Krumlauf, R., Gassmann, M. Defects in pathfinding by cranial neural crest cells in mice lacking the neuregulin receptor ErbB4. Nat. Cell. Biol. 2 (2), 103-109 (2000).
- Kulesa, P. M., Bailey, C. M., Kasemeier-Kulesa, J. C., McLennan, R. Cranial neural crest migration: new rules for an old road. Dev. Biol. 344 (2), 543-554 (2009).
- Lwigale, P. Y., Bronner-Fraser, M. Semaphorin3A/neuropilin-1 signaling acts as a molecular switch regulating neural crest migration during cornea development. Dev. Biol. 336 (2), 257-265 (2009).
- Killian, O. l. e. s. n. i. c. k. y., Birkholz, E. C., A, D., Artinger, K. B. A role for chemokine signaling in neural crest cell migration and craniofacial. Dev. Biol. 333 (1), 161-172 (2009).
- Gammill, L. S., Gonzalez, C., Bronner-Fraser, M. Neuropilin 2/semaphorin 3F signaling is essential for cranial neural crest migration and trigeminal ganglion condensation. Dev. Neurobiol. 67 (1), 47-56 (2007).
- Osborne, N. J., Begbie, J., Chilton, J. K., Schmidt, H., Eickholt, B. J. Semaphorin/neuropilin signaling influences the positioning of migratory neural crest cells within the hindbrain region of the chick. Dev. Dyn. 232 (4), 939-949 (2005).
- Kanzler, B., Foreman, R. K., Labosky, P. A., Mallo, M. BMP signaling is essential for development of skeletogenic and neurogenic cranial neural crest. Development. 127 (5), 1095-1104 (2000).
- Garcia-Lopez, R., Pombero, A., Martinez, S. Fate map of the chick embryo neural tube. Dev. Growth Differ. 51 (3), 145-165 (2009).
- Goldstein, A. M., Nagy, N. A bird's eye view of enteric nervous system development: lessons from the avian embryo. Pediatr. Res. 64 (4), 326-333 (2008).
- Le Douarin, N., Dieterlen-Lievre, F., Creuzet, S., Teillet, M. A. Quail-chick transplantations. Methods Cell. Biol. 87, 19-58 (2008).
- Wingate, R. J., Lumsden, A. Persistence of rhombomeric organisation in the postsegmental hindbrain. Development. 122 (7), 2143-2152 (1996).
- Karagenc, L., Sandikci, M. Tissue distribution of cells derived from the area opaca in heterospecific quail-chick blastodermal chimeras. J. Anat. 216 (1), 16-22 (2010).
- Teague, W. J., Jayanthi, N. V., Lear, P. V., Johnson, P. R. Foregut mesenchyme contributes cells to pancreatic acini during embryonic development in a chick-quail chimera model. Pediatr. Surg. Int. 21 (3), 138-142 (2005).
- Borue, X., Noden, D. M. Normal and aberrant craniofacial myogenesis by grafted trunk somitic and segmental plate mesoderm. Development. 131 (16), 3967-3980 (2004).
- He, L. Three different fates of cells migrating from somites into the limb bud. Anat. Embryol. (Berl). 207 (1), 29-34 (2003).
- Huang, R., Zhi, Q., Christ, B. The relationship between limb muscle and endothelial cells migrating from single somite. Anat. Embryol. (Berl). 206 (4), 283-289 (2003).
- Hidalgo-Sanchez, M., Simeone, A., Alvarado-Mallart, R. M. Fgf8 and Gbx2 induction concomitant with Otx2 repression is correlated with midbrain-hindbrain fate of caudal prosencephalon. Development. 126 (14), 3191-3203 (1999).
- Verberne, M. E., Gittenberger-de Groot, A. C., Poelmann, R. E. Lineage and development of the parasympathetic nervous system of the embryonic chick heart. Anat. Embryol. (Berl). 198 (3), 171-184 (1998).
- Burns, A. J., Douarin, N. M. The sacral neural crest contributes neurons and glia to the post-umbilical gut: spatiotemporal analysis of the development of the enteric nervous system. Development. 125 (21), 4335-4347 (1998).
- Debby-Brafman, A., Burstyn-Cohen, T., Klar, A., Kalcheim, C. F-Spondin, expressed in somite regions avoided by neural crest cells, mediates inhibition of distinct somite domains to neural crest migration. Neuron. 22 (3), 475-488 (1999).
- Lwigale, P. Y., Bronner-Fraser, M. Lens-derived Semaphorin3A regulates sensory innervation of the cornea. Dev. Biol. 306 (2), 750-759 (2007).
- Nakamura, H., Funahashi, J. Introduction of DNA into chick embryos by in ovo electroporation. Methods. 24 (1), 43-48 (2001).
- Chen, Y. X., Krull, C. E., Reneker, L. W. Targeted gene expression in the chicken eye by in ovo electroporation. Mol. Vis. 10, 874-883 (2004).
- Sato, F., Nakagawa, T., Ito, M., Kitagawa, Y., Hattori, M. A. Application of RNA interference to chicken embryos using small interfering RNA. J. Exp. Zool. A. Comp. Exp. Biol. 301 (10), 820-827 (2004).
- Lwigale, P. Y., Schneider, R. A. Other chimeras: quail-duck and mouse-chick. Methods Cell. Biol. 87, 59-74 (2008).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev. Dyn. 195 (4), 231-272 (1992).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bull. World Health Organ. 32 (1), 143-144 (1965).
- Le Douarin, N. M. A Feulgen-positive nucleolus. Exp. Cell. Res. 77 (1), 459-468 (1973).
- Feulgen, R., Rossenbeck, H. Mikroskopisch-chemischer Nachweis einer Nucleinsaure vom typus der Thymonucleinsiiure und die darauf beruhende elektive Faibung von Zellkemen in mikroskopischen Praparaten. Hoppe-Seyler's Z. Physiol. Chem. 135, 203-252 (1924).
- Lwigale, P. Y., Conrad, G. W., Bronner-Fraser, M. Graded potential of neural crest to form cornea, sensory neurons and cartilage along the rostrocaudal axis. Development. 131 (9), 1979-1991 (2004).
- Weston, J. A. A radioautographic analysis of the migration and localization of trunk neural crest cells in the chick. Dev. Biol. 6, 279-310 (1963).
- Le Douarin, N. M., Kalcheim, C. . The Neural Crest. , (2009).
- Le Douarin, N. M., Teillet, M. A. The migration of neural crest cells to the wall of the digestive tract in avian embryo. J. Embryol. Exp. Morphol. 30 (1), 31-48 (1973).
- Douarin, N. M. L. e., Jotereau, F. V. Tracing of cells of the avian thymus through embryonic life in interspecific chimeras. J. Exp. Med. 142 (1), 17-40 (1975).
- Le Douarin, N. M., Renaud, D., Teillet, M. A., Le Douarin, G. H. Cholinergic differentiation of presumptive adrenergic neuroblasts in interspecific chimeras after heterotopic transplantations. Proc. Natl. Acad. Sci. U. S. A. 72 (2), 728-732 (1975).
- Houssaint, E., Belo, M., Le Douarin, N. M. Investigations on cell lineage and tissue interactions in the developing bursa of Fabricius through interspecific chimeras. Dev. Biol. 53 (2), 250-264 (1976).
- Le Douarin, N. M., Jotereau, F. V., Houssaint, E., Belo, M. Ontogeny of the avian thymus and bursa of Fabricius studied in interspecific chimeras. Ann. Immunol. (Paris). 127 (6), 849-856 (1976).
- Fontaine, J., Le Douarin, N. M. Analysis of endoderm formation in the avian blastoderm by the use of quail-chick chimaeras. The problem of the neurectodermal origin of the cells of the APUD series. J. Embryol. Exp. Morphol. 41, 209-222 (1977).
- Narayanan, C. H., Narayanan, Y. On the origin of the ciliary ganglion in birds studied by the method of interspecific transplantation of embryonic brain regions between quail and chick. J. Embryol. Exp. Morphol. 47, 137-148 (1978).
- Lwigale, P. Y., Cressy, P. A., Bronner-Fraser, M. Corneal keratocytes retain neural crest progenitor cell properties. Dev. Biol. 288 (1), 284-293 (2005).
- Lwigale, P. Y. Embryonic origin of avian corneal sensory nerves. Dev. Biol. 239 (2), 323-337 (2001).
- Tanaka, H., Kinutani, M., Agata, A., Takashima, Y., Obata, K. Pathfinding during spinal tract formation in the chick-quail chimera analysed by species-specific monoclonal antibodies. Development. 110 (2), 565-571 (1990).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados